El desarrollo de medicamentos para ciertas enfermedades raras puede verse truncado por la falta de financiación. En estos casos, en ocasiones, los propios pacientes —o sus familiares— financian el ensayo clínico en el que recibirán el medicamento experimental. Hay 3modelos de autofinanciación: 2de ellos, «pagar por probar» y «pagar por participar», ya se han puesto en práctica; el tercero, el modelo «plutocrático», que ha sido recientemente planteado, es, hasta la fecha, un modelo teórico. En este trabajo se repasan los beneficios y riesgos científicos, sociales y éticos de los 2modelos de investigación clínica: «pagar por participar» y el modelo «plutocrático». Una manera frecuente de poder autofinanciar estos ensayos clínicos es la obtención de fondos por micromecenazgo. Los aspectos más controvertidos de esta modalidad de financiación también son abordados en este trabajo desde diversas perspectivas. Por último, se plantea un escenario futuro que permitiera en nuestro país la puesta en marcha de estos ensayos clínicos autofinanciados mediante el modelo plutocrático.
The development of medicines for certain rare diseases can be frustrated by lack of funding. In certain cases the patients themselves, or their relatives, occasionally fund the clinical trial in which they will be treated with the investigational medicine. There are 3models of self-funded research: 2of them, “pay to try” and “pay to participate”, have already been put into practice. The third, the “plutocratic” proposal, which has been recently put forward is still a theoretical model. In this work the scientific, social and ethical benefits and risks of the 2clinical research models, “pay to participate” and the “plutocratic” proposal, are reviewed. Patient-funded clinical trials are frequently performed through crowdfunding. The most controversial aspects of this funding modality are also addressed in this article from several perspectives. Finally, a future scenario that would allow the launching of self-funded clinical trials in Spain by the “plutocratic” proposal is proposed.
Hace unos meses, la prensa mundial1,2 se hizo eco de un ensayo clínico realizado en los EE. UU. con Mila, una niña de 6 años afectada de una variante genética de la enfermedad de Batten, enfermedad rara, neurodegenerativa, hereditaria y mortal3. Lo excepcional no es que se realizara un ensayo en un solo paciente, diseño conocido y utilizado desde hace décadas4, sino que el tratamiento (un oligonucleótido antisentido administrado por vía intratecal3) se desarrolló y se administró en un tiempo récord —en poco más de un año desde el diagnóstico clínico— y que fue posible gracias a la financiación obtenida por los padres a través del micromecenazgo o microfinanciación (crowdfunding). Pero, ¿es la financiación por parte de los participantes una vía adecuada para poder realizar ensayos clínicos que no cuentan con otro tipo de soporte económico? ¿Sería legalmente posible llevarlos a cabo en España? ¿Es éticamente aceptable? Y el micromecenazgo, ¿es una alternativa válida que no interfiere con el sistema actual de desarrollo de nuevos medicamentos?
El ensayo mencionado más arriba siguió la normativa americana de uso expandido de un medicamento en investigación y, tras el consentimiento informado de los padres, se obtuvo la correspondiente aprobación de la agencia reguladora (FDA)3. En España —y en la UE—, la regulación obligaría a los investigadores a presentar una solicitud de ensayo clínico, lo que muy probablemente hubiese conllevado un procedimiento mucho más prolongado, con el consiguiente perjuicio para la situación clínica y pronóstico de Mila. En principio, no se podría utilizar el procedimiento del uso compasivo para medicamentos en investigación, pues en casos como el que nos ocupa el medicamento no cumpliría ninguno de los 2supuestos que la regulación contempla: que esté siendo sometido a ensayos clínicos o que se haya solicitado una autorización de comercialización de medicamento5.
No cabe duda de que es excepcional que los pacientes financien el ensayo en el que participan. Lo habitual es que sean las agencias financiadoras públicas, la industria, las organizaciones benéficas y las fundaciones sin ánimo de lucro las fuentes de financiación de los ensayos clínicos. La posibilidad de que pacientes con enfermedades raras financien su acceso a un tratamiento experimental, al que de otra manera no tendrían acceso, plantea una serie de dudas éticas que hay que abordar, por mucho que, en el caso de Mila, se considere que todo transcurrió de forma correcta en un avance sobresaliente de la investigación médica actual.
A continuación, se tratará sobre la financiación de los ensayos clínicos por parte de los pacientes que participan en ellos (autofinanciación) y no de la financiación de los ensayos por asociaciones de pacientes en los que quienes participan de facto no son quienes los soportan económicamente. De estos últimos, tenemos ejemplos en España como el ensayo con propranolol (EU-CTR 2014-003671-30), financiado y promovido por la Alianza Española de Familias de von Hippel-Lindau —que recaudó los fondos a través de lotería de Navidad, torneos benéficos y solicitudes de subvenciones (Sra. Susi Martínez, comunicación personal)— ya concluido; o la participación española de la Fundación Stop Sanfilippo —perteneciente a la Alianza Global de Fundaciones Sanfilippo— para recaudar hasta casi 14 millones de dólares que permitieran la realización de un ensayo clínico de fase 1/2 de terapia génica (NCT02716246) promovido por Abeona Therapeutics, y que también se está realizando en varios países6.
Ensayos clínicos autofinanciados por los participantesLa autofinanciación de los ensayos clínicos por los pacientes que participaban en los mismos se inició en la década de 1980 en los EE. UU. (tabla 1). Un problema adicional y, desde luego, de relevancia, es que los ensayos autofinanciados por los participantes se incluyen en registros como ClinicalTrials.gov —registro público perteneciente a los Institutos Nacionales de la Salud de los EE. UU.—, por lo que los pacientes tienen acceso libre a la información, que no siempre se refiere a ensayos de calidad10.
Algunos ejemplos de autofinanciación de ensayos clínicos por los participantes
| En 1985, en Tenessee (EE. UU.), una compañía privada realizó ensayos clínicos con anticuerpos monoclonales en pacientes oncológicos que tuvieron que pagar 35.000 dólares para participar7 |
| Recientemente, en Florida (EE. UU.) se ha propuesto que los pacientes para prevenir el envejecimiento pagasen hasta 285.000 dólares para participar en un ensayo en el que recibirían transfusiones de sangre de personas jóvenes8 |
| En Panamá, se ha incluido a 20 niños con trastorno del espectro autista en un ensayo con células madre tras pagar 7.200 dólares8 |
| En México, pacientes de esclerosis lateral amiotrófica pagaron hasta 18.000 dólares para participar en un ensayo clínico que estudiaba un tratamiento de células CD133+, aunque hubo pacientes que participaron gratuitamente7; en otro ensayo, cada participante pagó 30.000 dólares para recibir tratamiento con células madre neuronales como terapia del daño cerebral asociado a ictus9 |
Los tratamientos con células madre son especialmente «atractivos» para la realización de ensayos autofinanciados, pues en ciertos países (como los EE. UU.) la regulación de este tipo de ensayo es menos estricta que la de los ensayos con otros tipos de terapias reguladas. Esto, sin embargo, no ocurre en España (ni en la UE) en donde los ensayos clínicos con terapias avanzadas (las que usan células madre es un tipo de ellas) están sujetos a la misma regulación que la de los ensayos con el resto de medicamentos, con unas salvaguardas añadidas11,12.
Si bien la autofinanciación de los ensayos clínicos tiene ya cierto recorrido en el tiempo, hacerlo mediante microfinanciación es relativamente reciente13. Como se verá más adelante, los ensayos clínicos autofinanciados a través de micromecenazgo pueden ser de varias modalidades, como la debida exclusivamente a la solidaridad de muchas personas o a un sistema mixto en el que a aquella se le añade, por ejemplo, la contribución importante de un paciente interesado en participar.
Modelos de acceso a medicamentos experimentales por autofinanciación de los participantesSe distinguen 3tipos de acceso a medicación experimental autofinanciada por el paciente: «pagar por probar» (pay to try), «pagar por participar» (pay to play, pay to participate) y la «propuesta plutocrática». Hay que resaltar que estos modelos son factibles en las primeras fases de desarrollo de un medicamento (fases 1 y 2a —esta última, de prueba de concepto—), cuando los donantes tienen la certeza de que van a ser tratados con el medicamento experimental. Es difícil imaginar que un paciente vaya a pagar por participar en un ensayo en el que pueda recibir placebo. Los 3modelos se fundamentan en la libertad individual que, bajo la propia autonomía del paciente, debe poder comprometerse a un intercambio libre de bienes, asumiendo que este es voluntario e informado: el paciente accede al medicamento experimental y el investigador a una financiación que permita la realización de la investigación14. Todo esto es particularmente relevante para pacientes de ciertas enfermedades ultrarraras (las que tienen en Europa una prevalencia <1/50.000 habitantes11), para quienes el desarrollo de tratamientos está, en muchas ocasiones, comprometido por falta de financiación.
«Pagar por probar»En esta modalidad, el paciente paga su acceso al medicamento experimental a través del uso compasivo; no es, por tanto, un ensayo clínico habitual, si bien, en el caso de Mila, la niña afectada de una variante genética de la enfermedad de Batten, los investigadores lo consideraron desde el punto de vista científico como un ensayo de «n=1»3. En este modelo se suelen tratar uno o muy pocos pacientes, por lo que suelen tener que pagar cantidades muy elevadas de dinero14. Al no ser considerado en los EE. UU. como un ensayo clínico, el protocolo de administración no tuvo que ser aprobado por un comité de ética de la investigación: esto fue lo que ocurrió en el caso de Mila, siendo el presidente del comité del centro hospitalario quien dio el visto bueno al procedimiento3.
«Pagar por participar»En la modalidad de «pagar por participar», cada participante en el ensayo clínico paga una cantidad de dinero, generalmente alta. Los aspectos positivos y negativos de este modelo se resumen en la tabla 2. Hay quienes entienden que los ensayos clínicos autofinanciados mediante el modelo «pagar por participar» son de poca calidad científica —con problemas que se plantean desde la selección sesgada de pacientes hasta la difícil interpretación de los resultados por ausencia de grupo control— y de cuestionable bondad ética —esencialmente el valor social y la justa selección de participantes7,15—. De hecho, hay quienes sostienen que este modelo de autofinanciación de ensayos clínicos debe prohibirse15. Esta forma de pensar se ve favorecida porque en los EE. UU. se llevan a cabo ensayos clínicos que en la UE estarían proscritos. Así, por ejemplo, si la investigación se realiza con células madre en clínicas privadas, sin fondos públicos y sin que se pretenda obtener la autorización de comercialización por la FDA, no se necesita que el protocolo del ensayo lo apruebe un comité de ética de la investigación9 —situación que no es admisible en Europa—. En los EE. UU., hay comités de ética de la investigación comerciales —desconocidos en Europa— que han aprobado ensayos con un variado grado de rigor10. Dicho esto, es claro que si se cumplen adecuadamente los aspectos científicos y éticos, como ocurre con la aplicación de la regulación europea, no tendría sentido prohibir los ensayos autofinanciados mediante la modalidad «pagar por participar»14,16,17.
Aspectos éticos y científicos positivos y negativos del modelo «pagar por participar» para la realización de ensayos clínicos autofinanciados por los participantes
| Aspectos positivos |
| a) Aceleración de la traslación de la investigación básica y preclínica a la investigación clínica |
| b) Empoderamiento de los pacientes |
| c) Máximo compromiso del paciente con el ensayo (es esperable que cumpla con todos los procedimientos y visitas que se programen) |
| d) Valor social del ensayo: se realizará una investigación de cuyos resultados se beneficiarán otros pacientes (si está bien diseñado, se realiza de forma rigurosa y los resultados se hacen públicos) |
| e) Certeza de que el consentimiento será informado: plena confianza de la voluntariedad del participante. Se admite la competencia para otorgar un consentimiento válido en pacientes que puedan estar desesperados (esto se admite sin problemas en, por ejemplo, pacientes oncológicos que participan en ensayos de fase 1) |
| f) Justificación para que sean los ricos quienes se expongan a los riesgos de la terapia experimental, si los más desfavorecidos acabarán beneficiándose de los resultados (dado que la posibilidad de obtener beneficio terapéutico es remota —así, solo el 10% de los medicamentos que inician la fase 1 acaban siendo autorizados19—) |
| Aspectos negativos |
| a) Que los pacientes sean simultáneamente donantes y participantes plantea potenciales conflictos de intereses: aquellos pueden imponer características en el diseño del ensayo, por ejemplo, que no sea comparativo o influir en los criterios de elegibilidad o presionar a los investigadores para no retirar del ensayo a participantes que no responden adecuadamente o no informar sobre eventos adversos del medicamento experimental |
| b) El riesgo de explotación del participante, bien porque tenga falsas expectativas con la medicación experimental, de modo que hay más posibilidades de que se presente el equívoco terapéutico20, bien porque no se ofrezca al participante suficiente beneficio potencial (algo que casi siempre está presente) |
| c) Los pacientes desesperados pueden sentirse presionados para pagar para participar, por lo que su voluntariedad quedaría en entredicho y, además, estar dispuestos a aceptar riesgos sustanciales |
| d) No se cumpliría el principio de justicia, por el que la selección de los participantes —y la distribución de beneficios y riesgos— debe realizarse entre los que se pueden beneficiar de la investigación y basarse en unos criterios de elegibilidad adecuados —que permitan la generalización de los resultados— y no en la capacidad de pagar de aquellos |
| e) Este modelo prioriza las necesidades de investigación de los ricos y sus enfermedades, y no de la sociedad en su conjunto |
La «propuesta plutocrática»21 viene a solucionar la práctica totalidad de los problemas de la modalidad «pagar por participar». Sin embargo, ha tenido una ínfima trascendencia, quizás porque ha transcurrido poco tiempo desde que fue propuesto en 2017 y porque su implementación es muy compleja.
En la «propuesta plutocrática», al donante se le ofrece la posibilidad —pero no la certeza— de participar en un ensayo clínico, pudiendo transferir esta posibilidad a un tercero (familiar, amigo o desconocido); además, la eventual participación en el ensayo tendrá lugar en el plazo de 2 o 3 años desde la donación —o incluso quizás más si se requiere el desarrollo de, por ejemplo, vectores para terapia génica—. Estas 2características la distinguen de los 2modelos anteriores, que sí ofrecían al donante la seguridad de recibir el medicamento experimental en un tiempo reducido. El correcto funcionamiento de este modelo requiere el concurso de una «agencia externa» que actúe de intermediario entre el paciente/donante y los investigadores, que vele por la calidad ético-científica de los ensayos propuestos y asegure la financiación de estos21. Las principales características de este modelo se recogen en la tabla 3. Además de ser un modelo orientado para el reposicionamiento terapéutico de medicamentos conocidos, también lo podría ser para terapia génica de sustitución, terapias moleculares o de edición genética que, previsiblemente, solo requerirían de una o muy pocas administraciones.
Principales características y ventajas de la propuesta plutocráticaa como modelo de autofinanciación de ensayos clínicos por los participantes afectos de enfermedades raras
| Características |
| 1. Modelo solo aplicable para ensayos clínicos de fases tempranas de desarrollo, no comparativos (fases 1 y 2a), y especialmente orientado para el reposicionamiento de medicamentos ya comercializados para otras indicaciones (conocido como «reposicionamiento terapéutico») |
| 2. Para ensayos clínicos cuyo inicio se demoraría 2 o 3 años desde la identificación del medicamento y desde el comienzo de la recepción de donaciones por parte de potenciales participantes. Este tiempo es necesario para completar los estudios necesarios que conduzcan a la autorización del ensayo y para producir las muestras del medicamento necesarias para completarlo. Al donante, pues, se le exige un compromiso a largo plazo con el ensayo, por lo que aquel deberá tener una esperanza de vida de, al menos, 3 años |
| 3. Deberá participar activamente una agencia externa que actuaría de intermediario entre el paciente y el equipo de investigación. Además: |
| a) Mantendría una base de datos de medicamentos potencialmente útiles que puedan ser investigados en ensayos clínicos. La base de datos sería de acceso público y gratuito |
| b) Sería responsable de revisar la idoneidad de las propuestas de ensayos clínicos de los investigadores |
| c) Sería responsable de asegurar que el ensayo cumple con las preceptivas autorizaciones ético-administrativas |
| d) Aseguraría la financiación completa del ensayo |
| e) Aseguraría la publicación de los resultados del ensayo |
| 4. Una vez que todo lo anterior se ha cumplido, se invitará a los donantes a participar en el ensayo. Esto solo se producirá si cumplen los criterios de selección del ensayo clínico |
| Ventajas |
| 1. Los pacientes no entran en contacto directo con los investigadores hasta el inicio del ensayo clínico. Este hecho minimiza la posibilidad de explotación de los participantes |
| 2. La agencia externa actuaría como garante para el donante y para el investigador. Al donante le garantiza que el ensayo, de realizarse, será ética y científicamente correcto; al investigador le asegura la solvencia económica del proyecto |
| 3. La agencia externa sería la responsable de acordar con los investigadores los criterios de selección de los participantes a incluir en el ensayo. Estos no tendrían papel alguno en esto |
| 4. Los donantes entregarían la totalidad de la cantidad de dinero requerida cuando se comprometen a participar, es decir, varios años antes del posible inicio del ensayo, cuando todavía pueden presentarse otras alternativas terapéuticas. Los donantes, por tanto, no se encontrarían en una situación desesperada por su cuadro clínico. La donación quedaría en manos de la agencia externa, incluso si el donante no pudiese ser incluido en el ensayo o si falleciese antes de que este se inicie |
| 5. Las donaciones recibidas servirían para pagar todas las actividades del ensayo, desde las derivadas del proceso de obtención de la autorización ético-administrativa y la producción de las muestras del medicamento, hasta la participación de pacientes que no pudiesen pagar cantidad alguna para participar. Se considera éticamente aceptable que hasta la mitad de los participantes fuesen donantes |
Plutocracia: situación en la que los ricos ejercen su preponderancia en el gobierno del Estado (Diccionario de la Lengua Española; Real Academia Española).
Fuente: Masters y Nutt21.
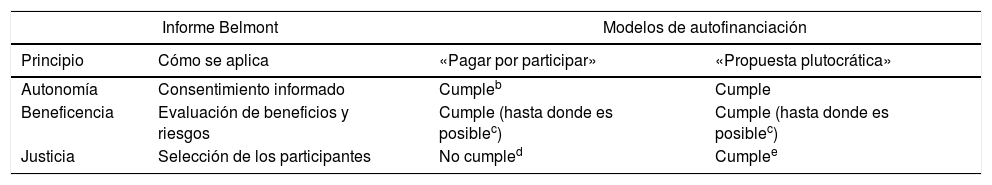
En la tabla 4 se recogen los 3principios éticos básicos que deben cumplir las investigaciones con seres humanos22 y hasta qué punto las cumplen los modelos «pagar por participar» y el «modelo plutocrático».
Informe Belmont: principios éticos básicos en la investigación con seres humanos y su aplicación en los ensayos clínicos autofinanciadosa
| Informe Belmont | Modelos de autofinanciación | ||
|---|---|---|---|
| Principio | Cómo se aplica | «Pagar por participar» | «Propuesta plutocrática» |
| Autonomía | Consentimiento informado | Cumpleb | Cumple |
| Beneficencia | Evaluación de beneficios y riesgos | Cumple (hasta donde es posiblec) | Cumple (hasta donde es posiblec) |
| Justicia | Selección de los participantes | No cumpled | Cumplee |
La correcta interpretación del contenido de esta tabla se podrá hacer con la lectura del texto y del contenido de las tablas 2 y 3.
Los investigadores deberán tener especial cuidado con la información que se otorga al participante para evitar el equívoco terapéutico20.
Depende del estado del conocimiento del medicamento experimental pero, en general, aquel será limitado.
Son solo los pacientes que pueden pagar el tratamiento experimental quienes pueden participar en el ensayo y recibir el medicamento en investigación.
Solo pagan los pacientes que pueden hacerlo, pero esto no les asegura que —años más tarde— vayan a recibir el tratamiento experimental permitiéndose, en el futuro, una participación abierta.
Fuente: The Belmont Report22.
Hasta aquí se han contestado las 3primeras preguntas que se formularon al principio del artículo. Queda por responder la cuarta: ¿es el micromecenazgo una alternativa válida que no interfiere con el sistema actual de desarrollo de nuevos medicamentos?
El micromecenazgo de proyectos de investigación médica se ha orientado especialmente a oncología y a las enfermedades raras, incluyendo investigación básica, y estudios genómicos, preclínicos y clínicos, a través de plataformas en Internet23,24. Estas son generalmente de origen estadounidense, pero algunas son ya internacionales como GoFundMe —la plataforma más grande del mundo—, que opera en 20 países, entre ellos España desde 2017, siendo las campañas relacionadas con la salud las más importantes en todos los países25. La mayor parte de estas plataformas son compañías con ánimo de lucro, que suelen cobrar el 5% de comisión y algo más del 3% de transacción por donativo. Como estas plataformas no tienen ningún control sobre quienes promueven las campañas ni en sus objetivos, plantean problemas de diversa índole. El mayor (y, en ocasiones, más llamativo) problema de las campañas relacionadas con la salud es el fraude: recaudar fondos para terapias ineficaces y potencialmente dañinas26,27.
El micromecenazgo en la biomedicinaUn reciente estudio identificó 16 plataformas en los EE. UU. dedicadas en exclusiva a recaudar donaciones para proyectos relacionados con la salud, 5en Europa (una en España: Funds4Research) y una en Australia28. Además, en nuestro país, y dedicada a la ciencia en general, la plataforma pública Precipita de la FECYT es de obligada mención. A través de Precipita, por ejemplo, recaudan donaciones para el estudio del posible efecto del 5-fluorouracilo en la esclerosis lateral amiotrófica los investigadores del grupo Lagenbio de la Universidad de Zaragoza29. Hay también diversas iniciativas nacionales —como, por ejemplo, Stop-FA, para la investigación de la ataxia de Friedriech30— o incluidas en proyectos internacionales —como Apoyodravet, englobada en la Red Internacional de Investigación del Síndrome de Dravet y Epilepsia Refractaria31—, que utilizan el micromecenazgo para poder realizar diversos programas científicos. El éxito en la recaudación por donativos de las campañas de microfinanciación para investigaciones médicas se fundamenta en gran medida en que los investigadores tengan una amplia red de contactos personales o profesionales, y en la participación de las redes sociales: cada tuit o retuit adicional aumenta la tasa de éxito de la campaña en un punto porcentual32.
Un análisis de 13 campañas de microfinanciación de ensayos clínicos mostró que 8alcanzaron sus objetivos de recaudación; 5(de las 8) eran para ensayos piloto o de fase 1; la mayor parte de las campañas exitosas contaron con financiación mixta, es decir, con financiación de otras fuentes además del micromecenazgo33. Los beneficios y los riesgos de la microfinanciación para la investigación sanitaria se resumen en la tabla 5. En la tabla 6 se mencionan algunos datos de interés sobre las campañas de microfinanciación en biomedicina.
Beneficios y riesgos del micromecenazgo en la investigación médica, especialmente orientada a las enfermedades raras
| Beneficios |
| 1. La ciudadanía se ocupa y participa de la agenda científica |
| 2. Aumenta el número de donantes |
| 3. Dirige la atención y la financiación a la investigación médica en áreas con poco o nulo soporte económico (como el caso de ciertas enfermedades ultrarraras) |
| 4. Subraya las limitaciones del sistema actual de financiación en salud al ocuparse, de forma parcial, del vacío dejado por la financiación pública y privada |
| 5. Los patrocinadores pueden hacer responsables a los investigadores y participar en el progreso de la investigación |
| Riesgos |
| 1. La sociedad difícilmente es capaz de elegir de forma eficiente los proyectos de alta prioridad para la salud pública. La asignación de los recursos sanitarios se altera de forma que, en los ensayos clínicos, la necesidad médica pasa a un segundo plano detrás de la capacidad de pagar |
| 2. Los proyectos pueden no ser financiados según su valor científico |
| 3. Los objetivos a largo plazo se pueden ver sustituidos por los objetivos a corto plazo |
| 4. La falta de transparencia puede impedir asegurar la pública rendición de cuentas |
| 5. Riesgo de fraude. La supervisión de la información que se facilita es casi inexistente, pudiendo ser fraudulenta |
| 6. Una alta tasa requerida por las plataformas (comerciales) —que suele ser del 5% de la cantidad recaudada— puede hacer del micromecenazgo un método ineficiente |
| 7. El micromecenazgo de ensayos clínicos por los participantes presenta problemas éticos: la privacidad (se suele dar mucha información personal y médica para maximizar las donaciones); la inequidad (la microfinanciación es más exitosa entre personas que tienen buenas conexiones sociales, habilidades en la mercadotecnia por Internet y en la comunicación, lo que puede perpetuar los sistemas sanitarios con deficiencias en equidad); la voluntariedad del consentimiento informado del paciente puede verse comprometido por la presión externa que ejerce el micromecenazgo; puede incentivar a los investigadores a incluir un número mayor de pacientes de los necesarios para el objetivo propuesto; los participantes pueden tener excesivas esperanzas en la terapia a ensayar |
Datos sobre el uso de campañas de microfinanciación en biomedicina
| Dos análisis de las campañas relacionadas con la salud de GoFundMe mostraron que en los EE. UU. la recaudación media fue de unos 3.000-3.700 dólares, alcanzando solo el 41% de las cantidades solicitadas36,38 |
| El interesado, los padres o los familiares cercanos son quienes organizan el 52% de las campañas36 |
| Cabe resaltar las campañas organizadas por familiares o amigos de los pacientes, generalmente a través de fundaciones ad hoc, que se acompañan de una gran presión mediática. Aquí destacarían los casos de Mila —niña afectada de una variante genética de la enfermedad de Batten3—, que recaudó 3 millones de dólares, y el de Charlie Gard —un bebé inglés en situación terminal afectado de encefalomiopatía por depleción de ADN mitocondrial— que consiguió 1,7 millones de dólares, ambos casos a través de la plataforma GoFundMe1,34 |
| Un caso de financiación mixta fue el que recaudó 2,2 millones de dólares para un ensayo de fase 1/2 para pacientes con cáncer pancreático neuroendocrino metastásico mediante una campaña de micromecenazgo y por un rico donante que quería participar en aquel21 |
Hay que tener en cuenta que el micromecenazgo introduce normas de mercado en los países con sistemas públicos de salud bien establecidos, pudiendo alterar la percepción tradicional que la población tiene sobre el cuidado de la salud34. Sin embargo, sería excepcional que la microfinanciación de ensayos clínicos distorsionase el sistema actual de desarrollo de nuevos medicamentos. Y esto es así porque el número de ensayos para enfermedades ultrarraras que podrían ponerse en marcha mediante este modelo de financiación sería muy pequeño. Así, supondría un porcentaje minúsculo sobre los aproximadamente 4.000 ensayos clínicos que se autorizan anualmente en Europa —de los que el 61% (unos 2.450/año) los promueve la industria farmacéutica y el resto 39% (unos 1.550/año) promotores no comerciales, especialmente la academia39---. En España, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) autoriza unos 800 ensayos clínicos cada año, siendo el 78% (unos 625/año) promovidos por la industria y el resto, 22% (unos 165/año), por investigadores y entidades sin ánimo de lucro40. Desde otra perspectiva, en febrero del 2020, y según datos del Registro Español de estudios clínicos (REec) de la AEMPS, había 379 ensayos clínicos en enfermedades raras en fase de reclutamiento de participantes, mientras 110 estaban autorizados y a la espera de iniciarse. El que a estas cifras se añadan anualmente en España uno o 2ensayos autofinanciados por los participantes gracias al micromecenazgo no supondría distorsión alguna para el sistema.
El micromecenazgo en los medios de comunicaciónEs bien conocido que los medios de comunicación (prensa, radio, TV) ejercen una influencia capital en el éxito de algunas campañas de microfinanciación, especialmente si se involucra una personalidad pública y famosa. Además, el empleo de los medios sociales de comunicación (Twitter, Facebook) es muy relevante para crear una audiencia interesada en el proyecto y para mantener su interés32.
Cómo trata la prensa estas campañas de micromecenazgo ha sido objeto de análisis por Murdoch et al.41 (tabla 7). Como en otros aspectos de la ciencia, es llamativo observar que, en la prensa, y a diferencia de en artículos académicos, solo se mencionan en contadas ocasiones los problemas que la microfinanciación puede acarrear. Esto puede crear una corriente de opinión favorable al micromecenazgo en la sociedad y legitimarlo como fuente de financiación para el cuidado médico41, algo que se evidencia al recaudar cerca de 7,5 millones de dólares en campañas de terapias más que cuestionables frente al cáncer a través de 2plataformas en 16 países de 4continentes26.
Las campañas de microfinanciación en la prensa
| Murdoch et al.41 estudiaron 336 artículos publicados en 2015-2017 que se referían a campañas de micromecenazgo en periódicos de alta tirada de Canadá y EE. UU. |
| Este estudio mostró que estos artículos: |
| 1. La mayor parte trataba las campañas de forma neutral (48%) o positiva (44%) |
| 2. Se referían a casos de cáncer (49%) o a alguna enfermedad rara (36%) |
| 3. La mayoría (83%) informaba cómo hacer las donaciones |
| 4. En muy pocas ocasiones (9%), los artículos mencionaban que el fenómeno de la microfinanciación plantea problemas éticos |
| 5. En el 21% de las campañas a las que se referían los artículos, se informaba de que el tratamiento pudiera ser ineficaz, estaba en experimentación o carecía de autorización reguladora |
La autofinanciación de ensayos clínicos por participantes afectados de ciertas enfermedades ultrarraras es un camino abierto hace años y que, muy probablemente, crecerá en el próximo futuro. No hay nada éticamente incorrecto en que los propios pacientes —sus padres o familiares y amigos— financien su participación en los ensayos, por lo que no hay razones para prohibirlos, siempre que se cumplan los requisitos que se exige a cualquier ensayo clínico14,16,17. La mayoría de los problemas que se han identificado, especialmente los relacionados con la falta de valor científico y valor social, se soslayan mediante la vigente regulación española sobre ensayos clínicos: todos los ensayos autofinanciados deberán ser aprobados por el comité de ética de la investigación con medicamentos pertinente y por la AEMPS12. La autofinanciación de los ensayos clínicos puede ser especialmente relevante en el reposicionamiento de medicamentos ya conocidos e, incluso, comercializados para otras indicaciones42.
De los 3modelos de autofinanciación —«pagar por probar», «pagar por participar» y la «propuesta plutocrática»—, este último parece ser el más adecuado para la investigación temprana de nuevos medicamentos huérfanos. A pesar de la buena acogida que ha tenido43, no conocemos que se haya implantado en país alguno. La necesidad de contar con una «agencia externa» —que representa el papel más importante e innovador de este modelo—, quizás sea la razón que complica sobremanera su implantación. Esta «agencia externa» debería ser una institución sin ánimo de lucro, que contase con un comité integrado por, al menos, científicos básicos, médicos clínicos, pacientes, abogados y expertos en finanzas. En España, la Federación Española de Enfermedades Raras (FEDER) podría convertirse en la «agencia externa» o albergar en su organización la institución que actuase como tal —aunque ello supondría modificar los estatutos de aquella—. CIBERER —como centro de investigación de enfermedades raras del Instituto de Salud Carlos III— y la AEMPS deberían involucrarse tempranamente en la evaluación de los proyectos como consultores científicos y reguladores, respectivamente. FEDER estaría en una situación idónea para ser la protagonista principal de los proyectos relativos a medicamentos huérfanos que requieran autofinanciación de los participantes —además de poder colaborar con las asociaciones de pacientes y/o familiares de enfermedades raras que quieran poner en marcha ensayos clínicos financiados por ellas mediante otros mecanismos—.
La autofinanciación de ensayos clínicos por los participantes —fundamentada en la ausencia de recursos públicos o privados disponibles— necesitará recurrir, en la gran mayoría de ellos, al micromecenazgo. El uso de este en la financiación de la investigación biomédica es controvertido33,44, aunque en sí misma la microfinanciación no plantea problemas éticos y ofrece la oportunidad de solidaridad social con los afectados por una determinada enfermedad rara. Para algunos, no es esta la mejor solución para abordar las insuficiencias de los sistemas de salud32. Sin embargo, esto no es óbice para que pueda tener su lugar en el desarrollo clínico temprano de determinados medicamentos huérfanos, ya que las campañas de micromecenazgo frecuentemente son exitosas33 y, en principio, no afectaría en lo más mínimo el sistema actual de desarrollo de nuevos fármacos.
Como es imparable el rápido avance que se está produciendo en el conocimiento de las bases genéticas de muchas enfermedades ultrarraras, España —y la UE— debería tener previsto un procedimiento administrativo que permitiera a la AEMPS la autorización rápida mediante la vía del uso compasivo para nuevos medicamentos experimentales. Para ello, a los 2supuestos mencionados al principio de este artículo —que el medicamento esté siendo sometido a ensayos clínicos o que se haya solicitado una autorización de comercialización de medicamento5—, la regulación debería añadir un tercero que permitiera la administración inicial de un medicamento experimental al primer paciente —y, si acaso, a alguno más—, sin que los investigadores tuviesen que presentar toda la documentación necesaria que exige la realización de un ensayo clínico. La situación clínica de estos pacientes afectados de enfermedades ultrarraras que, por definición, son enfermedades crónicas o gravemente debilitantes, o que ponen en peligro su vida, requiere que la regulación se adecúe a los avances científicos de forma que no enlentezca la administración de medicamentos potencialmente beneficiosos. Máxime cuando la modificación que aquí se sugiere estaría indicada para medicamentos huérfanos indicados para los muy pocos pacientes afectados de enfermedades de bajísima prevalencia que, al carecer de financiación pública o privada, tendrían que financiarse por micromecenazgo, un factor añadido de enlentecimiento en su desarrollo y posterior administración.
FinanciaciónEste trabajo no requirió de financiación alguna.
Conflicto de interesesLos autores declaran que carecen de conflicto de intereses.