La enfermedad de Gaucher (EG) se origina por el déficit de la enzima beta glucosidasa ácida (GBA)1. La clasificación aceptada actualmente es: tipo 1 (no neuronopática, EG-1), tipo 2 (neuronopática aguda, EG-2) y tipo 3 (neuronopática crónica). Desde 1994, el tratamiento enzimático sustitutivo (TES) está disponible en España. Debido a la limitada experiencia con la que se cuenta con relación a su eficacia y seguridad a largo plazo, pensamos de interés describir la experiencia en un hospital infantil terciario en el que se empezó a utilizar esta terapia en cuanto estuvo disponible.
Se describe retrospectivamente la evolución de siete pacientes con EG (5 EG-1 y 2 EG-2) tratados en los últimos 20 años en el Hospital Infantil La Fe de Valencia. El diagnóstico fue confirmado mediante medición de la actividad de GBA en leucocitos (AGL) y estudio de mutaciones en el gen GBA. Al diagnóstico, y posteriormente cada año, se evaluaron peso, talla, IMC, grado de hepatomegalia-esplenomegalia, hemograma, hemostasia, quitotriosidasa, quimiocina ligando 18 (CCL18) y densitometría ósea de la columna. Se realizó resonancia magnética (RM) abdominal para evaluar el volumen hepático y el esplénico, calculando el múltiplo del valor normal2. En pacientes con afectación ósea se llevó a cabo RM de los huesos largos. El TSE se administró por infusión intravenosa de 2h cada 2 semanas en dosis de 60UI/kg en pacientes con EG-1.
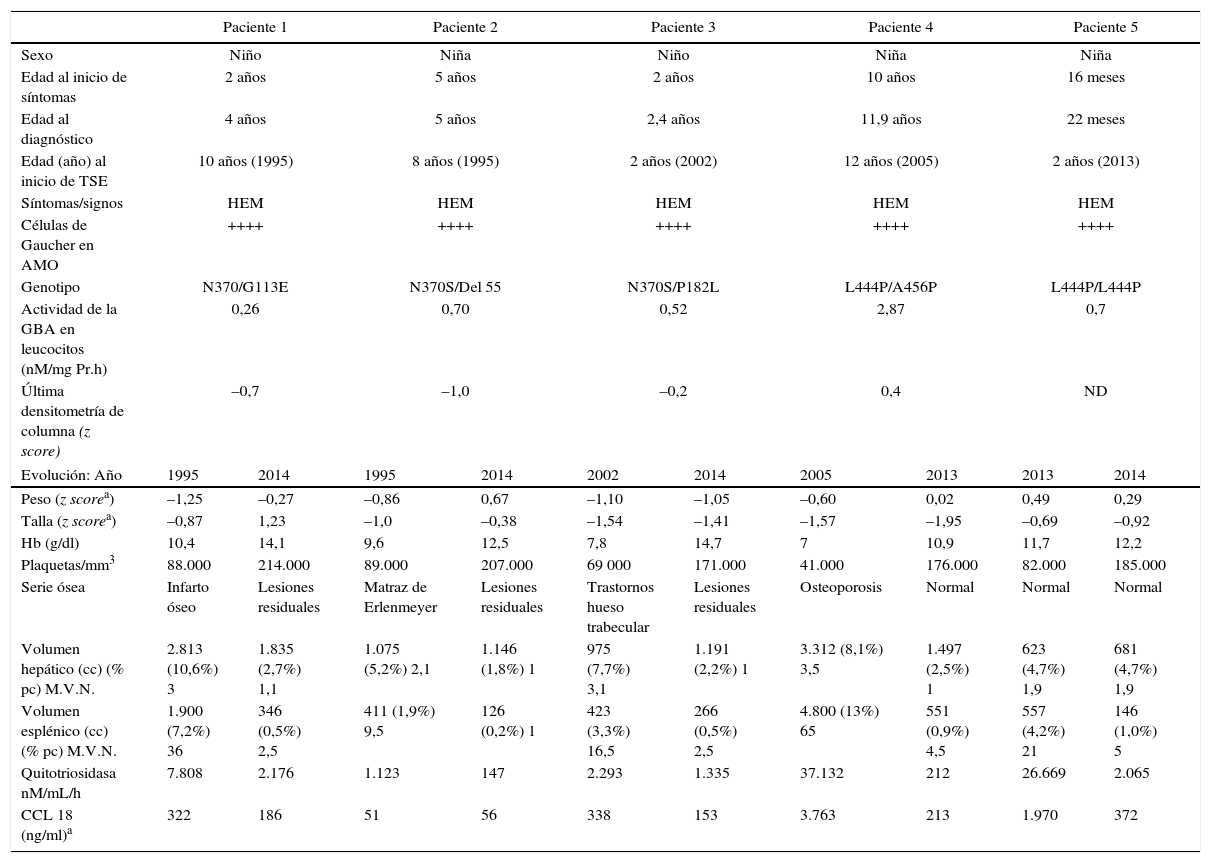
La tabla 1 muestra la evolución de los 5 pacientes con EG-1. La edad al diagnóstico osciló entre los 22 meses y los 11 años. En todos los casos se encontraron células de Gaucher en el aspirado de médula ósea. El análisis genético detectó la mutación N370S en heterocigosis en 3 de los pacientes y la mutación L444P en 2. Todos los pacientes presentaron hepatoesplenomegalia y anemia. La hepatomegalia inicial era de 1,9 a 3,5 veces el volumen normal, y la esplenomegalia de 9 a 65 veces el volumen normal. Un paciente presentó lesiones por infarto óseo y 2 tenían fémures con forma de matraz de Erlenmeyer. La AGL osciló entre 0,26 y 2,87nM/mg Prot.h (por debajo del 8% del valor control en todos los casos). Los pacientes 1 y 2 fueron tratados con alglucerasa entre 1995 y 1998 y, a partir de entonces, con imiglucerasa. Todos los pacientes mejoraron en peso y talla, y en los niveles de hemoglobina y plaquetas. El TSE redujo el volumen hepático hasta 3 veces, y el esplénico entre 4 y 5. Estas mejoras ocurrieron principalmente durante los primeros 12-24 meses de tratamiento. Los pacientes no requirieron transfusiones de sangre. En el año 2009, debido a una escasez en el suministro de imiglucerasa que duró 6 meses4, 2 pacientes empezaron a ser tratados con miglustat. Ambos mostraron un incremento en la quitotriosidasa y la CCL18; y los niveles de estos 2 biomarcadores se normalizaron al reintroducir el TSE a las dosis previas. Estos pacientes no presentaron afectación hematológica u ósea ni mostraron cambios en la hepatoesplenomegalia. En 4 pacientes con EG-1, el TSE se inició antes de los 10 años de edad (en 2 de ellos a los 2 años). Dos pacientes han recibido TSE durante 20 años y uno durante 13 años. En ningún caso hubo eventos adversos relacionados con el TSE, y en todos se alcanzaron y mantuvieron los objetivos terapéuticos5. La mutación N370S protege contra la afectación neurológica, mientras que la mutación L444P, presente en el 77% de los alelos de la EG neuronopática, aumenta el riesgo de esta forma de la enfermedad. No obstante, la coexistencia de determinados polimorfismos puede modificar este riesgo6. El paciente 4, que no presentó síntomas neurológicos, mostró lesiones hiperintensas en la sustancia blanca periventricular en RM que se han mantenido estables. De modo similar, en el paciente 5, homocigoto para la mutación L444P, la RM craneal y el examen neurológico fueron normales y respondió bien a la TSE.
Características basales y evolución de pacientes con EG tipo 1
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Sexo | Niño | Niña | Niño | Niña | Niña | |||||
| Edad al inicio de síntomas | 2 años | 5 años | 2 años | 10 años | 16 meses | |||||
| Edad al diagnóstico | 4 años | 5 años | 2,4 años | 11,9 años | 22 meses | |||||
| Edad (año) al inicio de TSE | 10 años (1995) | 8 años (1995) | 2 años (2002) | 12 años (2005) | 2 años (2013) | |||||
| Síntomas/signos | HEM | HEM | HEM | HEM | HEM | |||||
| Células de Gaucher en AMO | ++++ | ++++ | ++++ | ++++ | ++++ | |||||
| Genotipo | N370/G113E | N370S/Del 55 | N370S/P182L | L444P/A456P | L444P/L444P | |||||
| Actividad de la GBA en leucocitos (nM/mg Pr.h) | 0,26 | 0,70 | 0,52 | 2,87 | 0,7 | |||||
| Última densitometría de columna (z score) | –0,7 | –1,0 | –0,2 | 0,4 | ND | |||||
| Evolución: Año | 1995 | 2014 | 1995 | 2014 | 2002 | 2014 | 2005 | 2013 | 2013 | 2014 |
| Peso (z scorea) | –1,25 | –0,27 | –0,86 | 0,67 | –1,10 | –1,05 | –0,60 | 0,02 | 0,49 | 0,29 |
| Talla (z scorea) | –0,87 | 1,23 | –1,0 | –0,38 | –1,54 | –1,41 | –1,57 | –1,95 | –0,69 | –0,92 |
| Hb (g/dl) | 10,4 | 14,1 | 9,6 | 12,5 | 7,8 | 14,7 | 7 | 10,9 | 11,7 | 12,2 |
| Plaquetas/mm3 | 88.000 | 214.000 | 89.000 | 207.000 | 69 000 | 171.000 | 41.000 | 176.000 | 82.000 | 185.000 |
| Serie ósea | Infarto óseo | Lesiones residuales | Matraz de Erlenmeyer | Lesiones residuales | Trastornos hueso trabecular | Lesiones residuales | Osteoporosis | Normal | Normal | Normal |
| Volumen hepático (cc) (% pc) M.V.N. | 2.813 (10,6%) 3 | 1.835 (2,7%) 1,1 | 1.075 (5,2%) 2,1 | 1.146 (1,8%) 1 | 975 (7,7%) 3,1 | 1.191 (2,2%) 1 | 3.312 (8,1%) 3,5 | 1.497 (2,5%) 1 | 623 (4,7%) 1,9 | 681 (4,7%) 1,9 |
| Volumen esplénico (cc) (% pc) M.V.N. | 1.900 (7,2%) 36 | 346 (0,5%) 2,5 | 411 (1,9%) 9,5 | 126 (0,2%) 1 | 423 (3,3%) 16,5 | 266 (0,5%) 2,5 | 4.800 (13%) 65 | 551 (0,9%) 4,5 | 557 (4,2%) 21 | 146 (1,0%) 5 |
| Quitotriosidasa nM/mL/h | 7.808 | 2.176 | 1.123 | 147 | 2.293 | 1.335 | 37.132 | 212 | 26.669 | 2.065 |
| CCL 18 (ng/ml)a | 322 | 186 | 51 | 56 | 338 | 153 | 3.763 | 213 | 1.970 | 372 |
AMO: aspirado de médula ósea; CCL 18: quimiocina (motivo C-C) ligando 18; EG: enfermedad de Gaucher; GBA: glucocerebrosidasa; Hb: hemoglobina; % pc: porcentaje con respecto al peso corporal; HEM: hepatoesplenomegalia; M.V.N.: múltiplo del valor normal (valor normal: hígado: 2,5% del peso corporal; bazo: 0,2% del peso corporal); ND: no hay datos.
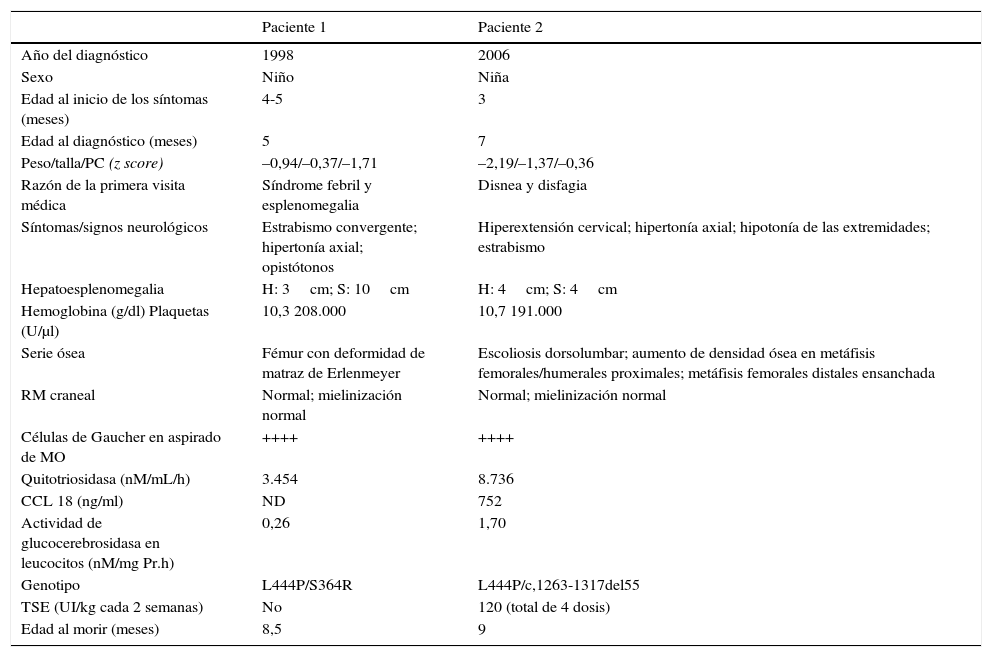
Como se aprecia en la tabla 2, los pacientes con EG-2 presentaron hepatoesplenomegalia, trastornos óseos y quitotriosidasa elevada, pero la RM craneal no mostró lesiones importantes. Ambos tenían la mutación L444P en heterocigosis y murieron antes de los 9 meses de edad. Uno de estos pacientes fue tratado con 4 dosis de TSE de 120 UI/kg. Hemos de resaltar que una RM craneal normal no descarta la EG-2.
Características basales de pacientes con EG tipo 2
| Paciente 1 | Paciente 2 | |
|---|---|---|
| Año del diagnóstico | 1998 | 2006 |
| Sexo | Niño | Niña |
| Edad al inicio de los síntomas (meses) | 4-5 | 3 |
| Edad al diagnóstico (meses) | 5 | 7 |
| Peso/talla/PC (z score) | –0,94/–0,37/–1,71 | –2,19/–1,37/–0,36 |
| Razón de la primera visita médica | Síndrome febril y esplenomegalia | Disnea y disfagia |
| Síntomas/signos neurológicos | Estrabismo convergente; hipertonía axial; opistótonos | Hiperextensión cervical; hipertonía axial; hipotonía de las extremidades; estrabismo |
| Hepatoesplenomegalia | H: 3cm; S: 10cm | H: 4cm; S: 4cm |
| Hemoglobina (g/dl) Plaquetas (U/μl) | 10,3 208.000 | 10,7 191.000 |
| Serie ósea | Fémur con deformidad de matraz de Erlenmeyer | Escoliosis dorsolumbar; aumento de densidad ósea en metáfisis femorales/humerales proximales; metáfisis femorales distales ensanchada |
| RM craneal | Normal; mielinización normal | Normal; mielinización normal |
| Células de Gaucher en aspirado de MO | ++++ | ++++ |
| Quitotriosidasa (nM/mL/h) | 3.454 | 8.736 |
| CCL 18 (ng/ml) | ND | 752 |
| Actividad de glucocerebrosidasa en leucocitos (nM/mg Pr.h) | 0,26 | 1,70 |
| Genotipo | L444P/S364R | L444P/c,1263-1317del55 |
| TSE (UI/kg cada 2 semanas) | No | 120 (total de 4 dosis) |
| Edad al morir (meses) | 8,5 | 9 |
CCL18: quimiocina (motivo C-C) ligando 18; EG: enfermedad de Gaucher; MO: médula ósea; ND: no hay datos; PC: perímetro cefálico; RM: resonancia magnética; TSE: terapia de sustitución enzimática.
En resumen, en los 20 años en los que se ha utilizado el TSE en pacientes con EG en nuestro centro hemos observado la evolución de pacientes de diferentes características: a) Tres pacientes con EG-1 con la mutación N370S evolucionaron bien, excepto durante el período de escasez del TSE, que afectó a 2 pacientes que mostraron incrementos considerables en los valores de quitotriosidasa y CCL18; estos marcadores son más sensibles y precoces que los cambios observados en parámetros hematológicos y óseos; b) Dos pacientes con EG-1 con la mutación L444P no presentaron ningún signo o síntoma neurológico durante los períodos de 10 y 2 años, respectivamente, en los que recibieron TSE, y c) Los 2 pacientes con EG-2 fallecieron a los 2-3 meses del diagnóstico, a pesar de haber sido tratados con dosis altas de TSE. Esta es la razón por la que las guías de tratamiento actuales no recomiendan el uso del TSE en la EG-27.