El síndrome de Cushing es una patología poco frecuente en la edad pediátrica producida por un exceso de glucocorticoides de origen endógeno o exógeno1. Los síntomas clásicos presentes en adultos (estrías rojo-vinosas, obesidad troncular, debilidad muscular…) no suelen aparecer en niños y debemos sospechar este diagnóstico en niños y adolescentes obesos que presenten un enlentecimiento de la velocidad de crecimiento. La sospecha diagnóstica no siempre es fácil y algunos pacientes acuden a revisiones durante años hasta ser diagnosticados2. Exponemos a continuación un paciente que presentó un estancamiento estatural asociado a una pérdida de peso sin ninguna otra sintomatología relevante.
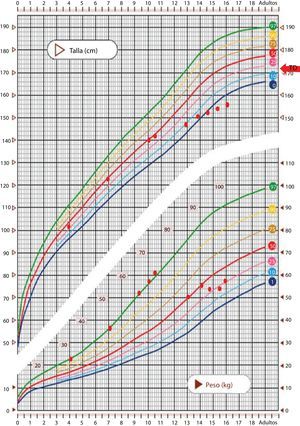
Se trata de un varón de 16 años remitido desde consultas de gastroenterología/psiquiatría infantil, donde realizaba seguimiento desde los 11 años por anorexia, para valoración de enlentecimiento de la velocidad de crecimiento. Refieren obesidad hasta los 11 años y posteriormente disminución del peso hasta un p25 y descenso de la talla hasta p<3 (fig. 1). Practicaba fútbol en un equipo de alto nivel y negaba consumo de fármacos o sustancias anabolizantes.
En la exploración física presentaba una talla de –2,4 DE, con peso e IMC normal para su edad (–0,4 DE y +0,6 DE, respectivamente) e hipertrofia de pantorrillas, con estadio puberal de Tanner V y volumen testicular de 20 cc bilateral. No presentaba otros estigmas típicos del síndrome de Cushing.
Se realizaron un hemograma y bioquímica, y un estudio hormonal que incluyó la determinación de hormonas tiroideas, prolactina y factor de crecimiento similar a la insulina, que informaron valores normales. También se realizó una cortisoluria en orina de 24 h en dos muestras, con resultados de 504 μg/24h (321 μg/m2) y 180 μg/24h (114,6 μg/m2). La cortisoluria en orina de 24 h es la primera prueba que se debe realizar ante la sospecha de un síndrome de Cushing y se consideran normales valores inferiores a 70 μg/m2/día3,4.
Se completó el cribado de la enfermedad administrando 1mg de dexametasona por vía oral a las 23:00h, con determinación del cortisol plasmático a las 8:00h del día siguiente, sin que se produjera una supresión de los niveles plasmáticos. Además, se determinó el cortisol en plasma a las 8:30h y a las 23:00h, objetivándose la pérdida del ritmo circadiano del cortisol (tabla 1).
Determinaciones de cortisol y ACTH basales y tras la administración de dexametasona a dosis de 1 y 8mg
| Pruebas funcionales | |
| Supresión con DXT 1mg v.o. (23:00h) | |
| Cortisol | Post-DXT (8:30h)11,4 μg/dl |
| Ritmo circadiano | ||
| Cortisol | Basal (8:30h)9,2 μg/dl | (23:00h)7,6 μg/dl |
| Supresión con DXT 8mg v.o. (23:00h) | ||
| Cortisol | Basal (8:30h)9,2 μg/dl | Post-DXT (8:30h)<1mg/dl |
| ACTH | Basal (8:30h)39,7ng/l | Post-DXT (8:30h)15ng/l |
Una vez realizado el diagnóstico del hipercortisolismo, se determinó el valor de la hormona corticotropina (ACTH) basal en plasma, que estaba elevado y orientaba a la presencia de un síndrome de Cushing dependiente de ACTH (valores superiores a 20ng/l confirman la dependencia)5. Por último, para localizar la hiperproducción del cortisol se hizo una prueba de supresión con dosis alta de dexametasona (administración de 8mg por vía oral a las 23:00h), resultando una supresión del cortisol plasmático superior al 90% que sugería el origen hipofisario de la enfermedad3-6 (tabla 1).
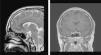
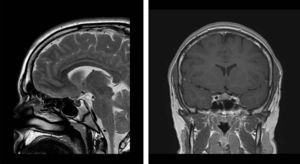
En la RM craneal se objetivó la presencia de un microadenoma hipofisario (3mm×5mm). Con todos estos datos se realizó el diagnóstico de enfermedad de Cushing (fig. 2).
El síndrome de Cushing es poco frecuente en niños y adolescentes; solo el 10-15% de los casos se diagnostica en la edad pediátrica1,2. La causa más frecuente de hiperproducción endógena de glucocorticoides es la presencia de un microadenoma hipofisario productor de ACTH (enfermedad de Cushing). Habitualmente, la enfermedad de Cushing se presenta en niños como un enlentecimiento de la velocidad de crecimiento asociado a un aumento de la ganancia ponderal, y todo ello es secundario a una exposición prolongada a glucocorticoides. El retraso del crecimiento a menudo precede a otras manifestaciones y se debe a una disminución de la síntesis junto con una resistencia a IGF-12. Por otra parte, los esteroides actúan directamente sobre las epífisis de los huesos reduciendo el crecimiento. Por este motivo, cuando se detecte un estancamiento estatural (con o sin pérdida de peso), siempre se ha de contemplar la posibilidad de que exista un exceso de glucocorticoides exógeno o endógeno. Nuestro paciente presentaba un enlentecimiento de la velocidad de crecimiento con una curva ponderal aplanada, sin obesidad.
Para poder diagnosticar la presencia de un hipercortisolismo es necesario realizar la determinación seriada del cortisol libre urinario y la confirmación de la pérdida del ritmo circadiano del cortisol plasmático. Los criterios diagnósticos en la población pediátrica se basan en estudios publicados en adultos y en datos comunicados por el National Institute of Health4. Es indispensable ser muy metódico en la realización de las pruebas complementarias dirigidas a establecer el diagnóstico definitivo con objeto de evitar la interpretación inadecuada de los resultados.