En España no se dispone de una guía de profilaxis antibiótica en cirugía cardíaca pediátrica. El objetivo del estudio es conocer la variabilidad en las pautas existentes en nuestro país.
Material y métodosSe elaboró un cuestionario que se envió a los integrantes del Grupo de Cardiología de la Sociedad Española de Cuidados Intensivos Pediátricos, con participación de 15 centros.
ResultadosEn el post-operatorio con tórax cerrado existe unanimidad en pacientes pediátricos en emplear una cefalosporina de primera o segunda generación, mientras que en neonatos 3 centros amplían la cobertura antibiótica. Once hospitales realizan profilaxis durante 12-72 h y 4 la prolongan hasta retirar los drenajes.
Trece centros utilizan ocasionalmente cierre esternal diferido. Ocho mantienen la misma pauta antibiótica que en cierre de esternotomía en quirófano. La profilaxis se mantiene durante 12-72 h en 6 centros y hasta el cierre del tórax en el resto. De los 10 hospitales que realizan asistencia con oxigenación con membrana extracorpórea (ECMO), 5 aplican el mismo protocolo que para cirugía sin ECMO.
ConclusionesSe observa una amplia variabilidad de pautas en los pacientes de mayor riesgo. Es necesario homogeneizar los protocolos existentes.
No Spanish guidelines for the prevention of surgical wound infection in paediatric cardiac surgery are currently available. The aim of this study was to analyse the nationwide variability in antibiotic prophylaxis use.
Material and methodsAn online questionnaire was distributed to all members of the Cardiology Group of the Spanish Society of Paediatric Intensive Care. Fifteen centres participated in the study.
ResultsIn heart surgery with no delayed sternal closure, all 15 centres used a 1st or 2nd generation cephalosporin in paediatric patients, while 3 hospitals used a broader-spectrum antibiotic therapy in neonates. Prophylaxis was maintained for 12-72h in 11 centres and until drainage removal in four.
Thirteen centres used delayed sternal closure, eight of which followed the same protocol for these patients as for standard procedures. Prophylaxis was maintained for 12-72h in 6 centres, and until sternal closure at the rest. Five out of 10 centres performing extracorporeal membrane oxygenation (ECMO) maintained the same antibiotic protocol as in standard surgery.
ConclusionsA wide variability was observed in antibiotic prophylaxis use in high-risk patients. Thus, national protocols need to be standardised.
El post-operatorio de cirugía cardíaca representa uno de los motivos más frecuentes de ingreso en las unidades de cuidados intensivos (UCI) pediátricos y neonatales1. Los avances médicos actuales han permitido una supervivencia global de estos pacientes superior al 95%. No obstante, una causa importante de morbilidad y en ocasiones de mortalidad en estos pacientes es la infección nosocomial, especialmente la infección de la herida quirúrgica. Las tasas de infección en cirugía cardíaca, así como sus factores de riesgo, están bien documentados en pacientes adultos2. En cambio, la información disponible en población pediátrica es escasa, con tasas de infección que oscilan entre el 0,5 y el 6,5%3–5.
La cirugía cardíaca se considera una cirugía limpia, pero la contaminación exógena de la herida es inevitable, bien sea por la flora cutánea del propio paciente durante el acto quirúrgico o por la manipulación de la herida en el post-operatorio. El riesgo de infección varía según la inmunidad del paciente, el tipo de cirugía y el inóculo bacteriano3,4. El uso de antibióticos profilácticos representa una medida adicional para evitar el crecimiento de microorganismos en la herida y debe ser activa frente a los microorganismos de la piel, especialmente cocos grampositivos (CGP). La prolongación de la profilaxis y el uso de antibióticos de amplio espectro favorece el desarrollo de resistencias, aumenta los efectos adversos y supone un gasto económico innecesario6.
En algunos pacientes o en algún tipo específico de reparaciones, el cierre esternal inmediato no es bien tolerado y debe diferirse para favorecer la estabilidad hemodinámica en el post-operatorio inmediato7,8. El mantenimiento del tórax abierto se postula como un factor de riesgo añadido de infección de herida quirúrgica, por lo que en las pautas de profilaxis antibiótica se tiende a diferenciar entre pacientes en los que se realiza cierre de tórax en quirófano y aquellos en que el post-operatorio inmediato se desarrolla con el tórax abierto6,9.
A nivel internacional, en pacientes en los que el post-operatorio transcurre con el tórax cerrado está extendido el uso de cefalosporinas de primera y segunda generación durante 12 a 72 h. Por el contrario, en post-operados con cierre de tórax diferido existe mayor variabilidad, tanto en el antibiótico de elección como en su duración, siendo frecuente que se añada cobertura para bacilos gramnegativos (BGN)6,9.
El objetivo de este trabajo es presentar las distintas pautas de profilaxis antibiótica de infección de herida quirúrgica que se emplean en los hospitales españoles en los que se realiza cirugía cardíaca pediátrica.
Material y métodosSe trata de un estudio transversal, multicéntrico, de ámbito nacional. La fuente de información del estudio fue un cuestionario elaborado conjuntamente con el Grupo de Infección Nosocomial de la Sociedad Española de Infectología Pediátrica (anexo 2) y que se envió vía correo electrónico a los distintos representantes del Grupo de Cardiología de la Sociedad Española de Cuidados Intensivos Pediátricos (SECIP) (anexo 1) en noviembre de 2011. El cuestionario constaba de 6 ítems en formato abierto en los que se solicitaba información correspondiente al año 2011 sobre: a) nombre del centro; b) características del centro y tipo de unidad donde ingresaba el paciente; c) número de intervenciones de cirugía cardíaca realizadas anualmente; d) antibióticos profilácticos empleados; d) duración de la profilaxis, según si el postoperatorio inmediato transcurría con el tórax cerrado o abierto, y e) protocolo de profilaxis antibiótica en pacientes en asistencia con oxigenación con membrana extracorpórea (ECMO) en los centros que dispusieran de ella. Los resultados de las variables cuantitativas se expresan en términos de frecuencias absolutas y porcentajes.
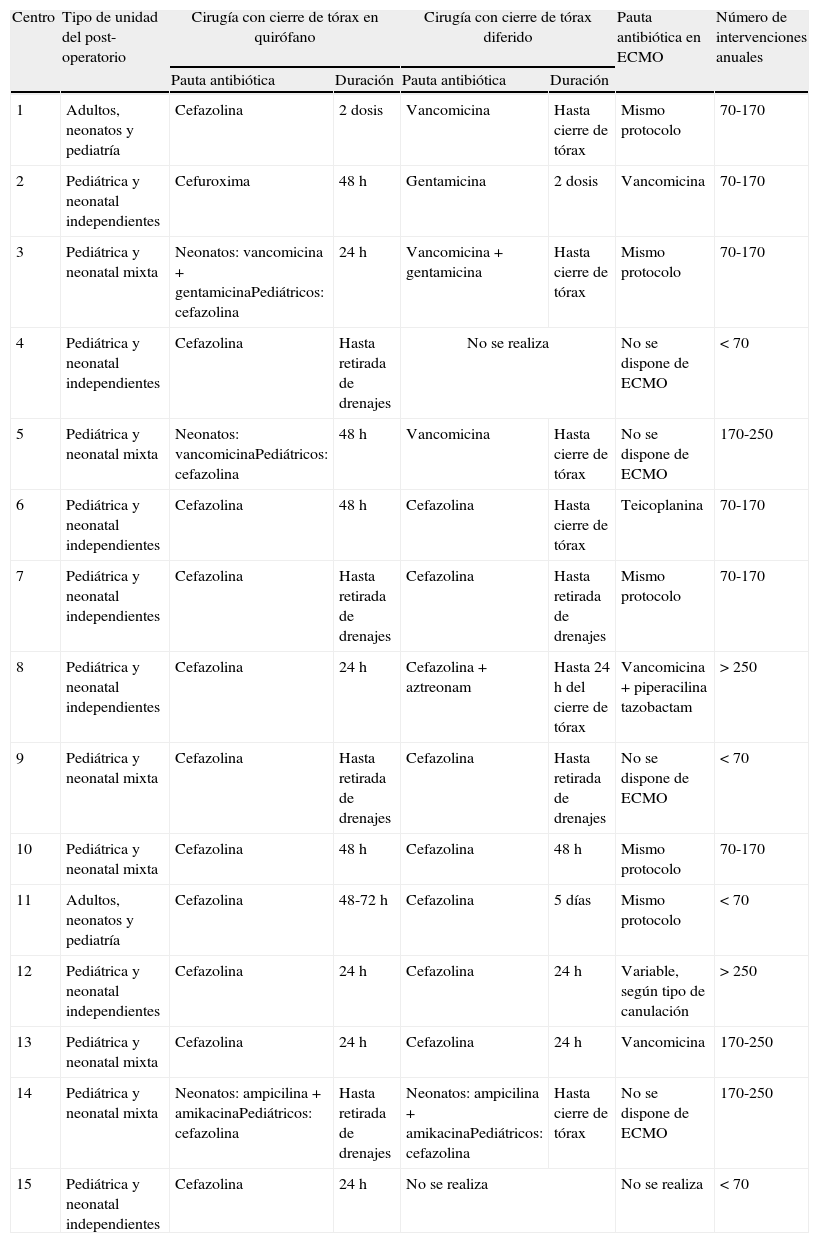
ResultadosCaracterísticas del centro y de la unidad post-operatoriaParticiparon en la encuesta 15 (88%) de los 17 centros encuestados (anexo 3). El resumen de los cuestionarios obtenidos se muestra en la tabla 1.
Resumen de los cuestionarios obtenidos
| Centro | Tipo de unidad del post-operatorio | Cirugía con cierre de tórax en quirófano | Cirugía con cierre de tórax diferido | Pauta antibiótica en ECMO | Número de intervenciones anuales | ||
| Pauta antibiótica | Duración | Pauta antibiótica | Duración | ||||
| 1 | Adultos, neonatos y pediatría | Cefazolina | 2 dosis | Vancomicina | Hasta cierre de tórax | Mismo protocolo | 70-170 |
| 2 | Pediátrica y neonatal independientes | Cefuroxima | 48 h | Gentamicina | 2 dosis | Vancomicina | 70-170 |
| 3 | Pediátrica y neonatal mixta | Neonatos: vancomicina + gentamicinaPediátricos: cefazolina | 24 h | Vancomicina + gentamicina | Hasta cierre de tórax | Mismo protocolo | 70-170 |
| 4 | Pediátrica y neonatal independientes | Cefazolina | Hasta retirada de drenajes | No se realiza | No se dispone de ECMO | < 70 | |
| 5 | Pediátrica y neonatal mixta | Neonatos: vancomicinaPediátricos: cefazolina | 48 h | Vancomicina | Hasta cierre de tórax | No se dispone de ECMO | 170-250 |
| 6 | Pediátrica y neonatal independientes | Cefazolina | 48 h | Cefazolina | Hasta cierre de tórax | Teicoplanina | 70-170 |
| 7 | Pediátrica y neonatal independientes | Cefazolina | Hasta retirada de drenajes | Cefazolina | Hasta retirada de drenajes | Mismo protocolo | 70-170 |
| 8 | Pediátrica y neonatal independientes | Cefazolina | 24 h | Cefazolina + aztreonam | Hasta 24 h del cierre de tórax | Vancomicina + piperacilina tazobactam | > 250 |
| 9 | Pediátrica y neonatal mixta | Cefazolina | Hasta retirada de drenajes | Cefazolina | Hasta retirada de drenajes | No se dispone de ECMO | < 70 |
| 10 | Pediátrica y neonatal mixta | Cefazolina | 48 h | Cefazolina | 48 h | Mismo protocolo | 70-170 |
| 11 | Adultos, neonatos y pediatría | Cefazolina | 48-72 h | Cefazolina | 5 días | Mismo protocolo | < 70 |
| 12 | Pediátrica y neonatal independientes | Cefazolina | 24 h | Cefazolina | 24 h | Variable, según tipo de canulación | > 250 |
| 13 | Pediátrica y neonatal mixta | Cefazolina | 24 h | Cefazolina | 24 h | Vancomicina | 170-250 |
| 14 | Pediátrica y neonatal mixta | Neonatos: ampicilina + amikacinaPediátricos: cefazolina | Hasta retirada de drenajes | Neonatos: ampicilina + amikacinaPediátricos: cefazolina | Hasta cierre de tórax | No se dispone de ECMO | 170-250 |
| 15 | Pediátrica y neonatal independientes | Cefazolina | 24 h | No se realiza | No se realiza | < 70 | |
ECMO: oxigenación con membrana extracorpórea.
En 2 hospitales (13%) el post-operatorio se desarrolla en una unidad de cuidados intensivos compartida para pacientes neonatales, pediátricos y adultos. Seis centros (40%) disponen de una unidad mixta para pacientes neonatales y pediátricos, mientras que en los 7 hospitales restantes (47%) existen unidades independientes para neonatos y pacientes pediátricos.
De los centros que respondieron a la encuesta, 4 (27%) realizan menos de 70 intervenciones de cirugía cardíaca anualmente, 6 (40%) llevan a cabo entre 70 y 170 operaciones, 3 (20%) entre 170 y 250, mientras que 2 centros (13%) superan las 250 intervenciones anuales.
Pauta de profilaxis antibiótica en cirugía con cierre de tórax en quirófanoAntibióticos empleadosEn las intervenciones en las que el post-operatorio transcurre con el tórax cerrado, existe coincidencia en pacientes pediátricos en seleccionar una cefalosporina de primera o segunda generación (cefazolina en 14 centros y cefuroxima en uno). En neonatos, 13 centros (86,5%) utilizan un único antibiótico (11 cefazolina, uno cefuroxima y uno vancomicina); los 2 centros restantes (13,5%) amplían la cobertura antibiótica a 2 antimicrobianos: vancomicina-gentamicina y ampicilina-amikacina.
DuraciónEn 11 centros (73%), la duración de la profilaxis se mantiene entre 12 y 72 h. En cambio, los otros 4 (27%) la prolongan hasta la retirada de los drenajes pleuromediastínicos (habitualmente entre 3 y 5 días).
Pauta de profilaxis antibiótica en cirugía con cierre de tórax diferidoAntibióticos empleadosDe los 15 centros que respondieron, 13 (86,5%) utilizan el cierre esternal diferido en determinados pacientes de riesgo. En 8 de los 13 (61,5%), se mantiene la misma pauta antibiótica que en cirugía con cierre de la esternotomía en quirófano. Los 5 hospitales restantes (38,5%) utilizan 2 antibióticos o uno de mayor espectro: vancomicina (2 centros), gentamicina, vancomicina-gentamicina y cefazolina-aztreonam.
DuraciónEn este tipo de cirugía, 6 centros (46%) mantienen la profilaxis entre 12 y 72 h, mientras que los 7 restantes (54%) la alargan hasta el cierre definitivo del tórax (habitualmente entre 2 y 5 días).
Pauta de profilaxis antibiótica en oxigenación con membrana extracorpóreaDiez de los hospitales (66,5%) que participaron en la encuesta disponen de ECMO. De ellos, 5 (50%) mantienen la misma pauta antibiótica que en cirugía cardíaca que no precisa ECMO. El resto utiliza distintas pautas: teicoplanina, vancomicina (2 centros), vancomicina con piperacilina-tazobactam y pauta variable según canulación cervical o transtorácica.
DiscusiónEsta es la primera encuesta publicada que pretende dar a conocer las distintas pautas de profilaxis antibiótica en cirugía cardíaca pediátrica empleada en las unidades de cuidados intensivos pediátricas y neonatales de nuestro país.
La base de la prevención de la infección de herida quirúrgica se fundamenta en la aplicación de unas medidas no farmacológicas apropiadas: higiene y desinfección de la piel en el preoperatorio, mantenimiento estricto de la asepsia durante el acto quirúrgico y realización de la curas post-operatorias de la herida quirúrgica en condiciones de asepsia10. A pesar de ello, la profilaxis con antibióticos sigue considerándose un factor importante en la prevención de la infección de la herida quirúrgica. Aunque existen guías internacionales de profilaxis antibiótica en cirugía cardíaca11,12, la epidemiología de los microorganismos causantes de infección de la herida quirúrgica puede variar según cada centro, por lo que es fundamental considerar este aspecto a la hora de establecer las recomendaciones específicas.
Los resultados de la encuesta muestran notables diferencias entre las pautas empleadas en los distintos centros que respondieron a la encuesta. Destaca que, de forma global, tan solo 3 centros coinciden en emplear el mismo protocolo de profilaxis antibiótica, mientras que el resto aplican pautas distintas entre sí. En cirugía con cierre de tórax en quirófano, tal y como sucede en la literatura internacional, existe una mayor uniformidad. Se trata del tipo de post-operatorio más frecuente y la incisión quirúrgica representa el momento de máximo riesgo de infección, por lo que la cobertura de CGP que colonizan la piel, con una cefalosporina de primera o segunda generación, se considera la pauta más adecuada6,9,11,12. En cambio, la cirugía con cierre de tórax diferido es menos frecuente y, además, los factores de riesgo se prolongan en el tiempo y varían más en función de los dispositivos y curas que se apliquen13. A nivel internacional, hay centros que mantienen como antibiótico profiláctico una cefalosporina de primera o segunda generación, mientras que otros amplían el espectro antimicrobiano para cubrir CGP (incluyendo Staphylococcus aureus resistente a meticilina) y BGN: vancomicina-gentamicina, teicoplanina-amikacina, vancomicina-cefotaxima, vancomicina-meropenem6. En nuestro estudio, la consideración de esta cirugía como de mayor riesgo desde el punto de vista infeccioso y el aislado con más frecuencia de BGN ha llevado a varios centros a ampliar la cobertura antibiótica a menudo con un segundo fármaco y mantenerla hasta la sutura de la esternotomía.
Uno de los retos en la utilización de la ECMO es el control de la infección nosocomial, en especial aquellos casos de canulación torácica14. Al igual que lo que se aprecia en nuestra encuesta (en los 10 centros que utilizan esta técnica, se aplican 7 pautas antibióticas profilácticas distintas), no existe en la actualidad un consenso en los antibióticos a emplear, en su duración, ni en si es necesario modificarlo según el tipo de canulación. Se observa que la mayoría de centros mantienen el mismo protocolo de profilaxis antibiótica que para cirugía con cierre esternal diferido6.
La encuesta revela una gran variabilidad de pautas de profilaxis antibiótica en los pacientes de mayor riesgo (post-operados con tórax abierto y en asistencia con ECMO). Si bien es cierto que se debe adaptar la profilaxis antibiótica a la epidemiología de cada hospital, consideramos que sería útil consensuar las diferentes pautas utilizadas en nuestro país para poder realizar futuros estudios de su efectividad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Ángela Ferrer Barba, Complejo Hospitalario Universitario, A Coruña. Patricia Roselló Millet, Hospital Clínico Universitario, Valencia. Victoria Ramos Casado, Hospital 12 de Octubre, Madrid. Eider Oñate Vergara, Hospital Donostia, San Sebastián. Amelia Caridad Sánchez Galindo, Hospital Gregorio Marañón, Madrid. Rosa Pérez-Piaya Moreno, Hospital Madrid-Montepríncipe, Madrid. Guillermo Milano Manso, Hospital Materno Infantil Carlos Haya, Málaga. José Camacho Alonso, Hospital Materno Infantil Carlos Haya, Málaga. José Manuel González González, Hospital Materno Infantil Carlos Haya, Málaga. Paula Madurga Revilla, Hospital Infantil Miguel Servet, Zaragoza. José Luís Vázquez Martínez, Hospital Ramón y Cajal, Madrid. César Pérez-Caballero Macarrón, Hospital Ramón y Cajal, Madrid. Ignacio Ibarra de la Rosa, Hospital Reina Sofía, Córdoba. Juan Luís Pérez Navero, Hospital Reina Sofía, Córdoba. Manuel Frías Pérez, Hospital Reina Sofía, Córdoba. Esther Ulloa Santamaría, Hospital Reina Sofía, Córdoba. José Jiménez Martínez, Hospital Sanitas La Moraleja, Madrid. Joan Balcells Ramírez, Hospital Universitari Vall d’Hebron, Barcelona, Francisco José Cambra Lasaosa, Hospital Sant Joan de Déu, Barcelona. Javier Gil Antón, Hospital Universitario Cruces, Bilbao. Silvia Redondo Blázquez, Hospital Universitario Cruces, Bilbao. Juan Antonio García Hernández, Hospital Virgen del Rocío, Sevilla. Eduardo Consuegra, Hospital Materno Infantil, Gran Canaria. Silvia Vidal Micó, Hospital Universitari i Politècnic La Fe, Valencia. Catalina González Hervás, Hospital Universitario Virgen de las Nieves, Granada.
Ana Abril Molina, Hospital Universitario Virgen de las Nieves, Granada. Fabiola Caracseghi, Hospital Universitari Vall d’Hebron, Barcelona. Andrea Martín-Nalda, Hospital Universitari Vall d’Hebron, Barcelona. José Antonio Couceiro Gianzo, Hospital, Complejo Hospitalario de Pontevedra. Ana Menasalvas Ruíz, Hospital Virgen de la Arrixaca, Múrcia. David Moreno Pérez, Hospital Materno Infantil Carlos Haya, Málaga. Roi Piñeiro Pérez, Hospital Universitario Puerta del Hierro-Majadahonda, Madrid. José Rumbao Aguirre, Hospital Reina Sofía, Córdoba. María del Mar Santos Sebastián, Hospital Gregorio Marañón, Madrid.
Hospital Universitario Virgen de las Nieves, Granada. Complejo Hospitalario Universitario, A Coruña. Hospital Universitari Vall d’Hebron, Barcelona. Hospital Materno Infantil Carlos Haya, Málaga. Hospital Reina Sofía, Córdoba. Hospital 12 de Octubre, Madrid. Hospital Madrid-Montepríncipe, Madrid. Hospital Infantil Miguel Servet, Zaragoza. Hospital Ramón y Cajal, Madrid. Hospital Universitario Cruces, Bilbao. Hospital Sant Joan de Déu, Barcelona. Hospital Virgen del Rocío, Sevilla. Hospital Materno Infantil, Gran Canaria. Hospital Universitari i Politècnic La Fe, Valencia. Hospital Gregorio Marañón, Madrid.