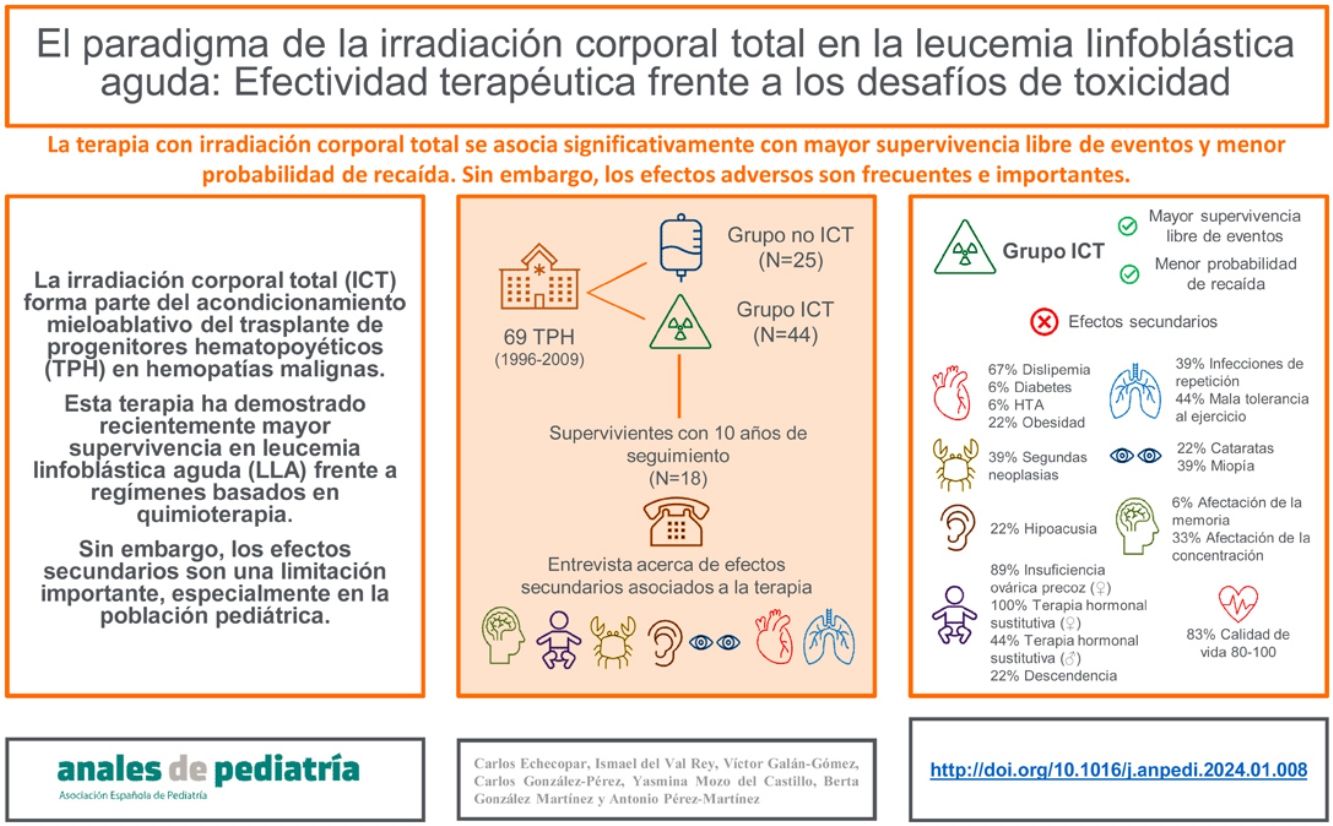
La irradiación corporal total (ICT) forma parte del acondicionamiento mieloablativo del trasplante de progenitores hematopoyéticos (TPH) en hemopatías malignas. Esta terapia ha demostrado recientemente mayor supervivencia en leucemia linfoblástica aguda (LLA) frente a regímenes basados en quimioterapia. Sin embargo, los efectos secundarios son una limitación importante, especialmente en la población pediátrica.
Pacientes y métodosAnalizamos retrospectivamente la supervivencia de pacientes con LLA que recibieron un TPH en un hospital terciario entre los años 1996 a 2009 (N=69 TPH en 57 pacientes). Diferenciamos una cohorte que había recibido ICT (N=44) y otra que no (N=25). Posteriormente entrevistamos a los supervivientes del grupo ICT con un mínimo de 10 años de seguimiento (N=18), preguntando acerca de la presencia de efectos secundarios.
ResultadosLa supervivencia global (SG) a los 2 y 5 años fue del 79,1 y 65,2%, respectivamente para el grupo ICT y del 66,2 y 55,8% para el grupo no ICT, aunque esta diferencia no fue significativa (p=0,31). La supervivencia libre de evento (SLE) a los 2 y 5 años fue del 77,3 y 63,6%, respectivamente para el grupo ICT y del 56 y 32% para el grupo no ICT (p=0,02). La probabilidad de recidiva (PR) a los 2 años habiendo recibido ICT fue del 10% y sin haber recibido ICT del 28,6% (p=0,005). Los supervivientes que recibieron ICT desarrollaron neoplasias secundarias (39%), dislipemia (67%), alteraciones cognitivas (44%), infecciones respiratorias de repetición (39%), alteraciones tiroideas (45%), insuficiencia ovárica precoz (89%), cataratas (22%) y problemas psicológicos (44%), aunque la calidad de vida, valorada por ellos mismos, fue considerada como buena para el 83% de los encuestados.
ConclusionesLos pacientes que recibieron ICT tuvieron significativamente mayor SLE y menor PR. Sin embargo, los efectos adversos son frecuentes e importantes, aunque no afectan subjetivamente a la calidad de vida.
Total body irradiation (TBI) is part of the myeloablative conditioning for hematopoietic stem cell transplantation (HSCT) in malignant hematologic disorders. This therapy has recently shown improved survival in acute lymphoblastic leukemia (ALL) compared to chemotherapy-based regimens. However, side effects are a significant limitation, especially in the pediatric population.
Patients and methodsWe retrospectively analyzed the survival of patients with ALL who underwent an HSCT at a tertiary hospital between 1996 and 2009 (N=69 HSCT in 57 patients). We differentiated a cohort that received TBI (N=44) from another that did not (N=25). Subsequently, we interviewed the survivors from the TBI group with a minimum of 10 years of follow-up (N=18), asking about the presence of side effects.
ResultsThe overall survival (OS) at 2 and 5 years was 79.1% and 65.2% respectively for the TBI group and 66.2% and 55.8% for the non-TBI group, although this difference was not significant (P=.31). The event-free survival (EFS) at 2 and 5 years was 77.3% and 63.6% respectively for the TBI group and 56% and 32% for the non-TBI group (P=.02). The probability of relapse (PR) at 2 years for those who received TBI was 10% compared to 28.6% for those who did not receive TBI (P=.005). Survivors who received TBI developed secondary neoplasms (39%), dyslipidemia (67%), cognitive impairments affecting memory (44%), recurrent respiratory infections (39%), thyroid abnormalities (45%), premature ovarian failure (89%), cataracts (22%), and psychological problems (44%). However, the quality of life, as self-assessed by the patients, was considered good for 83% of the participants.
ConclusionsPatients who received TBI had significantly higher EFS and lower PR. However, adverse effects are frequent and significant, although they do not subjectively affect quality of life.
El trasplante de progenitores hematopoyéticos (TPH) es un tratamiento de consolidación de la leucemia aguda linfoblástica (LLA) de alto riesgo. Esta terapia precisa de un acondicionamiento previo, el cual tiene como objetivos el crear espacio en la médula ósea del receptor para las nuevas células progenitoras hematopoyéticas del donante, generar una inmunosupresión suficiente que impida que el sistema inmune del paciente rechace las células progenitoras del donante y eliminar la mayor cantidad de posible enfermedad residual1. Clásicamente, los regímenes mieloablativos han sido los indicados en hemopatías malignas por su gran afecto antitumoral. Sin embargo, la toxicidad asociada a la terapia constituye su principal limitación en pediatría.
La irradiación corporal total (ICT) es una terapia que forma parte de algunos regímenes de acondicionamiento mieloablativos, aplicando radioterapia en todo el organismo con una dosis en torno a 12Gy2. El acondicionamiento con ICT constituye el estándar en el TPH desde hace más de 70 años, con resultados clínicos, que aún no han sido superados por los acondicionamientos con quimioterapia. En el año 2021 se publicó el estudio FORUM, un ensayo de fase III multicéntrico a nivel internacional que comparó ICT vs. quimioterapia, concluyendo que la ICT presenta mayor supervivencia global a los 2 años y menor riesgo de recidiva3.
Sin embargo, en este estudio no se consideran los efectos a largo plazo de la ICT en la población pediátrica. La ICT es una terapia que está asociada a múltiples efectos secundarios a medio y largo plazo, especialmente en pacientes pediátricos4–6. Los efectos adversos se ven acrecentados a menor edad del paciente, y no es un tratamiento recomendado para menores de 4 años7,8.
Durante los últimos años, las denominadas medidas patient-reported outcome mesaures (PROMs) y patient-reported experience measures (PREMs) han sido objeto de estudio con el objetivo de ayudar a medir el impacto de una determinada intervención desde el punto de vista del propio paciente9, siendo especialmente importante su estudio en pacientes con un elevado riesgo de morbilidad como son los pacientes que han recibido un TPH10.
El objetivo de nuestro estudio es realizar un análisis retrospectivo de supervivencia en los pacientes con LLA que hayan recibido un TPH, comparando a los pacientes que hayan recibido ICT con los que no han recibido ICT como parte de su acondicionamiento. Otro objetivo es el de describir la morbilidad acumulada de los pacientes que recibieron ICT como parte de su acondicionamiento, teniendo en cuenta las medidas PREMs para tratar de obtener información más completa sobre los efectos adversos asociados a la terapia, directamente desde la experiencia de los pacientes.
Pacientes y métodosSe trata de un estudio analítico retrospectivo en el cual analizamos los TPH realizados por LLA en el servicio de hematología y oncología pediatría de un hospital terciario entre los años 1996-2009. Durante este tiempo se realizaron 69 TPH a 57 pacientes. Elaboramos una base de datos clínicos de los pacientes separándolos entre los que habían recibido ICT durante su acondicionamiento y los que solo recibieron quimioterapia (tabla 1). Los datos clínicos se obtuvieron a partir de las historias clínicas y las variables cuantitativas se expresaron en media y desviación estándar.
Características clínicas basales de los pacientes en función del acondicionamiento recibido
| Total | ICT | No ICT | Valor de p | |
|---|---|---|---|---|
| Número de casos, n (%) | 69 | 44 (64) | 25 (36) | — |
| Edad (años), media (DS) | 14,9 (7,6) | 17,9 (7,2) | 9,6 (5,2) | 0,000 |
| Edad al diagnóstico (años), media (DS) | 6,3 (3,9) | 7,5 (3,4) | 4,1 (3,7) | 0,000 |
| Edad al TPH (años), media (DS) | 8,5 (4,3) | 9,8 (3,4) | 6,3 (4,7) | 0,001 |
| Género, n (%) | 0,941 | |||
| Varón | 41 (59) | 26 (59) | 15 (60) | |
| Mujer | 28 (41) | 18 (41) | 10 (40) | |
| Subtipo de LLA, n (%) | 0,075 | |||
| LLA B | 58 (84) | 39 (89) | 19 (76) | |
| LLA pre-B | 3 (4) | — | 3 (12) | |
| LLA Philadelphia | 5 (8) | 3 (7) | 2 (8) | |
| LLA T | 2 (3) | 2 (4) | — | |
| LLA bifenotípica | 1 (1) | — | 1 (4) | |
| Número de TPH, n (%) | 0,014 | |||
| 1. TPH | 60 (87) | 42 (96) | 18 (72) | |
| 2. TPH | 7 (10) | 1 (2) | 6 (24) | |
| 3. TPH | 2 (3) | 1 (2) | 1 (4) | |
| Tipo de donante, n (%) | 0,015 | |||
| DNE | 17 (25) | 8 (18) | 9 (36) | |
| Familiar idéntico | 29 (42) | 16 (36) | 13 (52) | |
| Autólogo | 23 (33) | 20 (46) | 3 (12) | |
| Fuente de PH, n (%) | 0,005 | |||
| SP | 34 (49) | 26 (59) | 8 (32) | |
| MO | 25 (36) | 16 (36) | 9 (36) | |
| CU | 10 (15) | 2 (5) | 8 (32) | |
| Enfermedad en el momento del TPH, n (%) | 0,656 | |||
| RC | 62 (90) | 39 (89) | 23 (92) | |
| RP | 7 (10) | 5 (11) | 2 (8) | |
CU: cordón umbilical; DNE: donante no emparentado; DS: desviación estándar; ICT: irradiación corporal total; LLA: leucemia linfoblástica aguda; MO: médula ósea; PH: progenitores hematopoyéticos; RC: remisión completa; RP: remisión parcial; SP: sangre periférica; TPH: trasplante de progenitores hematopoyéticos.
Las negritas indican los valores de p que fueron estadísticamente significativos.
El análisis de supervivencia se efectuó mediante el método de Kaplan-Meier. Las variables estudiadas fueron la supervivencia global (SG), la supervivencia libre de evento (SLE), considerando evento a la recaída o la muerte, la probabilidad de recidiva (PR) y la mortalidad relacionada con el trasplante (MRT). Para comparar estos parámetros se utilizó un log rank test.
En la segunda parte del estudio identificamos un total de 27 supervivientes de TPH por LLA con al menos 10 años de seguimiento, de los cuales finalmente aceptaron participar en la entrevista telefónica un total de 21 pacientes. De ellos, 18 pacientes (86%) recibieron ICT como parte de su acondicionamiento y 3 pacientes (14%) no recibieron ICT. Dado el escaso número de pacientes dentro del grupo no ICT (material suplementario 1), la comparación entre ambos grupos no fue posible, por lo que finalmente decidimos realizar un análisis descriptivo de los efectos adversos en el grupo ICT.
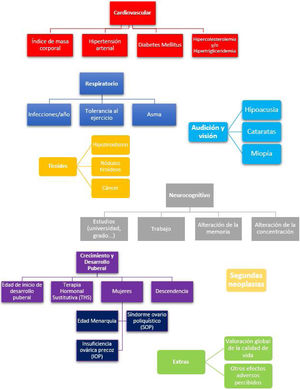
Las entrevistas telefónicas fueron realizadas siempre por el mismo investigador y consistieron en un cuestionario de elaboración propia con preguntas de respuestas cerradas compuesta por los ítems que se exponen en la figura 1. En este cuestionario se exploran los efectos secundarios más frecuentes tras un TPH: a) toxicidad pulmonar11, b) síndrome metabólico12, c) hipotiroidismo y cáncer de tiroides13, d) aparición de cataratas13, e) tinnitus y pérdida de audición14, f) déficits neurocognitivos15,16, g) desarrollo puberal y gonadal17 y h) segundas neoplasias18. Para completar la entrevista, añadimos 2 preguntas abiertas donde pudiesen exponer cualquier otro efecto adverso relevante no mencionado, así como una valoración del propio paciente de su calidad de vida en el momento actual con puntuación del 0-100.
El proyecto fue aprobado por el Comité de Ética de Investigación Clínica de nuestro centro el día 28 de marzo de 2022.
ResultadosDatos epidemiológicos de la muestraEn la tabla 1 se muestran las características clínicas de los pacientes incluidos en el estudio. La edad media de los pacientes trasplantados fue de 14,9±7,6 años, con una edad media al diagnóstico de 6,3±3,9 años y una edad media de realización del TPH de 8,5±4,3 años. Los pacientes que recibieron ICT tuvieron al diagnóstico, al TPH y al seguimiento una edad significativamente mayor que los pacientes que no recibieron ICT (p<0,001). El número de trasplantes fue significativamente mayor en el grupo de pacientes que no recibieron ICT, y el tipo de donante y fuente fue también diferente entre ambos grupos. No hubo diferencias significativas en cuanto al género, al subtipo de leucemia ni al estado de la enfermedad previo al TPH.
Análisis de supervivencia comparando irradiación corporal total vs. no irradiación corporal totalLa media de seguimiento de toda la serie fue de 8,4±7 años y de 12,4±6,6 para los supervivientes. En la tabla 2 se proporcionan los resultados resumidos del análisis de supervivencia
Análisis de supervivencia según el acondicionamiento recibido
| Total | ICT | No ICT | Valor de p | |
|---|---|---|---|---|
| SG 2 años (IC 95%) | 74,6 (69,3-79,9) | 79,1 (72,9-85,3) | 66,2 (56,4-76) | 0,31 |
| SLE 2 años (IC 95%) | 70 (64,5-75,5) | 77,3 (71-83,6) | 60 (50-70) | 0,02 |
| PR 2 años (IC 95%) | 16,5 (11,7-21,3) | 10 (5,2-14,8) | 18,3 (12-24,6) | 0,005 |
| Éxitus, n (%) | 29 (42) | 18 (41) | 11 (44) | 0,803 |
| MRT, n (%) | 16 (23) | 10 (23) | 6 (24) | 0,968 |
IC 95%: intervalo de confianza del 95%; ICT: irradiación corporal total; MRT: mortalidad relacionada con el trasplante; PR: probabilidad de recidiva; SG: supervivencia global; SLE: supervivencia libre de evento.
Las negritas indican los valores de p que fueron estadísticamente significativos.
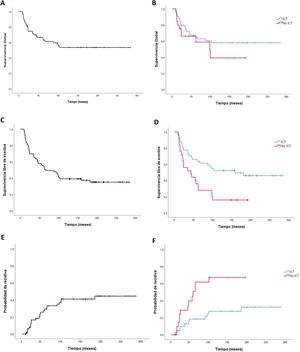
La supervivencia global (SG) a los 2 años fue del 74,6% (IC 95%: 69,3-79,9) y a 5 años del 64,8% (IC 95%: 70,7-58,9) (fig. 2). Comparando los grupos ICT vs. no ICT, se obtiene una SG a los 2 años del 79,1% para el grupo ICT (IC 95%: 72,9-85,3) vs. un 66,2% para el grupo no ICT (IC 95%: 56,4-76). La SG a 5 años fue del 65,2% para el grupo ICT (IC 95%: 57,9-72,5) vs. 58,8% para el grupo no ICT (IC 95%: 47,6-70), sin llegar a encontrar diferencias estadísticamente significativas (fig. 2).
Análisis de supervivencia libre de eventoLa supervivencia libre de evento (SLE) de toda la serie a los 2 años fue del 70% (IC 95%: 64,5-75,5), siendo a los 5 años del 53,6% (IC 95%: 47,6-59,6). Comparando los grupos ICT vs. no ICT, la SLE fue significativamente mayor en el grupo ICT, siendo a los 2 años del 77,3% (IC 95%: 71-83,6) vs. 60% (IC 95%: 50-70) para el grupo no ICT y a los 5 años del 63,6% (IC 95%: 56,3-70,9) vs. 32% (IC 95%: 22,7-41,3) (p=0,02) (fig. 2).
Se estudió la SLE a los 2 años según las variables con diferencias estadísticamente significativas entre el grupo ICT y no ICT, sin evidenciar diferencias significativas salvo en el tipo de donante de los pacientes (material suplementario 2).
Análisis de probabilidad de recidivaEn nuestra serie hay un total de 25 casos de recidivas (36%). Con una media de seguimiento hasta la recidiva de 3,4 años, la probabilidad de recidiva (PR) de toda la serie a los 2 años fue del 16,5% (IC 95%: 11,7-21,3) y a los 5 años del 20,8% (IC 95%: 12,6-29) (fig. 2). Diferenciando el acondicionamiento recibido, la PR habiendo recibido ICT a los 2 y 5 años fue del 10% (IC 95%: 5,2-14,8) y 18,3% (IC 95%: 12-24,6) vs. de no ICT 28,6% (IC 95%: 18,6-38,6) y 56% (IC 95%: 44,6-67,4), con una p=0,005.
Mortalidad relacionada con el tratamientoEn nuestra serie, 16 pacientes fallecieron a causa del TPH (23,2%). Al comparar la mortalidad relacionada con el tratamiento (MRT) con los diferentes regímenes de acondicionamiento, no se encontraron diferencias estadísticamente significativas.
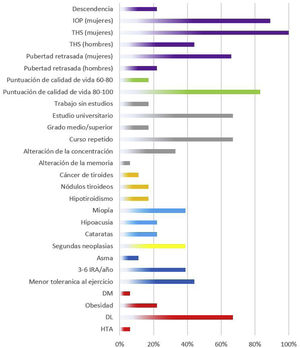
Descripción de los efectos adversos del grupo irradiación corporal totalLos efectos secundarios de los supervivientes de TPH que habían recibido ICT se detallan en la figura 3.
Se diagnosticaron 7 casos de neoplasias secundarias entre los supervivientes. Estas neoplasias consistieron en 2 casos de carcinoma folicular de tiroides, 2 tumores dermatológicos, un tumor de células granulares y un carcinoma basocelular, un tumor de partes blandas, no especificado, un tumor ovárico maligno, no especificado y un neurofibroma.
En la esfera respiratoria, un 44% de los pacientes refieren una menor tolerancia al ejercicio físico respecto a sus compañeros. En cuanto a los factores de riesgo cardiovasculares, un 22% de los pacientes presentan obesidad y un 67% dislipemia. El 45% de los encuestados presentaban alguna afectación tiroidea (17% tiroiditis, 17% nódulos tiroideos y 11% cáncer). Con relación a la esfera sexual, las 9 mujeres encuestadas precisaron de terapia hormonal sustitutiva (THS) y 8 de ellas desarrollaron insuficiencia ovárica precoz. En cuanto a otros efectos secundarios, se evidenció un 22% de cataratas, un 39% de miopía, un 22% de problemas de audición, un 33% de problemas de concentración y un 67% de problemas de rendimiento escolar.
Entre los efectos adversos que describen los propios pacientes destacan los problemas psicológicos relacionados tanto con la adaptación a la vida posterior al alta como con retomar las actividades cotidianas (56%). Los varones subrayan también la alopecia precoz (23%).
Respecto a la calidad de vida valorada por el propio paciente, la mayoría de los participantes cuentan con una calidad de vida puntuada por ellos mismos entre 80-100 puntos (83%).
DiscusiónA pesar de que no encontramos diferencias significativas en la SG a 2 años entre el grupo ICT y no ICT, la SLE y la PR fueron favorables para los pacientes que recibieron ICT durante el acondicionamiento. Estos resultados son similares con los del estudio prospectivo FORUM3. Esto sugiere un efecto protector de la ICT sobre la recaída.
En nuestro estudio, en el grupo que recibió ICT se realizaron significativamente más TPH autólogos en comparación con el grupo que no recibió ICT, donde se realizaron un mayor número de TPH alogénicos. En el TPH autólogo no se cuenta con el efecto de injerto contra leucemia que sí está presente en el TPH alogénico, pero a pesar de ello el análisis de supervivencia fue favorable al grupo que recibió ICT. Este hecho sugiere un gran efecto antileucemia de la ICT, pero debemos recordar que desde hace una más de una década no se recomienda el TPH autólogo como parte del tratamiento estándar de la leucemia aguda linfoblástica pediátrica.
De cara a una valoración global de la terapia, en este estudio intentamos describir los efectos adversos de pacientes que han recibido ICT como parte de su acondicionamiento, añadiendo el punto de vista del propio paciente en concordancia los recientemente establecidos marcadores de impacto PROMs y PREMs9.
El desarrollo de neoplasias malignas secundarias es un efecto secundario conocido del TPH, hay estudios que muestran que este riesgo se ve incrementado con el uso de ICT como método de acondicionamiento6. En nuestra serie de pacientes tratados con ICT aparecieron neoplasias secundarias en el 39%, siendo la mayoría de ellas de tiroides y de piel, dato muy superior al recogido en la literatura, con una incidencia aproximada del 3-5%19.
De acuerdo con la literatura, uno de los principales efectos adversos de la ICT es la toxicidad pulmonar, entre los cuales destacan la fibrosis pulmonar, descenso de la función respiratoria en las pruebas espirométricas y un aumento del número de infecciones11. De nuestros pacientes encontramos que un 44% refieren una menor tolerancia al ejercicio en comparación con sus compañeros de clase y un 11% tienen diagnosticado asma. Además, todos los pacientes presentan un grado leve/moderado de infecciones de repetición, siendo 11 (61%) los casos con menos de 3 episodios/año y 7 (39%) con 3-6 eventos al año.
Un 33% de los pacientes del grupo ICT refieren problemas de concentración, dato similar al recogido en la literatura, en el que uno de los efectos más relevantes en la esfera neurocognitiva de la radioterapia es la concentración, con un porcentaje de afectos del 50%16.
Las cataratas aparecieron en un 22% de los pacientes tratados con ICT, con una media de edad de 14 años y latencia de aproximadamente 2-2,5 años tras la realización del TPH, dato similar al recogido en la literatura con un 28% de incidencia tras ICT20.
Hasta un 50% de los pacientes que recibieron ICT se les diagnosticó de hipercolesterolemia con una edad media de 17-18 años, consiguiendo la mayoría control con medidas higiénico/dietéticas. Tanto la diabetes como el síndrome metabólico son efectos adversos en los pacientes tratados con radioterapia, afectando incluso a pacientes con un IMC normal21.
En cuanto a los efectos secundarios de la esfera sexual, las más afectadas son las mujeres, la mayoría (89%) afectas de insuficiencia ovárica precoz, necesitando de terapia hormonal sustitutiva para el resto de la vida y con la imposibilidad para la concepción. En la literatura se describe que las pacientes que reciben ICT tienen hasta un 30% menos de posibilidad de tener hijos17. Respecto a los varones existe claramente menor afectación con respecto a las mujeres, destaca en las preguntas la queja de muchos de ellos de alopecia precoz.
Sin embargo, a las preguntas acerca de la calidad de vida, la mayoría de los pacientes refieren una calidad de vida moderada/muy buena (83%), punto en común con la literatura, donde solo el 12% la catalogan como pobre19. Sin embargo, destaca que los propios pacientes refieren problemas psicológicos que han tenido durante los primeros años tras la enfermedad, sobre todo relacionados con depresión y ansiedad, requiriendo en muchos casos apoyo psicológico22.
A pesar de estos efectos secundarios, en nuestro estudio la mayoría de los pacientes refieren una buena calidad de vida, por encima de los 80-90 puntos, punto en común con la literatura, en la que el 57% de los pacientes puntúan su calidad de vida como buena o excelente, mientras que solo el 12% la catalogan como pobre23.
A pesar de que la recomendación actual sigue siendo el uso de ICT en la LLA pediátrica como parte del acondicionamiento para el TPH24, las toxicidades asociadas a esta terapia son importantes a medio/largo plazo. Sin embargo, los esquemas actuales de acondicionamiento con quimioterapia son claramente inferiores, por lo se debería explorar en ensayos clínicos randomizados la posibilidad de complementarlos con otras estrategias postrasplante que intensifiquen el efecto antileucemia sin generar toxicidad adicional, por ejemplo, mediante el uso de fármacos como inhibidores de la tirosina cinasa o diversas modalidades de inmunoterapia celular adoptiva.
Otras alternativas que se están considerando en la actualidad es la de reducir la intensidad de la ICT a 8Gy, alternativa que ha sido estudiada en adultos con LLA, y que aún debe ser confirmada en la población pediátrica25.
ConclusionesLos pacientes que recibieron acondicionamientos con ICT presentan mejor SLE y menor PR que los que recibieron acondicionamientos con quimioterapia. Esto sugiere un efecto protector sobre la recaída de la ICT, en concordancia con los resultados del estudio FORUM.
En este estudio, además hemos querido analizar los posibles efectos adversos asociados con la terapia ICT, teniendo en cuenta la perspectiva subjetiva de los propios pacientes a través de marcadores PREMs. Los supervivientes estudiados presentaron una alta tasa de complicaciones respiratorias en formas de infecciones respiratorias de repetición y disnea, desarrollo de síndrome metabólico con obesidad, HTA, diabetes y dislipemia, tiroiditis y cáncer tiroideo, desarrollo de cataratas y miopía, problemas de audición, dificultades de concentración y fracaso escolar, de insuficiencia ovárica precoz en el caso de las mujeres y desarrollo de neoplasias secundarias (en especial de tiroides y piel).
Es necesario implementar estrategias de seguimiento, monitorización e intervención, a medio y largo plazo en estos pacientes debido a la alta tasa de morbilidades que desarrollarán a lo largo de su vida. Para ello es importante incorporar la experiencia del paciente y su participación de forma directa a la hora de exponer su calidad de curación y el impacto en ella de los efectos adversos derivados del TPH.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a los Fondos FEDER (FIS) PI18/01301, y a la Fundación Cris contra el Cáncer (http://criscancer.org), por su apoyo.