El objetivo fue determinar si los antibióticos son más eficaces que el placebo o ninguna intervención en el tratamiento de la sinusitis aguda.
Pacientes y métodosSe revisaron las bases de datos y buscadores: PubMed, EMBASE, Cochrane Central Register of Controlled Trials y Google Académico para identificar ensayos clínicos aleatorizados (ECA) realizados en niños que compararan antibiótico frente a placebo. Se consideró sinusitis, la persistencia de sintomatología clínica compatible durante al menos 10 días. La calidad metodológica se evaluó mediante la escala de Jadad. Fueron seleccionados 4 ECA. Se evaluaron las siguientes variables: curación-mejoría clínica (a día 10-14), recaídas-recurrencias (a día 14-60) y presencia de efectos adversos. Los resultados se combinaron mediante metaanálisis. Se adoptó un análisis según modelo de efectos fijos o aleatorios en función de si existía o no heterogeneidad. El parámetro combinado que se estimó fue el riesgo relativo (RR) y su intervalo de confianza del 95% (IC 95%).
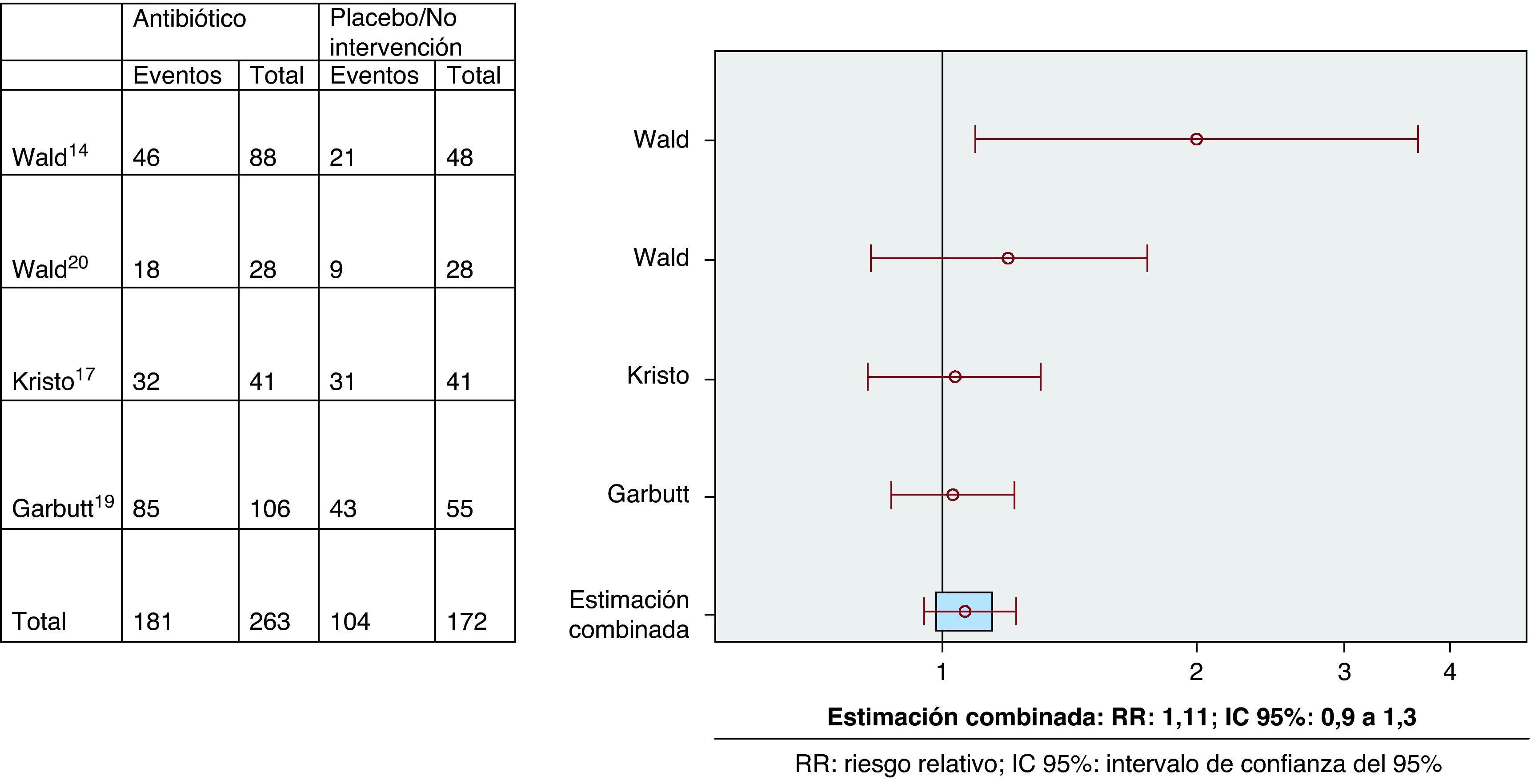
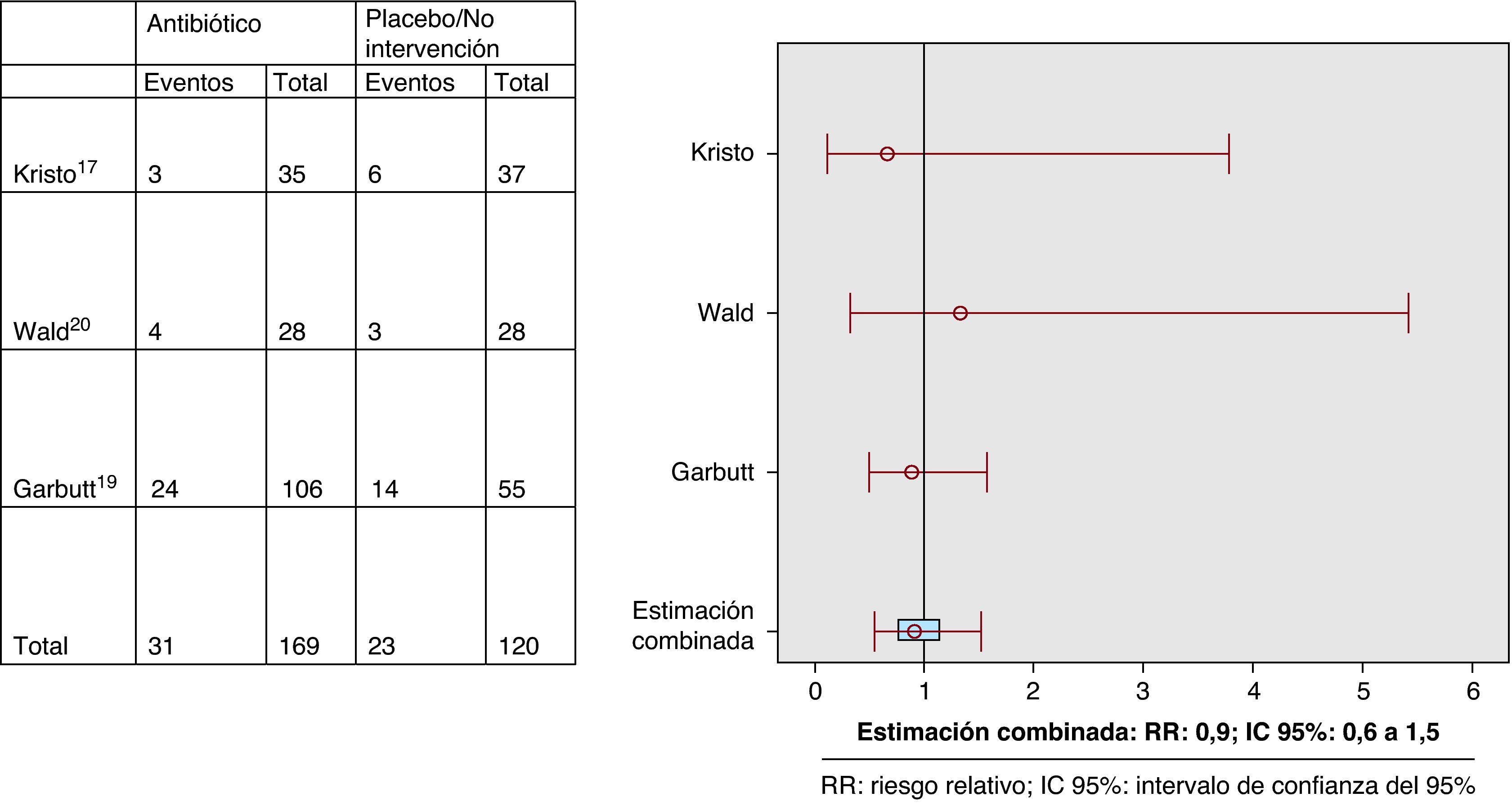
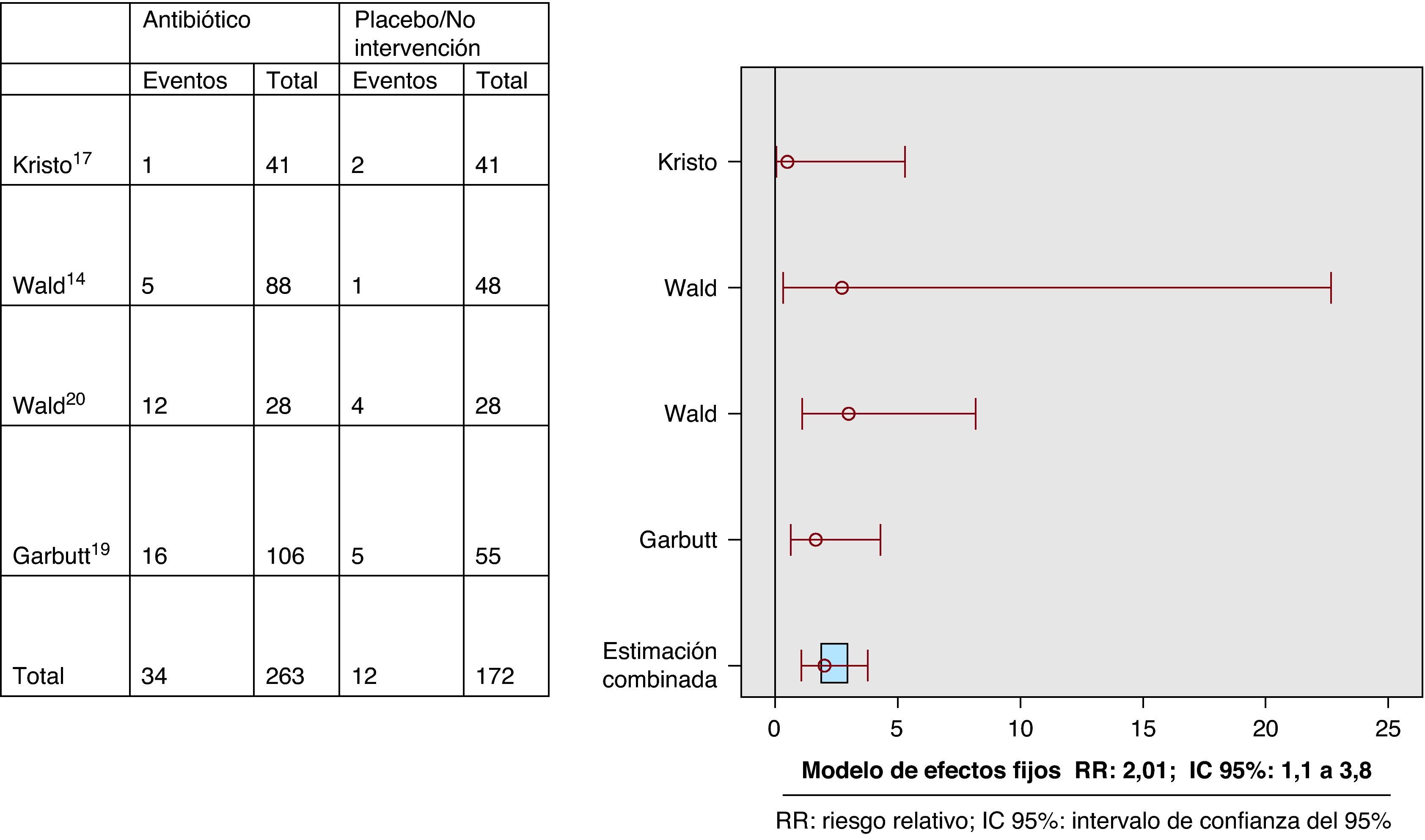
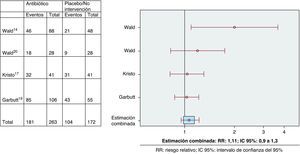
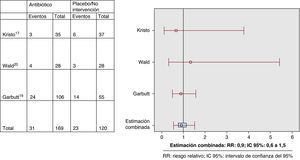
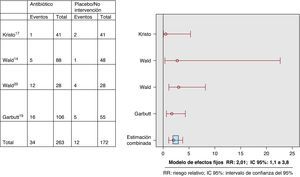
ResultadosDos ECA tenían una puntuación en la escala de Jadad ≥ 3. Variable curación-mejoría (4 ECA): RR: 1,11 (IC 95%: 0,9 a 1,3). Variable recaída-recurrencia (3 ECA): RR: 0,9 (IC 95%: 0,6 a 1,5); efectos adversos (4 ECA): 2,01 (IC 95%: 1,1 a 3,8).
ConclusionesEn niños con sinusitis aguda, el tratamiento antibiótico a las dosis estudiadas no parece aportar beneficio alguno en cuanto a la curación-mejoría evaluada al 10-14 día de seguimiento. El porcentaje de recaídas-recurrencias no fue inferior entre los niños que recibieron antibiótico. Los antibióticos se asocian con mayor probabilidad a efectos adversos.
The aim of this systematic review is to assess whether antibacterial agents are more effective than either placebo or no intervention at all in the treatment of acute bacterial sinusitis.
Patients and methodsWe reviewed the databases and search engines: PubMed, EMBASE, Cochrane Central Register of Controlled Trials and Google Scholar to identify randomized clinical trials (RCTs) in children comparing antibiotics versus placebo. Sinusitis was considered as the persistence of clinically compatible symptoms for at least 10 days. The methodological quality was assessed using the Jadad scale. Four RCTs were selected. We studied the following variables: cure, clinical improvement (on days 10 to 14), relapse-recurrence (from day 14 to day 60) and presence of adverse effects. The results were combined using meta-analysis. We used the fixed effects model or random model depending on whether or not there was heterogeneity. We estimated the combined relative risk (RR) and 95% confidence interval.
ResultsOnly two RCTs had a Jadad scale score ≥3. Variable cure-improvement (4 RCTs): RR 1.11 (95% CI: 0.9 to 1.3). Variable relapse-recurrence (3 RCTs): RR 0.9 (95% CI: 0.6 to 1.5). Adverse effects (4 RCTs): 2.01 (95% CI 1.1 to 3.8).
ConclusionsIn children with acute sinusitis, antibacterial agents at the studied doses did not appear to provide benefit in terms of cure and improvement, assessed at 10 to 14 days of follow up. Similarly, the percentage of relapse-recurrence was not lower among children who received antibiotics. Antibiotics are associated more frequently with adverse effects.
La sinusitis es una reacción inflamatoria de la mucosa de los senos paranasales. Se caracteriza por una conjunción de signos y síntomas: congestión u obstrucción nasal, descarga nasal (purulenta o no), rinorrea posterior, dolor facial o cefalea, fiebre, alteraciones del gusto y del olfato, tos, halitosis, y dolor dental1–3.
Se conoce como sinusitis aguda (SA) a la presencia de signos y/o síntomas compatibles durante al menos diez días sin mejoría y con una duración máxima no superior a cuatro semanas4,5.
Históricamente, la SA se ha considerado una infección bacteriana. Streptococcus pneumoniae y Haemophilus influenzae son los agentes etiológicos bacterianos más frecuentes, tanto en niños como en adultos5,6. Moraxella catarrhalis también debe considerarse, particularmente en la edad pediátrica3,5,6.
La SA es una importante causa de morbilidad aunque la mortalidad derivada de sus complicaciones es infrecuente7,8.
Tradicionalmente, el tratamiento de la SA se ha realizado mediante el uso de antibióticos (ATB). Actualmente, su indicación es controvertida, pues existen dudas sobre su efectividad3,9,10. Se ha de tener presente, que el uso inadecuado de ATB se asocia a un mayor índice de resistencias bacterianas11.
El objetivo principal de este estudio es determinar si, en niños diagnosticados de SA, el tratamiento ATB es más eficaz que el placebo o ninguna intervención para alcanzar la resolución clínica de la enfermedad. Como objetivos secundarios se estudió si los niños tratados con ATB presentaban un menor porcentaje de recaídas o recurrencias o una mayor frecuencia de efectos adversos asociados a la intervención.
Material y métodosSe realizó una búsqueda de ensayos clínicos aleatorizados (ECA) en las bases de datos de PubMed, EMBASE y Cochrane Central Register of Controlled Trials (hasta julio de 2010) y en el buscador Google Académico. Los estudios debían cumplir los siguientes criterios de inclusión: ECA; realizados en población pediátrica (de 0 a 18 años); que compararan ATB frente a placebo o ninguna intervención; y SA definida como congestión nasal, tos nocturna y/o diurna, cefalea, dolor facial y secreción nasal purulenta de duración ≥ 10 días. Se consideraron criterios de exclusión los ECA realizados en población adulta (≥ 18 años). En caso de recuperar algún estudio que incluyera población pediátrica y adulta, se extrajeron los datos únicamente referidos a edad pediátrica (< 18 años). También se excluyeron aquellos ECA que compararan la eficacia de dos o más ATB, sin grupo placebo. Todos estos cambios han sido introducidos en el manuscrito.
Se usaron los descriptores “Sinusitis”, “Rhinorrhea”, “Anti-Bacterial Agents”, “Rhinitis” y “Drug Therapy”. Se revisaron las bibliografías de los artículos recuperados para identificar estudios adicionales. No se hizo ninguna restricción por idioma. Se diseñó una hoja de extracción de datos y los resultados se extrajeron de cada estudio por parte de dos investigadores (JCB y BGI) de forma independiente y ciega. Los desacuerdos se resolvieron mediante consenso.
La calidad metodológica de cada ECA se evaluó mediante la escala de Jadad12, que fue aplicada por los dos investigadores (JCB y BGI) de forma independiente y ciega. Los desacuerdos se resolvieron mediante consenso.
Variables de resultadoSe estableció como variable principal la curación/mejoría clínica, evaluada transcurridos 10-14 días desde el inicio del tratamiento. Para ello se dicotomizó la variable principal, agrupando curación y mejoría por un lado, y persistencia y empeoramiento de la clínica por otro (siguiendo los criterios que para tal división realizaron los autores de cada ECA incluido). Otras variables de resultado medidas fueron: recaída, definida como paciente con sintomatología compatible con SA que no mejoró entre los días 21 y 28 de seguimiento, y que en el día 14 de seguimiento estaba considerado dentro del grupo curación-mejoría; y recurrencia: paciente con sintomatología compatible con SA en el segundo mes de seguimiento y de duración igual o superior a ≥ 10 días, y que a día 28 desde el inicio fue considerado dentro del grupo curación-mejoría; presencia de efectos adversos gastrointestinales.
Análisis estadísticoSe combinaron los datos de los estudios que utilizaron medidas de resultado comparables. Para todas las variables de resultado se obtuvo una estimación combinada del efecto del tratamiento mediante el cálculo del riesgo relativo (RR) y su intervalo de confianza del 95% (IC 95%). Se utilizó el método del inverso de la variancia según un modelo de efectos fijos o un modelo de efectos aleatorios, de acuerdo a la presencia o no de heterogeneidad en los resultados entre los estudios evaluados mediante la prueba Q. Se estimó que existía heterogeneidad si el valor de la prueba de significación estadística era inferior a 0,1. La presencia de sesgo de publicación se determinó mediante el método de Begg13. El análisis estadístico se realizó utilizando el programa SPSS 13.0.
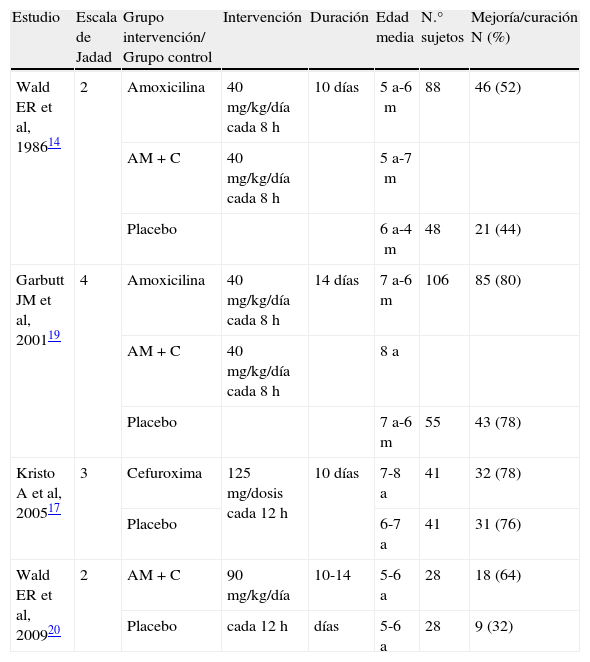
ResultadosSe recuperaron siete estudios14–20. Uno se descartó por ausencia de asignación aleatoria15, y otro por incluir exclusivamente población adulta16. Un tercer estudio no pudo ser localizado18. Cuatro ECA14,17,19,20 cumplieron los criterios de selección. Sus principales características se describen en la tabla 1.
Características de los ensayos clínicos sobre el tratamiento antibiótico de la sinusitis aguda
| Estudio | Escala de Jadad | Grupo intervención/ Grupo control | Intervención | Duración | Edad media | N.° sujetos | Mejoría/curación N (%) |
| Wald ER et al, 198614 | 2 | Amoxicilina | 40mg/kg/día cada 8h | 10 días | 5 a-6m | 88 | 46 (52) |
| AM+C | 40mg/kg/día cada 8h | 5 a-7m | |||||
| Placebo | 6 a-4m | 48 | 21 (44) | ||||
| Garbutt JM et al, 200119 | 4 | Amoxicilina | 40mg/kg/día cada 8h | 14 días | 7 a-6 m | 106 | 85 (80) |
| AM+C | 40mg/kg/día cada 8h | 8 a | |||||
| Placebo | 7 a-6 m | 55 | 43 (78) | ||||
| Kristo A et al, 200517 | 3 | Cefuroxima | 125mg/dosis cada 12 h | 10 días | 7-8 a | 41 | 32 (78) |
| Placebo | 6-7 a | 41 | 31 (76) | ||||
| Wald ER et al, 200920 | 2 | AM+C | 90mg/kg/día | 10-14 | 5-6 a | 28 | 18 (64) |
| Placebo | cada 12 h | días | 5-6 a | 28 | 9 (32) |
%: porcentaje; a: años; AM+C: amoxicilina+ácido clavulánico; h: horas; m: meses; N: número.
Fue posible determinar la variable principal en los cuatro ECA. No existieron diferencias entre los grupos de intervención y control en cuanto a la variable de resultado principal curación/mejoría clínica (prueba Q=0,19; RR estimado según modelo de efectos fijos: 1,11 (IC 95%: 0,9 a 1,3) (fig. 1). Respecto a la variable combinada recaída-recurrencia (tres estudios), no existieron diferencias entre el grupo de intervención y el de control (prueba Q: 0,4; RR estimado según modelo de efectos fijos: 0,9 (IC 95%: 0,6 a 1,5) (fig. 2). Los pacientes que recibieron ATB presentaron una mayor incidencia de efectos adversos, preferentemente vómitos y/o diarrea (variable recogida en cuatro ECA; prueba Q: 0,8; RR estimado según modelo de efectos fijos: 2 (IC 95%: 1,1 a 3,8) (fig. 3). El escaso número de estudios incluidos no hizo posible determinar la presencia de un sesgo de publicación.
Los resultados de la presente revisión sugieren que el tratamiento ATB, a las dosis estudiadas, en niños con SA no complicada no es más eficaz que el placebo para conseguir la curación-mejoría clínica a los 10-14 días de seguimiento.
Referente a la SA, se han publicado estudios epidemiológicos que sugieren que existe un elevado porcentaje de resolución espontánea, que oscilaría entre un 30 y un 80%21,23. Una correcta diferenciación de la infección aguda de vías respiratorias altas reduciría el uso inapropiado de ATBs21,22.
Analizando los cuatro ECA, deben señalarse algunos aspectos. La evaluación de la calidad metodológica mediante la escala de Jadad12 mostró resultados dispares. Dos ECA alcanzaron una puntuación inferior a 3 puntos, y se consideraron por tanto de baja calidad metodológica14,20. Wald et al14, en 1986, no describieron la forma en la que se llevó a cabo el doble ciego, a pesar de que los autores del artículo afirmaron que sí existió. No se describió el método de aleatorización. El mismo equipo investigador, en 200920, no describió el método de cegamiento. En ninguno de los dos estudios se efectuó ocultamiento de la secuencia de aleatorización (fue realizada por el mismo investigador principal). Los estudios de Garbutt et al19 y Kristo et al17 presentaron una puntuación ≥ 3, y se consideraron por tanto de buena calidad metodológica.
En cuanto a la procedencia de la muestra, en los dos ECA de Wald et al14,20 los pacientes se reclutaron en consultas externas de un hospital. Los otros dos estudios se emplazaron en Atención Primaria17,19.
Se observaron algunas diferencias en los criterios de inclusión de cada ECA. Así, Wald et al en 198614 consideraron necesaria, además de la clínica, la realización de una radiografía de senos paranasales patológica, realizada por un radiólogo que desconocía los datos clínicos. No se ofrecieron datos del número de radiólogos que las interpretaron ni la concordancia entre los mismos. Por otra parte, el seguimiento posterior mediante radiografía fue incompleto, y no se mostraron los resultados según el grupo de aleatorización. Kristo et al17 consideraron como criterio de inclusión una imagen ecográfica alterada en el momento de la sospecha diagnóstica, en al menos un seno maxilar.
Referente a la utilidad de la radiografía de senos paranasales como prueba complementaria en el diagnóstico y seguimiento de la SA, se recomienda que el estudio radiológico no se realice de forma rutinaria en la SA no complicada21,24–26. Es frecuente encontrar alteraciones de los senos paranasales en la radiografía simple o en la tomografía computerizada practicadas en niños sin evidencia clínica de SA21,27–31. En cuanto al uso de la ecografía para el diagnóstico de SA, las guías de práctica clínica consultadas no tienen en cuenta esta prueba diagnóstica, y no pueden por tanto ofrecer datos de su utilidad real21,23.
En tres ECA14,17,20 el análisis de los resultados se efectuó por protocolo; excepto Garbutt et al19, que realizaron un análisis mediante intención de tratar. Wald et al20 realizaron los dos tipos de análisis. Los mismos autores, en su estudio de 198614, excluyeron 28 pacientes post-aleatorización por causa dudosamente justificada como fue el aislamiento de un cultivo faríngeo positivo para estreptococo del grupo A. El elevado porcentaje de pérdidas de dicho estudio (31,6%), la ausencia de análisis multivariable para ajustar por potenciales variables de confusión, la presencia de un posible sesgo de financiación y la ausencia del cálculo previo de tamaño de la muestra son aspectos a tener en cuenta a la hora de valorar este estudio, cuyos autores concluyeron que el tratamiento con ATB era más eficaz que el placebo para conseguir la resolución clínica de la enfermedad.
También se encontraron limitaciones en los ECA de Garbutt et al19 y Kristo et al17: la medición de la variable principal fue realizada por los padres en un estudio19, y por acuerdo entre padres y médico en otro17. La valoración del resultado sólo por los padres podría implicar la presencia de un sesgo de mala clasificación, que en cualquier caso afectaría a ambos grupos de tratamiento por igual. El ECA realizado por Kristo et al17 era el único que tenía la potencia estadística suficiente para detectar diferencias estadísticamente significativas en la medición de la variable de resultado principal.
Se debe destacar la importancia de las posologías utilizadas en cada ECA. En la tabla 1 se detallan las dosis de ATB utilizadas14,17,19,20. A priori, podría atribuirse la ausencia de efecto del tratamiento ATB (respecto a placebo) por parte de Garbutt et al19 y de Kristo et al17 a la utilización de dosis bajas. Desde mediados de los años noventa, la resistencia de S. pneumoniae a la penicilina se ha incrementado21. También lo ha hecho la producción de betalactamasas por parte de H. influenzae y M. catarrhalis. Este fenómeno fue determinante para recomendar el aumento de las dosis de ATB (en concreto amoxicilina) para el tratamiento de la otitis media aguda24 y, al compartir otitis y SA los mismos agentes etiológicos, dicha recomendación se extendió a esta última. Actualmente, la Academia Americana de Pediatría recomienda el empleo de amoxicilina y amoxicilina-clavulánico a dosis entre 80 y 90mg/kg al día para evitar dichas resistencias14,21,24,32. También defiende su empleo a dosis comprendidas entre 45 y 90mg/kg, en algunas situaciones concretas: SA de severidad moderada o baja, niños que no acuden a la guardería o que no han sido tratados con ATB en los noventa días precedentes24.
Los pacientes de los estudios de Garbutt et al19 y Kristo et al17 fueron reclutados entre 1997 y 2001. En aquellos años se consideraba que la resistencia a S. pneumoniae oscilaba entre un 15 y un 38%24. De los neumococos resistentes, la mitad poseía una resistencia intermedia, y la otra mitad, elevada. Por otra parte, el 50% de los H. influenzae y el 100% de M. catarrhalis eran productores de betalactamasas24. Por todo lo expuesto, parece ser que no todos los niños que supuestamente tuvieran SA bacteriana poseerían un germen resistente y, por tanto, muchos (quizá la mayoría) recibieron una dosis suficiente. En el supuesto contrario, asumiendo que las dosis de ATB administradas fueran insuficientes, se ha de resaltar el elevado porcentaje de curaciones obtenido en ambos estudios en el grupo tratado con ATB: 80% en el ECA de Garbutt et al21 y 78% en el de Kristo et al19.
Los resultados de esta revisión sistemática deben interpretarse con cautela. Deberán ser apoyados por nuevos ECAs en el futuro con tamaños de muestra más amplios, con potencia adecuada para demostrar un efecto clínicamente importante en la variable de resultado principal (curación-mejoría). Estos nuevos ECAs deberían efectuarse con dosis de ATB suficientes, de acuerdo a las recomendaciones de las guías de práctica clínica actualmente vigentes21,23,24. En esos futuros ECAs debería planificarse a priori un control de los posibles factores de confusión mediante las técnicas estadísticas adecuadas. Sería interesante determinar también si el tratamiento ATB disminuye el número de días con síntomas, de forma similar a lo que sucede en la otitis media aguda33. Una revisión sistemática realizada en población adulta constató una tendencia a la mejoría con el uso de ATB cuando la variable de resultado principal era “falta de curación o mejoría a los 7-15 días de seguimiento” (RR: 0,66; IC 95%: 0,44 a 0,98)34. Sin embargo, los propios autores de la revisión señalan la escasa importancia clínica de este resultado ya que el porcentaje de curación-mejoría fue de 90% en los pacientes tratados con ATB y de 80% en los que recibieron placebo34.
Una limitación adicional del presente estudio es que, a pesar de los esfuerzos realizados para intentar recuperar todos los ECA de interés, puede haberse dado el caso de que alguno no haya sido localizado, hecho no infrecuente al realizar una revisión sistemática de la literatura35.
Respecto a la posibilidad de la presencia de un sesgo de publicación, el pequeño número de ECA localizados impide su estimación. De todos modos, cabe recordar que este sesgo suele estar presente cuando se localizan ECA favorables a la intervención de interés35.
De los resultados del presente estudio se concluye que el tratamiento con ATB (AM, AM+C y cefuroxima) a las dosis estudiadas no parece aportar beneficio alguno en cuanto a la curación/mejoría medida entre los días 10 a 14 de tratamiento, respecto al placebo o ninguna intervención. Asimismo, tampoco parece disminuir el porcentaje de recurrencias/recaídas entre los tratados con ATB a estas dosis. Sí se constató un aumento de la incidencia de efectos adversos entre los niños que tomaron ATB.
Los resultados de la presente revisión sistemática son de interés para la práctica clínica diaria, pues sugieren que, en niños con SA no complicada, el tratamiento exclusivamente sintomático es una opción a tener en cuenta siempre que el seguimiento del paciente esté asegurado, pudiendo de esta manera ahorrar tratamientos ATB innecesarios - o bien prescribiéndolos sólo en casos de evolución tórpida -, disminuir los costes del manejo de la enfermedad y la yatrogenia terapéutica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.