El crecimiento en pacientes con déficit aislado de hormona del crecimiento (GH) es heterogéneo a pesar del tratamiento, debido a la baja especificidad de las pruebas diagnósticas, por lo que es necesario definir las variables de eficacia.
ObjetivosEvaluar la eficacia de la terapia de reemplazo hormonal en niños con déficit aislado de GH.
MétodosEstudio observacional-ambispectivo de pacientes tratados en nuestro servicio en los últimos 14 años por déficit aislado de GH, definido como GH inferior a 7,4mg/dl en 2 pruebas de estímulo, en pacientes con talla<−2DE y velocidad de crecimiento disminuida.
ResultadosSe estudiaron 97 pacientes. El 69% eran varones. Con el tratamiento hubo una ganancia de talla de 1,17DE. El 79,31% alcanzaron la talla diana. El 71,13% fueron reevaluados en la edad adulta, de los cuales el 39,4% mantuvo el déficit. La talla diana, el pronóstico de talla adulta y la ganancia puberal total se correlacionaron positivamente con la talla adulta, mientras que la relación edad ósea/edad cronológica y factor de crecimiento insulínico tipo 1 inicial mostraron una correlación negativa. Ninguno tuvo efectos secundarios.
ConclusionesLa mayoría de los pacientes alcanzaron la talla diana, aunque no todos mostraron permanencia del déficit en edad adulta. La talla diana, el pronóstico de talla adulta y las variables de pubertad están directamente relacionados con la talla adulta; mientras que la edad ósea/edad cronológica y factor de crecimiento insulínico tipo 1 están inversamente relacionadas, pudiendo utilizarse estas como variables de eficacia. No se han observado efectos adversos en la muestra con las dosis utilizadas.
Growth in patients with isolated growth hormone (GH) deficiency is heterogeneous despite treatment due to the low specificity of diagnostic tests, making it necessary to define efficacy variables.
AimsTo evaluate efficacy of hormone replacement therapy in children with isolated GH deficiency.
MethodsObservational-ambispective study of patients treated in our department in the last 14 years for isolated GH deficiency. This was defined as a GH level less than 7.4mg/dl in response to 2 stimulation tests in patients with height<2SD and a decreased growth rate.
ResultsThe study included a total 97 patients, of whom 69% were boys. The large majority (89.58%) achieved final height. None of them had side effects. The median dose of GH used was 0.028mg/kg/day (0.03-0.025). There was a gain of 1.17 SD in final height. Around three-quarters (71.13%) of the patients were reassessed in adulthood, of whom 39.4% maintained the deficiency, and 79.31% achieved target range height. Target height, estimated height, and the total pubertal gain were positively correlated with final height, while the bone age/chronological age ratio and the initial insulin-like growth factor-1 showed a negative correlation.
ConclusionsA majority of patients reached target size, although only a few of them maintained the deficiency in adulthood. Target size, estimated adult height, and pubertal variables are directly related to adult height, while bone age/chronological age and insulin-like growth factor-1 were inversely related, and these can be used as efficacy variables. No adverse effects were observed in the sample with the doses used for the treatment.
El déficit de la hormona del crecimiento (DGH) conduce a una velocidad de crecimiento (vc) patológicamente disminuida y desórdenes metabólicos1.
Es importante realizar un diagnóstico precoz de DGH, con el fin de iniciar pronto el tratamiento sustitutivo para adquirir una talla definitiva similar a la talla diana (si el DGH no es tratado, la talla adulta puede quedar reducida −4,7desviaciones estándar [DE]) y evitar alteraciones metabólicas a largo plazo2.
Debido a que la secreción de hormona del crecimiento (GH) es pulsátil, no se puede confiar en sus niveles basales, por lo que se estimula la hipófisis para observar cómo responde su secreción3,4. La ausencia de respuesta debe confirmarse con una segunda prueba con distinto estímulo, por su alto ratio de falsos positivos4,5.
Una vez diagnosticado, cuando la talla es inferior a −2DE y la vc a −1DE, se trata con GH recombinante1.
En España los tratamientos están restringidos a hospitales, y son supervisados por el Comité Asesor para la Hormona del crecimiento de cada comunidad autónoma6.
El tratamiento se mantiene hasta que la vc es inferior a 2cm/año y la edad ósea (EO) superior a 16 años en el varón y 14 en las chicas. Sin embargo, en DGH puede prolongarse a la edad adulta por las acciones metabólicas de la misma7,8.
La GH supone un gasto elevado para el sistema sanitario, por lo que sería beneficioso definir los factores predictores de respuesta, para así optimizar la eficacia y seguridad del tratamiento. Este hecho justifica la necesidad de estudios a largo plazo con GH, para proveer a los clínicos la información necesaria para elegir qué pacientes podrían beneficiarse más del tratamiento sin riesgos a largo plazo9.
Planteamos un estudio de nuestra población para definir DGH y las variables que influyen en la talla adulta; ya que si bien ya se han realizado estudios similares en países como Italia, Francia o EEUU, no hay nada publicado en la literatura de nuestro ámbito geográfico al respecto10,11.
Por tanto, tomando como hipótesis que la GH aumenta la talla adulta en la población española con DGH aislado, sin relacionarse con un número significativo de efectos adversos, nos planteamos como objetivo evaluar la eficacia y seguridad del tratamiento con GH en pacientes con DGH idiopático aislada, determinando la influencia del desarrollo puberal durante el tratamiento, las variables de eficacia, y qué pacientes continúan manteniendo este déficit en edad adulta.
Material y metodologíaSe realizó un estudio longitudinal descriptivo ambispectivo de niños de ambos sexos, diagnosticados de DGH, entre 0-14 años, mediante 2 pruebas de estímulo, y tratados con GH hasta el momento actual o la edad adulta, en un hospital terciario durante 14 años. Además, al suspender el tratamiento en talla adulta, se realizó reevaluación en todos los casos mediante factor de crecimiento insulínico tipo 1 (IGF-1) y prueba de estímulo, previa firma de consentimiento informado.
Todas las medidas fueron realizadas 3 veces, en ropa interior y descalzos, con una báscula manual Seca, con una precisión de 0,1kg, y un tallímetro fijo de pared Holtain Stadiometer, con precisión de 0,1cm, que era calibrado diariamente.
Se realizaron para el diagnóstico, en 2 días diferentes, el test de ejercicio, por sus escasos efectos adversos, y el test de estímulo con clonidina; y para la reevaluación, el test estímulo con insulina. No se realizó cebamiento con esteroides sexuales. Los puntos de corte escogidos fueron 7,4ng/ml para el diagnóstico y 5,6ng/ml en la reevaluación, basándonos en la bibliografía actual12. Los resultados analíticos de GH e IGF-1 fueron procesados por personal cualificado mediante métodos de quimioluminiscencia inmune (IMMULITE 2000).
La cohorte fue monitorizada desde el diagnostico hasta la talla adulta, recogiendo variables como la edad al diagnóstico, DE de peso, talla e índice de masa corporal al inicio, al año, 2, 3 y 4 años de tratamiento, cociente EO/edad cronológica (EO/EC) inicial y al año, pronóstico de talla adulta (PTA) según método de Bayley Pinneau inicial y al año, IGF-1 inicial y al año, talla diana, edad puberal, talla al inicio de la pubertad (TIP), ganancia puberal total (GPT), talla adulta y niveles de GH e IGF-1 en la reevaluación.
Todos los valores que lo permitían fueron ajustados en DE según el estudio transversal de crecimiento español por el software antropométrico AUXOTEC®13, mientras que el IGF-1 fue ajustado por edad y sexo de acuerdo al software facilitado por IMMULITE.
Finalmente se procedió al cálculo estadístico de los datos recogidos mediante el paquete estadístico SPSS versión 22, utilizando t student en la comparación de 2 medias de muestras normales y U-Mann Whitney en aquellas no normales, ANOVA en la comparación de varias medias de muestras normales y Kruskal Wallis en muestras no normales, así como correlación de Pearson en la comparación de muestras cuantitativas. Además, se usó regresión múltiple en las variables estadísticamente significativas respecto a la talla adulta.
ResultadosSe estudiaron 97 pacientes de ambos sexos diagnosticados de DGH, los cuales recibieron durante 5 años (desde diagnóstico hasta edad adulta) una dosis mediana de GH de 0,028mg/kg/día (0,025-0,03). La mediana de edad al diagnóstico fue de 10,5 años (8,26-11,7). El 69% eran varones. El 89,58% alcanzaron la talla adulta. No se observó patología tumoral en ningún caso, y ningún paciente presentó efectos secundarios con el tratamiento.
Las principales características descriptivas se muestran en la tabla 1.
Estadística descriptiva de las variables cuantitativas recogidas durante el seguimiento a talla adulta de niños con déficit aislado de GH
| Variables | N | Mín | Máx | Media | DE |
|---|---|---|---|---|---|
| Edad al diagnóstico (años) | 97 | 3,18 | 14,70 | 9,99 | 2,53 |
| Talla inicial (DE) | 97 | −5,91 | −1,78 | −2,80 | 0,62 |
| Peso inicial (DE) | 97 | −3,20 | 0,83 | −1,25 | 0,65 |
| IMC inicial (DE) | 97 | −2,04 | 2,56 | −0,44 | 0,92 |
| Dosis tratamiento (mg/kg/d) | 97 | 0,020 | 0,036 | 0,03 | 0,003 |
| IGF-1 inicial (ng/ml) | 97 | 10 | 646 | 181,68 | 116,59 |
| IGF-1 inicial (DE) | 97 | −5,68 | 3,59 | −0,82 | 1,72 |
| Talla diana (DE) | 94 | −3,09 | 1,33 | −1,37 | 0,77 |
| Edad ósea/edad cronológica | 97 | 0,29 | 0,96 | 0,71 | 0,17 |
| Pronóstico talla adulta inicial (DE) | 97 | −4,28 | 2,99 | −1,55 | 1,44 |
| Talla primer año de tratamiento (DE) | 97 | −3,31 | −1,19 | −2,30 | 0,49 |
| Peso primer año de tratamiento (DE) | 97 | −2,07 | 0,63 | −1,13 | 0,59 |
| IMC primer año de tratamiento (DE) | 97 | −1,63 | 2,16 | −0,49 | 0,83 |
| Edad ósea/Edad cronológica primer año tratamiento | 97 | −0,12 | 1,05 | 0,77 | 0,19 |
| IGF-1 primer año tratamiento (ng/ml) | 97 | 40 | 1347 | 378,54 | 228,17 |
| IGF-1 primer año tratamiento (DE) | 97 | −4,46 | 4,58 | 0,55 | 1,60 |
| Pronóstico talla adulta primer año tratamiento (DE) | 97 | −3,75 | 3,87 | −0,95 | 1,52 |
| Talla segundo año tratamiento (DE) | 97 | −3,66 | 0,32 | −1,98 | 0,60 |
| Talla tercer año tratamiento (DE) | 97 | −3,39 | 0,77 | −1,71 | 0,67 |
| Talla cuarto año tratamiento (DE) | 96 | −3,09 | 1,28 | −1,59 | 0,78 |
| Talla adulta (DE) | 82 | −3,76 | 0,93 | −1,64 | 0,86 |
| GH reevaluación (ng/ml) | 69 | 0,04 | 33,50 | 9,23 | 8,63 |
| IGF-1 reevaluación (ng/ml) | 82 | 23,0 | 1045,0 | 362,51 | 173,37 |
| IGF-1 reevaluación (DE) | 82 | −7,99 | 3,74 | 0,02 | 2,01 |
DE: desviación estándar; GH: hormona del crecimiento; IGF-1: factor de crecimiento insulínico tipo 1; IMC: índice de masa corporal.
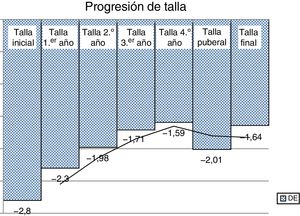
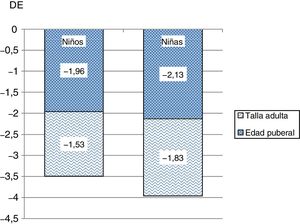
El incremento medio de talla en el primer año de tratamiento fue de 0,49DE. El PTA de acuerdo a EO/EC mejoró 0,6DE. La mejoría de talla progresiva se refleja en la figura 1. Hubo una ganancia de talla de 0,79DE desde el inicio hasta la pubertad en ambos sexos, y desde la pubertad a talla final de 0,43DE en varones y de 0,29DE en mujeres. La ganancia total hasta la edad adulta fue mayor en varones que en mujeres: 1,22DE y 1,08DE, respectivamente (fig. 2) La ganancia sobre la talla adulta respecto al PTA inicial fue de 0,1DE, y respecto a la talla diana de 0,28DE.
Se identificaron diferencias estadísticamente significativas entre el sexo y las variables mostradas en la tabla 2 (p<0,05).
Diferencias estadísticas de acuerdo al sexo en el seguimiento a talla adulta de niños con déficit aislado de GH
| Niños | Niñas | p | |||||
|---|---|---|---|---|---|---|---|
| N | Media | DE | N | Media | DE | ||
| Edad al diagnóstico (años) | 67 | 9,989 | 2,696 | 30 | 10,01 | 2,154 | NS |
| Talla inicial (DE) | 67 | −2,771 | 0,659 | 30 | −2,863 | 0,511 | NS |
| Peso inicial (DE) | 67 | −1,259 | 0,681 | 30 | −1,246 | 0,598 | NS |
| IMC inicial (DE) | 67 | −0,418 | 0,941 | 30 | −0,478 | 0,873 | NS |
| Dosis tratamiento (mg/kg/d) | 67 | ,0278 | 0,004 | 30 | 0,028 | 0,003 | NS |
| IGF-1 inicial (ng/ml) | 67 | 164,5 | 123,4 | 30 | 219,4 | 90,99 | 0,002 |
| IGF-1 inicial (DE) | 67 | −1,209 | 1,849 | 30 | 0,026 | 0,951 | <0,010 |
| Talla diana (DE) | 67 | −1,253 | 0,773 | 30 | −1,618 | 0,700 | 0,027 |
| Edad ósea/edad cronológica | 67 | 0,683 | 0,171 | 30 | 0,777 | 0,147 | 0,006 |
| Pronóstico talla adulta inicial (DE) | 67 | −1,236 | 1,368 | 30 | −2,237 | 1,366 | <0,001 |
| Talla primer año tratamiento (DE) | 67 | −2,327 | 0,523 | 30 | −2,256 | 0,421 | NS |
| Peso primer año tratamiento (DE) | 67 | −1,135 | 0,554 | 30 | −1,133 | 0,669 | NS |
| IMC primer año tratamiento (DE) | 67 | −0,464 | 0,830 | 30 | −0,553 | 0,844 | NS |
| Edad ósea/Edad cronológica primer año tratamiento | 67 | 0,750 | 0,201 | 30 | 0,813 | 0,160 | NS |
| IGF-1 primer año tratamiento (ng/ml) | 67 | 335,3 | 199,2 | 30 | 473,6 | 260,8 | 0,016 |
| IGF-1 primer año tratamiento (DE) | 67 | 0,183 | 1,697 | 30 | 1,367 | 0,975 | 0,001 |
| Pronóstico talla adulta primer año tratamiento (DE) | 67 | −0,707 | 1,265 | 30 | −1,499 | 1,879 | 0,002 |
| Talla segundo año tratamiento (DE) | 67 | −1,959 | 0,643 | 30 | −2,037 | 0,503 | NS |
| Talla tercer año tratamiento (DE) | 67 | −1,689 | 0,744 | 30 | −1,759 | 0,458 | NS |
| Talla cuarto año tratamiento (DE) | 67 | −1,548 | 0,835 | 29 | −1,690 | 0,655 | NS |
| Edad puberal (años) | 67 | 12,54 | 1,197 | 30 | 11,79 | 1,084 | 0,006 |
| Talla puberal (DE) | 67 | −1,964 | 0,689 | 30 | −2,127 | 0,630 | NS |
| Talla adulta (DE) | 59 | −1,533 | 0,937 | 25 | −1,834 | 0,596 | 0,034 |
| Ganancia puberal total (cm) | 59 | 24,84 | 7,432 | 25 | 17,03 | 5,617 | <0,010 |
| GH reevaluación (ng/ml) | 49 | 9,142 | 8,433 | 20 | 9,419 | 9,284 | NS |
| IGF-1 reevaluación (ng/ml) | 59 | 352,8 | 167,4 | 25 | 384,2 | 187,8 | NS |
| IGF-1 reevaluación (DE) | 59 | −0,146 | 2,251 | 25 | 0,403 | 1,293 | NS |
DE: desviación estándar; GH: hormona del crecimiento; IGF-1: factor de crecimiento insulínico tipo 1; IMC: índice de masa corporal; NS: no significativo.
La talla adulta se ve influenciada por el sexo masculino con mayor talla durante todo el tratamiento, mayor talla diana, PTA y GPT, así como, un inicio puberal más temprano, y menor EO/EC, e IGF-1 y GH en la reevaluación (p<0,05) (tabla 3).
Diferencias estadísticas entre las variables estudiados en el seguimiento a talla adulta de niños con déficit aislado de GH
| Variables | p |
|---|---|
| Edad al diagnóstico (años) | NS |
| Talla inicial (DE) | NS |
| Peso inicial (DE) | NS |
| IMC inicial (DE) | NS |
| Dosis tratamiento (mg/kg/d) | NS |
| IGF-1 inicial (ng/ml) | NS |
| IGF-1 inicial (DE) | NS |
| Talla diana (DE) | <0,01 |
| Edad ósea/Edad cronológica | 0,04 |
| Pronóstico talla adulta inicial (DE) | <0,01 |
| Talla primer año de tratamiento (DE) | 0,003 |
| Peso primer año de tratamiento (DE) | NS |
| IMC primer año de tratamiento (DE) | NS |
| Edad ósea/Edad cronológica primer año tratamiento | 0,036 |
| IGF-1 primer año tratamiento (ng/ml) | 0,006 |
| IGF-1 primer año tratamiento (DE) | 0,004 |
| Pronóstico talla adulta primer año tratamiento (DE) | <0,01 |
| Talla segundo año tratamiento (DE) | <0,01 |
| Talla tercer año tratamiento (DE) | <0,01 |
| Talla cuarto año tratamiento (DE) | <0,01 |
| Talla puberal | <0,01 |
| Ganancia puberal total | <0,01 |
| Sexo | <0,01 |
DE: desviación estándar; GH: hormona del crecimiento; IGF-1: factor de crecimiento insulínico tipo 1; IMC: índice de masa corporal; NS: no significativo.
Finalmente, también es constatada una relación lineal entre el índice de masa corporal y la dosis de GH, siendo la dosis mayor al final del tratamiento que al principio del mismo (p<0,05).
ReevaluaciónSe reevaluaron 69 pacientes en edad adulta (71,13%), manteniendo el déficit el 39,4%. El 69% de los pacientes con permanencia del déficit eran varones.
Se realizó la IGF-1 en la reevaluación de talla adulta en 87 pacientes (89,58%), con una media de 0,023DE, y una IGF-1 deficitaria en el 11,11% de los pacientes, definida como −2DE, todos ellos con GH en reevaluación también deficitaria (GH<5,4mg/dl) (p<0,05). Aunque no se hallaron diferencias estadísticamente significativas, los DGH permanentes presentaron un diagnóstico más temprano, un IGF-1 inicial menor, un peso y talla al diagnóstico menor, y una mejor respuesta al tratamiento.
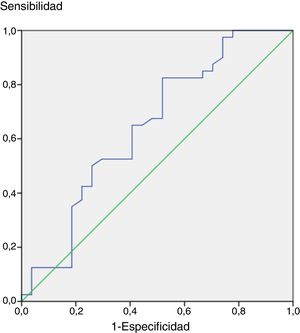
Si en lugar de −2DE utilizáramos un punto de corte de −3,22DE de IGF-1 en la reevaluación, este nuevo punto de corte mostraría un área bajo la curva ROC de 0,8, que supone que se trata de un buen test, y una mayor correlación con GH (fig. 3).
DiscusiónAunque la GH ha sido empleada para tratar la talla baja durante más de 40 años, no existe unanimidad a la hora de definir los criterios que determinen unos objetivos de respuesta satisfactorios14.
Uno de los puntos de interés de nuestro trabajo es que casi el 90% de los menores reclutados han alcanzado la talla adulta, pudiendo reevaluarse un número significativo de pacientes, para así establecer su evolución durante el tratamiento y tras el fin del mismo.
Todos los estudios, al igual que nosotros, presentan niños prepuberales con predominio masculino, pero con una edad al diagnóstico 2 años menor al nuestro que muestra una edad mediana de 10,5 años, lo que podría suponer una peor respuesta al tratamiento15.
Existe heterogeneidad en cuanto al inicio de la pubertad, afirmando en algunos estudios que existe un retraso frente a otros que no encuentran diferencia, como es en nuestro caso. Por otro lado, las publicaciones actuales establecen una correlación positiva entre la edad al diagnóstico y la pubertad; y entre la talla inicial, el crecimiento al año, la edad, sexo, tiempo de tratamiento, EO/EC y talla adulta, de las cuales solo son confirmadas en nuestro estudio la relación entre la edad al diagnóstico y edad puberal; y entre el sexo, la talla inicial y al año, y la talla adulta11,15–18. Maghnie et al., además, relacionan la talla adulta con la GPT19, hecho no nombrado por otros autores hasta el momento, pero sí corroborado en nuestro estudio, lo que responde a nuestro objetivo sobre la influencia de la pubertad sobre la talla final.
Adicionalmente, en nuestro estudio también se establece una correlación negativa entre la edad al diagnóstico y la TIP; entre la dosis y la TIP; y entre el IGF-1 inicial y el PTA al año, la TIP y la talla adulta, no nombradas hasta el momento. A esto se añade que en nuestro caso la EO respecto a la talla adulta presenta significación como correlación negativa, no positiva, lo que parece lógico puesto que cuanto más retrasada sea la EO, mayor será el tiempo de crecimiento, lo que en los estudios publicados se relaciona positivamente con la talla adulta, o no lo relaciona como ocurre en el estudio Kabi International Growth Study (estudio KIGS)20–22.
Aunque no hay acuerdo acerca de la relación del inicio de pubertad con la talla adulta; y entre el inicio de tratamiento y la talla adulta, estas relaciones no se observan en nuestro caso11,15–19,23,24.
En cuanto a las diferencias significativas en la talla según sexo cabe decir que aunque en las publicaciones y en nuestra muestra se ha establecido una relación11,14, estas se podrían deber al crecimiento puberal de acuerdo al sexo, así como al hecho de que la talla diana es menor en el sexo femenino, y que parte de nuestra muestra femenina se encontraba en periodo peripuberal al diagnóstico (el 38% inició pubertad en un año). A lo que se une que en nuestro estudio se establece una correlación negativa entre la edad puberal y la duración de la pubertad, con la GPT, al igual que lo reflejado en otros estudios11,20,21.
El estudio KIGS refiere influencias estadísticamente significativas entre la GPT y el sexo, talla diana, dosis de GH, EO/EC, TIP, y edad de inicio y fin de pubertad20,22, mientras que en nuestro estudio solo se establecen diferencias estadísticamente significativas entre la GPT y el sexo masculino. También enuncia que a pesar de la variabilidad interindividual del crecimiento con tratamiento entre ambos sexos en edad prepúber, las diferencias entre sexos en cuanto a ganancia de talla y vc no son observables en los 3 primeros años de tratamiento21,25.
Además, establece una relación negativa respecto a la diferencia de talla inicial y talla diana; y entre el pico de GH, la edad al diagnóstico y la talla final. Su correlación entre el pico de GH y talla final también coincide con nuestros resultados de los niveles de GH iniciales, edad al diagnóstico y talla final mayor, a pesar de no haberse establecido relación estadística en nuestro caso11,16–19,23,24.
El estudio KIGS también refiere influencia del número de pinchazos, dosis de GH, la vc durante el año previo, el peso actual y al nacimiento, y la severidad del déficit sobre la talla adulta; la cual no ha sido observada en nuestro estudio ni en estudios previos, por lo que serían necesarios más estudios al respecto11,15–19,23.
A esto, nuestro trabajo añade una relación entre la talla adulta, el PTA inicial, la talla diana y las distintas tallas entre sí, incluidas desde el inicio hasta la TIP; lo que hasta el momento no se había establecido de forma clara. Por tanto, la talla final se relaciona con la respuesta a lo largo de todos los años de tratamiento.
Por último, mientras que la mayoría afirman que la talla diana no influye en la talla final, debido a que posiblemente incluyan en sus muestras pacientes que podrían presentar talla baja idiopática, el The Nordinet International Outcome Study (estudio IOS) y el estudio KIGS la correlacionan positivamente con la misma, al igual que sucede en nuestro estudio11,15–19,23–25.
Aimaretti et al. aprecian al igual que nosotros un aumento de IGF-1 con el tratamiento. Además, en la reevaluación comentan cierta concordancia entre los test de estímulo, IGF-1 y el diagnóstico26. Ante esto, destacar nuestros resultados de IGF-1 y GH en la reevaluación, que apoyaría la concordancia indicada por este grupo y podría asignarle un papel concomitante al IGF-1 en la reevaluación del déficit de GH. Siempre que el IGF-1 fue deficitario en la reevaluación, lo era también el test de estímulo con GH; sin embargo, no todos los casos con valores de déficit en la prueba de estímulo con GH presentaban IGF-1 deficiente en la reevaluación, hecho no claramente descrito hasta el momento actual en la literatura27.
Por tanto, de acuerdo a nuestros objetivos, los datos publicados y nuestra experiencia, la talla diana, el PTA inicial, la TIP, la edad puberal, la GPT, la progresión de la talla durante los años de tratamiento, la EO/EC y el IGF-1 podrían ser factores predictores para la respuesta al tratamiento con GH.
En cuanto a la eficacia, las publicaciones establecen con el tratamiento una ganancia de talla entre +0,4DE y +1,5DE, que es acorde a nuestra ganancia de +1,17DE11,15,17,24. Además Ranke et al. refieren una ganancia de +1,2cm y +0,2DE al año de tratamiento28, frente a nuestros datos de ganancia algo superiores (+0,49DE). Esta mejoría de talla supone en nuestra cohorte una talla adulta dentro de los rangos normales de nuestra población nacional, al igual que lo reflejado por el estudio KIGS29.
Acerca de la GPT las publicaciones establecen una ganancia de +0,8DE, frente a nuestros +0,43DE, pudiendo deberse a la EO/EC y el inicio de la pubertad no muy retrasados, resistencias al tratamiento, o falta de cumplimiento, sin poder confirmarlo15,30. Kirk también comenta que existe una mejora de talla respecto a la talla diana de entre +0,2 y +0,8DE16, y Blethen et al. refieren una mejora respecto al PTA de +0,7DE11, consecuente con nuestra mejoría de +0,28DE respecto a la talla diana, pero con una diferencia marcada respecto a nuestra mejoría conforme el PTA de tan solo +0,1DE, probablemente en relación con la EO escasamente retrasada de nuestra muestra.
Por último, destacar que en la literatura se encuentra en la reevaluación una permanencia del déficit del 44,4-71,9%, frente a nuestro 39,4%12,26,31. Por otro lado, nosotros hemos hallado en nuestro estudio una edad más temprana al diagnóstico, un IGF-1 inicial y talla inicial menor, y una mejor respuesta al tratamiento en aquellos con permanencia del déficit. Asimismo destaca el predominio masculino, probablemente relacionado con que también presentaron más hallazgos en la resonancia al diagnóstico.
Aunque se han descrito efectos adversos con el tratamiento, Sotos y Tokar aportan que sus pacientes no presentaron efectos adversos con el tratamiento32, lo que apoya nuestros resultados con GH y nuestra hipótesis, aunque podría ser debido al tamaño de nuestra muestra. Sin embargo, estos resultados son compatibles con aquellos obtenidos en el estudio Safety and Appropriateness of Growth Hormone treatment in Europe (SAGhE) y en el estudio IOS, con muestras y seguimientos mayores, en los que refieren una baja incidencia de efectos adversos en estos pacientes. Aún así, es necesario un seguimiento a largo plazo de los niños tratados para vigilar los posibles efectos secundarios tardíos que aún no conocemos25,31,33–35.
Finalmente, acerca de los estudios publicados hasta el momento sobre niños con DGH aislado tratados con GH, salvo Ranke et al. que presenta un ensayo clínico controlado36, todos se tratan de estudios observacionales no controlados de entre 20 y 2.852 niños de ambos sexos, seguidos durante uno y 9 años, lo que supone un tiempo de seguimiento menor al nuestro. Solo el 40% de los estudios presentaron más pacientes que nosotros, y en algunas ocasiones por muy pocos. En cualquier caso, cabe decir que la mayoría de los estudios que superaban nuestra muestra estaban patrocinados por empresas farmacéuticas, hecho que no ocurre en nuestro caso, ya que no contamos con ninguna colaboración ni conflicto de interés.
Dicho esto, la solidez de nuestro estudio queda avalada por una n elevada, el carácter unicéntrico, una metodología cuidada y la significación estadística confirmada con diversas pruebas.
Por otro lado, las principales limitaciones del estudio son la pérdida de información en los datos obtenidos retrospectivamente, y el hecho de que aunque la mayoría ha alcanzado la talla adulta, no es el 100% de la muestra. Además, siempre hay que contar con los posibles errores interobservador y de medición. Además, el DGH podría haber sido sobrediagnosticado debido a las limitaciones de los test actuales para su diagnóstico, incluyendo que no hicimos primación esteroidea.
En resumen, en nuestra población, la talla adulta tras el tratamiento con GH es similar a la talla diana, lo que avala nuestra hipótesis de eficacia. El 39,4% mostraron permanencia del déficit de GH en la reevaluación, de los cuales 11,1% asociaron déficit de IGF-1 en la reevaluación. Además, aquellos con déficit permanente mostraron un diagnóstico más precoz, un IGF-1 y talla al diagnóstico menores, y una mejor respuesta al tratamiento, lo que apoyaría que los permanentes podrían ser los verdaderos casos de DGH, aunque serían necesarios más estudios y encontrar mejores pruebas diagnósticas.
Durante el tiempo de seguimiento ninguno de estos pacientes presentaron efectos adversos con las dosis utilizadas de tratamiento; y aunque no podemos establecer por completo la seguridad del tratamiento con GH, nuestros resultados son avalados por otros estudios publicados.
Finalmente, al relacionar las distintas variables con la respuesta se vislumbran posibles datos pronósticos para la eficacia del tratamiento, como puede ser: la talla diana, el PTA inicial, la edad puberal, la GPT, las tallas durante el tratamiento, y la TIP, que se correlacionan positivamente; mientras que la EO/EC y el IGF-1 inicial mantienen una correlación negativa sobre la talla adulta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.