La aparición de las guías K/DOQI en el año 2002 sobre definición, evaluación y clasificación en estadios de la enfermedad renal crónica (ERC) han supuesto un cambio importante en la forma de evaluar la función renal en adultos y en niños. Estas guías, recientemente actualizadas, recomiendan que el estudio de la función renal se realice a partir de la medida de la concentración sérica de creatinina y de la estimación del filtrado glomerular (FG) obtenido mediante una ecuación. Sin embargo, la implementación de esta recomendación en los informes del laboratorio clínico en población pediátrica ha sido casi nula.
Los estudios aparecidos en los últimos años sobre la importancia de la detección y seguimiento de los pacientes con ERC, la aparición de nuevas ecuaciones de estimación del FG y los avances en los laboratorios clínicos respecto a los métodos de medida de creatinina y de cistatina C han determinado la colaboración entre los servicios de pediatría y de los laboratorios clínicos con objeto de establecer recomendaciones homogéneas y basadas en la mejor evidencia científica sobre la utilización de las ecuaciones de estimación del FG en este grupo de población.
El objetivo de este documento es proporcionar recomendaciones sobre la evaluación de la función renal y la utilización de ecuaciones de estimación del FG en niños. Los destinatarios de estas recomendaciones son los pediatras, nefrólogos, bioquímicos clínicos, analistas clínicos y todos los profesionales de la salud relacionados con el estudio y la evaluación de la función renal de este grupo de pacientes.
The appearance of the K/DOQI guidelines in 2002 on the definition, evaluation and staging of chronic kidney disease (CKD) have led to a major change in how to assess renal function in adults and children. These guidelines, recently updated, recommended that the study of renal function is based, not only on measuring the serum creatinine concentration, but this must be accompanied by the estimation of glomerular filtration rate (GFR) obtained by an equation. However, the implementation of this recommendation in the clinical laboratory reports in the paediatric population has been negligible.
Numerous studies have appeared in recent years on the importance of screening and monitoring of patients with CKD, the emergence of new equations for estimating GFR, and advances in clinical laboratories regarding the methods for measuring plasma creatinine and cystatin C, determined by the collaboration between the departments of paediatrics and clinical laboratories to establish recommendations based on the best scientific evidence on the use of equations to estimate GFR in this population.
The purpose of this document is to provide recommendations on the evaluation of renal function and the use of equations to estimate GFR in children from birth to 18 years of age. The recipients of these recommendations are paediatricians, nephrologists, clinical biochemistry, clinical analysts, and all health professionals involved in the study and evaluation of renal function in this group of patients.
La aparición, en el año 2002, de las guías K/DOQI sobre definición, evaluación y clasificación en estadios de la enfermedad renal crónica (ERC), recientemente actualizadas por la iniciativa internacional Kidney Disease: Improving Global Outcomes (KDIGO), ha supuesto un cambio importante en la forma de evaluar la función renal, tanto en adultos como en niños1,2. Entre otros aspectos, estas guías recomiendan que el estudio de la función renal se realice no solo con la medida de la concentración sérica de creatinina, sino que esta debe acompañarse de una estimación del filtrado glomerular (FG) obtenido mediante una ecuación. Sin embargo, a pesar de la amplia implementación de esta recomendación en los informes de laboratorio en la población adulta, su repercusión en la población pediátrica ha sido casi nula3.
Los numerosos estudios aparecidos en los últimos años sobre la importancia de la detección y el seguimiento de los pacientes con ERC, la aparición de nuevas ecuaciones de estimación del FG y los avances en los laboratorios clínicos respecto a los métodos de medida de creatinina y de cistatina C han determinado la colaboración entre los servicios de pediatría y de laboratorio clínico con objeto de establecer recomendaciones homogéneas y basadas en la evidencia científica sobre la utilización de las ecuaciones de estimación del FG en este grupo de población.
El objetivo del presente documento es proporcionar recomendaciones sobre la evaluación de la función renal y la utilización de ecuaciones de estimación del FG en la población pediátrica, desde el nacimiento hasta los 18 años de edad, sin considerar otros marcadores de lesión renal crónica, como la presencia persistente de proteinuria o de alteraciones en el sedimento urinario. En su elaboración han participado miembros de la Comisión de Función Renal de la Sociedad Española de Química Clínica y Patología Molecular y de la Asociación Española de Nefrología Pediátrica. Las recomendaciones incluidas en el mismo se basan en las guías de práctica clínica publicadas en los últimos años o son opiniones consensuadas entre todos los autores y utilizan el sistema GRADE (anexo 2)4,5. Estas recomendaciones están dirigidas a todos los profesionales de la salud relacionados con la evaluación de la función renal en población pediátrica.
Importancia de la enfermedad renal crónica en la población pediátricaEn la ERC se produce no solo una pérdida de la capacidad depurativa y de mantenimiento de la homeostasis hidroelectrolítica del organismo, sino también de sus funciones endocrinas, con una disminución de la síntesis de eritropoyetina y de la forma activa de la vitamina D.
La ERC se asocia a una mortalidad elevada (del 20% a los 5 años tras el inicio de la diálisis o del 5% tras el trasplante renal) y tiene una repercusión importante en la calidad de vida de los pacientes debido a las frecuentes hospitalizaciones, a la falta de resistencia al ejercicio físico secundaria a la anemia crónica, a las restricciones dietéticas y al consumo importante de fármacos6.
La historia natural de la enfermedad conduce hacia una disminución progresiva del FG hasta llegar, en algunos casos, a cifras que requieren de tratamiento sustitutivo, como la diálisis o el trasplante renal. La velocidad de progresión depende de las causas de la ERC, de la presencia de factores de riesgo adicionales y de la instauración de medidas de prevención secundarias que permitan enlentecer o frenar el curso de la enfermedad. La identificación precoz de estos pacientes es de gran importancia; pese a ello, un elevado porcentaje de estos niños desarrollarán ERC terminal (ERCT) hacia los 20 años de edad7.
Para conocer la realidad epidemiológica de la ERC en nuestro país, la Asociación Española de Nefrología Pediátrica ha creado los Registros Españoles Pediátricos de Insuficiencia Renal (REPIR) que incluyen datos actualizados tanto sobre la ERCT (REPIR I), como sobre la ERC no terminal que comprende los estadios 2 a 5 prediálisis (REPIR II).
Según los informes correspondientes al año 2008, la incidencia anual y la prevalencia de ERC no terminal es de 8,7 y 71,1 casos por millón de habitantes menores de 18 años. El 66% de los pacientes son varones y el 80% se sitúa en los estadios 2 y 3. Las causas más frecuentes de ERC son las anomalías estructurales (59%), las enfermedades quísticas o hereditarias (14%) y las enfermedades vasculares (11%). Las glomerulopatías suponen solo el 3% de los casos, aunque alcanzan hasta el 15% entre los adolescentes8. Estas cifras son muy similares a las de los registros italiano (ItalKid)9 y norteamericano (NAPRTCS)10. Las complicaciones más frecuentes son la anemia (30%), el retraso del crecimiento (25%), principalmente en los niños menores de 2 años, y la hipertensión arterial (19%). Tan solo el 17% mantiene las concentraciones plasmáticas de calcio, fosfato y hormona paratiroidea en los intervalos aconsejados11.
Respecto a la ERCT, los datos del año 2010 indican una incidencia anual y una prevalencia de 5,6 y 40,1 casos por millón de habitantes menores de 14 años, respectivamente. Estos resultados muestran una incidencia semejante y una prevalencia superior a la media europea de 5,3 y 30,7 casos por millón de habitantes menores de 14 años12. Las malformaciones estructurales (42,6%) y las glomerulopatías (18,1%) son las causas más frecuentes. En relación con el tratamiento sustitutivo, las cifras del registro español indican una prevalencia de trasplante renal, de hemodiálisis y de diálisis peritoneal de 31,8, 2,7 y 4,5 casos por millón de habitantes menores de 14 años, respectivamente.
Definición, diagnóstico y clasificación de la enfermedad renal crónicaEl término ERC abarca un conjunto heterogéneo de enfermedades que afectan a la estructura y la función renal. La variabilidad de su expresión clínica es debida a su distinta etiopatogenia, a la estructura del riñón afectada (glomérulo, vasos, túbulos o intersticio renal) y a su velocidad de progresión.
El diagnóstico de ERC se basa en la presencia de alteraciones en la función o en la estructura del riñón de más de 3 meses de duración, con consecuencias sobre la salud. La alteración en la función renal se define por un valor de FG inferior a 60ml/min/1,73m2. Las anomalías estructurales del riñón pueden ser identificadas directamente, mediante biopsia renal o técnicas de imagen, o indirectamente por la presencia de proteinuria, albuminuria o alteraciones en el sedimento urinario1,2.
Las recientes guías KDIGO sobre ERC incorporan una nueva clasificación de la enfermedad que tiene en cuenta su etiología, los valores de FG (tabla 1) y de albuminuria o proteinuria y define grupos con distinto riesgo de progresión y de aparición de complicaciones2. Estas guías suscriben la utilización de los mismos criterios diagnósticos y de clasificación de la ERC para adultos y niños de más de 2 años, estableciendo las siguientes modificaciones para los niños de menor edad:
- a)
El criterio de cronicidad, definido por una duración superior a 3 meses, no es aplicable a niños de menos de 3 meses de edad.
- b)
El valor del FG en niños menores de 2 años, obtenido mediante una ecuación de estimación, el aclaramiento de creatinina o de un marcador exógeno, se comparará con valores de referencia estratificados por edad. Si el FG se sitúa entre 1 y 2 desviaciones estándar por debajo de la media de referencia para su edad, se considerará que presentan una reducción moderada y aquellos con más de 2 desviaciones estándar por debajo de la media serán catalogados de disminución intensa del FG.
Clasificación en estadios de la enfermedad renal crónica en función del valor del filtrado glomerular en niños mayores de 2 años
| Estadio | FG (mL/min/1,73m2) | Definición |
| G1 | >90 | Lesión renal con FG normal o elevado |
| G2 | 60-89 | Lesión renal con descenso leve del FG |
| G3a | 45-59 | Descenso moderado del FG |
| G3b | 30- 44 | Descenso moderado-intenso del FG |
| G4 | 15- 29 | Descenso intenso del FG |
| G5 | <15 | Fallo renal |
FG: filtrado glomerular.
Adaptado de: Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group2.
El valor del FG varía con la edad, el sexo y el tamaño corporal. En recién nacidos, sus valores se sitúan alrededor de 20ml/min/1,73m2 y aumentan, progresivamente, hasta alcanzar las cifras de los adultos jóvenes (120-130ml/min/1,73m2) hacia los 2 años de edad. Se han publicado valores de referencia del FG en recién nacidos pretérmino13-15, a término16,17, niños y adolescentes17-21 obtenidos, en general, a partir de la medida del aclaramiento de creatinina en recién nacidos o de un marcador exógeno en niños y adolescentes (tabla 2).
Valores de referencia del filtrado glomerular en población pediátrica
| Edad | n | FG (mL/min/1,73m2), media±DE | Método de referencia | Cita |
| Recién nacidos pretérmino (27-31 semanas) | ||||
| Día 7 | 142 | 19,9±9,3 | Aclaramiento de creatinina | Vieux et al.15, 2010 |
| Día 14 | 115 | 22,1±14,9 | ||
| Día 21 | 100 | 24,6±10,8 | ||
| Día 28 | 92 | 27,8±12,6 | ||
| Recién nacidos a término | ||||
| 0-3 meses | 30 | 60,4±17,4 | Aclaramiento renal de inulina | Brodehl et al.18, 1982 |
| 4-6 meses | 11 | 87,4±22,3 | ||
| 7-12 meses | 10 | 96,2±12,2 | ||
| 1 - 2 años | 9 | 105,2±17,3 | ||
| < 1,2 mes | 18 | 54,6±14,1 | Aclaramiento plasmático de 51Cr-EDTA | Piepsz et al.19, 1994 |
| 1,2-3,6 meses | 18 | 65,2±14,4 | ||
| 3,6-7,2 meses | 22 | 81,8±19,2 | ||
| 7,2-12 meses | 17 | 103±20,1 | ||
| 12-18 meses | 20 | 116±28,3 | ||
| 18-24 meses | 19 | 111±19,8 | ||
| > 24 meses | 142 | 114±24,4 | ||
| Niños | ||||
| 3-4 años | 24 | 111,2±18,5 | Aclaramiento renal de inulina | Brodehl et al.18, 1982 |
| 5-6 años | 21 | 114,1±18,6 | ||
| 7-8 años | 18 | 111,3±18,3 | ||
| 9-10 años | 19 | 110,0±21,6 | ||
| 11-12 años | 25 | 116,4±18,9 | ||
| 13-15 años | 27 | 117,2±16,1 | ||
51Cr-EDTA: 51Cr-ácido etilendiaminotetraacético; DE: desviación estándar: FG: filtrado glomerular.
La prevalencia de niños y adolescentes con un riesgo elevado de ERC no ha sido estudiada sistemáticamente, aunque es probable que el número de niños en riesgo exceda al de pacientes conocidos. En la actualidad, solo algunos países realizan programas de cribado en población pediátrica a partir de la detección de la presencia significativa de proteínas o hematíes en orina22. Cabe destacar que algunos de los factores de riesgo de ERC en el adulto, como la obesidad, la diabetes mellitus o la hipertensión arterial, pueden iniciarse en la infancia, por lo que el papel del pediatra en la identificación de estos factores y la puesta en marcha de medidas que permitan enlentecer la progresión de la ERC es de gran importancia. Las condiciones clínicas que incrementan el riesgo de presentar ERC aparecen en la tabla 3.
Condiciones clínicas que incrementan el riesgo de enfermedad renal crónica
| 1. | Historia familiar de enfermedad renal poliquística u otras enfermedades renales genéticas |
| 2. | Recién nacidos con bajo peso |
| 3. | Antecedentes de fracaso renal agudo |
| 4. | Displasia o hipoplasia renal |
| 5. | Trastornos urológicos, especialmente uropatía obstructiva |
| 6. | Reflujo vesicoureteral con infecciones urinarias recurrentes y cicatrices renales |
| 7. | Antecedentes de nefritis aguda o síndrome nefrótico |
| 8. | Antecedentes de síndrome hemolítico-urémico |
| 9. | Antecedentes de púrpura de Schönlein-Henoch |
| 10. | Diabetes mellitus |
| 11. | Lupus eritematoso sistémico |
| 12. | Hipertensión arterial |
Adaptado de Hogg, et al. Pediatrics 2003;111:1416–1421.
El FG se mide mediante la depuración o aclaramiento renal o plasmático de un marcador y corresponde al volumen de plasma del que dicho marcador es eliminado totalmente por el riñón por unidad de tiempo. Las características que debe cumplir esta sustancia son: presentar concentraciones estables en plasma, no unirse a las proteínas plasmáticas, ser filtrada libremente por el glomérulo, no ser reabsorbida ni secretada por el túbulo renal, ser fisiológicamente inactiva y, si es de administración exógena, no ser tóxica23.
Marcadores exógenosDiversas sustancias, radioisotópicas y no radioisotópicas, pueden ser utilizadas para medir el FG aunque por sus características estas últimas son de elección en pediatría.
La inulina es un polímero de la fructosa que cumple todas las características de un marcador ideal y su aclaramiento renal es considerado como el método de referencia para la medida del FG. Sin embargo, presenta numerosas limitaciones debidas a la dificultad de obtener recolecciones apropiadas de orina en niños que todavía no controlan la micción o con trastornos urológicos y a los problemas técnicos asociados tanto a la administración de inulina, como a los métodos para su determinación24. Un procedimiento alternativo, más sencillo y ampliamente utilizado, ya que no requiere la obtención de muestras de orina, es la determinación del aclaramiento plasmático de inulina mediante técnicas de infusión por vía intravenosa continua25 o a partir de la inyección de un bolus simple26.
El iotalamato es un contraste radiológico de bajo peso molecular que es filtrado libremente a nivel glomerular, presenta cierta unión a proteínas plasmáticas (8%) y secreción tubular (10%) produciendo una sobreestimación del FG con respecto al aclaramiento renal de inulina.
El iohexol es un contraste no iónico de baja osmolaridad que no es secretado, metabolizado ni reabsorbido por el riñón, con menos de un 2% de unión a proteínas plasmáticas y prácticamente nula eliminación extrarrenal27. El aclaramiento plasmático de iohexol ha sido utilizado para valorar el FG en el estudio Chronic Kidney Disease in Children (CKiD)28.
Los marcadores radioisótopos más utilizados son el 125I-iotalamato, el 51Cr-ácido etilendiaminotetraacético (51Cr-EDTA) y el 99mTc-ácido dietilentriaminopentaacético. Cada uno de ellos presenta diversas ventajas e inconvenientes, pero el hecho de ser sustancias radiactivas limita su uso en niños.
La complejidad técnica y la incomodidad que representa para los pacientes el uso de marcadores exógenos determinan que no sean utilizados en la práctica clínica habitual y que sean relegados para aquellas circunstancias en que se requiera una medida exacta del FG como el ajuste de dosis de fármacos de elevada nefrotoxicidad.
Marcadores endógenosConcentración sérica de creatininaLa medida de la concentración de creatinina en suero o plasma ha sido clásicamente utilizada para evaluar la función renal; sin embargo, su utilidad como marcador del FG presenta limitaciones relacionadas con sus características biológicas y los métodos de medida.
La creatinina es el producto del metabolismo de la creatina en el músculo. Su producción es proporcional a la masa muscular, lo que explica las diferencias en su concentración sérica en función de la edad, el sexo, el grupo racial y el estado nutricional29. Su eliminación se realiza mayoritariamente por filtración glomerular, aunque también existe un componente de secreción en el túbulo proximal que aumenta a medida que disminuye el FG, situación en la que también se produce un aumento de su eliminación extrarrenal debido a la degradación por las bacterias intestinales. Todo ello condiciona que la concentración sérica de creatinina presente una elevada variabilidad biológica interindividual y explica la escasa utilidad de los valores de referencia poblacionales. Además, debido a que la relación de la creatinina con el FG no es lineal, se precisan descensos importantes del mismo para que la concentración de creatinina se sitúe por encima de los valores de referencia. Como consecuencia de todas estas limitaciones las guías de práctica clínica, publicadas por diferentes sociedades científicas, aconsejan que la evaluación de la función renal no se base únicamente en la concentración sérica de creatinina, sino que esta debe de ir acompañada de una estimación del FG obtenido a partir de una ecuación1,2,30–35.
Los métodos de medida de creatinina más implementados son los de Jaffé y los enzimáticos. Los primeros se basan en la reacción de la creatinina con el picrato, que, en medio alcalino, da lugar a un compuesto anaranjado que es medido espectrométricamente. Diversas sustancias presentes en el suero como la glucosa, las proteínas, el ácido ascórbico, los cetoácidos, el piruvato y el ácido úrico reaccionan con el picrato (seudocromógenos) produciendo una sobreestimación de la concentración de creatinina, mientras que concentraciones elevadas de bilirrubina, de hemoglobina fetal y de hemoglobina, presente en las muestras hemolizadas, enmascaran el color desarrollado por la reacción ocasionando una infraestimación de su concentración36. Con la finalidad de minimizar estas interferencias, los fabricantes de reactivos han realizado modificaciones en sus procedimientos de medida; algunos de ellos introducen un factor de corrección negativo (−0,2 a −0,3mg/dl, según el fabricante) para contrarrestar la interferencia positiva de los seudocromógenos (métodos compensados)37. Estos métodos asumen que las interferencias son constantes en todas las muestras, pero dicha corrección puede ser excesiva en las muestras de pacientes en los que la producción diaria de creatinina es baja y la presencia de seudocromógenos variable, como es el caso de la población pediátrica.
Los métodos enzimáticos presentan menos interferencias que los de Jaffé, aunque no están totalmente exentos de ellas; en especial, las debidas a concentraciones elevadas de bilirrubina, frecuentes en recién nacidos38,39. La mayoría de los métodos enzimáticos cumplen las especificaciones internacionales de calidad analítica recomendadas para concentraciones séricas de creatinina inferiores a 0,45mg/dl (40μmol/l), que son las habituales en niños40,41. Por todo ello, diferentes autores38,42–44 y sociedades científicas37,45,46 recomiendan la utilización de los métodos enzimáticos para la medida de creatinina en población pediátrica, especialmente en neonatos y niños pequeños. Sin embargo, la implementación de estos métodos en los laboratorios clínicos está limitada por su elevado coste con respecto a los métodos de Jaffé.
En los últimos años, fruto del esfuerzo llevado a cabo por distintas organizaciones internacionales y por la industria del diagnóstico in vitro47, se ha realizado la estandarización de los métodos de medida de creatinina, gracias a la introducción del material de referencia SRM 96748 y del procedimiento de medida de referencia de dilución isotópica-espectrometría de masas (IDMS)49. El objetivo de la estandarización es disminuir las diferencias en los valores de creatinina obtenidos con los distintos métodos y el impacto de las mismas en los resultados de FG obtenidos mediante una ecuación. Los métodos estandarizados producen resultados de creatinina entre un 15 y un 20% inferiores, lo que determina la necesidad de valores de referencia y ecuaciones de estimación del FG específicos que tengan en cuenta dichos cambios.
El Comitte on Reference Intervals and Decision Limits de la International Federation of Clinical Chemistry and Laboratory Medicine (IFCC) ha publicado intervalos de referencia para creatinina en niños aplicables a los métodos de rutina con trazabilidad al método de referencia de IDMS50 (tabla 4). Los recién nacidos presentan concentraciones elevadas de creatinina (procedentes de la madre) que descienden rápidamente durante las primeras semanas de vida y se estabilizan entre los 2 meses y los 3 años de edad, momento a partir del cual aumentan progresivamente hasta alcanzar, en la adolescencia, los valores propios del adulto51,52.
Intervalos de referencia de la concentración de creatinina en suero para métodos de medida estandarizados
| Grupo de edad | n | Percentil 2,5μmol/L (mg/dL) | Percentil 97,5μmol/L (mg/dL) |
| Neonatos pretérmino 0-21 días | 58 | 29 (0,32) | 90 (1,01) |
| Neonatos a término 0-14 días | 69 | 22 (0,25) | 73 (0,82) |
| 2 meses a < 1 año | 41 | 11 (0,12) | 34 (0,38) |
| 1 a < 3 años | 45 | 15 (0,17) | 30 (0,34) |
| 3 a < 5 años | 41 | 21 (0,24) | 34 (0,38) |
| 5 a < 7 años | 43 | 26 (0,29) | 40 (0,45) |
| 7 a < 9 años | 46 | 31 (0,35) | 46 (0,52) |
| 9 a < 11 años | 47 | 35 (0,39) | 53 (0,60) |
| 11 a < 13 años | 42 | 39 (0,44) | 59 (0,66) |
| 13 a < 15 años | 38 | 41 (0,46) | 65 (0,73) |
Adaptado de Ceriotti et al.50.
La cistatina C es una proteína de bajo peso molecular sintetizada por todas las células nucleadas, filtrada a nivel glomerular, reabsorbida y catabolizada por las células del túbulo proximal53. Su concentración sérica es más elevada en el momento del nacimiento y disminuye progresivamente durante los siguientes 12-18 meses, momento a partir del cual permanece estable. A diferencia de la creatinina, no está influida por la masa muscular o la ingesta proteica, aunque el tratamiento con dosis altas de glucocorticoides, el hipertiroidismo, el tratamiento con tiroxina y concentraciones elevadas de proteína C reactiva están asociadas a un incremento en su concentración sérica54–57.
La cistatina C puede medirse mediante métodos nefelométricos (Particle-Enhanced Nephelometric Immuno-Assay) o turbidimétricos (Particle-Enhanced Turbidimetric Immuno-Assay). Las discrepancias en los resultados obtenidos por distintos laboratorios son consecuencia del tipo de método utilizado (los turbidimétricos producen resultados hasta un 30% más elevados58,59) y de las diferencias en los materiales de calibración y en la especificidad de los anticuerpos utilizados por los distintos fabricantes. Con el objetivo de minimizar estas diferencias, la IFCC, en colaboración con el Institut for Reference Materials and Measurements, inició, en el año 2010, el proceso de estandarización de la medida de cistatina C mediante la elaboración del material de referencia certificado ERM-DA471/IFCC60. Este material permitirá a los fabricantes de reactivos asegurar la trazabilidad de sus métodos de medida y conseguir la armonización de los resultados de cistatina C obtenidos por los distintos laboratorios clínicos.
Dos metaanálisis que han comparado la exactitud diagnóstica de las concentraciones séricas de cistatina C y de creatinina respecto al valor del FG muestran la superioridad de cistatina C para la identificación de alteraciones del FG en el intervalo de 60-79mL/min/1,73m261,62.
El elevado coste de cistatina C con respecto a creatinina hace que, en la actualidad, la medida de cistatina C quede relegada a aquellas circunstancias (alteraciones de la masa muscular, espina bífida, enfermedades neuromusculares, anorexia nerviosa, cirrosis hepática, etc.) en las que la concentración sérica de creatinina no puede ser utilizada para evaluar la función renal.
Aclaramiento de creatininaEl aclaramiento de creatinina se obtiene a partir de su concentración en suero y de su excreción en orina recogida, generalmente, durante un periodo de 24h. La estimación del FG obtenido de esta forma presenta una serie de limitaciones importantes como son la sobreestimación, entre el 10-20% del verdadero valor del FG como consecuencia de la secreción tubular de creatinina, en individuos con función renal normal, así como la dificultad e incomodidad que representa la obtención de orina de 24h, especialmente en niños pequeños o con problemas de incontinencia, que con frecuencia da lugar a recolecciones incompletas de orina. Además, la medida del aclaramiento de creatinina no mejora la valoración del filtrado glomerular obtenido mediante ecuaciones de estimación1.
Ecuaciones de estimación del filtrado glomerularDado que la medida del FG no es factible en la práctica diaria, se han desarrollado ecuaciones que tratan de obtener una estimación del FG a partir de la concentración sérica de creatinina, cistatina C o ambas y de variables como la edad, el sexo, la talla y la raza.
En los últimos años, se han publicado numerosas ecuaciones resultado de la utilización de diferentes sustancias exógenas para la medida del FG, de los procedimientos de medida de creatinina y cistatina C, de las características clínicas de las poblaciones y de los modelos matemáticos utilizados en la generación de las mismas.
Basadas en la concentración sérica de creatininaLas más conocidas son la ecuación de Schwartz63 y la de Counahan-Barratt64, que incluyen una constante (k) multiplicada por la talla y dividida por la concentración sérica de creatinina (tablas 5 y 6). La diferencia entre las constantes de ambas ecuaciones es debida al uso de métodos distintos para valorar la creatinina y al procedimiento de referencia utilizado para medir el FG. Schwartz publicó, posteriormente, diferentes valores de la constante (k) para niños de distintas edades ya que la relación entre la masa muscular y la talla varía en función de la edad17. Algunas ecuaciones (Léger65, British Columbia's Children's Hospital [BCCH1])66 incluyen también el peso (tabla 5) y otras eliminan la necesidad de conocer la variable talla mediante fórmulas que relacionan el valor de creatinina con la mediana de la concentración de creatinina de referencia para cada grupo de edad67 o utilizan percentiles de la talla específicos para la edad y el sexo68.
Ecuaciones basadas en la concentración sérica de creatinina
| Schwartz | Counahan-Barratt | Léger | BCCH1 | Schwartz-IDMS (bedside) | |
| Año publicación | 1976 | 1976 | 2002 | 2006 | 2009 |
| Número de individuos | 186 (desarrollo)223 (validación) | 103 (desarrollo)83 (validación) | 64 (desarrollo)33 (validación) | 180 (desarrollo)86 (validación) | 349 (desarrollo)168 (validación) |
| Población | ERC y niños con función renal normal | ERC | ERC, TR (40%) | ERC y niños con función renal normal | ERC |
| Sexo femenino (%) | NC | NC | 40% | 43% | 39% |
| Edad | 6 meses-20 años | 2 meses-14 años | 11 años (0,8-18)a | 10,5 años (1,1-19,4)a | 10,8 años (7,7-14,3)c |
| Peso (kg) | NC | NC | 39 (8-72)a | 38±20b | 35 (23,6-53)c |
| Talla (cm) | NC | NC | 139 (67-174)a | 137±27b | 140 (120-160)c |
| Área (m2) | NC | NC | 1,24 (0,4-1,77)a | NC | 1,2 (0,9-1,5)c |
| Creatinina (mg/dL) | NC | NC | 0,98 (0,37-3,75)a | 0,87±0,48b | 1,3 (1,0-1,8)c |
| FG (mL/min/1,73m2) | 0-220 | 4-200 | 100 (31-200)a | 97±43b | 41 (32-52)c |
| Método de referencia | Aclaramiento de creatinina | 51Cr-EDTAPL | 51Cr-EDTAPL | 99mTc-DTPAPL | IohexolPL |
| Método determinación creatinina | Jaffé modificadoAnalizador Technicon® | Jaffé manual por duplicado (tras absorción resina intercambio iónico)y en Analizador Technicon® en grupo desarrolloy solo Technicon® en grupo validación, pero introduciendo un factor de compensación de –0,14 mg/dL | Jaffé cinéticoAnalizador Hitachi 911® (Roche Diagnostics) | EnzimáticoAnalizador Vitros 950®,(Ortho Clinical Diagnostics) | EnzimáticoAnalizador Advia 2400® (Siemens Diagnostics) |
BCCH: British Columbia's Children's Hospital: 51Cr-EDTA; 51Cr-ácido etilendiaminotetraacético; ERC: enfermedad renal crónica; FG: filtrado glomerular; IDMS: dilución isotópica-espectrometría de masas; NC: no consta; 99mTc-DTPA: 99mTc-ácido dietilentriaminopentaacético; TR: trasplante renal.
Durante más de 30 años se ha utilizado, de modo preferente, la ecuación de Schwartz. Debido a la gran variación entre laboratorios en cuanto al método de medida de creatinina, la constante (k) debía de ser adaptada localmente aunque esta corrección no se ha realizado habitualmente. Los métodos de medida de creatinina estandarizados, utilizados en la actualidad de forma mayoritaria por los laboratorios clínicos, producen resultados del orden de un 10 a un 20% inferiores respecto a los del método utilizado en la ecuación original dando lugar a una sobreestimación del 20 al 40% en el valor de FG si se utiliza esta ecuación56,69,70.
Schwartz et al. han publicado nuevas ecuaciones a partir de una población de 349 niños de entre 1 y 16 años de edad incluidos en el estudio (CKiD)71, con ERC (FG entre 15 y 75mL/1,73/m2) e importante retraso de crecimiento y utilizando el aclaramiento plasmático de iohexol como método de referencia del FG72 (tabla 6). Una de ellas, la ecuación de Schwartz «bedside», incorpora la talla y la medida de creatinina a partir de un método enzimático con trazabilidad a IDMS. Dicha ecuación ha sido validada en poblaciones de niños sanos y con alteraciones de la función renal, utilizando métodos de medida de creatinina tanto enzimáticos como de Jaffé68,73-79. Algunos autores sugieren realizar una modificación de la constante en función de la edad73 o derivan nuevas ecuaciones que incluyen también la edad y el sexo (ecuación Schwartz-Lyon74 y ecuación cuadrática de Gao79 (tabla 6).
Debido a que la ecuación de Schwartz «bedside» se ha derivado de niños con FG inferior a 75mL/min/1,73m2, todos los valores superiores a este se deben de informar como «>75mL/min/1,73m2»72.
Las ecuaciones para la estimación del FG utilizadas en adultos (MDRD, CKD-EPI) no deben ser aplicadas en población de menos de 18 años, ya que todas sobreestiman el valor del FG74,80.
En la actualidad, la ecuación de Schwartz «bedside» es la más ampliamente recomendada para evaluar el FG en población pediátrica2,45,46. Debido a que esta ecuación se ha derivado a partir de métodos de creatinina estandarizados a IDMS y el término «bedside» puede ser equívoco, los autores de este documento han decidido denominarla ecuación Schwartz-IDMS.
Hay que tener en cuenta que las ecuaciones basadas en creatinina no deben utilizarse cuando la función renal no es estable, como sucede en el fracaso renal agudo, ni tampoco en niños con desviaciones importantes del índice de masa corporal, amputaciones, paraplejía, enfermedades musculares o neuromusculares y con malnutrición importante81.
Basadas en la concentración sérica de cistatina CEstas ecuaciones son más simples que las elaboradas a partir de creatinina debido a que no incluyen datos antropométricos. Algunas de ellas se han desarrollado a partir de población adulta y pediátrica y otras, como la de Grubb82, Filler83, Zappitelli84 o Schwartz85, solo incluyen población infantil (tablas 6 y 7).
Descripción de diferentes ecuaciones de estimación del filtrado glomerular
| Basadas en la concentración sérica de creatinina | |
| Schwartz, 1976 (mL/min/1,73m2) | ka×(talla/Cr) |
| Counahan-Barratt, 1976 (mL/min/1,73m2) | 0,43×(talla/Cr) |
| Léger, 2002 (mL/min) | 0,641×(peso/Cr)+16,063×(talla2)/Cr) |
| BCCH1, 2006 (mL/min/1,73m2) | 1,18+(0,0016× peso)+(0,01×talla)+([149,5/Cr×88,4])−(2141/[Cr×88,4]2) |
| Schwartz-IDMS, 2009 (mL/min/1,73m2) | 0,413×(talla/Cr) |
| Schwartz-Lyon, 2011 (mL/min/1,73m2) | 0,373×(talla/Cr)0,418×(talla/Cr) para varones mayores de 13 años |
| Gao, 2013 (mL/min/1,73m2) | 0,68×(talla/Cr)−0,0008×(talla/Cr)2+(0,48×edad)−(21,53 para niños o 25,68 para niñas) |
| Basadas en la concentración sérica de cistatina C | |
| Filler, 2003 (mL/min/1,73m2) | 91,62×CisC−1,123 |
| Grubb, 2005 (mL/min/1,73m2) | 84,69×CisC−1,680×1,384 (si edad<14) |
| Zappitelli, 2006 (mL/min/1,73m2) | 75,94/CisC1,17×1,2 (si TR) |
| Schwartz, 2012 (mL/min/1,73m2) | 70,69×CisC−0,931 |
| Basadas en las concentraciones séricas de creatinina y cistatina C | |
| Bouvet, 2006 (mL/min) | 63,2×(1,09/Cr)0,35×(1,2/CisC)0,56×(peso/45)0,3×(edad/14)0,4 |
| Zappitelli, 2006 (mL/min/1,73m2) | (43,82×e00,3X talla)/(CisC0,635×Cr0,547)×1,165 (si TR) |
| Schwartz (CKiD), 2009 (mL/min/1,73m2) | b39,1×(talla/Cr]0,516×(1,8/CisC)0,294×(30/BUN)0,169×1,099varón×(talla/1,4)0,188 |
| Schwartz (CKiD), 2012 (mL/min/1,73m2) | c39,8×(talla/Cr)0,456×(1,8/CisC)0,418×(30/BUN)0,079×1,076varón×(talla/1,4)0,179 |
Todas las ecuaciones, con la excepción de las de Léger y Bouvet, expresan el valor del filtrado glomerular en mL/min estandarizados a una superficie corporal de 1,73m2 ya que el método de referencia de medida del filtrado glomerular utilizado para la obtención de la ecuación se estandarizó a 1,73m2.
BUN: nitrógeno ureico; CisC: concentración sérica de cistatina C (mg/L); Cr: concentración sérica de creatinina (mg/dL); edad: años; IDMS: dilución isotópica-espectrometría de masas; peso: kg; talla: cm (Schwartz [CKiD] 2009 y Schwartz [CKiD] 2012 en m); TR: trasplante renal.
Ecuaciones basadas en la concentración sérica de cistatina C
| Filler | Grubb | Zappitelli | Schwartz | |
| Año publicación | 2003 | 2005 | 2006 | 2012 |
| Número de individuos | 536 | 85 | 103 | 643 (derivación)322 (validación) |
| Población | ERC, TR (5,4%) | ERC | ERC, TR (25%) | ERC |
| Sexo femenino (%) | 41 | 43 | 40 | 49 |
| Edad (años) | 11,2 (1,0-18)1 | 12 (0,3-17)a | 12,7 ± 4,7b | NC |
| Peso (kg) | 40,2 (6,5-104)1 | 41 (5-99)a | NC | NC |
| Talla (m) | 1,36 (0,62-1,89)1 | 1,46 (0,62-1,97)a | NC | 1,4 (1,2-1,6)c |
| Área (m2) | 1,22 (0,33-2,20)1 | 1,29 (0,28-2,32)a | NC | NC |
| Cistatina C (mg/L) | 0,89 (0,36-7,44)1 | 0,97 (0,75-2,98)a | 1,43±0,92b | 1,7 (1,3-2,3)c |
| FG (mL/min/1,73m2) | 103 (7-209)1 | 108 (11-240)a | 74±36b | 43,3 (32,6-55,6)c |
| Método de referencia | 99mTc-DTPAPL | IohexolPL | IotalamatoPL | IohexolPL |
| Método determinación cistatina C | PENIA (Dade-Behring)Analizador BN-ProSpec® (Dade-Behring) | PETIA (Dako)Analizador HitachiModular P® (Roche Diagnostics) | PENIA (Dade-Behring)Analizador BN-II® (Dade-Behring) | PENIA (Siemens Diagnostics)Analizador BN-II® (Siemens Diagnostics) |
ERC: enfermedad renal crónica; FG: filtrado glomerular; NC: no consta; PENIA: Particle-Enhanced Nephelometric Immuno-Assay; PETIA: Particle-Enhanced Turbidimetric Immuno-Assay; 99mTc-DTPA: 99mTc-ácido dietilentriaminopentaacético; TR: trasplante renal.
Los diferentes procedimientos de medida, calibradores, poblaciones en la derivación de estas ecuaciones y modelos matemáticos usados en la generación de las mismas hacen que solo sean aplicables en aquellas poblaciones de características similares y que no se puedan usar de modo generalizado.
En la actualidad, no existe ninguna ecuación pediátrica obtenida a partir de la medida de cistatina C estandarizada frente al material de referencia ERM-DA471/IFCC.
Basadas en las concentraciones séricas de creatinina y cistatina CLas ecuaciones que combinan creatinina y cistatina C tratan de minimizar las fuentes de error que afectan a cada uno de estos marcadores. Tanto la ecuación de Bouvet86 como la de Zappitelli84 se han desarrollado a partir de niños con ERC e incluyen un elevado porcentaje de trasplantados renales. Bouvet utiliza como método de referencia el aclaramiento plasmático de 51Cr-EDTA e incluye las variables peso y edad, mientras que Zappitelli utiliza el aclaramiento plasmático de iotalamato e incorpora la talla y un factor de ajuste para trasplantados renales (tablas 6 y 8).
Ecuaciones basadas en las concentraciones séricas de creatinina y cistatina C
| Bouvet | Zappitelli | Schwartz (CKiD) | Schwartz (CKiD) | |
| Año publicación | 2006 | 2006 | 2009 | 2012 |
| Número de individuos | 100 | 103 | 349 (desarrollo)168 (validación) | 643 (derivación)322 (validación) |
| Población | ERC, TR (45%) | ERC, TR (25%) | ERC | ERC |
| Sexo femenino (%) | 42 | 40 | 39% | 49% |
| Edad (años) | 13,9 (1,4-22,8)a | 12,7±4,7c | 10,8 (7,7-14,3)a | NC |
| Peso (kg) | 45 (10-89)a | NC | 35 (23,6-53)b | NC |
| Talla (m) | 1,5 (0,8-1,9)a | NC | 1,4 (1,2-1.6)b | 1,4 (1,2-1,6)b |
| Área (m2) | 1,34 (0,47-2,05)a | NC | 1,2 (0,9-1,5)b | NC |
| Creatinina (mg/dL) | 1,09 (0,41-4,28)a | 1,1±0,8c | 1,3 (1,0-1,8)b | 1,3 (1,0-1,9)b |
| Cistatina C (mg/L) | 1,22 (0,49-4,10)a | 1,43±0,92c | 1,8 (1,5-2,3)b | 1,7 (1,3-2,3)b |
| FG (mL/min/1,73m2) | 92 (18-198)a | 74 (±36)c | 41 (32-51,7)b | 43,3 (32,6-55,6)b |
| Método de referencia | 51Cr-EDTAPL | IotalamatoPL | IohexolPL | IohexolPL |
| Método determinación creatinina | Jaffé cinético no compensadoAnalizador Olympus® | EnzimáticoAnalizador Vitros® (Ortho Clinical Diagnostics Inc) | EnzimáticoAnalizador Advia 2400® (Siemens Diagnostics) | Enzimático (Analizador Advia 2400® (Siemens Diagnostics) |
| Método determinación cistatina C | PENIA (Dade-Behring)Analizador BN-ProSpec® (Dade-Behring) | PENIA (Dade-Behring)Analizador BN-II® (Dade-Behring) | PETIA (Dako) | PENIA (Siemens Diagnostics)Analizador BN-II® (Siemens Diagnostics) |
51Cr-EDTA; 51Cr-ácido etilendiaminotetraacético; ERC: enfermedad renal crónica; FG: filtrado glomerular; NC: no consta; PENIA: Particle-Enhanced Nephelometric Immuno-Assay; PETIA: Particle-Enhanced Turbidimetric Immuno-Assay; TR: trasplante renal.
La ecuación CKiD, obtenida a partir del estudio del mismo nombre, incluye como variables la talla y las concentraciones séricas de creatinina, urea y cistatina C (obtenida a partir de un método turbidimétrico)72. Recientemente, Schwartz ha publicado una nueva versión de la ecuación CKiD utilizando un método de cistatina C basado en una medida nefelométrica en lugar de la turbidimétrica empleada originariamente (tablas 6 y 8), así como una ecuación más simple, formulada solo a partir de una constante y de la concentración sérica de cistatina85 (tablas 6 y 8).
Recomendaciones- 1.
Recomendamos que la evaluación de la función renal se base en la medida de la concentración sérica de creatinina y en la estimación del FG obtenido mediante una ecuación (1A) y no exclusivamente en la medida de la concentración sérica de creatinina (1B).
- 2.
Respecto a la medida de la concentración sérica de creatinina, recomendamos que los laboratorios clínicos:
- –
Utilicen procedimientos con trazabilidad al método de referencia de IDMS (1B).
- –
Utilicen procedimientos de medida enzimáticos ya que cumplen las especificaciones de calidad analítica recomendadas y son menos susceptibles a las interferencias.
- –
Indiquen el método utilizado para la medida de la concentración sérica de creatinina.
- –
Informen los resultados con una aproximación de dos decimales si expresan los resultados en unidades convencionales (mg/dL) y sin decimales si utilizan el Sistema Internacional de unidades (μmol/L) (1B).
- –
Incluyan en sus informes valores de referencia estratificados por edad y adecuados al método de medida utilizado.
- –
- 3.
De acuerdo con la mayoría de sociedades científicas, aconsejamos utilizar la ecuación de Schwartz-IDMS para la estimación del FG:
- –
Esta ecuación solo es válida para valores de creatinina obtenidos mediante métodos con trazabilidad a IDMS.
- –
Aquellos laboratorios que usen métodos de medida de creatinina no estandarizados deberían abstenerse de informar el filtrado glomerular mediante una ecuación o bien utilizar la ecuación de Schwartz original.
- –
Los valores del filtrado glomerular estimado se informarán con el valor obtenido si son inferiores a 75mL/min/1,73m2 y en caso contrario como «>75mL/min/1,73m2».
- –
- 4.
Sugerimos la utilización de pruebas adicionales (concentración sérica de cistatina C o una medida de aclaramiento) en aquellas circunstancias en las que las ecuaciones de estimación del FG basadas en creatinina son inadecuadas (2B).
- 5.
Respecto a la medida de la concentración sérica de cistatina C:
- –
Recomendamos la utilización de métodos con trazabilidad al material de referencia internacional ERM-DA471/IFCC (1B).
- –
Recomendamos que la concentración sérica de cistatina C se exprese en mg/L con una aproximación de 2 decimales (1B)
- –
Aconsejamos que los laboratorios clínicos indiquen el método utilizado para la medida de la concentración sérica de cistatina C.
- –
Sugerimos que la medida de la concentración sérica de cistatina C se acompañe de una estimación del FG (2C). La ecuación a seleccionar debe tener en cuenta el método de medida utilizado.
- –
- 6.
En caso de utilizar una ecuación basada en la medida de la concentración sérica de creatinina y cistatina C, las ecuaciones recomendadas son las de CKiD 2009 (para métodos de medida de cistatina C turbidimétricos no estandarizados) o CKiD 2012 (para métodos de medida de cistatina C nefelométricos no estandarizados), mientras no exista una ecuación obtenida a partir de procedimientos de medida de cistatina C estandarizados. El resto de ecuaciones que combinan ambas magnitudes son inadecuadas, ya que no se basan en un método de medida de creatinina estandarizado.
- 7.
Se aconseja que los resultados del FG, en niños mayores de 2 años, se acompañen de un comentario que facilite su interpretación en cuanto al estadio de enfermedad renal crónica (tabla 9).
Tabla 9.Sugerencias de comentarios a los resultados del filtrado glomerular estimado para niños de entre 2 y 18 años
Filtrado glomerular estimado (mL/min/1,73m2) Comentario >90 Filtrado glomerular estimado compatible con ERC estadio 1 si persiste durante más de 3 meses y se acompaña de proteinuria 60-89 Filtrado glomerular estimado compatible con ERC estadio 2 si persiste durante más de 3 meses y se acompaña de proteinuria 45-59 Filtrado glomerular estimado indicador de ERC estadio 3a si persiste durante más de 3 meses 30-44 Filtrado glomerular estimado indicador de ERC 3b si persiste durante más de 3 meses 15-29 Filtrado glomerular estimado indicador de ERC estadio 4 si persiste durante más de 3 meses <15 Filtrado glomerular estimado indicador de ERC estadio 5 si persiste durante más de 3 meses
Los autores declaran no tener ningún conflicto de intereses.
Miembros de la Comisión de Función Renal de la SEQC que han colaborado en la revisión de este documento: J.A. Jiménez García, C. Macías Blanco, R. Martínez López, J. Ruiz Altarejos y S. Ventura Pedret.
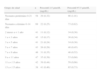
Calidad de la evidencia
| A | Alta calidad: es muy improbable que las investigaciones adicionales modifiquen la certidumbre con respecto al cálculo del efecto |
| B | Calidad moderada: probablemente, las investigaciones adicionales tendrán una repercusión importante en la certidumbre con respecto al cálculo del efecto, y pueden modificarlo |
| C | Baja calidad: muy probablemente, las investigaciones adicionales tendrán una repercusión importante en la certidumbre con respecto al cálculo del efecto y es posible que lo modifiquen |
| D | Muy baja calidad: cualquier cálculo del efecto es muy dudoso |
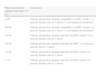
Fuerza de la recomendación
| Nivel 1 «Recomendamos» | Fuerte: existe un alto grado de confianza en que los efectos deseables de la intervención superan a los no deseables (recomendación fuerte a favor) o viceversa (recomendación fuerte en contra) |
| Nivel 2 «Sugerimos» | Débil: probablemente, los efectos deseables de la intervención superan a los no deseables (recomendación débil a favor), o viceversa (recomendación débil en contra), pero existe menor grado de certeza |
| No clasificación GRADE | Cuando las recomendaciones expresan opiniones consensuadas por los autores, no abordables desde la evidencia científica |