El fetus in fetu (FiF) es una malformación congénita infrecuente1. Su incidencia estimada es de 1:500.000 recién nacidos vivos; se han publicado unos 200 casos2. Su etiopatogenia es una embriogénesis anómala en una gestación monocorial biamniótica en la que un feto queda en el interior del otro.
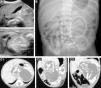
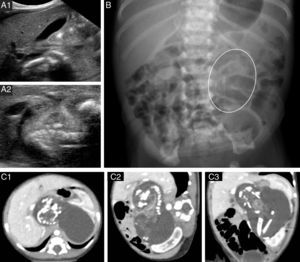
Se presenta un recién nacido a término, varón, con diagnóstico ecográfico de masa abdominal a las 25 semanas de gestación. Exploración física anodina. Valores séricos elevados de ferritina, LDH, β-HCG y FA; hemograma, función renal, α-fetoproteína y antígeno carcinoembrionario normales. Catecolaminas urinarias normales. La ecografía abdominal muestra una masa retroperitoneal sólida lobulada bien delimitada rodeada de líquido y con calcificaciones lineales en su interior que recuerdan a estructuras óseas (fig. 1A). En la radiografía de abdomen se visualizan estructuras óseas maduras simulando huesos largos en flanco izquierdo (fig. 1B). La TAC abdominal (fig. 1C) confirma los hallazgos y detalla la relación de la masa con importantes estructuras vasculares y viscerales. La exploración quirúrgica, realizada a los 5 días de vida, revela una masa encapsulada que se secciona obteniendo un líquido translúcido y una masa de aspecto fetiforme con las 4 extremidades y un vestigio de cordón umbilical de 8mm de longitud que continúa con un tejido membranáceo correspondiente a la bolsa amniótica (fig. 2). El estudio anatomopatológico describe una estructura fetiforme recubierta de piel con arrinia, anoftalmia, acráneo y raquisquisis. Se identifican lengua, gérmenes dentarios, tráquea, esófago, intestino, vejiga, tejido pancreático y testicular, glándula adrenal, columna espinal con médula ósea y pelvis. Se descartan signos de malignidad. A las 48h postexéresis presenta distensión abdominal, elevación sérica de parámetros inflamatorios y radiografía abdominal con neumatosis intestinal. Ante la sospecha de enterocolitis necrosante se inicia antibioterapia. En la reintervención quirúrgica se objetiva necrosis isquémica del íleon terminal hasta colon ascendente, secundaria a la ligadura de una rama de la arteria mesentérica superior. Se realiza hemicolectomía derecha, ileostomía distal y colostomía en colon transverso. El postoperatorio transcurre sin incidencias, con normalización de los valores de ferritina, LDH, β-HCG y FA. Se realiza reconstrucción intestinal mediante anastomosis término-terminal sin incidencias a los 3 meses. Su evolución a los 12 meses es excelente con adecuado desarrollo pondero-estatural.
A) Ecografía abdominal. B) Radiografía simple de abdomen, la figura ovalada remarca las estructuras óseas longitudinales. C) TAC abdominal: masa bien delimitada con estructuras calcificadas en su interior correspondientes a huesos largos y vértebras del FiF; C1) corte axial, C2) corte sagital; C3) corte oblicuo.
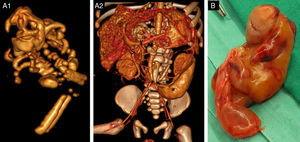
A) Reconstrucción 3D, VR en proyección oblicua izquierda: A1) estructura ósea del FiF; A2) parte del lóbulo hepático izquierdo eliminado para mejor visualización de la masa. Estructuras óseas del FiF de la misma densidad que las estructuras óseas del paciente. Se observa la vena esplénica (¥) desplazada craneal y anteriormente. El páncreas (no se observa) está desplazado anterior y cranealmente. El riñón izquierdo está rechazado lateral y anteriormente (*) y la vena renal izquierda (*) está elongada y anterior. El tronco celíaco (no se muestra) está elongado y desplazado cranealmente por encima de la masa. La vena cava inferior (#) y la arteria mesentérica superior ($) están lateralizadas hacia la derecha. B) Pieza quirúrgica: masa fetiforme con cordón umbilical.
El FiF es una enfermedad infrecuente, fácilmente identificable si se conocen sus peculiaridades radiológicas3. Se postula que su etiología es una división desigual del blastocito en una gestación gemelar monozigota, en la que el feto de menor tamaño (feto parásito o FiF) se desarrolla en el interior del feto huésped1. El FiF suele tener una cápsula con contenido líquido, correspondientes a su bolsa y líquido amniótico. Tiene aspecto de feto en desarrollo con una complejidad variable. Puede contener estructuras del sistema nervioso, tracto gastrointestinal o urinario y huesos largos bien diferenciados, los cuerpos vertebrales son patognomónicos, y es excepcional la existencia de corazón o encéfalo4. El 80% de los FiF descritos se localizan en región retroperitoneal, pero pueden ubicarse en tórax, cerebro, escroto, incluso en la cavidad oral. Habitualmente hay un único gemelo parásito, pero se han descrito FiF múltiples.
Su presentación clínica suele ser una masa palpable, habitualmente abdominal, pero puede comenzar por síntomas secundarios al crecimiento del FiF. La mayoría de los FiF se describen en la infancia.
Su diagnóstico se basa en pruebas de imagen. La ecografía prenatal puede identificar una masa quística con componentes sólidos y/o calcificaciones5. Posnatalmente, la radiografía simple muestra estructuras óseas, aunque su no visualización no excluye el diagnóstico, la presencia de cuerpos vertebrales es patognomónica. La TAC detalla las estructuras que constituyen la masa, su anatomía vascular y la relación con los órganos adyacentes, importante para el abordaje quirúrgico. La RM está ganando protagonismo debido a su alta resolución espacial y discriminación entre tejidos, además evita la radiación y el empleo de contraste endovenoso6. Se ha descrito elevación sérica ocasional de α-fetoproteína y/o β-hCG en relación a esta enfermedad2.
El principal diagnóstico diferencial es con el teratoma altamente diferenciado. La existencia de cuerpos vertebrales en el FiF indica que el feto parásito alcanzó la etapa primitiva embriogénica de la notocorda, precursora de la columna vertebral. Contrariamente, el teratoma se origina por un crecimiento descontrolado de células pluripotenciales sin organogénesis ni segmentación vertebral. Asimismo, a diferencia del teratoma, el FiF no suele presentar recurrencias y raramente maligniza.
A pesar de la benignidad del FiF, la evolución de la masa puede comprometer estructuras adyacentes, por lo que la resección quirúrgica es la primera opción terapéutica. Asimismo, se recomienda la monitorización de β-HCG y α-fetoproteína séricas y el seguimiento ultrasonográfico de estos pacientes durante 2 años2.