Introducción
Los errores innatos de la oxidación mitocondrial de ácidos grasos conforman un grupo de enfermedades de carácter autosómico recesivo de espectro clínico y pronóstico variable, dependiendo del déficit enzimático. Desde su primera descripción han sido comunicados varios defectos incluyendo algunos subtipos.
Las manifestaciones clínicas resultan de la inhabilidad por parte de los tejidos que oxidan ácidos grasos para mantener el aporte de energía cuando hay un incremento en la demanda; por lo tanto, los órganos diana de los defectos de la oxidación de ácidos grasos incluyen el músculo esquelético y cardíaco, así como el hígado.
Los síntomas sugestivos de estas deficiencias incluyen síndrome de Reye (especialmente recurrente), hipotonía y/o miopatía, neuropatía periférica, niveles alterados de conciencia y muerte súbita, así como complicaciones metabólicas del embarazo1,2.
Dentro de los hallazgos sugestivos se encuentran la hipoglucemia hipocetócica, miocardiopatía, arritmias cardíacas, acidosis metabólica y, en algunos casos, hiperamoniemia, síndromes AFLP/HELLP (hígado adiposo agudo del embarazo/hemólisis, enzimas hepáticas elevadas, plaquetas bajas), rabdomiólisis recurrente, aciduria dicarboxílica, deficiencia de carnitina e insuficiencia hepática, recurrente o fulminante1. Debido a que la carnitina es el vehículo mediante el cual los grupos acilo pueden abandonar la mitocondria y existe un equilibrio entre las acilcarnitinas y sus respectivos ésteres de coenzima A (CoA) en la mitocondria, el análisis de carnitina y acilcarnitinas en sangre es aproximadamente equivalente al análisis de acil-CoA en la mitocondria3. El concepto de un perfil de acilcarnitinas para reemplazar al perfil de ácidos orgánicos en orina ha sido indicado como una herramienta potencialmente más útil para el diagnóstico de las alteraciones del metabolismo de los aminoácidos de cadena ramificada y la oxidación mitocondrial de los ácidos grasos.
El objetivo del presente estudio fue establecer valores de referencia para acilcarnitinas en una población infantil sana como herramienta diagnóstica de errores hereditarios de la β-oxidación mitocondrial y revisar la literatura médica relacionada con estas alteraciones.
Pacientes y métodos
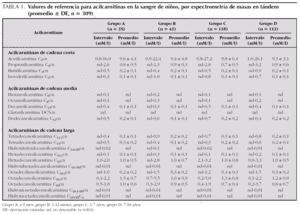
Se tomaron muestras de sangre de 309 niños (154 niños y 155 niñas) normales divididos en cuatro grupos de edad (grupo A, < 1 mes; grupo B, 1-12 meses; grupo C, 1-7 años; grupo D, 7-18 años) y fueron analizadas por espectrometría de masas en tándem (MS/MS). Los padres firmaron un consentimiento escrito y toda la información se considera confidencial. Las muestras se mantuvieron en congelación (20 °C) antes de la determinación de acilcarnitinas por MS/MS, hasta obtener la totalidad de los especímenes necesarios para realizar el estudio.
El estudio cumplió con las normas establecidas por los correspondientes comités de ética y contó con su respectiva aprobación. La determinación de acilcarnitinas se realizó de acuerdo con Millington et al4. La técnica utiliza métodos de fragmentación de moléculas positivamente cargadas mediante ionización electrodifusora de los ésteres butílicos. Las concentraciones se calculan después de obtener la relación entre la intensidad de la señal correspondiente para cada compuesto y la intensidad de la señal producida por un estándar interno (IS) que se añade a las muestras como patrón interno. El equipo utilizado fue un VG Quattro II, triple quadrupole tandem mass spectrometer (Micromass, Reino Unido), equipado con una fuente de ionización en aerosol (ESI), y un sistema de análisis de datos micromass (MassLynx). La introducción de las muestras a la fuente se hizo mediante el dispositivo automático Jasco AS980 (Jasco, Reino Unido), acoplado a una bomba Jasco PU980 HPLC. Para obtener las concentraciones de acilcarnitinas se realizó un registro de precursores m/z 85 (PAR 85). La prueba t de Student fue utilizada para establecer las posibles diferencias relacionadas con la edad o el sexo.
Resultados y discusión
Nuestros resultados (tabla 1) muestran un valor promedio total de acilcarnitinas en niños de 15,2 ± 6,9; 14,4 ± 8,3; 14,9 ± 9,9 y 14,6 ± 6,8 mM/l, para los cuatro grupos de edad respectivamente (grupo A, < 1 mes; grupo B, 1-12 meses; grupo C, 1-7 años; grupo D, 7-18 años), conformado por valores promedio de 10,7 ± 4,8; 10,6 ± 5,3; 10,8 ± 6,9, y 10,5 ± 3,9 para las acilcarnitinas de cadena corta; 8,3 ± 0,2; 0,2 ± 0,2; 0,3 ± 0,3, y 0,3 ± 0,3 para las acilcarnitinas de cadena media, y 4,1 ± 2,4; 3,6 ± 2,8; 4,0 ± 2,7, y 3,8 ± 2,6 para las acilcarnitinas de cadena larga para cada grupo de edad respectivamente. Estos valores son diferentes de los publicados por otros autores5, quienes trabajaron con niños con seis grupos de edad (cordón umbilical, menores de 2 meses, de 2 a 18 meses, de 18 meses a 5 años, de 5 a 10 años y de 11 a 17 años) y compararon los valores obtenidos para estos grupos con las muestras recibidas para cribado neonatal (primera semana de vida).
Para ellos hay diferencias significativas para algunas acilcarnitinas, cuando se comparan los grupos estudiados, con el grupo de muestras recibidas para el cribado neonatal. Sin embargo, no encuentran diferencias significativas entre los otros grupos de edad ni entre sexos. Nosotros presentamos cuatro grupos de edad y no encontramos diferencias significativas relacionadas con la edad o el sexo entre ningún grupo. Los estudios son similares al afirmar que a medida que se incrementa la edad, los valores de acilcarnitinas son menores; sin embargo, los intervalos para algunas acilcarnitinas, comunicados por ellos, son muy superiores, cuando se comparan con los nuestros, por lo que consideramos necesario más investigación al respecto.
La identificación de acilcarnitinas en fluidos corporales utilizando espectrometría de masas en tándem fue desarrollada a finales de la década de 19803,6 y representa una herramienta útil para el diagnóstico de algunos defectos de la oxidación de los ácidos grasos, los cuales son difíciles de diagnosticar mediante el método cromatográfico tradicional. El método tiene el potencial de tamizar efectivamente al menos una docena de otras alteraciones7-11. Algunos autores sugieren que el perfil de acilcarnitinas en sangre debería ser determinado en todos los pacientes que presenten un episodio agudo de hipoglucemia hipocetócica, síndrome de Reye, miocardiopatía hipertrófica, insuficiencia cardíaca o muerte súbita durante el período neonatal o durante la infancia, además en estados de hipotonía con retardo en el crecimiento, retinitis pigmentosa e incluso dolor muscular ocasionado por el ejercicio12.
La determinación de acilcarnitinas ha sido comunicada en sangre entera13, plasma14, orina15, líquido amniótico16 y bilis17.
La mayoría de los signos y síntomas de los pacientes sospechosos de sufrir alteraciones hereditarias de la β-oxidación mitocondrial de los ácidos grasos han sido identificados. En general, estas alteraciones deben ser incluidas como diagnóstico diferencial en casos de hipoglucemia sin explicación, acidosis metabólica, síndrome de Reye-like, miopatía, mioglobinuria persistente y miocardiopatía18. Los hallazgos de laboratorio soportan el diagnóstico clínico, niveles de metabolitos intermediarios en orina (glucosa, cuerpos cetónicos, lactato, piruvato) y en sangre (ácidos grasos no esterificados)19; perfil de ácidos orgánicos en orina20; perfil de acilcarnitinas21; análisis enzimáticos en cultivos celulares y leucocitos22,23 y análisis de ADN24 son utilizados para confirmar el diagnóstico del tipo de alteración.
Los principales hallazgos bioquímicos de los trastornos de la β-oxidación mitocondrial incluyen disminución en la concentración de carnitina en plasma excepto en la deficiencia de carnitina palmitoiltransferasa I, donde se encuentra incrementado; concentraciones normales o disminuidas de carnitina libre en plasma excepto en la deficiencia del transportador de carnitina, en el que las concentraciones son siempre muy bajas; incremento en la relación acilcarnitinas/carnitina libre excepto en las deficiencias del transportador de carnitina y carnitina palmitoiltransferasa I, en el que las concentraciones son normales; perfil alterado de ácidos grasos en plasma, con incremento en los niveles de C14:1n-9 en la deficiencia de acil-CoA deshidrogenasa de cadena muy larga, 3-hidroxiacil-CoA deshidrogenasa de cadena larga, flavoproteína de transferencia de electrones y deshidrogenasa de la proteína de transferencia de electrones, así como niveles elevados de C10:1n-6 en las deficiencias de acil-CoA deshidrogenasa de cadena media, flavoproteína de transferencia de electrones, y deshidrogenasa de la proteína de transferencia de electrones. La oxidación de ácidos grasos en fibroblastos está, además, deprimida en todas las deficiencias25,26.
Los ácidos orgánicos en orina son muy variables en pacientes con alteraciones de la β-oxidación mitocondrial, la mayoría de ellos presentan excreción normal durante la remisión. Incluso durante los episodios de descompensación, la aciduria dicarboxílica no cetócica puede ser el único hallazgo anormal. Pocos trastornos, sin embargo, presentan metabolitos anormales característicos; acilglicinas en la deficiencia de acil-CoA deshidrogenasa de cadena media, glutarato e isovalerilglicina en la deficiencia de la proteína de transferencia de electrones (aciduria glutárica tipo II), etilmalonato y adipato en la deficiencia de acil-CoA deshidrogenasa de cadena corta7,8.
El análisis de acilcarnitinas es probablemente la prueba más útil para el diagnóstico diferencial de estas alteraciones, y presentan en su gran mayoría un perfil anormal característico. Por ejemplo, se encuentran niveles incrementados de C4cn y C5cn en la deficiencia de acil-CoA deshidrogenasa de cadena corta; C6cn, C8cn y C10:1cn en la deficiencia de acil-CoA deshidrogenasa de cadena media; C14:1cn y C14:2cn en la deficiencia de acil-CoA deshidrogenasa de cadena muy larga; C14cn y C18cn en la deficiencia de carnitina acilcarnitina translocasa; C16cn, C16:1cn, C18cn, C18:1cn y C18:2cn en la deficiencia de carnitina palmitoiltransferasa II y C16:OHcn, C18:1 OHcn, y C18:OHcn en la deficiencia de 3-hidroxiacil-CoA deshidrogenasa de cadena larga. La C10:2cn, identificada como 2-trans,4-cis-C10:2, un intermediario en la degradación del ácido linoleico, ha sido encontrada en un paciente con deficiencia de 2,4-dienoil-CoA reductasa. Además, otras alteraciones metabólicas hereditarias son responsables de perfiles de acilcarnitinas anormales (acidurias orgánicas tales como las deficiencias de glutaril-CoA deshidrogenasa, 3-hidroximetilglutaril-CoA liasa, β-cetotiolasa, propionil-CoA carboxilasa, metilmalonil-CoA mutasa, e isovaleril-CoA deshidrogenasa)27. Los estudios de valoración de acilcarnitinas en muestras diferentes a las recibidas en el cribado neonatal son poco numerosos5,28,29. Por eso se hace necesario que otros grupos de investigación también hagan su aporte con relación a valores de referencia y tratar de unificar criterios.
En conclusión, la espectrometría de masas en tándem es una técnica eficaz para la determinación de acilcarnitinas en muestras de sangre, de niños en diferentes grupos de edad. Es posible aportar valores de referencia como herramienta diagnóstica de las enfermedades hereditarias de la β-oxidación mitocondrial de los ácidos grasos.
Correspondencia: Dr. J.H. Osorio.
Universidad de Caldas.
Departamento de Ciencias Básicas de la Salud.
Calle 65, 26-10. Manizales. Colombia.
Correo electrónico: josheno@yahoo.com
Recibido en julio de 2007.
Aceptado para su publicación en octubre de 2007.