Se midió hipertirotropinemia neonatal en 3 provincias del sur de España y se analizó la repercusión de una posible deficiencia de yodo en un programa de cribado de hipotiroidismo congénito (CH, congenital hypothyroidism).
Material y métodosEl estudio comprende 113.108 recién nacidos que se dividieron en 2 grupos según el momento en que se extrajo la muestra para el cribado. En 78.646 se recogió después de las 48h de vida y en 34.462 se obtuvo en el momento del nacimiento del cordón umbilical (muestras precoces). Los recién nacidos procedían de las provincias de Sevilla, Huelva y Córdoba. La tirotropina (TSH) se midió por fluorimetría a tiempo discriminado.
ResultadosEl porcentaje de hipertirotropinemia neonatal fue superior en Huelva (5,2%) que en Sevilla (1%) (p<0,001), hecho constatado igualmente en el grupo de muestras precoces (Huelva: 5,3%; Sevilla: 1,9%, y Córdoba: 1,7%: p<0,001). En este último grupo, el 0,3 y el 0,2% de los recién nacidos de Sevilla y Córdoba, respectivamente, presentaron TSH >20mUI/l y 10 recién nacidos tuvieron que localizarse por cada recién nacido con CH. En Huelva hubo que llamar a 17 recién nacidos por caso detectado.
ConclusionesLa distribución heterogénea de las concentraciones de TSH en los recién nacidos de las 3 áreas geográficas parece indicar una ingesta de yodo irregular y deficiente. La extracción de muestras precoces más una posible deficiencia de yodo incrementa el número de falsos positivos en el programa de cribado neonatal de CH.
Neonatal hyperthyrotropinemia by measurements of thyrotropin (TSH) concentrations has been assessed in three different areas of Spain. The repercussions of a possible iodine deficiency in a congenital hypothyroidism screening program have also been analysed
Material and MethodsThe study comprised 113,108 newborns, which were divided into two groups according to the time of blood sampling. In 78,646 newborns heel blood samples were obtained after 48h whereas in 34,462 newborns, samples were obtained at birth from the umbilical cord (early samples). Newborns came from three areas of the south of Spain, Seville, Huelva and Cordoba. TSH concentrations were measured by time-resolved fluoroimmunoassay.
ResultsThe percentage of hyperthyrotropinemia was greater in Huelva (5.2%) than Seville (1.0%) (p<0.001), similar to that observed in early samples, which was higher in Huelva (5.3%) than in Seville (1.9%) and Cordoba (1.7%) (p<0.001). In the early samples group, 0.3% and 0.2% of the newborns from Seville and Cordoba respectively, had TSH >20mIU/L and 10 infants should have been recalled for a new sample for each case detected. While in Huelva 17 infants (0.9%) were recalled per case detected.
ConclusionsThe heterogeneous distribution of TSH concentrations in newborns from several geographical areas appears to indicate an irregular and deficient iodine intake. Using early samples and a possible iodine deficiency, increase false positive results in a Neonatal Screening Program of congenital hypothyroidism.
El yodo es un oligoelemento esencial y un sustrato indispensable para la síntesis correcta de hormonas tiroideas (tiroxina [T4] y triyodotironina). Se asimila a través de la dieta y se requiere una ingesta mínima de yodo que difiere según la edad, el embarazo y la lactancia1. La Organización Mundial de la Salud (OMS) declara que la carencia de este micronutriente es la principal causa de retraso mental evitable y su erradicación es prioritaria en materia de salud pública. Se considera un problema mundial, y existen en Europa áreas de deficiencia de yodo en general leve2.
La deficiencia de yodo puede definirse al atender a 3 indicadores básicos: la prevalencia de bocio, la yoduria en escolares y la prevalencia de hipertirotropinemia neonatal. La yoduria media en escolares en el sur de España se ha duplicado desde 1993 como consecuencia del consumo de sal yodada en la dieta (130,78μg/l), pero más del 22,8% de los niños tiene yodurias inferiores a 100μg/l y sólo el 3% de ellos reconoce con certeza que consume sal yodada3,4. La prevalencia de bocio se modifica más tarde que la yoduria y refleja peor la ingesta actual de yodo5. No obstante, es útil para reflejar tendencias y en los escolares españoles aún permanece elevada3,4.
En un programa de cribado de hipotiroidismo congénito (CH, congenital hypothyroidism), una prevalencia de tirotropina (TSH) >5mUI/l después de las 48h de vida indica deficiencia de yodo6. En la mayoría de los programas de cribado, las muestras de sangre seca en papel de filtro se obtienen a partir de las 48h. Sin embargo, algunos programas utilizan muestras de sangre del cordón umbilical o del talón extraídas en las primeras 48h7. En estos casos, la elevación neonatal fisiológica de TSH es un inconveniente, ya que incrementa el número de falsos positivos y dificulta la detección de una posible deficiencia de yodo.
El objetivo de este estudio es analizar la prevalencia de hipertirotropinemia como posible indicador de deficiencia de yodo. Para esto, se analizan las concentraciones de TSH de los recién nacidos de las provincias de Sevilla, Huelva y Córdoba obtenidas en el programa de cribado neonatal de CH. Como objetivo secundario se estudia el impacto del posible déficit de yodo en dicho programa.
Material y métodosEl estudio cuenta con la aprobación del Comité de Ética del Hospital Universitario Virgen Macarena. Los datos analíticos y demográficos de los recién nacidos se obtuvieron previa autorización de la base de datos de la Escuela Andaluza de Salud Pública (MetNet). Se han excluido aquellos recién nacidos en los que se obtuvo la muestra fuera de los límites de tiempos definidos en el estudio y aquellos que no nacieron en las provincias seleccionadas.
Se establecieron 2 grupos de pacientes:
Grupo 1, compuesto por 78.646 niños nacidos entre el 1 de enero de 2001 y el 31 de diciembre de 2004 en Sevilla y Huelva. Cada provincia se dividió a su vez en distritos sanitarios. No fue posible obtener datos de la provincia de Córdoba porque en este período de tiempo las muestras de los recién nacidos se obtenían del cordón umbilical. Todas las muestras se extrajeron en papel de filtro (Whatman n.o 903, certificado UE) por punción en el talón a partir de las 48h de vida y se enviaron al Laboratorio de Bioquímica Clínica del Hospital Universitario Virgen Macarena para el análisis de TSH neonatal. Se ha considerado una concentración de TSH >5mUI/l para definir hipertirotropinemia (valor recomendado para reflejar deficiencia de yodo partir de las 48h de vida)6.
Grupo 2, compuesto por 34.462 niños nacidos entre el 1 de mayo de 2005 y el 1 de marzo de 2006 en las provincias de Sevilla, Huelva y Córdoba. Las muestras se obtuvieron del cordón umbilical y, en ocasiones, por punción en el talón durante las primeras 24h de vida. En estos casos se consideraron 2 puntos de corte para definir la hipertirotropinemia (10 y 20mUI/l de TSH neonatal), que son los que se utilizan para localizar a los recién nacidos y reanalizar la concentración de TSH neonatal en los programas de cribado8. En los recién nacidos con hipertirotropinemia de este grupo se recogieron las siguientes variables: sexo, peso al nacer, semanas de gestación y antecedentes maternos de enfermedad tiroidea.
Método de determinación de tirotropinaLa concentración de TSH se midió en las 48h siguientes a la recepción de la muestra en el laboratorio. Durante este tiempo se mantuvieron a temperatura ambiente y el análisis de éstas se realizó mediante inmunofluorometría a tiempo discriminado en el autoanalizador Autodelfia 1235 (Perkin Elmer, Boston, EE. UU.)9. La concentración de TSH neonatal se valoró con respecto al estándar OMS 2nd IRP (80/558) de TSH humana para inmunoanálisis. La variabilidad intraanálisis e interanálisis (CV, %) fue inferior al 6,1 y al 9,5%, respectivamente. El laboratorio participa en los programas de control de calidad y cualificación del Control Disease Center (CDC/CCEHIP/NECH) con una calificación óptima (el 100% de satisfacción)10.
Análisis estadísticoSe ha estimado la prevalencia de hipertirotropinemia en las diferentes provincias y sus distritos sanitarios con un intervalo de confianza del 95%. Se valoraron las posibles diferencias con los estadísticos χ2 y el test de Poisson. Como factores de confusión se analizaron sexo, bajo peso al nacer, prematuridad, enfermedad tiroidea materna y momento de extracción de la muestra.
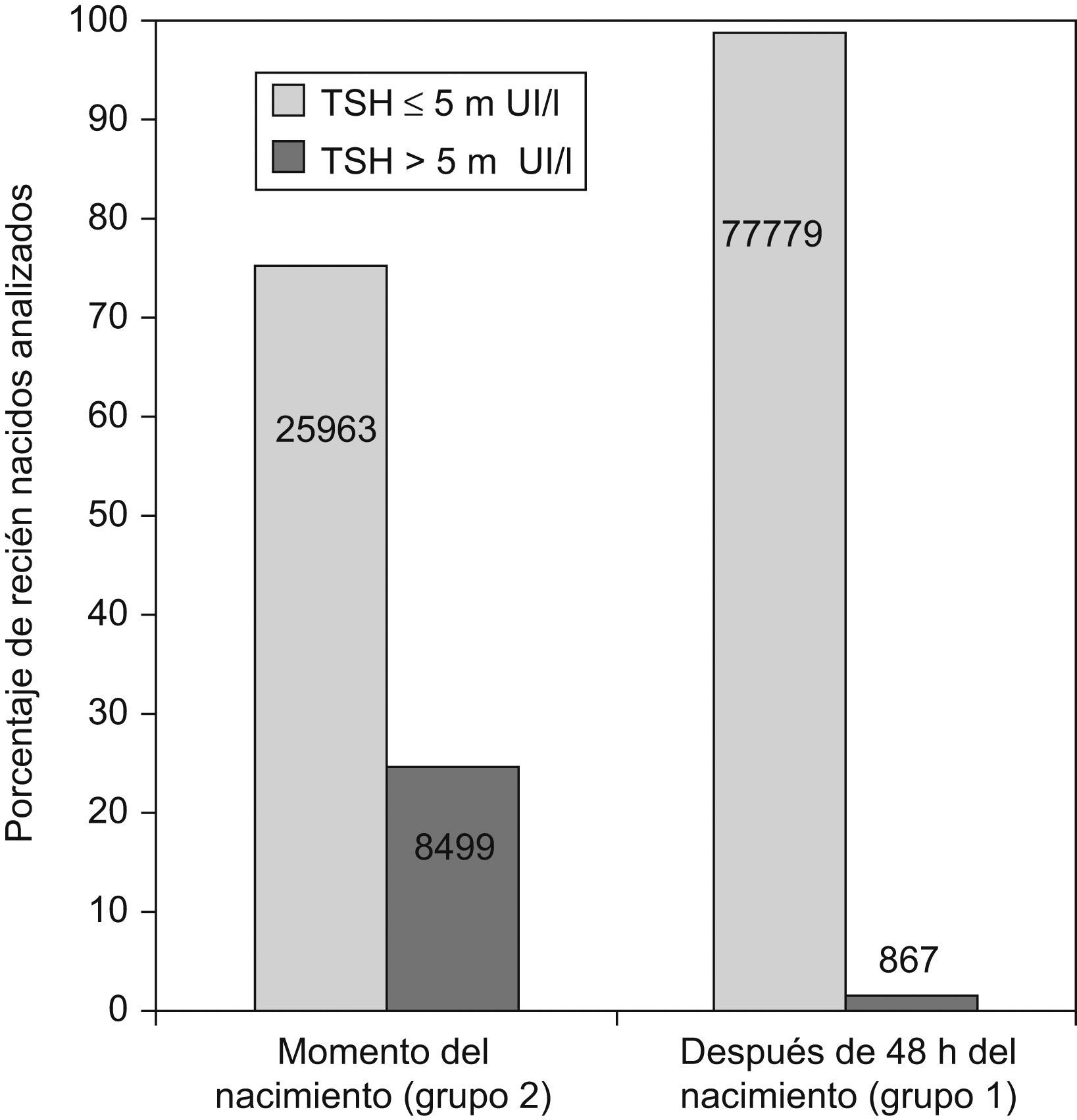
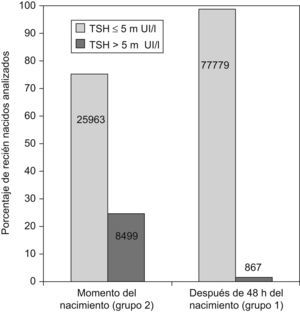
ResultadosEn la figura 1 se representan las concentraciones de TSH obtenidas antes y después de las 48h de vida. Se considera hipertirotropinemia cuando la concentración de TSH supera 5mUI/l. Como es de esperar, en el grupo de recién nacidos analizados al nacer, las concentraciones de TSH se incrementaron como consecuencia de la elevación fisiológica neonatal. Por esto, en estos casos, se decide utilizar concentraciones de TSH de 10 mUI/l y de 20mUI/l para definir hipertirotropinemia como posible indicador de deficiencia de yodo.
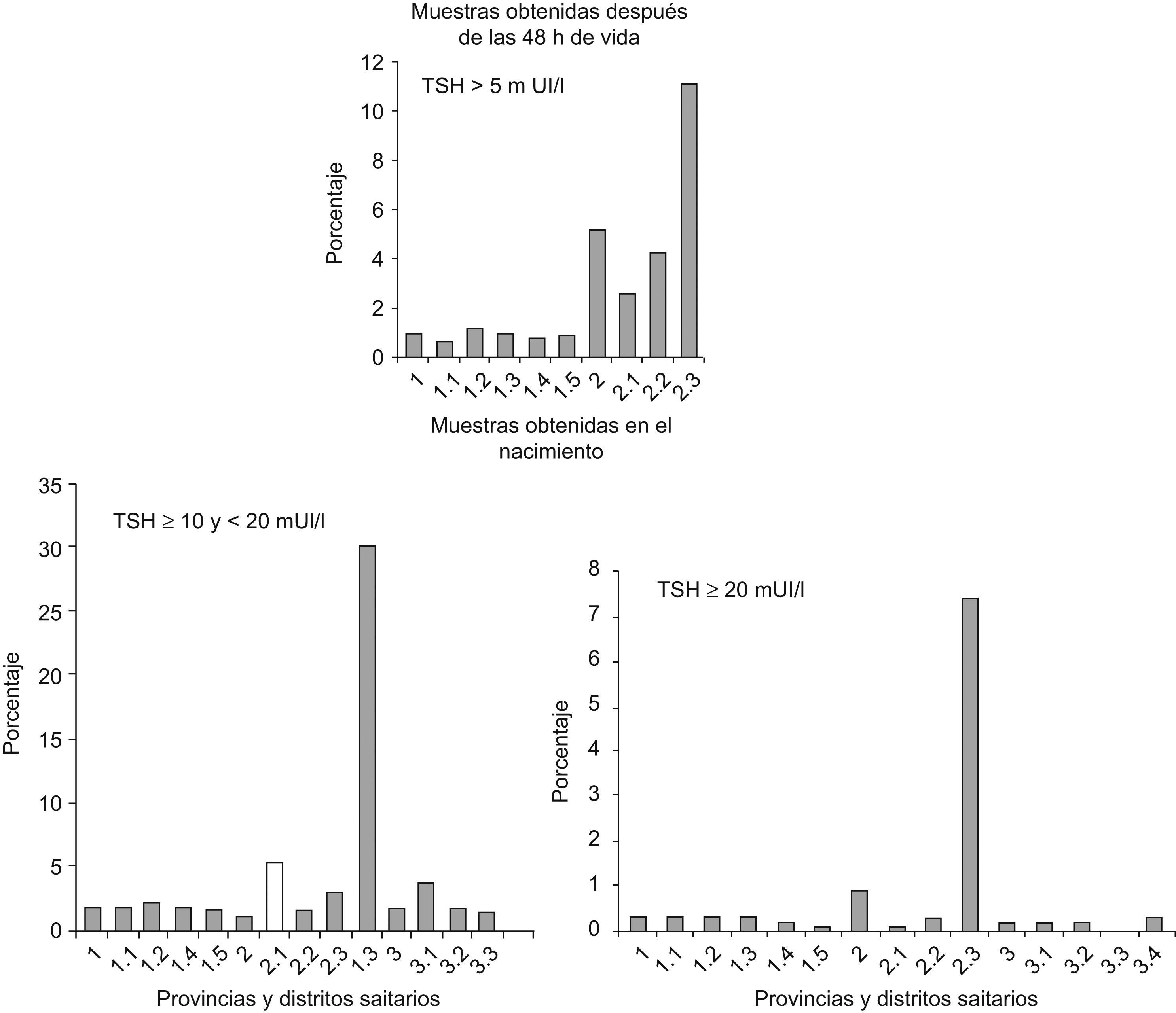
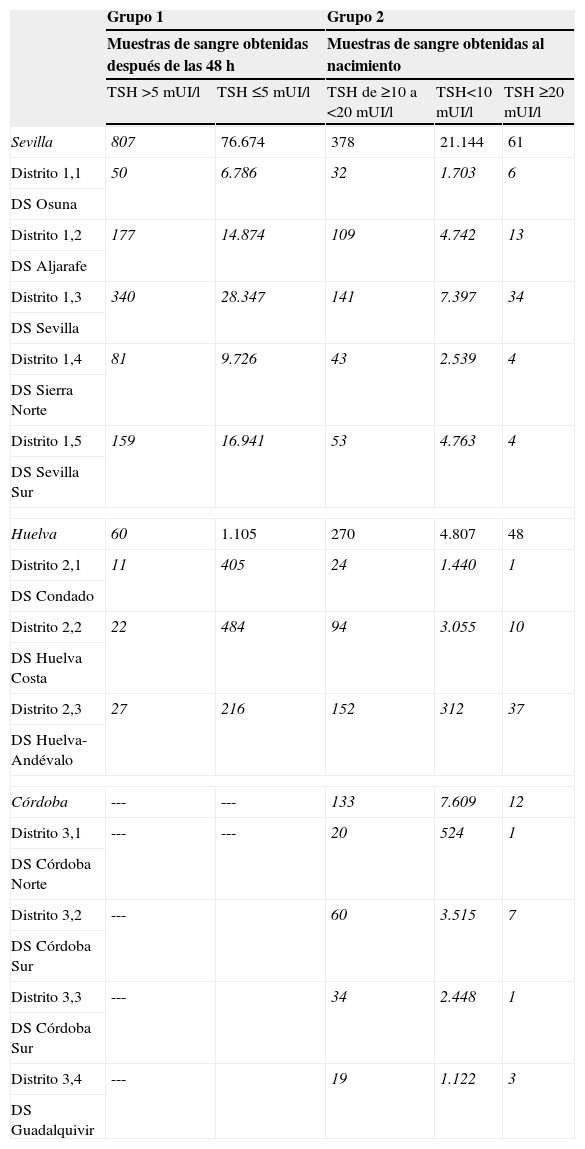
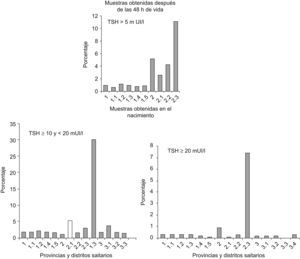
La tabla 1 muestra la distribución de la concentración de TSH en los recién nacidos en función de las diferentes provincias y distritos sanitarios con los 2 tipos de muestreo; mientras que la figura 2 representa porcentajes en lugar de valores absolutos para facilitar la comparación. Como puede observarse, la concentración de TSH se incrementó significativamente en los recién nacidos de Huelva, independientemente del momento de muestreo. En concreto, la mayor prevalencia de hipertirotropinemia se observa en el distrito de Sierra de Huelva-Andévalo (distrito 2,3), donde el 30,3 y el 11,1% de los recién nacidos tenía hipertirotropinemia en las muestras obtenidas al nacer y a partir de las 48h de vida, respectivamente. Los distritos correspondientes a Huelva-Condado (distrito 2,1) y Huelva-Costa (distrito 2,2) también poseían concentraciones más elevadas de TSH (el 2,6 y el 4,3%) como se observa en la figura 2.
Distribución de la concentración de tirotropina en recién nacidos clasificados en función del tiempo de obtención de la muestra, provincia y distrito sanitario
| Grupo 1 | Grupo 2 | ||||
| Muestras de sangre obtenidas después de las 48h | Muestras de sangre obtenidas al nacimiento | ||||
| TSH >5mUI/l | TSH ≤5mUI/l | TSH de ≥10 a <20mUI/l | TSH<10mUI/l | TSH ≥20mUI/l | |
| Sevilla | 807 | 76.674 | 378 | 21.144 | 61 |
| Distrito 1,1 | 50 | 6.786 | 32 | 1.703 | 6 |
| DS Osuna | |||||
| Distrito 1,2 | 177 | 14.874 | 109 | 4.742 | 13 |
| DS Aljarafe | |||||
| Distrito 1,3 | 340 | 28.347 | 141 | 7.397 | 34 |
| DS Sevilla | |||||
| Distrito 1,4 | 81 | 9.726 | 43 | 2.539 | 4 |
| DS Sierra Norte | |||||
| Distrito 1,5 | 159 | 16.941 | 53 | 4.763 | 4 |
| DS Sevilla Sur | |||||
| Huelva | 60 | 1.105 | 270 | 4.807 | 48 |
| Distrito 2,1 | 11 | 405 | 24 | 1.440 | 1 |
| DS Condado | |||||
| Distrito 2,2 | 22 | 484 | 94 | 3.055 | 10 |
| DS Huelva Costa | |||||
| Distrito 2,3 | 27 | 216 | 152 | 312 | 37 |
| DS Huelva-Andévalo | |||||
| Córdoba | --- | --- | 133 | 7.609 | 12 |
| Distrito 3,1 | --- | --- | 20 | 524 | 1 |
| DS Córdoba Norte | |||||
| Distrito 3,2 | --- | 60 | 3.515 | 7 | |
| DS Córdoba Sur | |||||
| Distrito 3,3 | --- | 34 | 2.448 | 1 | |
| DS Córdoba Sur | |||||
| Distrito 3,4 | --- | 19 | 1.122 | 3 | |
| DS Guadalquivir | |||||
En las muestras obtenidas antes de las primeras 24h existen diferencias estadísticamente significativas entre las diferentes provincias (χ2=308,8; p<0001) y DS (χ2=2.613,6; p<0001).
En las muestras obtenidas después de las 48h había diferencias significativas entre las 3 provincias (χ2=177,7; p<0001) y DS (χ2=303,9; p<0001).
DS: distrito sanitario; TSH: tirotropina.
En los recién nacidos de los distritos Huelva-Condado y Sierra de Huelva-Andévalo se observó que en el 9,7 y en el 18% de ellos las muestras de sangre se habían extraído en las primeras 24h de vida en lugar de obtenerlas del cordón umbilical al nacer (como se recomienda en Andalucía). En el resto de los distritos más del 98,3% de las muestras se habían obtenido del cordón umbilical (p<0,005). Este hecho podría contribuir, al menos en parte, al incremento significativo de los niveles de TSH en los recién nacidos del distrito Sierra de Huelva-Andévalo, si bien, esto no se manifestó en el distrito Huelva-Condado. Otros posibles factores de confusión se excluyeron. Así, no se observaron diferencias significativas respecto al sexo (χ2=2,1; p=no significativo [NS]), enfermedad tiroidea materna (χ2=6; p=NS), bajo peso (χ2=0,9; p=NS) ni prematuridad (χ2=1,1; p=NS). La frecuencia de enfermedad tiroidea materna osciló entre el 0,69% observado en la provincia de Córdoba y el 1,14% en la de Sevilla. La frecuencia de bajo peso (<2.500g) varió entre el 1,3% de Huelva y el 0,8% de Córdoba y Sevilla. Por último, el porcentaje de nacimientos pretérmino (menos de 37 semanas de gestación) varió entre el 4,8 y el 12,8% y el de nacimientos de menos de 32 semanas de gestación lo hizo entre el 0 y el 0,3%. Como el muestreo se realizó simultáneamente en todas las provincias y distritos incluidos en el estudio, se descartó una posible influencia estacional.
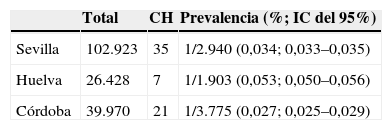
Por último, en la tabla 2 se muestra la prevalencia de CH en las 3 provincias estudiadas. Se observa que fue significativamente mayor en Huelva con respecto a Córdoba y Sevilla.
Prevalencia de hipotiroidismo congénito
| Total | CH | Prevalencia (%; IC del 95%) | |
| Sevilla | 102.923 | 35 | 1/2.940 (0,034; 0,033–0,035) |
| Huelva | 26.428 | 7 | 1/1.903 (0,053; 0,050–0,056) |
| Córdoba | 39.970 | 21 | 1/3.775 (0,027; 0,025–0,029) |
χ2=126; p<0,001.
CH: congenital hypothyroidism, hipotiroidismo congénito; IC: intervalo de confianza.
La OMS recomienda que las mujeres embarazadas o en período de lactancia ingieran al menos 200μg/día de yodo11. Se han realizado numerosos esfuerzos nacionales e internacionales para regularizar su ingesta, inicialmente a través de los programas de yodación de la sal, pero a pesar de esto, la deficiencia de yodo continúa siendo un problema mundial. En España, gracias a las campañas realizadas, la concentración media de yodo en orina se ha incrementado a más de 100μg/l3,4. Sin embargo, cuando se consideran otros marcadores de deficiencia de yodo, parece que la ingesta sigue siendo deficiente, bien por una ineficaz yodación de la sal, o por un consumo insuficiente o nulo. Recientemente en Estados Unidos se ha observado un incremento de la deficiencia de yodo en lactantes, lo que probablemente refleja una ingesta insuficiente de sal en esta población de riesgo12.
En este estudio se investiga la deficiencia de yodo en 3 provincias del sur de España y se miden las concentraciones de TSH neonatal. Los resultados obtenidos muestran una distribución heterogénea; en Córdoba y Sevilla menos del 3% de los recién nacidos poseen concentraciones de TSH superiores a 5mUI/l, lo que excluye la deficiencia de yodo. No obstante, en la provincia de Huelva, más concretamente en los distritos sanitarios de Huelva-Costa y Sierra de Huelva-Andévalo, más del 3% de los recién nacidos alcanzaron estas concentraciones. La frecuencia observada (el 4,3 y el 11%, respectivamente) las clasificaría como zonas con deficiencia leve de yodo6. Recientemente se ha descrito una heterogeneidad en la distribución de la hipertirotropinemia en otras áreas de Europa, especialmente en la región central de Italia13, tal y como ocurre en la provincia de Huelva incluida en nuestro estudio. El yodo está implicado en la biosíntesis de T4. Cuando existe deficiencia de yodo se produce un incremento en la síntesis de triyodotironina a expensas de T4. Esta autorregulación no existe en el feto. Por esto, las concentraciones bajas de T4 en sangre en el embarazo influyen negativamente en el desarrollo mental del niño. Esto hace que las embarazadas y las lactantes se conviertan en un objetivo prioritario de las campañas de suplementación de yodo, al igual que la población infantil. De hecho, se ha comprobado que los beneficios de la suplementación de yodo superan los posibles efectos adversos de un exceso crónico de éste14,15.
Por otra parte, se ha observado que en las zonas deficitarias de yodo se incrementan las concentraciones de TSH en las muestras de cribado extraídas a los recién nacidos a partir de las 48h de vida16,17. Este hecho se manifiesta igualmente al nacer, tal y como se observa en las muestras precoces de la provincia de Huelva.
En los prematuros la regulación del eje hipotalamohipofisotiroideo no está madura y por esto se recomienda monitorizar la función tiroidea en las primeras 4 semanas de vida18,19. En nuestro estudio, la prematuridad, el bajo peso al nacer, el sexo y la enfermedad tiroidea materna se controlaron como posibles factores de confusión que pudieran influir en las muestras extraídas precozmente a los recién nacidos.
Numerosas asociaciones, como la American Academy of Pediatrics, la American Thyroid Association y la National Academy of Clinical Biochemistry, recomiendan el cribado del CH en muestras obtenidas después de las 48h de vida, concretamente entre el segundo y el sexto día de vida19,20. No obstante, la corta estancia hospitalaria de los recién nacidos origina una recogida de muestras cada vez más temprana; pero es preferible este tipo de muestra que el riesgo de perder un posible diagnóstico de CH. Esto supone un incremento de resultados falsos positivos que podría disminuirse al ajustar el punto de corte de TSH en función de la edad. De cualquier modo, la National Academy of Clinical Biochemistry recomienda analizar una segunda muestra extraída después de las 2 semanas del nacimiento cuando la primera se obtuvo en las primeras 12 h de vida19.
Los métodos de análisis de TSH por inmunofluorometría son más sensibles y han permitido observar que los niveles de TSH en el cordón umbilical sean más bajos que los inicialmente descritos21,22. Así, el actual rango de normalidad para el ensayo utilizado en nuestro estudio con muestras del cordón umbilical es de 1,0–8,4mUI/l para sangre total y de 2,0–16,8mUI/l para suero23. Se define hipertirotropinemia cuando las concentraciones de TSH son superiores a 10 mUI/l y a 20mUI/l de sangre total. Ambos puntos de corte parecen indicar deficiencia de yodo, pero se considera que 10mUI/l puede ser mejor, ya que concentraciones superiores son infrecuentes en recién nacidos normales, como podemos ver en la figura 2.
Al nacer, una concentración de 20mUI/l de TSH indica un riesgo elevado de CH. El 0,3 y el 0,2% de los recién nacidos de las provincias de Sevilla y Córdoba tuvieron riesgo elevado y se diagnosticó un recién nacido hipotiroideo por cada 2.940 (0,034%) y 3.370 (0,027%) recién nacidos escrutados, respectivamente. Por cada caso detectado, 10 recién nacidos tuvieron que ser llamados para realizar un segundo análisis. Estos resultados son similares a los reportados por Hardy et al24, los que reanalizaron 13 recién nacidos por cada caso detectado al usar un punto de corte de 13mUI/l. En las muestras obtenidas después de las 48h de vida (grupo 1), entre el 0,05 y el 0,3% de los niños cribados tuvo un riesgo elevado y se los llamó para un nuevo análisis. En la provincia de Huelva, el 0,9% de las muestras presentó concentraciones de TSH superiores a 20mUI/l, y sólo el 0,05% se diagnosticó de CH; este dato indica que 17 niños tuvieron que reanalizarse por cada caso detectado. La hipertirotropinemia tan acentuada que se observa en el distrito Sierra de Huelva-Andévalo puede verse influida por el momento de la toma de la muestra, ya que hay un mayor porcentaje de recién nacidos a los que se extrae la muestra en las primeras horas de vida en lugar de al nacer, respecto a las otras zonas geográficas estudiadas.
En conclusión, la concentración de TSH neonatal en los recién nacidos del suroeste de España varía en función de la localización geográfica e indica una deficiencia de yodo en la provincia de Huelva y sus distritos sanitarios. En las muestras extraídas de sangre del cordón también se evidencia la hipertirotropinemia ocasionada por el déficit de yodo. Además, en este estudio ha influido un segundo factor, el momento de la toma de la muestra (en las primeras 24h de vida), en uno de los distritos estudiados. Ambos factores ocasionan un incremento de hipertirotropinemias transitorias en un programa de cribado de CH, lo que incrementa el número de recién nacidos localizados y reanalizados por cada hipotiroideo detectado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.