El daño renal es frecuente en niños con trasplante hepático (TH), aunque su detección es un desafío. Nuestro objetivo fue evaluar el daño renal agudo (DRA) perioperatorio y analizar la prevalencia de enfermedad renal crónica (ERC) mediante diferentes fórmulas de estimación de la tasa de filtración glomerular (TFG).
MétodosAnálisis transversal unicéntrico de una cohorte de niños menores de 18años con TH. Estimamos la TFG utilizando la fórmula Schwartz bedside 2009 basada en la creatinina, Caucasian Asian Pediatric and Adult cohort (CAPA) para cistatinaC y la fórmula combinada de Pottel Full Age Spectrum (FAS). Analizamos la concordancia mediante prueba de Bland Altman y el índice kappa. Medimos la albuminuria, la presión arterial y el volumen urinario por 100ml de filtrado glomerular. Analizamos los factores de riesgo asociados a ERC mediante un análisis univariante y multivariante.
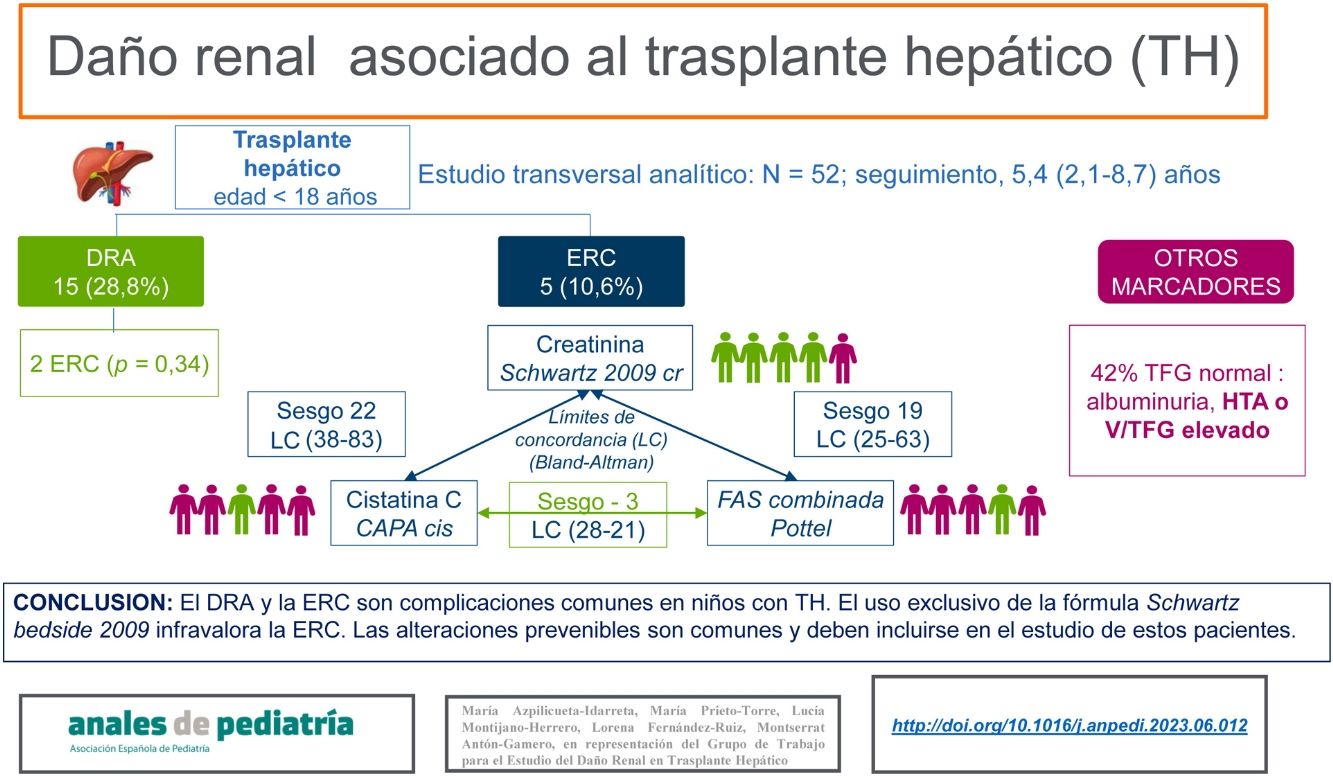
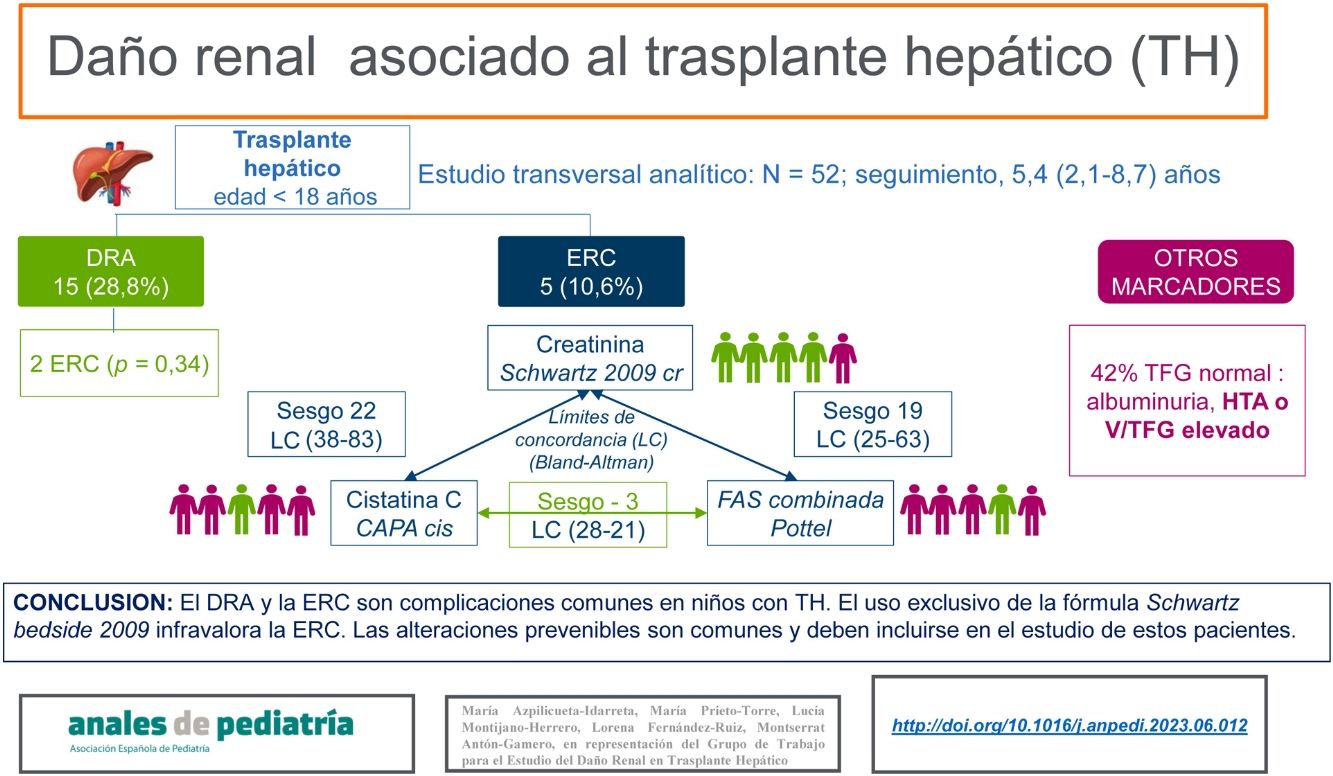
ResultadosSe incluyeron 52 pacientes, con una mediana de edad de 9,21años y 5,42años de evolución. Quince (28,8%) tuvieron DRA. Cinco niños (10%) presentaban ERC. El único factor de riesgo asociado fue el fallo hepático agudo en el momento del TH (OR: 8,57, p=0,04). Hubo poca concordancia entre las diferentes fórmulas de estimación. La fórmula de Schwartz clasificó a un paciente con ERC, mientras que Pottel FAS combinada y CAPA clasificaron a cuatro. Hasta el 42% de los niños sin ERC tenían algún marcador de daño renal.
ConclusionesEl uso exclusivo de la fórmula Schwartz bedside 2009 para estimar el FG puede limitar el diagnóstico de ERC en niños con TH. La presencia de otros marcadores de daño renal es frecuente y su detección puede prevenir la progresión de la ERC.
Kidney injury associated with paediatric liver transplantation (LT) is common, but its evaluation is challenging. Our aim was to analyse the presence of perioperative acute kidney injury (AKI) and study the prevalence of chronic kidney disease (CKD) using different glomerular filtration rate (GFR) estimation formulas.
MethodsWe conducted a cross-sectional study in a cohort of children aged less than 18years with a history of LT followed up for 5.42years. We estimated the GFR using the creatinine-based Schwartz bedside formula (2009), the cystatin C-based Caucasian Asian Pediatric and Adult cohort (CAPA) equation and the combined full-age spectrum (FAS) formula as modified by Pottel. We analysed the agreement between them using the Bland-Altman method and the kappa statistic. We measured the albumin level in urine, the urine volume adjusted to 100mL of GFR and blood pressure. We performed univariate and multivariate analyses of the risk factors associated with CKD.
ResultsThe sample included 52 patients with a median age of 9.21years. Fifteen (28.8%) had AKI. Five (10%) had CKD and the only associated risk factor was acute liver failure at the time of LT (odds ratio, 8.57; P=.04). There was poor agreement between the different estimation formulas. One patient was classified as having CKD with the Schwartz formula compared to four patients with the CAPA and the Pottel combined FAS formulas. Up to 42% of children without CKD had some positive marker of kidney injury.
ConclusionsThe exclusive use of the 2009 Schwartz bedside formula to estimate GFR may lead to underdiagnosis of CKD in children post LT. Other markers of kidney injury are common, and their detection may help prevent the progression of CKD.
El trasplante hepático (TH) es el tratamiento de elección para niños con enfermedad hepática avanzada grave1. Las mejoras en la técnica quirúrgica, en los cuidados postoperatorios y en el tratamiento inmunosupresor han conseguido aumentar la supervivencia de los niños con TH hasta el 95% al año del trasplante y del 85 al 90% a los 5años2. No obstante, pueden desarrollarse complicaciones a largo plazo como la enfermedad renal crónica (ERC), que se asocia a un aumento de la morbimortalidad3, a un descenso en la supervivencia del injerto hepático y a un incremento en los costes sanitarios3,4.
Las causas más comunes del daño renal en pacientes con TH son la presencia de enfermedad renal de base, el daño renal agudo (DRA) perioperatorio y la nefrotoxicidad a largo plazo de los inhibidores de la calcineurina3,5. Su prevalencia varía según las características de las series estudiadas, el tiempo de evolución de la enfermedad o la duración del seguimiento y las diferencias en los criterios empleados para definir el daño renal y los métodos aplicados para estimar la tasa de filtración glomerular (TFG). Así, en niños con TH la incidencia de DRA en el postoperatorio inmediato oscila entre el 17 y el 57%6,7, y la prevalencia de ERC a los 5años postrasplante es del 17,6%8. En adultos, la afectación renal, tanto antes como después del TH, es aún más frecuente y está presente en más de la mitad de los trasplantados a los 10años de seguimiento, lo que podría estar relacionado con la mayor frecuencia de comorbilidades4.
La evaluación de la función renal en estos pacientes es compleja y tiene ciertas limitaciones. El patrón oro para el estudio de la función glomerular es la medida del filtrado glomerular mediante marcadores exógenos, lo que requiere procedimientos invasivos que se reservan para la investigación9. En la práctica clínica se utilizan fórmulas matemáticas para estimar la TFG basadas en el nivel sérico de creatinina o de cistatinaC3. Pocos estudios han analizado la aplicación de estas fórmulas en el contexto de TH10,11. Las fórmulas de estimación basadas en la creatinina, como la fórmula de Schwartz para el cálculo a pie de cama (bedside) de 2009, sobreestiman la TFG en pacientes con enfermedad hepática4,12. Las fórmulas basadas en la cistatinaC parecen ofrecer una concordancia superior con las cifras obtenidas mediante la medición de marcadores exógenos10,13.
También son escasos los datos sobre los marcadores tempranos de daño renal en estos pacientes, como el manejo renal del agua, la albuminuria y la hipertensión arterial (HTA)14,15.
A pesar de estas limitaciones, la evaluación del daño renal en niños con TH puede ayudar a identificar a pacientes con riesgo aumentado y detectar factores de riesgo tratables para modificar el manejo y prevenir o aminorar la progresión de la nefropatía.
El objetivo del estudio fue analizar la prevalencia y las características del DRA perioperatorio, la ERC y otros parámetros relacionados con el daño renal en una cohorte de niños con TH. También se analizó la concordancia entre distintas fórmulas para estimar la TFG.
MétodosSe llevó a cabo un análisis transversal en una cohorte de niños menores de 18años que habían recibido un TH con seguimiento en la consulta de un hospital terciario entre enero de 2019 y febrero de 2020. Se excluyó a los pacientes con disfunción hepática, a los sometidos a trasplante múltiple de órganos o a retrasplante hepático, o con un seguimiento postrasplante inferior a 6meses.
Calculamos la prevalencia de DRA perioperatoria de acuerdo con los criterios KDIGO 2012 mediante la revisión retrospectiva de las historias clínicas16, clasificando los casos exclusivamente en base al nivel de creatinina.
Durante la visita se tomaron medidas antropométricas mediante métodos estandarizados, calculándose el índice de masa corporal (IMC) y clasificando a los pacientes según su estado ponderal para la edad y el sexo17,18. Se recogieron muestras de sangre venosa para la medición del nivel sérico de creatinina con el método colorimétrico con trazabilidad a IDMS y del nivel sérico de cistatinaC por el método turbidimétrico, así como una muestra de orina de la primera micción de la mañana para medir los niveles de creatinina y de albúmina. También se recogieron los hallazgos de la ecografía más reciente.
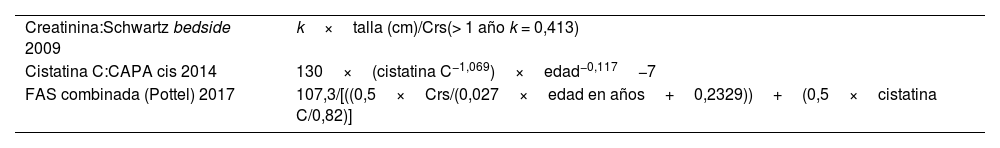
La TFG se estimó aplicando las fórmulas de Schwartz «a pie de cama» de 2009, basada en la creatinina (Schwartz 2009cr), Caucasian Asian Pediatric and Adult cohorts basada en la cistatina C (CAPAcis) y Full-Age Spectrum modificada por Pottel, que combina la creatinina y la cistatina (Pottel FAScr-cis)10,13 (tabla 1). Se definieron dos grupos según la presencia o ausencia de ERC en base al resultado de cualquiera de las fórmulas y aplicando los criterios diagnósticos KDIGO19.
Fórmulas para la estimación de la tasa de filtración glomerular (ml/min/1,73 m2)
| Creatinina:Schwartz bedside 2009 | k×talla (cm)/Crs(> 1 año k = 0,413) |
| Cistatina C:CAPA cis 2014 | 130×(cistatina C−1,069)×edad−0,117−7 |
| FAS combinada (Pottel) 2017 | 107,3/[((0,5×Crs/(0,027×edad en años+0,2329))+(0,5×cistatina C/0,82)] |
CAPA: Caucasian Asian Pediatric Adult Cohort; cis: cistatina; Crs: creatinina sérica; FAS: Full-Age Spectrum.
El volumen urinario correspondiente a 100ml de TFG (V/TFG) se calculó mediante la siguiente fórmula: creatinina sérica ×100 /creatinina urinaria, y se consideró que el manejo tubular de agua se encontraba alterado si el valor era superior a 1,03ml/100ml de filtrado glomerular. También se calculó la osmolalidad urinaria, considerando los valores inferiores a 800mOsm/l como alterados20,21. Se analizó la relación albúmina/creatinina expresada en mg/g19 y se tomó la presión arterial casual mediante el método oscilométrico para evaluar la presencia de HTA22.
Se registraron variables relacionadas con el paciente, como la edad, el sexo, la raza, la enfermedad hepática (con énfasis en patologías con posible afectación renal) y la puntuación de enfermedad hepática terminal pretrasplante (puntuación pediátrica PELD en menores de 12años y puntuación MELD a partir de los 12años) en el momento de la inclusión en el programa de TH. Las variables perioperatorias recogidas fueron el tipo de donante, el rechazo agudo del injerto, las complicaciones cardiopulmonares y del injerto, la sepsis, los días de ingreso en la unidad de cuidados intensivos pediátricos (UCIP) y el DRA.
Los pacientes recibieron tratamiento inmunosupresor de acuerdo con el protocolo vigente en el momento del trasplante. La toxicidad por tacrolimus se definió como un nivel valle superior a 15ng/ml durante el periodo postrasplante1.
Las variables cualitativas se presentan como frecuencias absolutas y relativas, y las cuantitativas, como media y desviación estándar o mediana y rango intercuartílico, dependiendo de su distribución. Se utilizó la prueba de Shapiro-Wilk para evaluar la normalidad de la distribución, y la prueba de Levene para evaluar la homogeneidad de varianzas. Las proporciones se compararon mediante la prueba χ2. Las variables continuas se compararon en pacientes con y sin DRA y ERC mediante la prueba t de Student para muestras independientes y la prueba U de Mann-Whitney, según correspondiera en base a la distribución de los datos.
Los factores de riesgo para la ERC se analizaron mediante un modelo de regresión logística, calculando odds ratios (OR) e intervalos de confianza del 95% (IC95%). Las variables que mostraron asociaciones con un valor de p inferior a 0,25 se incluyeron en el análisis de regresión logística múltiple. Mediante el método de selección de pasos hacia atrás se eliminaron una a una las variables con valores de p de 0,15 o superiores para el estadístico Wald del modelo hasta obtener la estimación del OR ajustado. La raza no se incluyó en el análisis multivariante porque se detectó una interacción estadística.
Los resultados obtenidos con las tres fórmulas de estimación de la TFG se cotejaron mediante análisis de varianza (ANOVA) con la corrección de Sidak para comparaciones post hoc. La correlación entre los valores de la TFG obtenidos con las distintas fórmulas se evaluó mediante el coeficiente rho de Spearman (ρ) y su concordancia mediante el método de Bland-Altman. Se empleó el coeficiente kappa (κ) para evaluar la concordancia entre los porcentajes de pacientes clasificados como casos de ERC aplicando las distintas fórmulas de estimación de la TFG.
Todas las pruebas se realizaron a dos colas, y los valores de p inferiores a 0,05 se consideraron estadísticamente significativos. Los análisis se realizaron con el paquete SPSS versión 24.0.
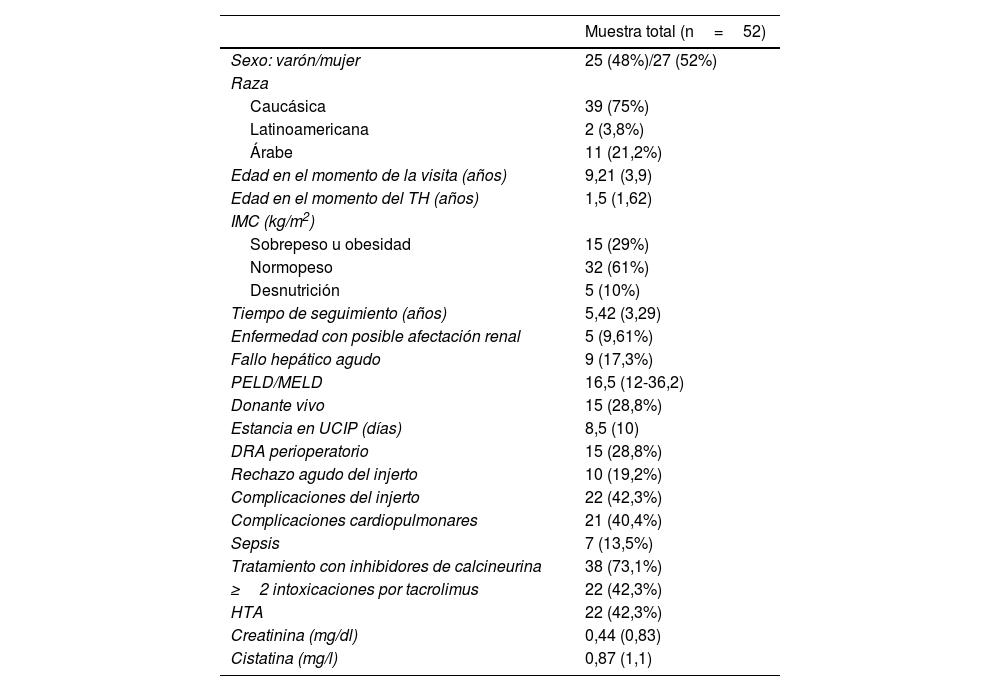
ResultadosSe evaluó a un total de 61 niños con TH. Ocho fueron excluidos porque habían recibido más de un injerto y uno por seguimiento inferior a 6meses. La muestra final incluyó 52 pacientes (25 varones) con una mediana de edad de 9,21años y de seguimiento postrasplante de 5,42años. Sus principales características demográficas y clínicas se muestran en la tabla 2. El motivo más frecuente de TH fueron las anomalías congénitas de la vía biliar (59,6%), especialmente la atresia biliar (46,15%). Otras causas fueron el fallo hepático agudo (17,3%), las enfermedades metabólicas (11,53%), la cirrosis hepatocelular (9,61%) y los tumores hepáticos (1,92%). En 5 pacientes se identificaron enfermedades con posible afectación renal, 3 con síndrome de Alagille y 2 con enfermedad de Caroli, aunque ninguno de ellos tenía ERC antes del TH. En nuestra serie, la enfermedad metabólica no se asoció a la enfermedad renal (tabla 3). La ecografía solo detectó hipoplasia renal derecha en un paciente.
Parámetros demográficos, antropométricos y clínicos
| Muestra total (n=52) | |
|---|---|
| Sexo: varón/mujer | 25 (48%)/27 (52%) |
| Raza | |
| Caucásica | 39 (75%) |
| Latinoamericana | 2 (3,8%) |
| Árabe | 11 (21,2%) |
| Edad en el momento de la visita (años) | 9,21 (3,9) |
| Edad en el momento del TH (años) | 1,5 (1,62) |
| IMC (kg/m2) | |
| Sobrepeso u obesidad | 15 (29%) |
| Normopeso | 32 (61%) |
| Desnutrición | 5 (10%) |
| Tiempo de seguimiento (años) | 5,42 (3,29) |
| Enfermedad con posible afectación renal | 5 (9,61%) |
| Fallo hepático agudo | 9 (17,3%) |
| PELD/MELD | 16,5 (12-36,2) |
| Donante vivo | 15 (28,8%) |
| Estancia en UCIP (días) | 8,5 (10) |
| DRA perioperatorio | 15 (28,8%) |
| Rechazo agudo del injerto | 10 (19,2%) |
| Complicaciones del injerto | 22 (42,3%) |
| Complicaciones cardiopulmonares | 21 (40,4%) |
| Sepsis | 7 (13,5%) |
| Tratamiento con inhibidores de calcineurina | 38 (73,1%) |
| ≥2 intoxicaciones por tacrolimus | 22 (42,3%) |
| HTA | 22 (42,3%) |
| Creatinina (mg/dl) | 0,44 (0,83) |
| Cistatina (mg/l) | 0,87 (1,1) |
DRA: daño renal agudo; HTA: hipertensión arterial; IMC: índice de masa corporal; MELD: puntuación Model For End-Stage Liver Disease; PELD: puntuación Pediatric End-Stage Liver Disease; TH: trasplante hepático; UCIP: unidad de cuidados intensivos pediátricos.
Las variables cuantitativas se expresan como mediana (rango intercuartílico), y las cualitativas, como n (%).
Enfermedades que motivaron el trasplante hepático
| Anomalías de la vía biliar (59,6%) | Atresia de vías biliares (46,15%)Síndrome de Alagillea (5,76%)Enfermedad de Carolia (3,84%)Idiopática (3,84%) |
| Fallo hepático agudo (17,3%) | Idiopática (9,62%)Hepatitis A (7,69%) |
| Enfermedad metabólica (11,53%) | Deficiencia de ornitina transcarbamilasa (5,76%)Citrulinemia (3,84%)Glucogenosis tipo III (1,92%) |
| Cirrosis hepatocelular (9,61%) | Idiopática (7,69%)Autoinmune (1,92%) |
| Tumor (1,92%) | Hepatoblastoma (1,92%) |
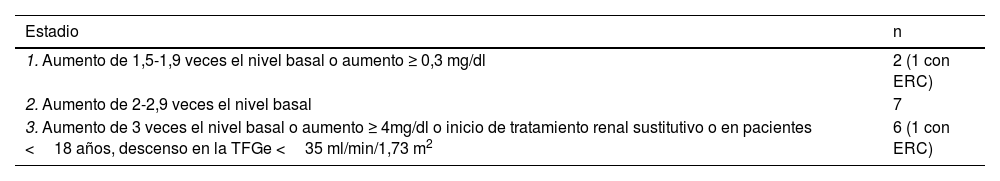
Quince niños (28,8%) sufrieron DRA perioperatorio. De ellos, solo dos progresaron a ERC (tabla 4). Ambos habían tenido fallo hepático agudo.
Clasificación del daño renal agudo de acuerdo con los criterios de la creatinina sérica de las guías KDIGO 2012
| Estadio | n |
|---|---|
| 1. Aumento de 1,5-1,9 veces el nivel basal o aumento ≥ 0,3 mg/dl | 2 (1 con ERC) |
| 2. Aumento de 2-2,9 veces el nivel basal | 7 |
| 3. Aumento de 3 veces el nivel basal o aumento ≥ 4mg/dl o inicio de tratamiento renal sustitutivo o en pacientes <18 años, descenso en la TFGe <35 ml/min/1,73 m2 | 6 (1 con ERC) |
ERC: enfermedad renal crónica; TFGe: tasa de filtración glomerular estimada.
A corto plazo no hubo diferencias significativas, salvo una incidencia mayor de sepsis (33,3% vs. 5,6%; p=0,01). La prevalencia de albuminuria y la de HTA a largo plazo no difirieron de manera significativa en los pacientes con DRA perioperatorio. El V/TFG fue significativamente mayor en los pacientes que requirieron técnicas de reemplazo renal continuo (TRRC) (1,44 [0,95] vs. 0,78 [0,44]; p=0,02).
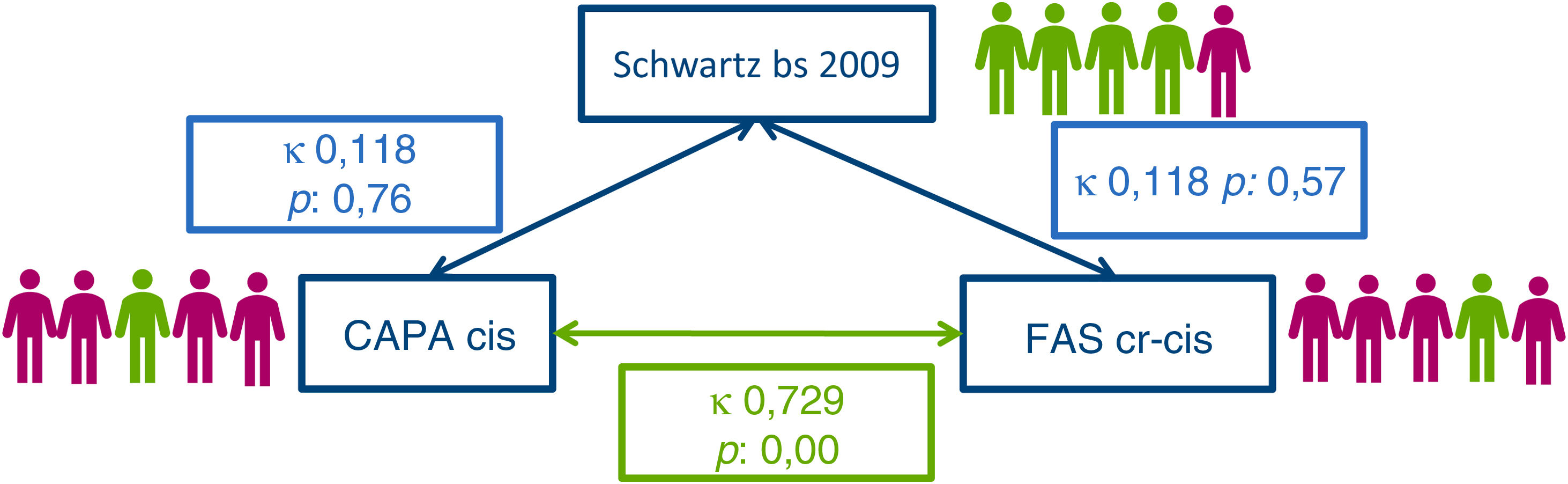
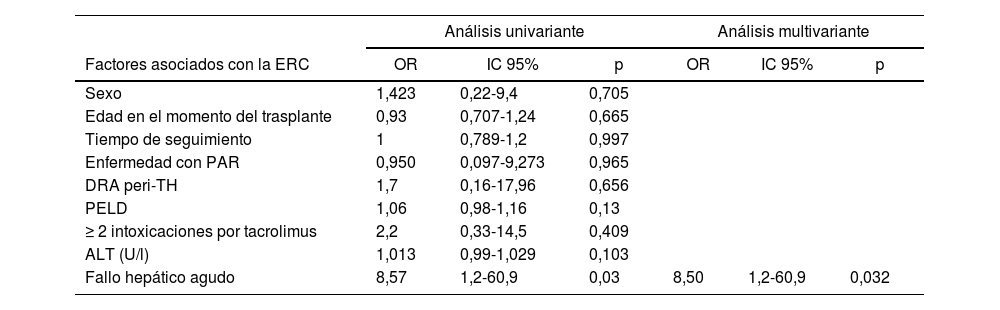
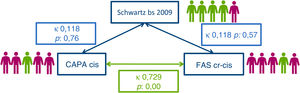
Enfermedad renal crónicaCinco pacientes (10,6%) presentaron ERC de acuerdo con la clasificación basada en la TFG con la estimación obtenida por al menos una de las fórmulas, y ninguno de ellos requirió tratamiento renal sustitutivo. En este grupo, el motivo del TH fue atresia biliar en dos pacientes y fallo hepático agudo en los tres restantes. Con la fórmula Schwartz 2009cr solo se clasificó a un paciente con ERC (en estadio2). Con las fórmulas CAPAcis y Pottel FAScr-cis se clasificó a cuatro (dos en estadio2 y dos en estadio3), aunque hubo desacuerdo en el diagnóstico de dos pacientes (fig. 1). No encontramos diferencias significativas en las características demográficas o clínicas entre los pacientes con ERC y los que tenían una TFG normal, exceptuando la proporción de pacientes de origen árabe (60% vs. 20%; p=0,01) y de fallo hepático agudo (60% vs. 12,76%; p=0,03). En los análisis univariante y multivariante, el único factor de riesgo asociado a la presencia de ERC fue el antecedente de fallo hepático agudo (tabla 5).
Análisis de regresión logística univariante y multivariante de la asociación entre distintos factores de riesgo y la ERC
| Análisis univariante | Análisis multivariante | |||||
|---|---|---|---|---|---|---|
| Factores asociados con la ERC | OR | IC 95% | p | OR | IC 95% | p |
| Sexo | 1,423 | 0,22-9,4 | 0,705 | |||
| Edad en el momento del trasplante | 0,93 | 0,707-1,24 | 0,665 | |||
| Tiempo de seguimiento | 1 | 0,789-1,2 | 0,997 | |||
| Enfermedad con PAR | 0,950 | 0,097-9,273 | 0,965 | |||
| DRA peri-TH | 1,7 | 0,16-17,96 | 0,656 | |||
| PELD | 1,06 | 0,98-1,16 | 0,13 | |||
| ≥ 2 intoxicaciones por tacrolimus | 2,2 | 0,33-14,5 | 0,409 | |||
| ALT (U/l) | 1,013 | 0,99-1,029 | 0,103 | |||
| Fallo hepático agudo | 8,57 | 1,2-60,9 | 0,03 | 8,50 | 1,2-60,9 | 0,032 |
ALT: alanina aminotransferasa; DRA: daño renal agudo; ERC: enfermedad renal crónica; IC: intervalo de confianza; OR: odds ratio; PAR: posible afectación renal; PELD: puntuación Pediatric End-Stage Liver Disease score; TH: trasplante hepático.
El 60% de los pacientes con ERC y el 42% de los pacientes con cifras de filtrado glomerular normales tenían algún marcador de daño renal. La prevalencia de HTA fue del 27% vs. el 29% y la de albuminuria del 17% vs. el 10% en pacientes con ERC en comparación con los pacientes con valores normales de la TFG. Un solo paciente recibió enalapril para tratar la HTA. La relación V/TFG fue elevada, con una osmolalidad urinaria alterada, en el 28% de los pacientes con ERC, en comparación con el 18% de los pacientes con valores normales de la TFG.
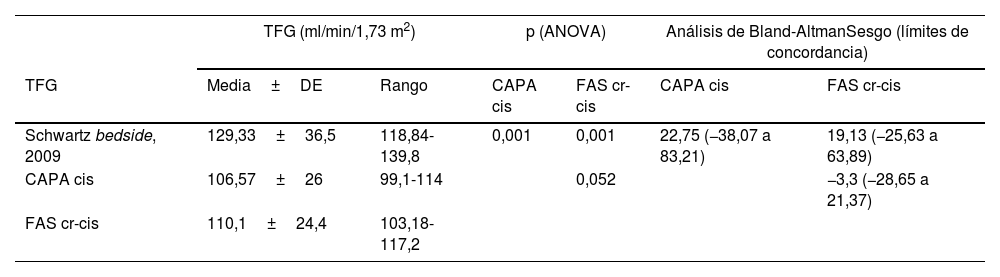
Concordancia entre las estimaciones de la TFGLa TFG estimada con la fórmula Schwartz 2009cr mostró una correlación positiva con la TFG estimada con la fórmula basada exclusivamente en la cistatinaC (CAPAcis) (ρ: 0,553; p<0,001) y la que combinaba la cistatinaC y la creatinina (Pottel FAScr-cis) (ρ: 0,789; p<0,001). No obstante, los valores medios de las dos últimas fueron significativamente mayores (p<0,001) (tabla 5).
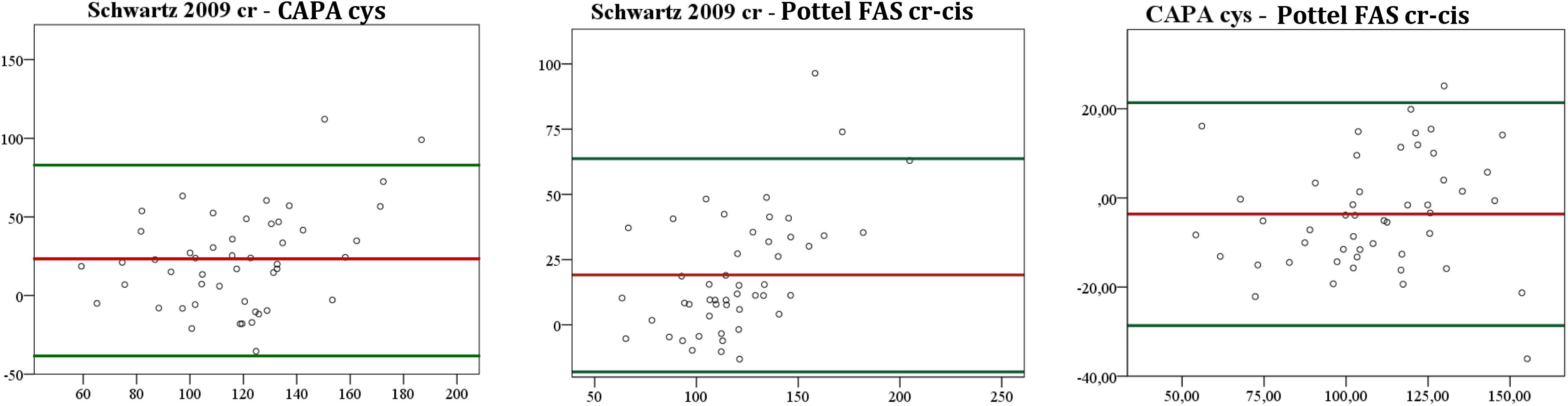
La concordancia entre las tres fórmulas, evaluada mediante el método de Bland-Altman, fue inaceptable. El sesgo y los límites de concordancia del 95% fueron muy amplios en todos los casos, salvo en la comparación de las fórmulas CAPAcis y Pottel FAScr-cis, en la que el sesgo fue de −3,32 (tabla 6 y fig. 2).
Concordancia entre las fórmulas de estimación de la TFG. Análisis de Bland-Altman
| TFG (ml/min/1,73 m2) | p (ANOVA) | Análisis de Bland-AltmanSesgo (límites de concordancia) | ||||
|---|---|---|---|---|---|---|
| TFG | Media±DE | Rango | CAPA cis | FAS cr-cis | CAPA cis | FAS cr-cis |
| Schwartz bedside, 2009 | 129,33±36,5 | 118,84-139,8 | 0,001 | 0,001 | 22,75 (−38,07 a 83,21) | 19,13 (−25,63 a 63,89) |
| CAPA cis | 106,57±26 | 99,1-114 | 0,052 | −3,3 (−28,65 a 21,37) | ||
| FAS cr-cis | 110,1±24,4 | 103,18-117,2 | ||||
CAPA: Caucasian Asian Pediatric Adult Cohort; cis: cistatina; cr: creatinina; DE: desviación estándar; FAS: Full-Age Spectrum; TFG: tasa de filtración glomerular.
Gráficos Bland-Altman comparando las distintas fórmulas de estimación de la tasa de filtración glomerular.
CAPA: fórmula Caucasian Asian Pediatric Adult cohorts; cis: cistatina; cr: creatinina; FAS: Full-Age Spectrum; κ: índice kappa; Pottel FAScr-cis: fórmula Full-Age Spectrum combinada modificada por Pottel; Schwartz 2009cr: fórmula Schwartz bedside 2009.
La línea roja representa el sesgo y las líneas verdes los límites de concordancia. Los valores correspondientes se presentan en la tabla 6.
Con la aplicación de la fórmula Schwartz 2009cr solo se clasificó a un paciente como afecto de ERC, mientras que las fórmulas CAPAcis y Pottel FAScr-cis clasificaron a 4 de los 5 pacientes con ERC, con una concordancia baja entre sus resultados (fig. 1).
DiscusiónEl daño renal es común en niños con TH y puede estar infraestimado debido a su evolución lenta y silente8. Presentamos el primer estudio en España en evaluar el daño renal en una serie de 52niños provenientes de un solo centro de referencia para el TH. Sus características demográficas y etiológicas fueron similares a las descritas con anterioridad1, con excepción de una proporción mayor de raza árabe asociada al fallo hepático agudo en nuestra serie. Nuestra unidad es un centro de referencia de TH pediátrico para niños de países norafricanos en caso de diagnóstico de fallo hepático agudo, lo que podría haber supuesto un sesgo en el estudio. Prácticamente el 10% de los pacientes tenían enfermedades que cursan con posible afectación renal, como el síndrome de Alagille y la enfermedad de Caroli. Ninguno desarrolló ERC antes o después del trasplante.
Quince niños (28,8%) presentaron DRA perioperatorio, un porcentaje ligeramente menor al reportado previamente, de hasta el 57%6,7,23, posiblemente debido a la heterogeneidad de los criterios aplicados para el diagnóstico del DRA23.
Aunque el DRA se reconoce como un factor de riesgo para la progresión a ERC23, en nuestra serie solo dos de los niños con DRA progresaron a ERC. A largo plazo, no se observó una frecuencia superior de albuminuria o HTA —marcadores clásicos de daño renal— en pacientes con DRA. La frecuencia de la relación V/TFG y la osmolalidad urinaria alteradas fue mayor en aquellos que requirieron TRRC, aunque sería necesario realizar una prueba de restricción hídrica para confirmar la alteración del manejo renal de agua21. La capacidad de concentración urinaria del riñón es compleja y requiere una función tubular normal. La pérdida de la capacidad de concentración urinaria es un marcador precoz y simple para la detección de daño renal20 que no ha sido descrito previamente en niños con TH.
La prevalencia de ERC en contexto de TH llega hasta el 50% en adultos y está determinada principalmente por las comorbilidades asociadas y la nefrotoxicidad producida por los inhibidores de calcineurina3. En niños es más baja, de alrededor del 17% a los 5años, aunque varía considerablemente entre las series publicadas8. A pesar de la recomendación del uso de criterios internacionales en base a las guías KDIGO para la definición de la ERC19, se han aplicado criterios distintos en los diversos estudios realizados, contribuyendo a esta variabilidad. De este modo, Yasui et al.24 definieron la ERC como una TFG inferior a 90ml/min/1,73m2, sin tener en cuenta otros factores asociados, como la albuminuria o el daño estructural, y encontraron una prevalencia de ERC que oscilaba entre el 3,8 y el 15,3% en 26 niños receptores de TH de donante vivo dependiendo de la fórmula utilizada. Basiratnia et al.25 aplicaron los criterios KDIGO y reportaron una prevalencia del 2 al 33% de ERC en estadio3 en 46niños con TH, dependiendo de la fórmula empleada. En nuestra cohorte, aplicando la clasificación KDIGO, la prevalencia de ERC fue del 10,6%, y osciló entre el 1,9% con la fórmula Schwartz 2009cr y el 9,6% con las otras fórmulas de estimación. Esta variabilidad ya fue descrita en una serie más amplia por Brinkert et al.26, en la que la prevalencia osciló entre el 1,8 y el 20% en 168 niños con TH, dependiendo de si se aplicaba la fórmula Schwartz 2009cr o la fórmula de Filler basada en la cistatinaC.
La medición de la TFG es cara e invasiva, lo que limita su aplicación en la práctica clínica. Se han desarrollado ecuaciones para estimar la TFG de manera sencilla y precisa. Las más utilizadas son las basadas en el nivel sérico de creatinina, como la fórmula Schwartz 2009cr. No obstante, su uso presenta limitaciones importantes en niños con malnutrición, masa muscular baja y cirrosis hepática12. La cistatinaC es un marcador endógeno independiente de estas variables. Las ecuaciones de estimación basadas en la cistatinaC son más sensibles para detectar cambios en la TFG y, por lo tanto, de elección en situaciones en las que la creatinina sérica no es un parámetro válido27. Estudios previos que han analizado la concordancia entre las fórmulas basadas en la creatinina y la cistatinaC en el TH pediátrico han obtenido resultados similares a los nuestros, corroborando la sobreestimación de la TFG con la aplicación de fórmulas basadas en la creatinina y sin evidencia de una concordancia aceptable para las basadas en la cistatinaC10. No obstante, la fórmula CAPAcis ha mostrado un nivel bueno de concordancia en comparación con métodos basados en la medición de marcadores exógenos, llevando a la conclusión de que debería utilizarse al menos una vez al año y con mayor frecuencia de detectarse una disminución en la TFG10,13.
No se pudieron identificar los factores de riesgo de ERC detectados con anterioridad, quizá por el corto tiempo de evolución, por el número de pacientes o por la dificultad de evaluar el efecto de la nefrotoxicidad del tacrolimus más allá de la medida del número de intoxicaciones. La asociación del fallo hepático agudo como causa de la ERC no se ha descrito previamente. El DRA perioperatorio fue más frecuente en pacientes con insuficiencia hepática aguda y podría explicar este hallazgo, aunque la diferencia no tuvo significación estadística y requeriría confirmación en una serie más amplia.
Identificamos a niños que, a pesar de no padecer ERC, tenían albuminuria, HTA o una relación V/TFG alterada. Son marcadores de daño renal cuya importancia a largo plazo ha de ser evaluada, ya que se relacionan con la progresión del daño renal. Estos hallazgos no se habían descrito con anterioridad en esta población y podrían ser relevantes, pues posibilitarían la detección precoz y el tratamiento del daño renal.
LimitacionesLas limitaciones principales de nuestro estudio son las intrínsecas a su diseño transversal, que impiden verificar la estabilidad de los hallazgos. Aunque los estadios de la ERC se clasificaron de acuerdo con las guías KDIGO, dada la naturaleza retrospectiva del estudio, sería necesario un seguimiento de 3meses para asegurar los criterios diagnósticos de ERC. También serían necesarias mediciones seriadas para confirmar la presencia de albuminuria e HTA. Dado que no se utilizó un método directo para la medición de la TFG como patrón oro, solo nos fue posible señalar la variabilidad en los resultados de la estimación de la TFG dependiendo de la ecuación empleada y la asociación entre dichos resultados, sin poder establecer cuál es la más fiable. Por último, no nos fue posible definir la DRA en base a la diuresis por las dificultades que entrañaba la recogida retrospectiva de este parámetro.
ConclusiónEl DRA y la ERC fueron complicaciones frecuentes (28,8% y 10,6%, respectivamente) en nuestra cohorte de niños con TH tras un tiempo de evolución medio considerable durante la infancia. Hasta el 42% de los niños sin ERC tenían algún marcador de daño renal.
El estudio del daño renal en esta población facilita la prevención, el diagnóstico precoz, la clasificación y el tratamiento de la enfermedad renal, y podría mejorar el pronóstico a largo plazo16,19. A pesar de ello, no existen recomendaciones sobre las fórmulas a utilizar para la evaluación del filtrado glomerular, que muestran una concordancia pobre. El uso exclusivo de la fórmula Schwartz 2009cr puede limitar el diagnóstico, y es probable que las fórmulas basadas en la cistatinaC, o la combinación de la cistatina y la creatinina que además incluyan parámetros demográficos, sean más precisas para la estimación de la TFG. Se recomienda incluir otros marcadores en la evaluación del daño renal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
María Azpilicueta-Idarreta: Unidad de Nefrología Pediátrica, Hospital Universitario Reina Sofía, Córdoba, España.
María Prieto-Torre: Servicio de Gastroenterología, Hospital Universitario Reina Sofía, Córdoba, España.
Lucía Montijano-Herrero: Servicio de Pediatría, Hospital Universitario de Toledo, Toledo, España.
Lorena Fernández-Ruiz: Servicio de Pediatría, Hospital Universitario Poniente, El Ejido, Almería, España.
María José Torre-Aguilar: Unidad de Metabolismo e Investigación Pediátrica, Instituto Maimónides de Investigación Biomédica de Córdoba (IMIBIC), Hospital Universitario Reina Sofía, Universidad de Córdoba, Córdoba, España.
Mónica Rodríguez-Salas: Unidad de Trasplante Hepático Pediátrico, Hospital Universitario Reina Sofía, Córdoba, España.
Juan José Gilbert-Pérez: Unidad de Trasplante Hepático Pediátrico, Hospital Universitario Reina Sofía, Córdoba, España.
Elena López-Vargas: Servicio de Pediatría, Hospital Público Santa Bárbara, Puertollano, Ciudad Real, España.
Montserrat Antón-Gamero: Unidad de Nefrología Pediátrica, Hospital Universitario Reina Sofía, Universidad de Córdoba, Instituto Maimónides de Investigación Biomédica de Córdoba (IMIBIC), Córdoba, España.
Los miembros del Grupo de Trabajo para el Estudio del Daño Renal en Trasplante Hepático se presentan en el Anexo 1.
Presentación previa: los resultados del estudio se presentaron en forma de comunicación oral en el XLV Congreso de la Asociación Española de Nefrología Pediátrica, mayo de 2022, La Coruña, España.