La ventilación no invasiva (VNI) se ha convertido en un tratamiento habitual de la insuficiencia respiratoria aguda (IRA). Nuestro objetivo ha sido identificar factores predictores de fracaso de VNI para detectar precozmente a los pacientes en los que no tendrá éxito.
Pacientes y métodosEstudio de cohortes prospectivo que incluyó a todos los pacientes con IRA que recibieron VNI como tratamiento inicial entre 2005 y 2009, en una unidad de cuidados intensivos pediátricos de 14 camas de un hospital universitario de tercer nivel. Se recogieron datos clínicos e información sobre la VNI, previamente a su inicio, a las 2, 8, 12 y 24horas. La razón entre saturación de hemoglobina y fracción de oxígeno inspirada (S/F) se calculó retrospectivamente. Se definió fallo de VNI como necesidad de intubación o necesidad de rescate con presión binivel (BLPAP). Se realizaron análisis estadísticos univariable y multivariable.
ResultadosUn total de n=282 pacientes recibieron soporte no invasivo, presión continua= 71, BLPAP=211. El porcentaje de éxito de la muestra global fue 71%. Los pacientes tratados con BLPAP vs. presión continua, aquellos con S/F más elevados a las 2horas (odds ratio 0,991, IC 95%: 0,986-0,996, p=0,001) y los mayores de 6 meses (hazard ratio 0,375, IC 95% 0,171-0,820, p=0,014), presentaron menor riesgo de fracaso. Los pacientes con frecuencias cardíacas más altas y mayor presión positiva inspiratoria en vía aérea a las 2horas (odds ratio 1,021, IC 95%: 1,008-1,034, p=0,001; hazard ratio 1,214, IC 95%: 1,046-1,408, p=0,011) presentaron mayor riesgo de fracaso.
ConclusionesLa edad<6 meses, S/F, frecuencia cardíaca y presión positiva inspiratoria en la vía aérea a las 2horas son factores predictores independientes de fracaso de VNI inicial en pacientes con IRA admitidos en una unidad de cuidados intensivos pediátricos.
Despite there being limited evidence, non-invasive ventilation (NIV) has become a common treatment for acute respiratory failure (ARF). The aim of this study was to identify the predictive factors of NIV failure, in order to enable early detection of patients failing the treatment.
Patients and methodsProspective cohort study was conducted that included all ARF patients that received NIV as the initial treatment between 2005 and 2009 in a fourteen-bed Paediatric Intensive Care Unit (PICU) of a tertiary university hospital. Information was collected about the NIV, as well as clinical data prior to NIV, at 2, 8, 12, and 24hrs. The haemoglobin saturation (SpO2)/fraction of inspired oxygen (FiO2) ratio (S/F) was retrospectively calculated. NIV failure was defined as the need for intubation or requiring rescue with bi-level pressure (BLPAP). Univariate and multivariate statistical analyses were performed.
ResultsA total of 282 patients received non-invasive support, with 71 receiving Continuous Pressure (CPAP), and 211 with BLPAP treatment. The overall success rate was 71%. Patients receiving BLPAP vs. CPAP, patients with higher S/F ratios at 2hours (odds ratio [OR] 0.991, 95% CI 0.986-0.996, P=.001], and patients older than 6 months (Hazard ratio [HZ] 0.375, 95% CI 0.171-0.820, P=.014], were also more likely to fail. Patients with higher heart rates (HR) at 2hours (OR 1.021, 95% CI [1.008-1.034], P=.001) and higher inspiratory positive airway pressure (IPAP) at 2hours were more prone to failure (HZ 1.214, 95% CI [1.046-1.408], P=.011).
ConclusionsAge below 6 months, S/F ratio, HR, and IPAP at 2hours are independent predictive factors for initial NIV failure in paediatric patients with ARF admitted to the PICU.
La ventilación no invasiva (VNI) se ha convertido en un tratamiento comúnmente aceptado para la insuficiencia respiratoria aguda (IRA) en pacientes pediátricos. Hasta la fecha solo se dispone de un ensayo clínico aleatorizado controlado llevado a cabo en población pediátrica de una unidad de cuidados intensivos pediátricos (UCIP)1, que objetiva reducción en el porcentaje de intubación en los pacientes tratados con VNI. Sin embargo, mantener la VNI en pacientes adultos que no responden a este tratamiento aumenta el riesgo de complicaciones e incluso de mortalidad2. Por ello, resulta necesario identificar factores predictores de fracaso de VNI, que permitan detectar precozmente aquellos pacientes que fracasaran y evitar prolongar un tratamiento inapropiado. Entre los factores identificados hasta ahora se encuentran: la hipoxemia3–6, el síndrome de distrés respiratorio agudo7, puntuación elevada de escalas de gravedad (PELOD, PRISM II)6–10, trabajo respiratorio1,6,10,11, la edad4,10, la hipercapnia4,7–9, la presión arterial12 y el uso de interfases nasales o respiradores sin mezclador de oxígeno en pacientes hipoxémicos13.
El principal objetivo del estudio fue identificar factores predictores de fracaso de la VNI inicial en la población de UCIP. El objetivo secundario fue describir las características de la VNI como tratamiento de primera línea en niños con IRA.
MétodosPacientes y situaciónEstudio prospectivo de cohortes, realizado en una UCIP de 14 camas de un hospital de tercer nivel, desde enero de 2005 hasta diciembre de 2009. Se realizó un muestreo consecutivo de todos los pacientes de 0 a 18 años con diagnóstico de IRA admitidos en UCIP que recibieron VNI como tratamiento inicial. Se inició VNI en los pacientes con criterios clínicos de IRA con elevada probabilidad de intubación en las siguientes 6horas. La decisión fue tomada por el facultativo responsable cuando el paciente presenta uno de los siguientes signos clínicos: FR mayor 2 desviaciones estándar de la normalidad, necesidad de fracción de oxígeno inspirado (FiO2) mayor a 0,5 para mantener saturación de hemoglobina (SpO2) mayor de 94% y disnea progresiva en reposo. El fracaso respiratorio fue clasificado en tipo i (alteración de la ventilación/perfusión sin hipoventilación alveolar) o tipo ii (alteración con hipoventilación alveolar) según la clasificación de Newth14. Los criterios de exclusión fueron la presencia de alguna contraindicación para el uso de VNI15: parada cardiorrespiratoria, inestabilidad hemodinámica que requiere soporte inotrópico, arritmias graves, escala de Glasgow inferior a 10, traumatismo facial, cirugía, parálisis de cuerdas vocales, neumotórax no drenado y hemorragia digestiva alta activa. Los pacientes intubados en el momento de la admisión o ventilados por traqueostomía, así como los pacientes que recibieron VNI postextubación o paliativa (p. ej. pacientes con una enfermedad en la que la intubación es considerada una medida fútil) se excluyeron. Este estudio fue aprobado por el Comité de Ética e Investigación del Hospital Sant Joan de Déu, que renunció al consentimiento informado, dado que la VNI es un tratamiento rutinario en nuestra unidad y el permiso para el uso de estos datos era innecesario en ese momento.
Técnica de ventilación no invasivaLa decisión de aplicar presión positiva continua en la vía aérea (CPAP) o 2 niveles de presión positiva en la vía aérea (BLPAP) fue tomada por el facultativo responsable. Se usó CPAP en pacientes con apneas y/o dificultad respiratoria leve, y BLPAP en pacientes con dificultad respiratoria moderada-severa, trabajo respiratorio significativo (según auscultación y excursión torácica), a pesar del uso de CPAP, volumen inspiratorio bajo o hipercapnia progresiva.
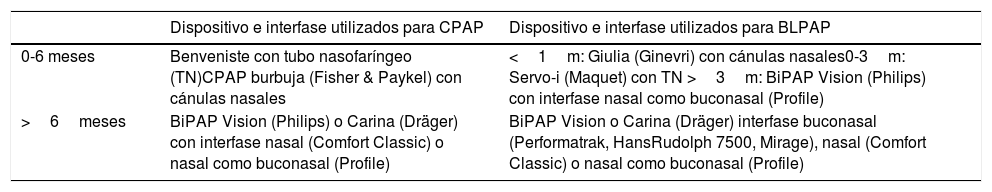
MaterialesSe usaron las siguientes interfases: cánulas binasales para Bubble CPAP Fisher & Paykel (Nueva Zelanda) y Giulia® Ginevri (Italia); interfases nasales Profile® Lite y Comfortclassic® Philips Respironics (Holanda) usadas como buconasales; interfases buconasales Mirage® ResMed (California), Performatrak® Philips Respironics, Hans Rudolph 7500® (Kansas); y tubos endotraqueales usados como tubos nasofaríngeos. La tabla 1 muestra los criterios de selección de la interfase y el ventilador. Apósitos hidrocoloides (Comfeel® Coloplast [Dinamarca]) y una solución de ácidos grasos hiperoxigenada (Mepentol® Bama-Geve [España]) se aplicaron para prevenir úlceras de presión. Se utilizó humidificación activa (Fisher & Paykel) en todos los casos desde 2007.
Criterios de selección de interfase y ventilador
| Dispositivo e interfase utilizados para CPAP | Dispositivo e interfase utilizados para BLPAP | |
|---|---|---|
| 0-6 meses | Benveniste con tubo nasofaríngeo (TN)CPAP burbuja (Fisher & Paykel) con cánulas nasales | <1m: Giulia (Ginevri) con cánulas nasales0-3m: Servo-i (Maquet) con TN >3m: BiPAP Vision (Philips) con interfase nasal como buconasal (Profile) |
| >6meses | BiPAP Vision (Philips) o Carina (Dräger) con interfase nasal (Comfort Classic) o nasal como buconasal (Profile) | BiPAP Vision o Carina (Dräger) interfase buconasal (Performatrak, HansRudolph 7500, Mirage), nasal (Comfort Classic) o nasal como buconasal (Profile) |
El dispositivo Benveniste (usado en nuestro centro en el 64% de los pacientes de 0-6 meses) es una adaptación artesanal de un sello de agua conectado a la interfase (habitualmente TN) mediante un anillo abierto que permite disminuir el trabajo respiratorio del paciente en la fase exhalatoria.
La estrategia de ventilación se aplicó según el protocolo del Grupo Respiratorio de la Sociedad Española de Cuidados Intensivos Pediátricos15. Para el modo CPAP los parámetros iniciales fueron 4-5cmH2O. En los pacientes que no se objetivó mejoría del trabajo respiratorio o de las apneas, el CPAP se aumentó hasta 8cmH2O. Para el modo BLPAP se usó una presión inspiratoria positiva en la vía aérea (IPAP) o presión inspiratoria máxima de 6-8cmH2O y una presión espiratoria positiva en la vía aérea (EPAP) o presión positiva al final de la espiración de 4cmH2O. La IPAP se aumentó escalonadamente en 2cmH2O hasta 22cmH2O cuando era detectado un volumen inspiratorio inadecuado, escasa mejoría del trabajo respiratorio o hipercapnia. La EPAP se aumentó hasta 8cmH2O para mejorar el reclutamiento alveolar y la oxigenación. No se limitó FiO2 máxima.
Cuando era objetivado algún signo de fracaso del tratamiento, era retirada la VNI y el paciente era intubado y conectado a ventilación mecánica convencional. Se consideraron signos de fracaso: SpO2<85% y presión parcial de dióxido de carbono (pCO2) mayor a 65mmHg, a pesar de aplicar parámetros máximos de VNI, aumento del trabajo respiratorio, apneas, o aparición de criterios de exclusión. El destete de la VNI se realizó de forma progresiva, disminuyendo escalonadamente la IPAP en 2cmH2O y la EPAP en 1cmH2O cuando era objetivado un descenso de la FR y del trabajo respiratorio, y la FiO2 era inferior a 0,4. Se colocó una sonda nasogástrica para evitar la distensión gástrica y administrar alimentación enteral.
MonitorizaciónEn todos los pacientes se monitorizó de manera continua FC, FR y SpO2. Las gasometrías solo se determinaron cuando el facultativo responsable lo consideró necesario.
SedaciónCuando las medidas no farmacológicas fueron insuficientes para mantener al paciente adaptado, se utilizaron fármacos sedantes (solos o combinados) como: levomepromacina oral (1mg/kg/dosis), midazolam en perfusión continua (0,05-0,1mg/kg/h) o propofol (1-2mg/kg/h) durante menos de 24horas.
Recogida de datosLa edad de los pacientes, el género, las condiciones subyacentes y la puntuación de la escala de gravedad (Pediatric Risk of Mortality Score II [PRISM II]) se documentaron en cada episodio. También se recogieron variables relativas al soporte con VNI: etiología de la IRA, tipo de fracaso respiratorio, modo ventilatorio, parámetros ventilatorios (FiO2, IPAP, EPAP), variables fisiológicas (FC, FR y SpO2) previas al inicio de la VNI y a las 2, 8, 12 y 24horas, cambios (diferencia numérica entre valores) en FC y FR respecto a los valores iniciales, gasometría venosa (cuando era solicitada), cambios en el modo de ventilación, ventilador o interfases usadas, sedación administrada, aparición de complicaciones o contraindicaciones, mortalidad, duración de la VNI, resultado de la VNI (éxito/fracaso) y estancia en la UCIP.
El fracaso de la VNI fue definido como la necesidad de intubación o rescate con BLPAP en el grupo inicialmente tratado con CPAP. La excelente correlación entre S/F y P/F se confirmó en la población pediátrica en 200916. Así, el S/F fue calculado y usado de forma retrospectiva, para ser evaluado como predictor de fracaso de VNI. El S/F se calculó previamente al inicio de la VNI y a las 2, 4, 8, 12 y 24horas del tratamiento con VNI, excluyendo valores de SpO2 mayor al 97%.
Análisis estadísticoLa estadística descriptiva para las variables cualitativas se expresó como porcentaje con intervalo de confianza (IC) 95%. Para las variables cuantitativas se usaron medias y medianas como medidas de tendencia central, y desviación estándar y rango intercuartílico P25-P75 como medidas de dispersión según la normalidad de la distribución de la muestra. Los resultados se correlacionaron con las distintas variables analizadas mediante el test de Chi-cuadrado, el test de «t» de Student y el test de U de Mann-Whitney, según cumplimiento o no de la normalidad. Se realizó análisis multivariable con modelo de regresión logística binario y con modelo de regresión de Cox con análisis de pasos sucesivos hacia delante para identificar potenciales predictores de éxito/fracaso de VNI, expresado como odds ratio y hazard ratio con IC 95% respectivamente. Se seleccionan variables con p inferior a 0,1 en el estudio univariante o que hayan sido significativas en la literatura publicada. En caso de riesgo de colinealidad se selecciona la variable más precoz en el tiempo. Se cita la capacidad de predicción del modelo (-2LL), mejor cuanto menor es el número, para mejor información del lector.
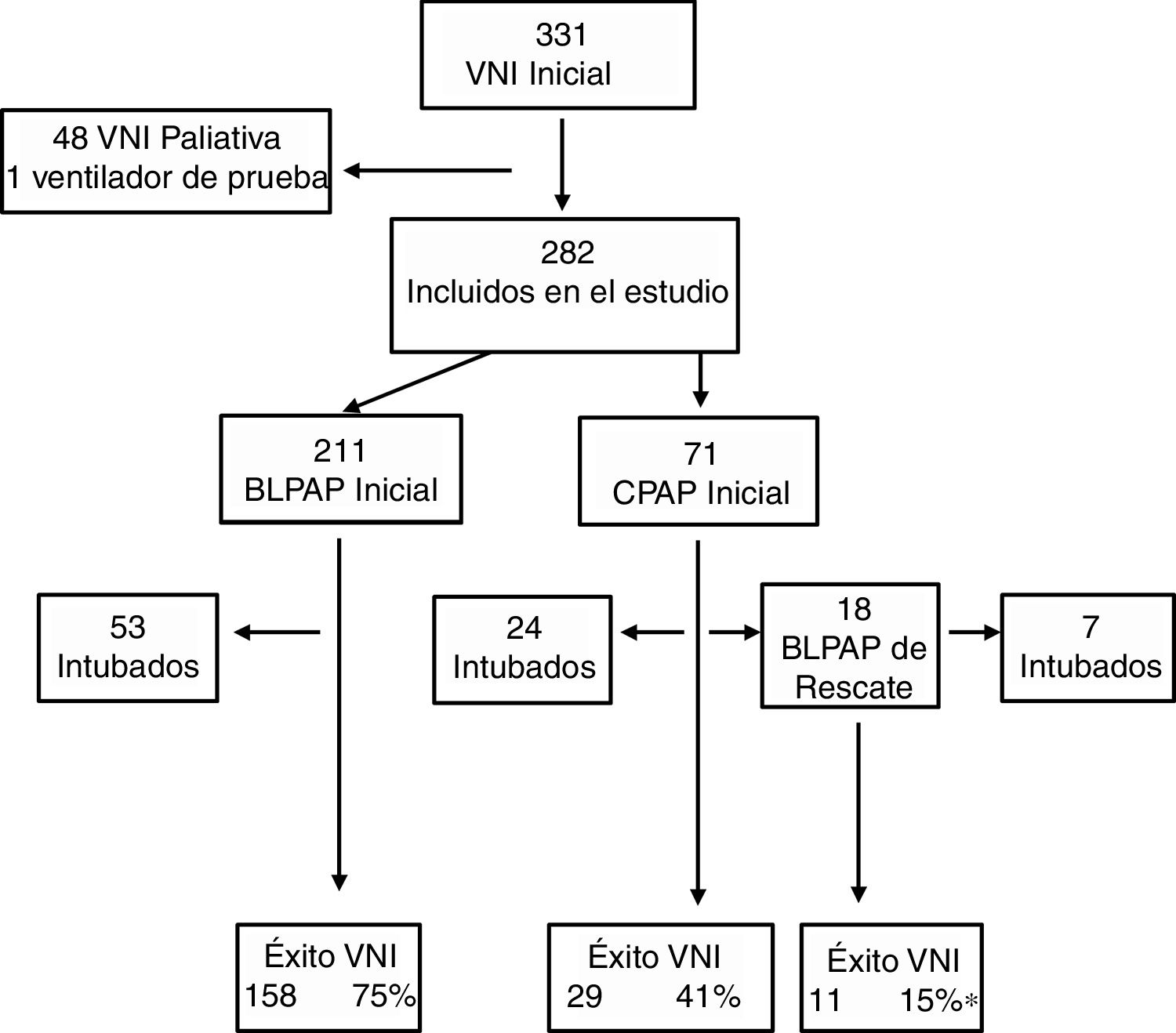
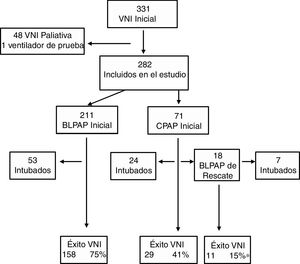
ResultadosEstudio descriptivoDurante el periodo de estudio 5.101 pacientes fueron admitidos en la UCIP, de los que 2.238 (43,9%) requirieron soporte respiratorio. En este grupo 331 (14,8%) recibieron VNI como tratamiento inicial. Se excluyeron 48 pacientes que recibieron VNI con indicación paliativa y un caso en el que se usó un ventilador de prueba. Así, la muestra estudio fue de 282 (12,6%) pacientes, 71 recibieron CPAP y el resto fueron tratados en modalidad BLPAP (fig. 1). Del grupo CPAP el 14% se clasificaron como fracaso respiratorio tipo i y en el grupo BLPAP un 40%.
Las principales enfermedades subyacentes fueron: cardiopatías congénitas (12,4%), enfermedades neuromusculares crónicas (9,1%), postoperados de cirugía cardiovascular (8,7%), ex-prematuros (3,2%) y síndrome de Down (2%). Un 47% eran pacientes sanos. Bronquiolitis (31%), neumonía (15%), infecciones respiratorias víricas (9%) y asma (7%) fueron los principales diagnósticos de IRA.
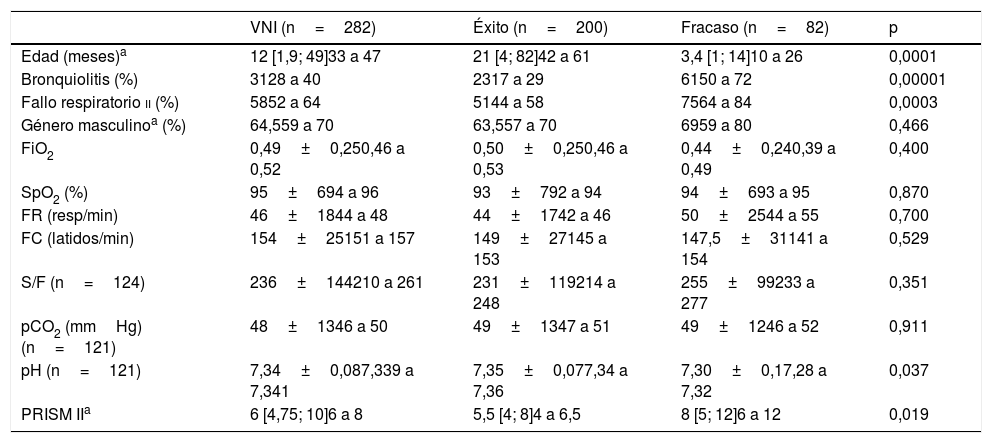
Se usó sedación en el 47% de los casos para facilitar la adaptación, siendo la levomepromazina oral el fármaco más usado. Quince pacientes requirieron cambio de interfase por problema de fugas. Las complicaciones fueron leves e infrecuentes: úlceras por presión (11 casos), neumomediastino (un caso), distensión gástrica (un caso), hipercapnia (un caso) y conjuntivitis (un caso).Cuatro pacientes fallecieron, en ningún caso atribuible al uso previo de VNI. El porcentaje de éxito del estudio fue 71%, pero con diferencias en función de tratamiento inicial, siendo en el grupo CPAP exclusiva la más baja, 55% (fig. 1). Tal como se observa en esta figura, 18 pacientes fueron rescatados con BLPAP, de los cuales 11 evitaron la intubación (61%). Los datos previos de la cohorte general comparando los grupos éxito y fracaso se exponen en la tabla 2. Se encontraron diferencias significativas entre los grupos de éxito y fracaso previamente al inicio de la VNI, para la edad (21 versus 3,4 meses), pH, tipo de fallo respiratorio y frecuencia del diagnóstico de bronquiolitis y el valor PRISM a las 24 horas (5,5 versus 8).
Características de los pacientes previamente al inicio de VNI en función del éxito o fracaso
| VNI (n=282) | Éxito (n=200) | Fracaso (n=82) | p | |
|---|---|---|---|---|
| Edad (meses)a | 12 [1,9; 49]33 a 47 | 21 [4; 82]42 a 61 | 3,4 [1; 14]10 a 26 | 0,0001 |
| Bronquiolitis (%) | 3128 a 40 | 2317 a 29 | 6150 a 72 | 0,00001 |
| Fallo respiratorio ii (%) | 5852 a 64 | 5144 a 58 | 7564 a 84 | 0,0003 |
| Género masculinoa (%) | 64,559 a 70 | 63,557 a 70 | 6959 a 80 | 0,466 |
| FiO2 | 0,49±0,250,46 a 0,52 | 0,50±0,250,46 a 0,53 | 0,44±0,240,39 a 0,49 | 0,400 |
| SpO2 (%) | 95±694 a 96 | 93±792 a 94 | 94±693 a 95 | 0,870 |
| FR (resp/min) | 46±1844 a 48 | 44±1742 a 46 | 50±2544 a 55 | 0,700 |
| FC (latidos/min) | 154±25151 a 157 | 149±27145 a 153 | 147,5±31141 a 154 | 0,529 |
| S/F (n=124) | 236±144210 a 261 | 231±119214 a 248 | 255±99233 a 277 | 0,351 |
| pCO2 (mmHg) (n=121) | 48±1346 a 50 | 49±1347 a 51 | 49±1246 a 52 | 0,911 |
| pH (n=121) | 7,34±0,087,339 a 7,341 | 7,35±0,077,34 a 7,36 | 7,30±0,17,28 a 7,32 | 0,037 |
| PRISM IIa | 6 [4,75; 10]6 a 8 | 5,5 [4; 8]4 a 6,5 | 8 [5; 12]6 a 12 | 0,019 |
FC: frecuencia cardíaca; FiO2: fracción inspirada de oxígeno; FR: frecuencia respiratoria; pCO2: presión parcial de dióxido de carbono; PRISM II: Pediatric Risk Score Mortality II; S/F: saturación de hemoglobina/fracción inspirada de oxígeno; SpO2: saturación de hemoglobina.
aLa edad y el PRISM II que no cumplen normalidad se expresan como mediana y rango intercuartílico P50 [P25; P75]; el género, bronquiolitis y fallo respiratorio tipo ii (n) y en porcentajes y el resto de variables que cumplen normalidad como media±desviación estándar. En todas, debajo, el intervalo de confianza de media poblacional al 95%.
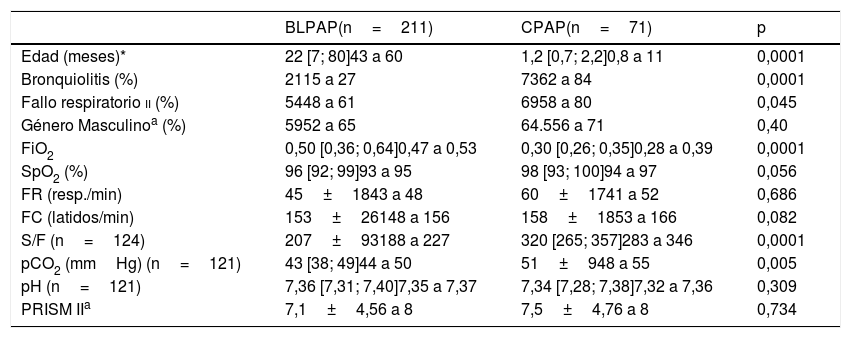
En la tabla 3 se comparan según CPAP y BLPAP, destacando que los pacientes que recibieron CPAP tenían significativamente menor edad y necesidades inferiores de oxígeno que los pacientes tratados con BLPAP.
Características de los pacientes previamente al inicio de VNI. Comparativa entre modo CPAP y BLPAP
| BLPAP(n=211) | CPAP(n=71) | p | |
|---|---|---|---|
| Edad (meses)* | 22 [7; 80]43 a 60 | 1,2 [0,7; 2,2]0,8 a 11 | 0,0001 |
| Bronquiolitis (%) | 2115 a 27 | 7362 a 84 | 0,0001 |
| Fallo respiratorio ii (%) | 5448 a 61 | 6958 a 80 | 0,045 |
| Género Masculinoa (%) | 5952 a 65 | 64.556 a 71 | 0,40 |
| FiO2 | 0,50 [0,36; 0,64]0,47 a 0,53 | 0,30 [0,26; 0,35]0,28 a 0,39 | 0,0001 |
| SpO2 (%) | 96 [92; 99]93 a 95 | 98 [93; 100]94 a 97 | 0,056 |
| FR (resp./min) | 45±1843 a 48 | 60±1741 a 52 | 0,686 |
| FC (latidos/min) | 153±26148 a 156 | 158±1853 a 166 | 0,082 |
| S/F (n=124) | 207±93188 a 227 | 320 [265; 357]283 a 346 | 0,0001 |
| pCO2 (mmHg) (n=121) | 43 [38; 49]44 a 50 | 51±948 a 55 | 0,005 |
| pH (n=121) | 7,36 [7,31; 7,40]7,35 a 7,37 | 7,34 [7,28; 7,38]7,32 a 7,36 | 0,309 |
| PRISM IIa | 7,1±4,56 a 8 | 7,5±4,76 a 8 | 0,734 |
FC: frecuencia cardíaca; FiO2: fracción inspirada de oxígeno; FR: frecuencia respiratoria; pCO2: presión parcial de dióxido de carbono; PRISM II: Pediatric Risk Score Mortality II; S/F: saturación de hemoglobina/fracción inspirada de oxígeno; SpO2: saturación de hemoglobina..
La edad y el PRISM II y otras variables que no cumplen normalidad se expresan como mediana y rango intercuartílico P50 [P25; P75]; el género en porcentajes y el resto de variables que cumplen normalidad como media±desviación estándar. En todas, debajo, el intervalo de confianza de media poblacional al 95%.
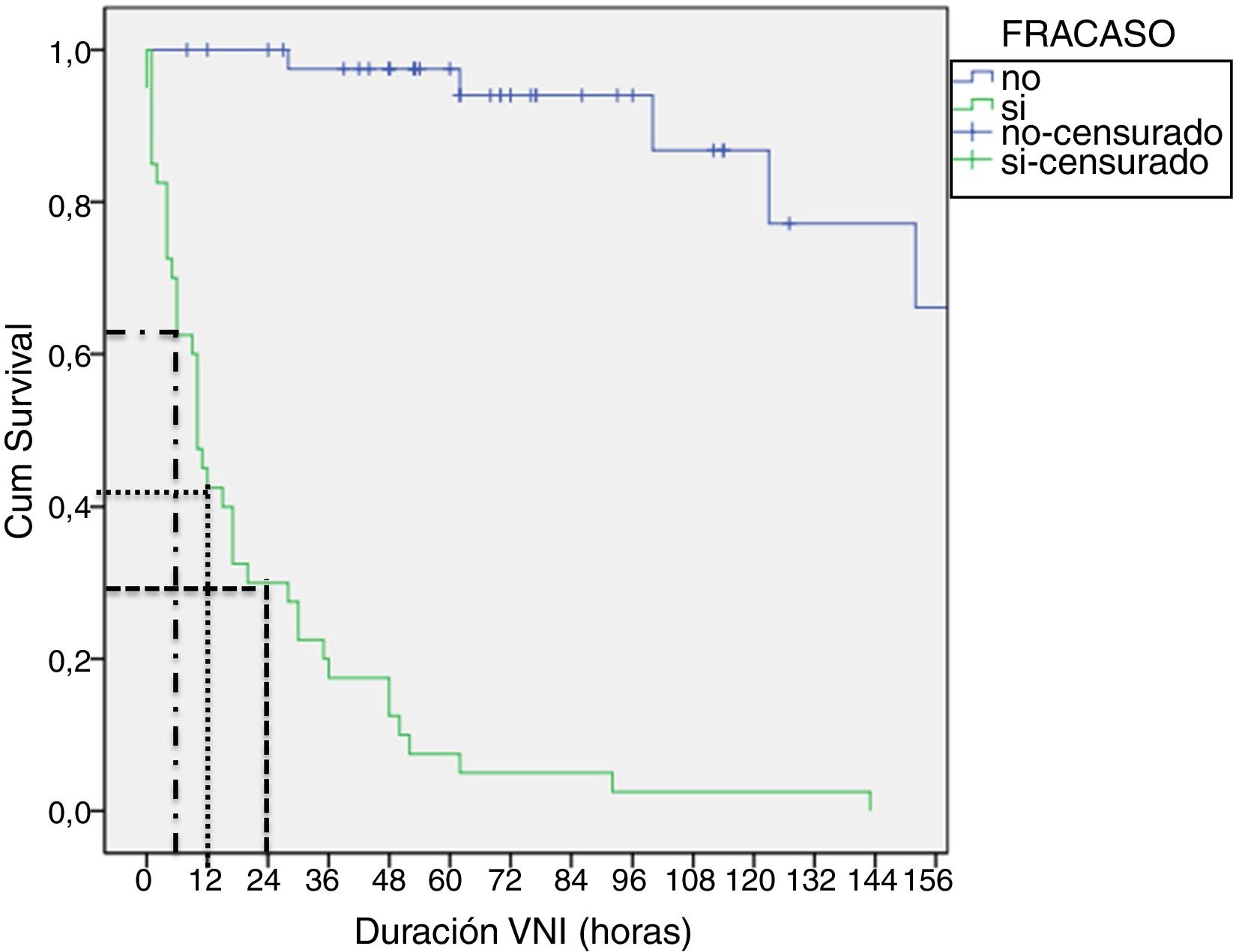
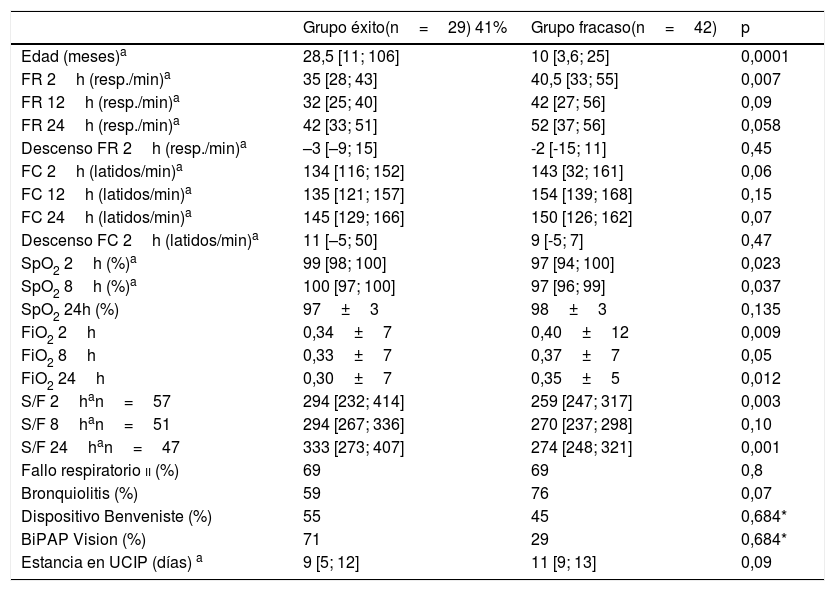
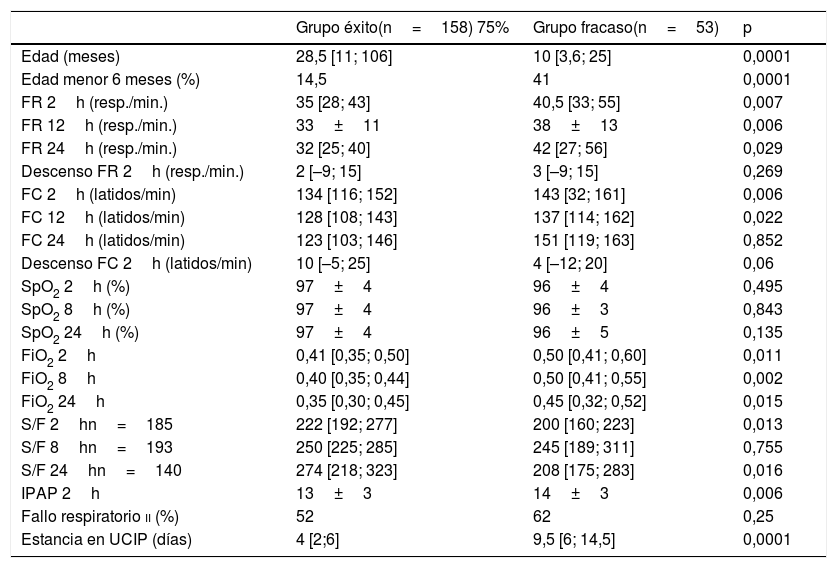
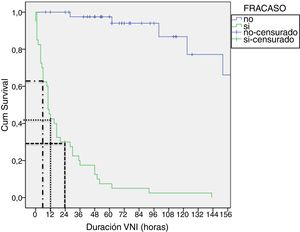
En las tablas 4 y 5 se muestran las diferencias entre los grupos éxito y fracaso, en la cohorte tratada con CPAP y en la cohorte tratada con BLPAP respectivamente. Aunque parece destacable la diferencia de eficacia entre dispositivos de CPAP (Benveniste 55%, BiPAP Vision® 71%) no alcanza significación estadística. En la muestra BLPAP los pacientes que fracasaron eran significativamente más jóvenes (10 vs. 28,5 meses, p=0,001), tenían FR significativamente mayores (51 vs. 41, p=0,010) y presentaron pH significativamente más bajos (pH 7,30 vs. 7,35, p=0,014) previamente al inicio de la VNI, en comparación con aquellos que no requirieron intubación. Tal como se observa en la figura 2, un porcentaje de pacientes cercano al 70% se intuban durante las primeras 24horas. El agotamiento clínico (ausencia de mejora de las variables FC y FR, descoordinación toracoabdominal) y la hipoxemia persistente fueron las principales causas de intubación.
Variables del grupo tratado con CPAP en función de éxito o fracaso
| Grupo éxito(n=29) 41% | Grupo fracaso(n=42) | p | |
|---|---|---|---|
| Edad (meses)a | 28,5 [11; 106] | 10 [3,6; 25] | 0,0001 |
| FR 2h (resp./min)a | 35 [28; 43] | 40,5 [33; 55] | 0,007 |
| FR 12h (resp./min)a | 32 [25; 40] | 42 [27; 56] | 0,09 |
| FR 24h (resp./min)a | 42 [33; 51] | 52 [37; 56] | 0,058 |
| Descenso FR 2h (resp./min)a | –3 [–9; 15] | -2 [-15; 11] | 0,45 |
| FC 2h (latidos/min)a | 134 [116; 152] | 143 [32; 161] | 0,06 |
| FC 12h (latidos/min)a | 135 [121; 157] | 154 [139; 168] | 0,15 |
| FC 24h (latidos/min)a | 145 [129; 166] | 150 [126; 162] | 0,07 |
| Descenso FC 2h (latidos/min)a | 11 [–5; 50] | 9 [-5; 7] | 0,47 |
| SpO2 2h (%)a | 99 [98; 100] | 97 [94; 100] | 0,023 |
| SpO2 8h (%)a | 100 [97; 100] | 97 [96; 99] | 0,037 |
| SpO2 24h (%) | 97±3 | 98±3 | 0,135 |
| FiO2 2h | 0,34±7 | 0,40±12 | 0,009 |
| FiO2 8h | 0,33±7 | 0,37±7 | 0,05 |
| FiO2 24h | 0,30±7 | 0,35±5 | 0,012 |
| S/F 2han=57 | 294 [232; 414] | 259 [247; 317] | 0,003 |
| S/F 8han=51 | 294 [267; 336] | 270 [237; 298] | 0,10 |
| S/F 24han=47 | 333 [273; 407] | 274 [248; 321] | 0,001 |
| Fallo respiratorio ii (%) | 69 | 69 | 0,8 |
| Bronquiolitis (%) | 59 | 76 | 0,07 |
| Dispositivo Benveniste (%) | 55 | 45 | 0,684* |
| BiPAP Vision (%) | 71 | 29 | 0,684* |
| Estancia en UCIP (días) a | 9 [5; 12] | 11 [9; 13] | 0,09 |
FiO2: fracción inspirada de oxígeno; SpO2: saturación de hemoglobina; FR: frecuencia respiratoria; FC: frecuencia cardíaca; S/F: saturación de hemoglobina/fracción inspirada de oxígeno.
a Se expresan como mediana y rango intercuartílico P50 [P25; P75]; el resto de variables que cumplen normalidad como media±desviación estándar.
Variables del grupo tratado con dos niveles de presión positiva en vía aérea (BLPAP) comparadas entre grupo éxito y fracaso
| Grupo éxito(n=158) 75% | Grupo fracaso(n=53) | p | |
|---|---|---|---|
| Edad (meses) | 28,5 [11; 106] | 10 [3,6; 25] | 0,0001 |
| Edad menor 6 meses (%) | 14,5 | 41 | 0,0001 |
| FR 2h (resp./min.) | 35 [28; 43] | 40,5 [33; 55] | 0,007 |
| FR 12h (resp./min.) | 33±11 | 38±13 | 0,006 |
| FR 24h (resp./min.) | 32 [25; 40] | 42 [27; 56] | 0,029 |
| Descenso FR 2h (resp./min.) | 2 [–9; 15] | 3 [–9; 15] | 0,269 |
| FC 2h (latidos/min) | 134 [116; 152] | 143 [32; 161] | 0,006 |
| FC 12h (latidos/min) | 128 [108; 143] | 137 [114; 162] | 0,022 |
| FC 24h (latidos/min) | 123 [103; 146] | 151 [119; 163] | 0,852 |
| Descenso FC 2h (latidos/min) | 10 [–5; 25] | 4 [–12; 20] | 0,06 |
| SpO2 2h (%) | 97±4 | 96±4 | 0,495 |
| SpO2 8h (%) | 97±4 | 96±3 | 0,843 |
| SpO2 24h (%) | 97±4 | 96±5 | 0,135 |
| FiO2 2h | 0,41 [0,35; 0,50] | 0,50 [0,41; 0,60] | 0,011 |
| FiO2 8h | 0,40 [0,35; 0,44] | 0,50 [0,41; 0,55] | 0,002 |
| FiO2 24h | 0,35 [0,30; 0,45] | 0,45 [0,32; 0,52] | 0,015 |
| S/F 2hn=185 | 222 [192; 277] | 200 [160; 223] | 0,013 |
| S/F 8hn=193 | 250 [225; 285] | 245 [189; 311] | 0,755 |
| S/F 24hn=140 | 274 [218; 323] | 208 [175; 283] | 0,016 |
| IPAP 2h | 13±3 | 14±3 | 0,006 |
| Fallo respiratorio ii (%) | 52 | 62 | 0,25 |
| Estancia en UCIP (días) | 4 [2;6] | 9,5 [6; 14,5] | 0,0001 |
FC: frecuencia cardíaca; FiO2: fracción inspirada de oxígeno; FR: frecuencia respiratoria; h: horas/horas de tratamiento con VNI; IPAP: presión inspiratoria positiva en vía aérea; Resp/min: respiraciones/minuto; S/F: saturación de hemoglobina/fracción inspirada de oxígeno; SpO2: saturación de hemoglobina; UCIP: unidad de cuidados intensivos pediátricos.
Finalmente, la duración de la estancia en UCIP fue significativamente mayor en los pacientes en los que fracasó el BLPAP.
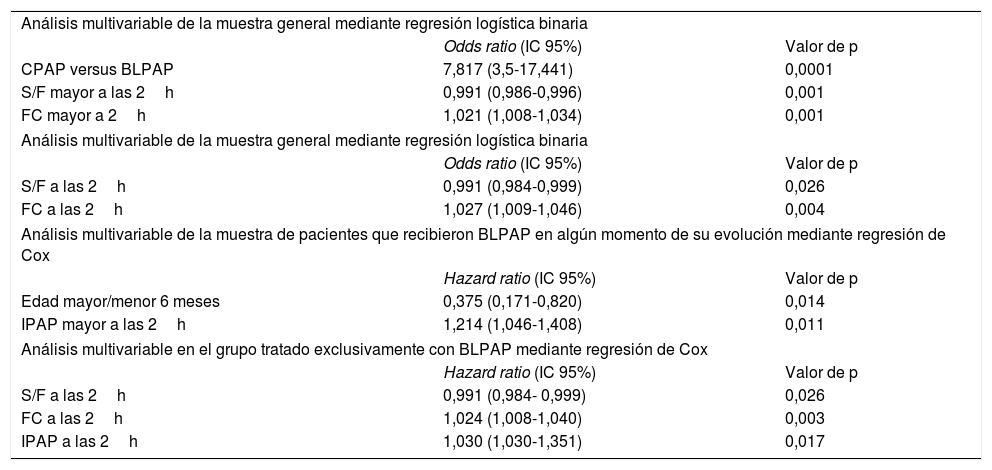
Análisis multivariable (tabla 6)Se realizó análisis multivariable de la muestra general mediante regresión logística binaria (RLB). Se analizaron las siguientes variables: modo de ventilación, tipo de fracaso respiratorio, edad de 6 meses (mayor/menor), FR, FC y S/F a las 2horas de tratamiento y bronquiolitis (sí/no). Capacidad de predicción (-2LL=232). Se realizó análisis multivariable de la muestra de pacientes que recibieron BLPAP en algún momento de su evolución mediante análisis de regresión de Cox. Se analizaron las siguientes variables: modo de ventilación, edad de 6 meses (mayor/menor) y FC, S/F e IPAP a las 2horas. Buena capacidad de predicción (-2LL=22).
Resumen análisis multivariable
| Análisis multivariable de la muestra general mediante regresión logística binaria | ||
| Odds ratio (IC 95%) | Valor de p | |
| CPAP versus BLPAP | 7,817 (3,5-17,441) | 0,0001 |
| S/F mayor a las 2h | 0,991 (0,986-0,996) | 0,001 |
| FC mayor a 2h | 1,021 (1,008-1,034) | 0,001 |
| Análisis multivariable de la muestra general mediante regresión logística binaria | ||
| Odds ratio (IC 95%) | Valor de p | |
| S/F a las 2h | 0,991 (0,984-0,999) | 0,026 |
| FC a las 2h | 1,027 (1,009-1,046) | 0,004 |
| Análisis multivariable de la muestra de pacientes que recibieron BLPAP en algún momento de su evolución mediante regresión de Cox | ||
| Hazard ratio (IC 95%) | Valor de p | |
| Edad mayor/menor 6 meses | 0,375 (0,171-0,820) | 0,014 |
| IPAP mayor a las 2h | 1,214 (1,046-1,408) | 0,011 |
| Análisis multivariable en el grupo tratado exclusivamente con BLPAP mediante regresión de Cox | ||
| Hazard ratio (IC 95%) | Valor de p | |
| S/F a las 2h | 0,991 (0,984- 0,999) | 0,026 |
| FC a las 2h | 1,024 (1,008-1,040) | 0,003 |
| IPAP a las 2h | 1,030 (1,030-1,351) | 0,017 |
El análisis multivariable también se llevó a cabo en el grupo tratado exclusivamente con BLPAP.
- RLB: se analizaron las siguientes variables: edad de 6 meses (mayor/menor), valores de IPAP, S/F, FC y disminución de FR a las 2horas. Buena capacidad de predicción (2LL=131).
– Análisis de regresión de Cox: las siguientes variables fueron analizadas: edad de 6 meses (mayor/menor) y valores de IPAP, FC y S/F a las 2horas. Capacidad de predicción menor (-2LL=240).
A pesar de que el análisis multivariable también se realizó en el grupo CPAP, no se encontraron diferencias estadísticamente significativas debido al reducido tamaño de la muestra.
DiscusiónLos hallazgos muestran 2 importantes factores predictores de fracaso de VNI. El primero y más destacado es la edad, lo que concuerda con resultados previos4,11. Específicamente se muestra que la edad menor de 6 meses es predictora de fracaso. Esto podría explicarse por particularidades anatómicas y fisiológicas, que hacen que este grupo de edad presente insuficiencia respiratoria grave con más frecuencia. Además, estos pacientes realizan apneas con mayor frecuencia17, y en especial los prematuros presentan más asincronía paciente-ventilador18 que los pacientes mayores de 7 meses19. Por otra parte, las limitaciones tecnológicas de los ventiladores y las interfases usadas en este grupo de edad dificultan la aplicación de la VNI.
Otro importante factor predictor de fracaso encontrado en la cohorte general del estudio fue el uso inicial de CPAP, lo que contradice los hallazgos de James12. Dado que en la cohorte tratada con CPAP no se observó la apnea grave como causa de fracaso excepto en 2 casos, podría deberse a que en la mayoría de los pacientes tratados con CPAP se utiliza el Benveniste, dispositivo con menor efectividad (actualmente en desuso en nuestra unidad) porque no permite medir presiones ni volúmenes ni compensar fugas. Por otra parte, el uso de ventiladores convencionales en niños de menor edad3, como hizo James, ha mostrado peores resultados que el uso de ventiladores específicos para VNI6,10,20. Así, lo que posiblemente muestran ambos estudios son las limitaciones tecnológicas de los dispositivos usados, y no tanto si el modo ventilatorio puede ser un verdadero factor predictor21.
El cociente S/F fue factor predictor de fracaso de VNI, especialmente los valores más bajos a las 2horas de tratamiento. El estudio más grande realizado hasta la fecha en población pediátrica (390 episodios), que utiliza el S/F como herramienta de monitorización, mostró su validez como predictor de fracaso a la hora y a las 6horas de tratamiento22, y sugirió el punto de corte de S/F en 200. En este sentido, estudios previos ya mostraron la hipoxemia como factor predictor de fracaso, sugiriendo un P/F<175 en adultos23, y un S/F<189 en niños24, como puntos de corte para intubación. Basándonos en la evidencia acumulada el S/F podría incluirse como marcador no invasivo de oxigenación estándar en pacientes que no disponen de acceso arterial, condición frecuente en pacientes pediátricos con VNI.
En cuanto a otras variables que miden indirectamente el trabajo respiratorio, los valores más elevados de FC a las 2horas de tratamiento también fueron identificados como factor predictor independiente de fracaso, resultado coherente con hallazgos previos1,11, y nos recuerdan la importancia de una monitorización estrecha de la FC especialmente al inicio del tratamiento. El valor más elevado de IPAP a las 2horas de tratamiento también fue identificado como predictor independiente de fracaso. Esto coincide con un trabajo previo5 que identifica la presión media en la vía aérea (MAP) superior a 11,5cm H2O en los ventiladores convencionales como un factor predictor de fracaso. Dado que en los ventiladores específicos para VNI no puede determinarse la MAP, la variable IPAP equivalente a la presión pico puede ser más interesante, pues es medida en todos los ventiladores.
Cabe destacar que los valores de odds ratio y hazard ratio de las variables FC, S/F e IPAP a las 2horas tienen valores cercanos a 1, por lo que cada uno de ellos de forma aislada no permite tomar decisiones clínicas. Los hallazgos son congruentes con el conocimiento actual, sugiriendo que la detección precoz de pacientes con riesgo de fracaso de VNI se debe basar en la edad y en la monitorización de estos 2 factores: hipoxemia y trabajo respiratorio. Mientras estudios previos han sugerido el PRISM II como factor predictor6–10, se descartó en el estudio dado que su valor se obtiene tras finalizar las primeras 24horas de ingreso, y un gran porcentaje de los pacientes con VNI precisan intubación antes de las primeras 24horas, lo que inhabilita esta escala medida a las 24horas para la predicción de fracaso.
En el presente estudio existen diversas limitaciones; en primer lugar analizar el fracaso de CPAP no solo como intubación, sino como la necesidad de rescate con BLPAP puede ser confuso para el lector y contener sesgos no controlados por el análisis multivariable; otro de los posibles puntos débiles del trabajo es la pérdida de pacientes con SpO2 mayor a 97% en el estudio multivariable, lo que disminuía la potencia del S/F a medida que avanza el tratamiento con VNI. Sin embargo, el mismo modelo de regresión de Cox usando la FiO2 (n=282) en lugar del S/F proporciona una menor capacidad predictora (mayor valor -2LL), asegurando así la validez de los datos con S/F. La falta de una realización sistemática de gasometría venosa a todos los pacientes, previo al inicio y durante la VNI, también supone una grave limitación para evaluar la monitorización de la acidosis/hipercapnia y comparar con otros estudios.
Finalmente, la amplia variabilidad de material requerido en función de la edad del paciente también limita la posibilidad de extrapolar los resultados a otros centros, especialmente en lo que refiere al uso del CPAP con un dispositivo artesanal.
La introducción de múltiples dispositivos para administrar CPAP y BLPAP, así como de nuevos modos de ventilación como VNI Neural Adjusted Ventilatory Assist o interfases como la facial total, y el hecho de que los datos del estudio se recogieran hace como mínimo 9 años, hace que algunas de nuestras conclusiones puedan ser cuestionadas. Sin embargo, estas novedades no se han introducido en muchos centros, por lo que los resultados todavía pueden considerarse válidos y aplicables en aquellos centros donde no se han producido cambios sustanciales en el material usado ni en los protocolos.
ConclusionesEn este estudio se identifican como factores predictores independientes a las 2horas del inicio del tratamiento con ventilación no invasiva que a menor cociente S/F y mayor frecuencia cardiaca, mayor fue el riesgo de fracaso de la ventilación mecánica no invasiva, tanto en la cohorte general como en el grupo BLPAP, si bien este riesgo fue mínimo. En el grupo de pacientes que recibieron BLPAP en algún momento de su evolución se identifica además que, a mayor presión inspiratoria a las 2horas del inicio del tratamiento, y edad menor de 6 meses, mayor fue el riesgo de necesidad de intubación traqueal.
Conflicto de interesesEn el momento de realización del artículo ninguno de los autores presentaba conflictos de interés. En los últimos 5 años el Dr. Pons ha realizado charlas para ResMed, Fisher & Paykel. Ha colaborado en el desarrollo de una interfase nasal domiciliaria para Air Liquide Healthcare. El Hospital Sant Joan de Déu dispone de material cedido por Philips, ResMed.
Presentación previa en reuniones, congresos o simposios: Análisis de 10 años de experiencia en VNI en UCIP. XXIV Congreso anual de la Sociedad Española de Cuidados Intensivos Pediátricos. Valencia 2009. Lectura de tesis doctoral, junio 2013, Universitat de Barcelona.