La oxigenoterapia de alto flujo (OAF) es un tratamiento seguro y eficaz de la bronquiolitis en las plantas de hospitalización. Se desconoce cuál es el flujo óptimo para iniciar esta terapia. Nuestro objetivo es analizar si hay diferencias en la evolución de los pacientes según el flujo inicial empleado.
MétodosDurante el periodo 2014-2016 se realizó un estudio clínico observacional y analítico de cohortes prospectivas en lactantes ingresados por bronquiolitis que precisaron OAF. Se establecieron dos cohortes en función del flujo inicial: cohorte1: flujo 15l/min (OAF-15); cohorte2: flujo 10l/min (OAF-10). El fracaso terapéutico se definió como la presentación de pausas de apnea o a la ausencia de mejoría clínica en las siguientes 12-24h. Se construyeron modelos probabilísticos multivariantes para identificar variables predictivas de fracaso terapéutico.
ResultadosSe incluyeron 57 pacientes. Mediana de edad, 4meses (RIQ2-13). Recibieron tratamiento con OAF-10 el 54% y con OAF-15 el 46%. En la cohorte OAF-15 la frecuencia respiratoria empezó a disminuir en la primera hora y en la cohorte OAF-10 a partir de las 6 primeras horas (p=0,03). En la cohorte OAF-10 ocurrió fracaso terapéutico en el 71%, frente al 15% de la OAF-15 (p<0,01). Precisaron ingreso en la UCIP el 35%, en la cohorte OAF-10 vs el 18% en la OAF-15 (p=0,11). No se encontraron efectos adversos en ninguna de las cohortes.
ConclusionesLa OAF a 15l/min en el tratamiento de la bronquiolitis es segura y eficaz, consigue una mejoría precoz de la frecuencia respiratoria y tiene un menor porcentaje de fracaso terapéutico.
High-flow nasal cannula (HFNC) is a safe and effective treatment in bronchiolitis in paediatric wards. The optimal flow on starting HFNC is still unknown. The main aim of this study was to determine if there were differences in clinical outcome of patients according the initial flow.
MethodsA prospective, observational and analytical study was conducted between 2014 and 2016 on infants admitted with bronchiolitis and who required HFNC. Two cohorts were established according to the initial flow: cohort1: flow 15L/min (HFNC-15), and cohort2: flow 10L/min (HFNC-10). Treatment failure was defined as the presentation of apnoea or the absence of clinical improvement in the first 12-24hours. Multivariate probabilistic models were built to identify predictive variables of treatment failure.
ResultsA total of 57 patients were included. The median age was 4months (IQR 2-13), and 54% received treatment with HFNC-10 and 46% with HFNC-15. In HFNC-15 cohort, respiratory rate (RR) decreased in the first hour, and in the HFNC-10 cohort in the first 6hours (P=.03). In HFNC-10 cohort, treatment failure rate was 71%, compared to 15% of HFNC-15 (P<.01). Admission to PICU was required in 35% of the HFNC-10 group vs 18% in HFNC-15 (P=.11). No adverse effects were found.
ConclusionsThe use of HFNC 15L/min in bronchiolitis treatment in paediatric wards is safe and effective, achieves a faster improvement of respiratory rate and has a lower treatment failure rate.
La bronquiolitis es la primera causa de hospitalización en lactantes menores de un año de edad. Aproximadamente entre el 10 y el 15% de los pacientes hospitalizados precisarán ingreso en las unidades de cuidados intensivos pediátricos (UCIP). Dentro del manejo terapéutico de los pacientes con bronquiolitis es fundamental el tratamiento de soporte, que incluye el mantenimiento de un correcto estado de hidratación y nutrición, así como un adecuado aporte de oxígeno1. En este contexto surge la oxigenoterapia de alto flujo (OAF), una terapia utilizada inicialmente en las UCIP y que posteriormente, debido al desarrollo de la especialidad de Pediatría Hospitalaria, se empezó a utilizar en las plantas de hospitalización pediátricas (PHP) con buenos resultados. Actualmente, en la planta de hospitalización la OAF se considera un tratamiento seguro y eficaz de la bronquiolitis2.
La OAF funciona aumentando el volumen de aire y de oxígeno en la vía respiratoria, de forma caliente y humidificada, lo que permite aumentar el flujo inspiratorio y optimizar el aporte de oxígeno al alvéolo, reduciendo el trabajo respiratorio y mejorando el intercambio gaseoso3-5. Aunque el procedimiento para su administración se encuentra estandarizado, existen algunos aspectos en discusión, como el flujo inicial idóneo de oxígeno o el momento ideal de inicio de administración de la terapia.
Existe una gran variabilidad en cuanto al flujo empleado al inicio del tratamiento con OAF: la mayoría de los autores lo calculan según el peso, otros en función de la gravedad, o según el criterio del facultativo6. Algunos estudios indican que con un flujo de 2l/kg/min se puede conseguir una presión faríngea ≥4cmH2O, pero no se define el flujo máximo que se puede utilizar durante el tratamiento con OAF en lactantes5. Nuestra impresión clínica, tras siete años utilizando este tratamiento en las PHP, es que muchos lactantes se podrían beneficiar de flujos más elevados desde el inicio de la terapia.
El objetivo de nuestro trabajo consistió en evaluar la seguridad de la administración de OAF en las bronquiolitis tratadas en la PHP y analizar si el flujo inicial empleado (10 vs 15l/min) condiciona diferencias en la efectividad de dicho tratamiento, en términos de gravedad clínica y probabilidad de fracaso.
Pacientes y métodosDurante el periodo 2014-2016 se realizó un estudio clínico observacional y analítico de cohortes prospectivas en lactantes menores de 24meses ingresados por bronquiolitis que precisaron OAF. El ámbito de estudio fue un hospital terciario con 38 camas de hospitalización de pediatría general y 1.750 ingresos anuales. Se consideró bronquiolitis al primer o segundo episodio agudo de sibilancias, precedido por un cuadro respiratorio de origen viral que afectó a niños menores de 2años7. La bronquiolitis representó la primera causa de ingreso durante el período del estudio.
El muestreo fue consecutivo y se incluyeron los pacientes de edades comprendidas entre 1 y 24meses ingresados por bronquiolitis grave en la PHP, que precisaron OAF y cuyo consentimiento fue firmado por sus padres o tutores. Se excluyeron los neonatos, los lactantes que ingresaron directamente en la UCIP, aquellos a los que se indicó OAF en urgencias de nuestro centro e ingresaron con los parámetros ya definidos, aquellos en los que la OAF se inició en otro hospital, y aquellos con neumotórax en la radiografía de tórax, malformaciones faciales o traqueostomía que contraindicaban la OAF.
Los pacientes que ingresaron en la PHP fueron evaluados por pediatras generales hospitalarios, y en el caso de indicación de OAF fueron incluidos dentro del protocolo de OAF. La gravedad de los pacientes se midió mediante la escala clínica de Wood-Downes-Ferres (WDF-S)8 (tabla 1). Los criterios para iniciar la OAF en la PHP fueron: progresión de la dificultad respiratoria valorada por el incremento del WDF-S ≥8, disminución de la saturación de oxígeno (SatO2) <92% a pesar de la oxigenoterapia convencional, o la presencia de pausas de apnea en número de 2 o más por hora.
Escala de Wood-Downes (modificada por Ferres)
| Puntos | Sibilancias | Tiraje | FR (rpm) | FC (lpm) | Ventilación | Cianosis |
|---|---|---|---|---|---|---|
| 0 | No | No | <30 | <120 | Buena y simétrica | No |
| 1 | Final de la espiración | Subcostal | 31-45 | >120 | Regular y simétrica | Sí |
| 2 | Toda la espiración | +Intecostal | 46-60 | Muy disminuida | ||
| 3 | Inspiración y espiración | +Aleteo nasal | Tórax silente |
Bronquiolitis leve 1-3 puntos, moderada 4-7 puntos y grave 8-14 puntos.
FC: frecuencia cardiaca; FR: frecuencia respiratoria.
En nuestra práctica clínica habitual algunos pacientes empiezan la OAF a 10l/min y otros a 15l/min, dependiendo del médico prescriptor; por ello los pacientes fueron asignados a la cohorte de OAF-10 u OAF-15, respectivamente, de acuerdo al criterio del médico que estaba al cargo de la planta. En ambas cohortes se aportó una FiO2 para conseguir una SatO2 ≥92% y con una temperatura de humidificación entre 35-37°C. De esta forma se definieron dos cohortes de estudio en función del flujo inicial: cohorte OAF-15, con flujo inicial de 15l/min, y cohorte OAF-10, con flujo inicial de 10l/min. Se utilizó el sistema de aire caliente y humidificado Fisher & Paykel® (MR850® humidification system; Fisher & Paykel Healthcare) con cánulas nasales F&P Optiflow Junior, Infant Size (OPT-316).
El fracaso terapéutico se definió como:
- -
Presencia de pausas de apnea una vez instaurada la terapia con OAF, o
- -
Aumento de FR, FC, SatO2 y WDF-S en las primeras 12-24h, o
- -
Estancamiento de los valores de FR, FC, SatO2 o WDF-S (o descenso de menos de un 15% del valor basal).
Se recogieron datos clínicos y epidemiológicos, incluyendo edad, sexo, peso, edad gestacional, antecedentes personales y test rápido de VRS. Se diseñó una hoja de recogida de datos, donde se realizó un registro temporal durante el tratamiento con OAF de los siguientes parámetros: temperatura, frecuencia respiratoria (FR), frecuencia cardiaca (FC) y SatO2. Los parámetros fueron registrados en el momento de la indicación del alto flujo, en 1, 3, 6, 12 y 24h del inicio de la terapia y, posteriormente, de forma diaria hasta la retirada. La WDF-S fue evaluada diariamente por los médicos responsables del estudio. Se registraron los tratamientos asociados, el ingreso en la UCIP, las complicaciones y la tolerancia de la OAF.
El análisis estadístico se realizó mediante los programas estadísticos SPSS versión 21.0 (IBM SPSS Statistics, Armonk, NY) y GraphPad Prism version 7, La Jolla, California, EE.UU. Las variables cuantitativas se expresaron como mediana y rango intercuartílico. Las variables cualitativas se expresaron como porcentajes. Para comparar las variables cualitativas se utilizó el test de Fisher, y para las variables cuantitativas, la U de Mann Whitney y el test de Kruskall Wallis para muestras no pareadas y el test de Friedman para muestras pareadas. Para el análisis del tiempo hasta el fracaso terapéutico se utilizó la curva de supervivencia de Kaplan Meier y el test de Long-Rank Mantel Cox.
Para valorar los factores que podrían condicionar el fracaso terapéutico y el ingreso en UCIP se construyeron dos modelos probabilísticos de regresión logística, en que se incluyeron como covariables todas las variables con significación estadística y las clínicamente relevantes como edad, enfermedad de base, peso, WDF-S y flujo de inicio (OAF-10/OAF-15).
Los resultados se expresaron en los modelos de regresión logística como OR e IC95%. Como criterios de selección y comparación entre los modelos de regresión se utilizaron los índices de Akaike (Akaike informative criterion [AIC]) y los Bayesian information criteria (BIC). El modelo elegido fue aquel con menor valor de AIC y BIC, lo que indicaba mejor ajuste del modelo. Se descartó colinealidad en todos los modelos. Se consideró estadísticamente significativa una p<0,05. El estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital Gregorio Marañón (Código 57/18).
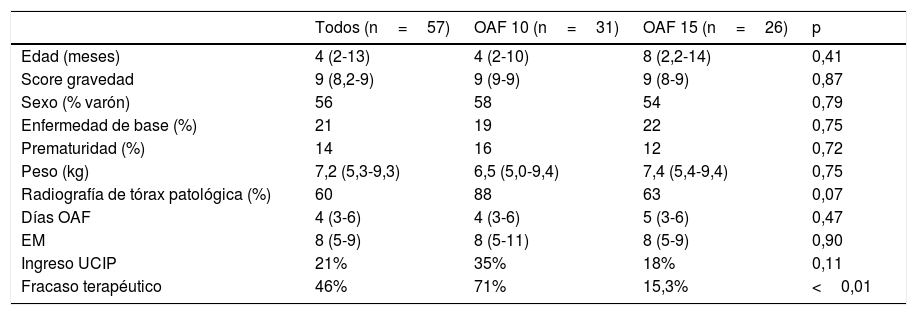
ResultadosGeneralesDurante el periodo de estudio ingresaron en las PHP 481 bronquiolitis. Cumplieron los criterios de inclusión 57 pacientes. La mediana de edad fue de 4meses, y el 50% fueron bronquiolitis por VRS. Las características basales de los pacientes se resumen en la tabla 2.
Características basales y evolución clínica de los todos los pacientes y según el flujo inicial de OAF
| Todos (n=57) | OAF 10 (n=31) | OAF 15 (n=26) | p | |
|---|---|---|---|---|
| Edad (meses) | 4 (2-13) | 4 (2-10) | 8 (2,2-14) | 0,41 |
| Score gravedad | 9 (8,2-9) | 9 (9-9) | 9 (8-9) | 0,87 |
| Sexo (% varón) | 56 | 58 | 54 | 0,79 |
| Enfermedad de base (%) | 21 | 19 | 22 | 0,75 |
| Prematuridad (%) | 14 | 16 | 12 | 0,72 |
| Peso (kg) | 7,2 (5,3-9,3) | 6,5 (5,0-9,4) | 7,4 (5,4-9,4) | 0,75 |
| Radiografía de tórax patológica (%) | 60 | 88 | 63 | 0,07 |
| Días OAF | 4 (3-6) | 4 (3-6) | 5 (3-6) | 0,47 |
| EM | 8 (5-9) | 8 (5-11) | 8 (5-9) | 0,90 |
| Ingreso UCIP | 21% | 35% | 18% | 0,11 |
| Fracaso terapéutico | 46% | 71% | 15,3% | <0,01 |
EM: estancia media; OAF: oxigenoterapia de alto flujo; UCIP: unidad de cuidados intensivos pediátricos.
Los valores se expresan como medianas y P25-P75 rangos intercuartílicos y porcentajes.
Las variables continuas (edad, score de gravedad, estancia media, días de OAF y peso) se analizaron con el test de Mann-Whitney. Para las variables categóricas (sexo, presencia de enfermedad de base, radiografía patológica, prematuridad, ingreso en UCIP y fracaso terapéutico) se utilizó el test exacto de Fisher.
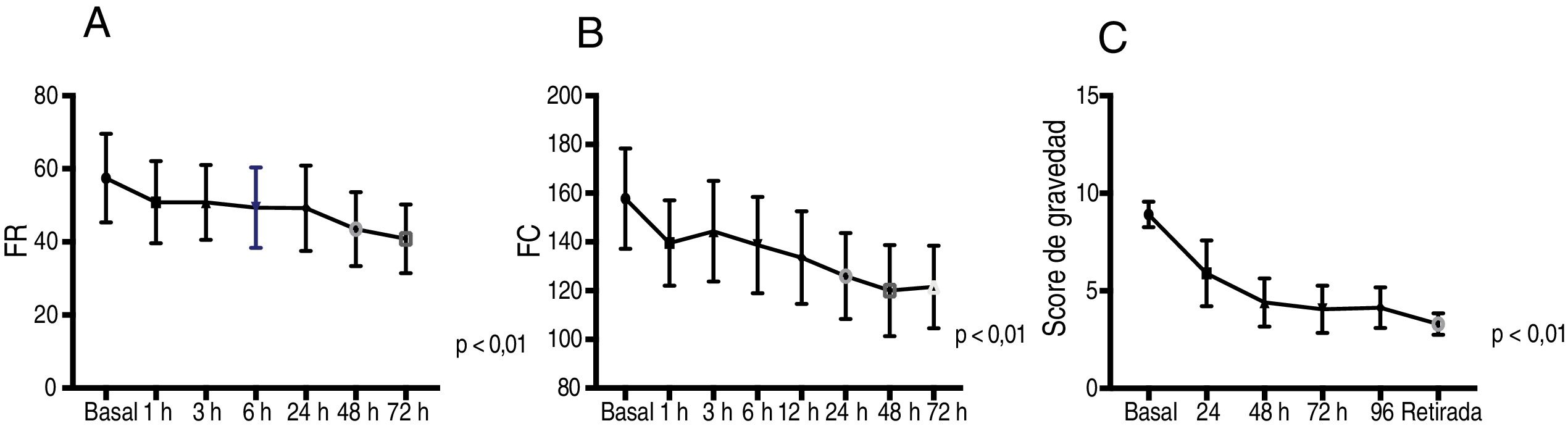
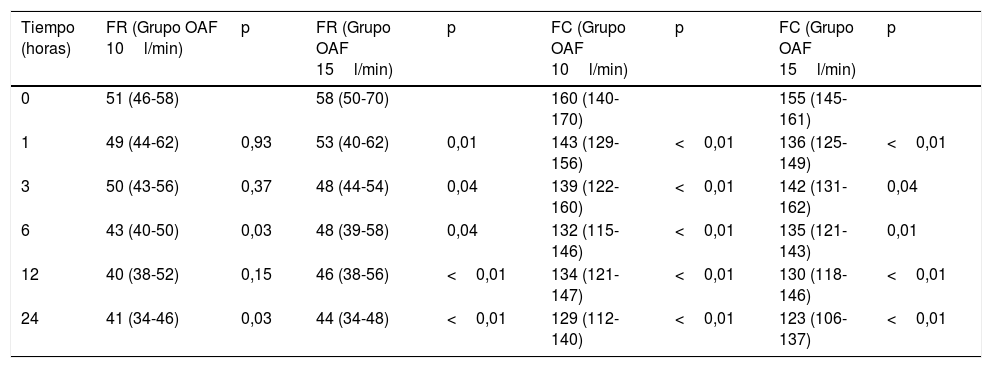
La OAF en los pacientes con bronquiolitis produjo una reducción significativa en la FC, la FR y la WDF-S en las primeras horas de tratamiento (fig. 1).
Reducción de la FR, de la FC y del score de gravedad en las primeras horas de tratamiento.
Evolución de la frecuencia respiratoria, de la frecuencia cardíaca y del score de Wood-Downes-Ferres en los pacientes con OAF. Test de Friedman para muestras relacionadas.
FC: frecuencia cardiaca; FR: frecuencia respiratoria; Score de gravedad: score de Wood-Downs-Ferres.
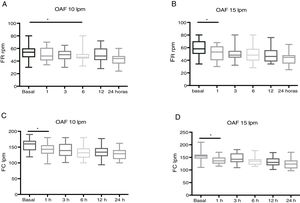
Ingresaron en la UCIP el 21% (n=12), y el soporte ventilatorio que recibieron en dicha unidad fue: el 25%3 continuaron con OAF, el 67%8 precisaron ventilación no invasiva (CPAP/BiPAP) y el 8%1 precisaron ventilación mecánica invasiva (fig. 2).
Estudio de la seguridadLa OAF fue bien tolerada en todos los pacientes. No precisaron sedación en ningún caso. No se observaron complicaciones relacionadas con el tratamiento de OAF como neumotórax, epistaxis o escaras nasales.
Análisis comparativo de ambas cohortesSe realizó un estudio comparativo entre las dos cohortes según el flujo al inicio de la OAF; el 54% (n=31) comenzaron en la cohorte OAF-10 y el 46% (n=26) en la cohorte OAF-15. Las dos cohortes fueron comparables en cuanto a edad, sexo, enfermedad de base, peso, WDF-S, tratamientos concomitantes y etiología viral (tabla 2). La comparación en la evolución en ambas cohortes se resume en la tabla 2.
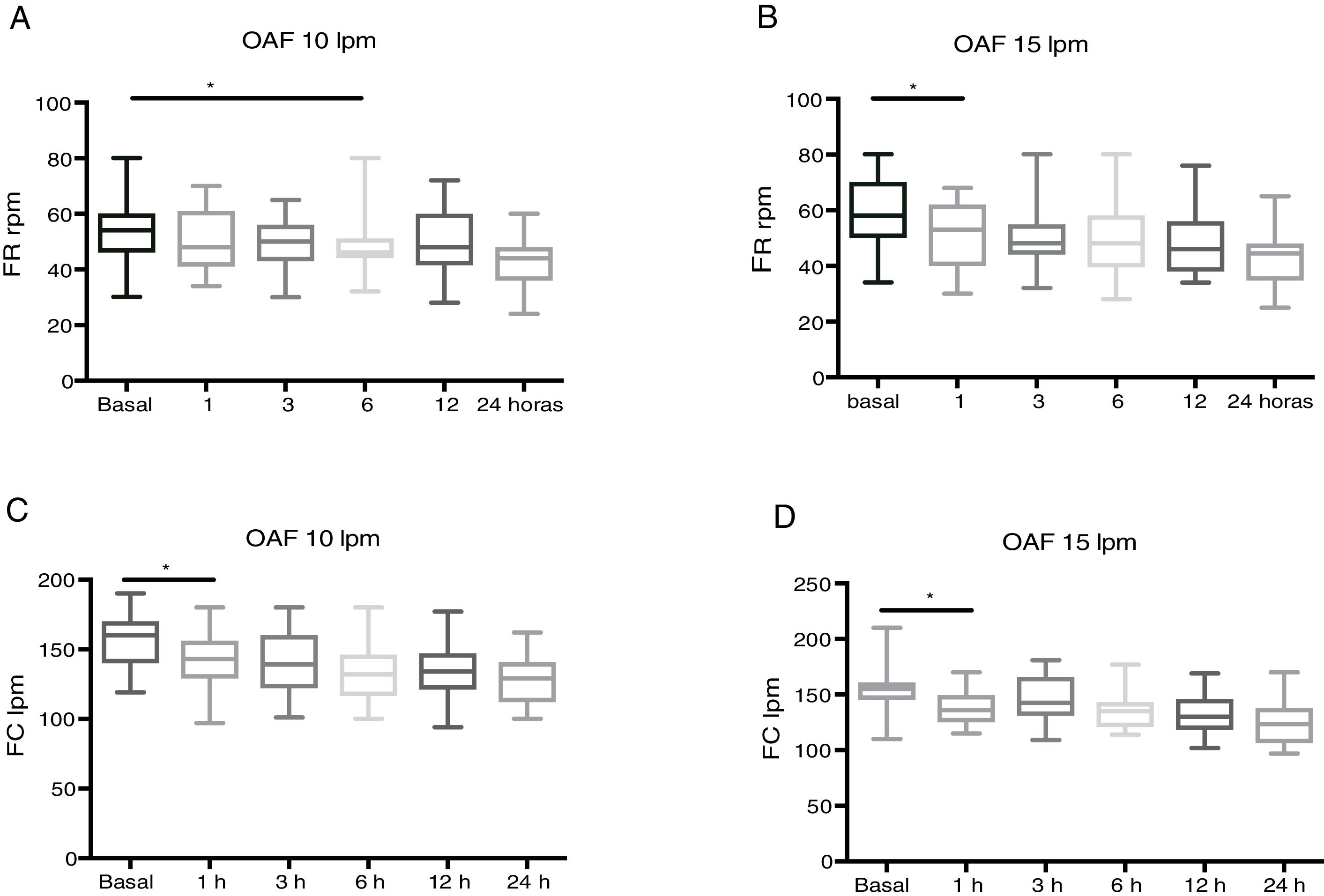
En la cohorte OAF-15 la FR empieza a disminuir significativamente a partir de la primera hora tras el inicio de la terapia (p=0,01), mientras que en la cohorte OAF-10 dicha diferencia significativa se alcanza a partir de las 6h (p=0,03) (tabla 3).
Evolución de la frecuencia respiratoria y la frecuencia cardiaca en las siguientes horas de iniciar OAF en función del flujo utilizado
| Tiempo (horas) | FR (Grupo OAF 10l/min) | p | FR (Grupo OAF 15l/min) | p | FC (Grupo OAF 10l/min) | p | FC (Grupo OAF 15l/min) | p |
|---|---|---|---|---|---|---|---|---|
| 0 | 51 (46-58) | 58 (50-70) | 160 (140-170) | 155 (145-161) | ||||
| 1 | 49 (44-62) | 0,93 | 53 (40-62) | 0,01 | 143 (129-156) | <0,01 | 136 (125-149) | <0,01 |
| 3 | 50 (43-56) | 0,37 | 48 (44-54) | 0,04 | 139 (122-160) | <0,01 | 142 (131-162) | 0,04 |
| 6 | 43 (40-50) | 0,03 | 48 (39-58) | 0,04 | 132 (115-146) | <0,01 | 135 (121-143) | 0,01 |
| 12 | 40 (38-52) | 0,15 | 46 (38-56) | <0,01 | 134 (121-147) | <0,01 | 130 (118-146) | <0,01 |
| 24 | 41 (34-46) | 0,03 | 44 (34-48) | <0,01 | 129 (112-140) | <0,01 | 123 (106-137) | <0,01 |
FC: frecuencia cardiaca; FR: frecuencia respiratoria; OAF: oxigenoterapia de alto flujo.
Los valores se expresan como medianas y P25-P75 rangos intercuartílicos.
Las variables FR y FC se analizaron con el test de Mann-Whitney.
En la cohorte OAF-10 el porcentaje global de descenso de FR en las primeras 3h fue del 2% (de 51 a 50rpm) y en las primeras 24h fue del 19% (de 51 a 41rpm), en tanto que en la cohorte OAF-15 dicho descenso fue del 18% en las primeras 3h (de 58 a 48rpm) y del 24% en las primeras 24h (de 58 a 44rpm). Por tanto, en la cohorte OAF-15 se produjo una reducción de la FR mayor y más rápida que la cohorte OAF-10 (fig. 3).
Respecto a la FC, en ambas cohortes se produjo una disminución significativa desde la primera hora de inicio del OAF (p<0,01) (tabla 2, fig. 3), y lo mismo ocurrió con el WDF-S, que mejoró significativamente en ambas cohortes en las primeras 24h (p<0,01).
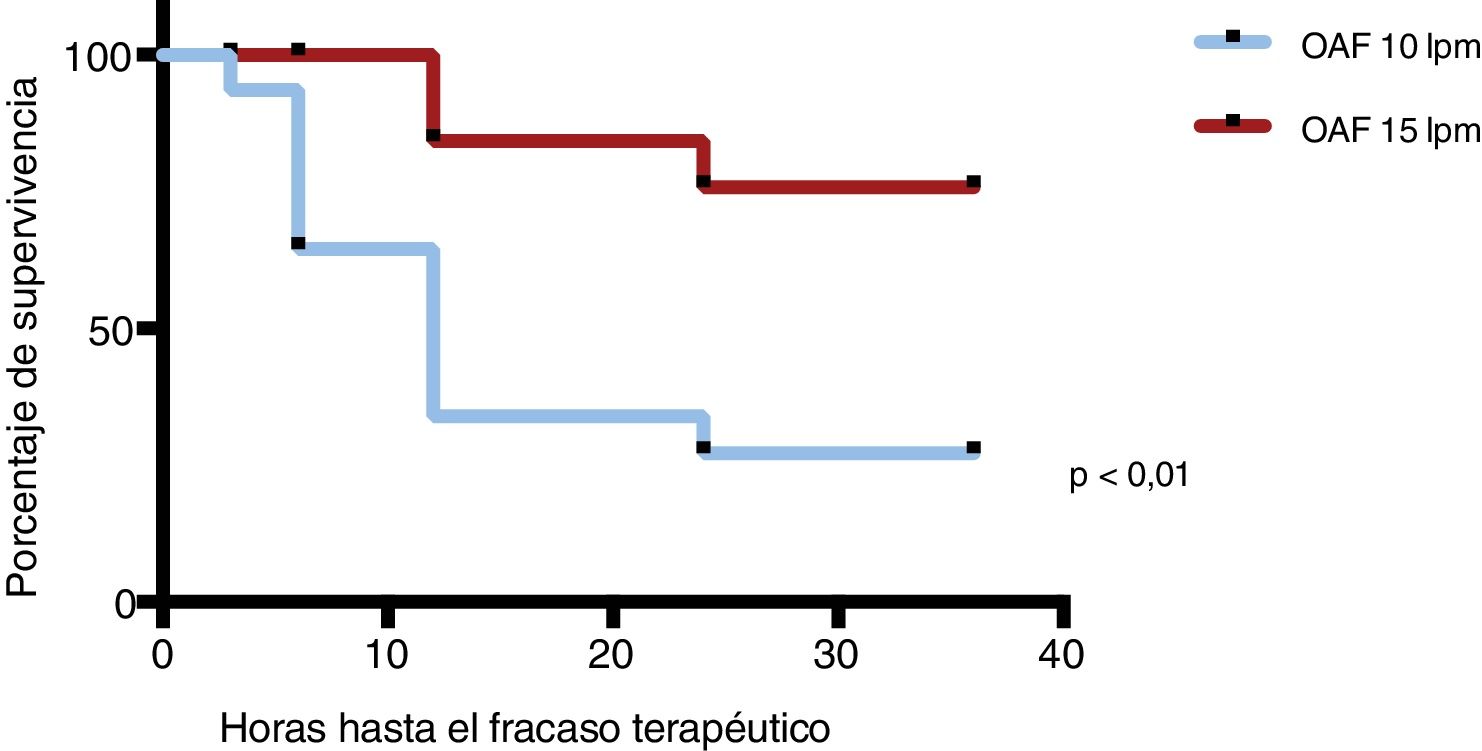
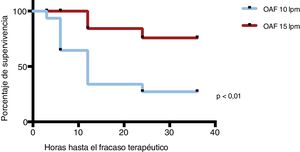
En lo referente al fracaso terapéutico, en la cohorte OAF-10 el porcentaje de fracaso terapéutico fue del 71%, frente al 15% en OAF-15 (p<0,01) (fig. 2). Globalmente, el fracaso terapéutico ocurrió predominantemente entre las 12-24h del inicio de la terapia. En la cohorte OAF-10 ocurrió más temprano, a las 6-12h de iniciar la OAF. En el análisis de supervivencia de Kaplan-Meier encontramos que los pacientes de la cohorte OAF-10 que fracasaron lo hicieron antes que los pacientes de la cohorte OAF-15 (p<0,01) (fig. 3). El paciente intubado fue de la cohorte de 10l/min.
En la cohorte OAF-10 (n=31) la terapia fue eficaz en el 29% (n=9) de los pacientes, que no precisaron en ningún momento incremento del flujo y que finalizaron su tratamiento en las PHP, pero fracasó en 22 pacientes (71%). En los pacientes de la cohorte OAF-10 en los que fracasó el tratamiento, 14 (64%) necesitaron aumentar el flujo hasta 15l/min por ausencia de mejoría en las primeras horas de tratamiento pero continuaron tratamiento en planta de hospitalización, y 8 (36%) ingresaron en la UCIP (fig. 2).
En la cohorte OAF-10 la terapia fracasó por aparición de pausas de apnea en 3 pacientes (13,5%), por aumento de FR, FC o SatO2 en el 73% (16/22) o por descenso insuficiente de FR, FC o SatO2 en el 13,5% (3 pacientes). Los 8 pacientes que precisaron ingreso en la UCIP fueron los 3 que comenzaron con pausas de apnea y 5 de los que presentaron incremento de los parámetros de gravedad a pesar del OAF (fig. 2).
En la cohorte OAF-15 (n=26) la terapia fue eficaz en el 85% de los pacientes, que terminaron su tratamiento con OAF en la PHP, y solamente en 4 pacientes (15%) de OAF-15 precisaron traslado a la UCIP, ya que en la PHP el flujo máximo que se permite es de 15l/min (fig. 2). En esta cohorte OAF-15 el fracaso terapéutico en todos los casos fue por empeoramiento de la FR, la FC o la SatO2 en las primeras 24h del inicio, y en ningún caso presentaron pausas de apnea durante el tratamiento en planta.
Estudio multivarianteEn el primer modelo de regresión logística el fracaso terapéutico fue la variable dependiente, y encontramos que la menor edad (odds ratio [OR]=0,84 (IC95%: 0,75-0,95), p<0,01) y la cohorte OAF-10 al inicio del tratamiento (OR=26,80 (IC95%: 4,83-150), p<0,01) son las dos covariables que predicen el fracaso terapéutico (tabla 4).
En el segundo modelo de regresión logística se consideró como variable dependiente el ingreso en la UCIP. En este modelo encontramos que solamente la menor edad (OR=0,82 (IC95%: 0,68-0,99), p=0,04) fue la covariable que explica la necesidad de ingreso en la UCIP en nuestra cohorte (tabla 4).
Los valores de R2 de Nagelkerke, de AIC y BIC de los tres modelos se recogen en la tabla 4.
DiscusiónEl objetivo principal de este estudio fue definir el flujo inicial más adecuado de la OAF en las PHP en niños con bronquiolitis, así como evaluar la seguridad de esta modalidad de oxigenoterapia en este ámbito. En primer lugar, confirmamos que la OAF en las bronquiolitis en las PHP es una terapia eficaz que mejora los parámetros de gravedad en las primeras horas de tratamiento, es una terapia segura, ya que no encontramos efectos secundarios reseñables, y nuestros hallazgos sugieren que el flujo inicial con 15l/min proporciona una mejoría más temprana de la FR y tiene menos proporción de fracaso terapéutico que la terapia inicial con 10l/min (tabla 4)
Análisis multivariante
| Predictores | Fracaso terapéutico*, OR (IC95%) | p | UCIP**, OR (IC95%) | p |
|---|---|---|---|---|
| Edad | 0,84 (0,75-0,95) | <0,01 | 0,82 (0,68-0,99) | 0,04 |
| Score gravedad | 3,20 (0,84-13,7) | 0,09 | 2,08 (0,72-6,00) | 0,17 |
| Enfermedad de base | 0,32 (0,03-2,77) | 0,30 | 0,46 (0,05-3,65) | 0,46 |
| OAF inicio (10/15lpm) | 26,8 (4,83-150) | <0,01 | 2,22 (0,46-10,1) | 0,31 |
| Peso (kg) | 0,86 (0,60-1,23) | 0,42 | 0,92 (0,61- 1,36) | 0,67 |
AIC: Akaike informative criterion; BIC: Bayesian informative criterion; IC: intervalo de confianza; OAF: oxigenoterapia de alto flujo; OR: odds ratio; UCIP: unidad de cuidados intensivos pediátricos.
La edad, el peso y el score de gravedad fueron analizadas como variables continuas, en tanto que la presencia o no de enfermedad de base y el flujo de inicio se analizaron como variables dicotómicas. Entre las variables dependientes, el fracaso terapéutico y el ingreso en UCIP fueron variables dicotómicas (regresión logística). Los resultados resaltados en negrita indican significación estadística. * y ** indican la bondad del ajuste de cada modelo.
Existe un número creciente de artículos que confirman el beneficio de la OAF en las PHP en diferentes patologías respiratorias como bronquiolitis, asma, laringitis u otras causas de insuficiencia respiratoria2,9-13. Sin embargo, todavía existen algunos aspectos en discusión, como pueden ser el flujo inicial idóneo o el mejor momento para iniciar la administración de la terapia, lo que se demuestra por la diversidad de protocolos de trabajo8.
Debido a la falta de consenso en lo referente al cálculo del flujo inicial, algunos autores lo estiman según criterios clínicos como la edad, el peso o la escala de gravedad. Existen estudios en los que se utilizó un flujo entre 2-8l/min y posteriormente se ajustó individualmente en función del trabajo respiratorio y de la SatO2. Muchos estudios estiman el flujo inicial por el peso, generalmente 2l/kg/min, lo que parece que produce un grado adecuado de distensión alveolar y disminuye el trabajo respiratorio8,14-21, con un máximo de 8-12l/min, y algún estudio utiliza flujos de 1-3l/kg/min pero con un máximo de 8l/min, sin efectos adversos17. La mayor parte de estos estudios, algunos realizados en PHP, utilizan un flujo máximo de 10l/min, siendo la terapia segura8,15,22-24. No hemos encontrado ningún estudio que utilice 15l/min en las PHP, aunque algunos autores sugieren que flujos más altos de los habituales (10l/min) podrían ser útiles24.
En nuestro estudio, en los pacientes tratados desde el principio con 15l/min la FR empieza a disminuir significativamente desde la primera hora del tratamiento, mientras que en la cohorte de lactantes tratados inicialmente con 10l/min dicho descenso ocurre a partir de las 6h, lo que retrasa la mejoría del paciente. Asimismo, dentro de la cohorte de OAF-15 se produjo una reducción de la FR mayor que en la cohorte de OAF-10. Se produjo una mejoría significativa de FC y WDF-S, sin observarse diferencias entre ambas cohortes. Es importante señalar que en ninguna cohorte se objetivaron efectos secundarios relevantes, por lo que nuestros resultados sugieren que empezar la OAF a 15l/min en lactantes con bronquiolitis —fuera del periodo neonatal, y hasta que se desarrollen más ensayos clínicos al respecto con precaución hasta que el paciente adquiera 5-7kg— permitiría una mejoría más rápida y con mayores probabilidades de éxito terapéutico.
En algunos estudios realizados en la UCIP, hasta el 25% de los pacientes tratados con OAF presentaron fracaso terapéutico y precisaron mayor asistencia respiratoria16,25. La edad y el peso del paciente son factores en discusión, ya que mientras para algunos autores no se asocia con fracaso, para otros sí26. Hay otros factores clínicos, como SatO2, pCO2 y el score de gravedad, que se han intentado relacionar con el fracaso terapéutico sin resultados definitivos26-28. En nuestro estudio, ni la WDF-S ni el peso de los pacientes se asociaron con fracaso terapéutico, pero sí la edad.
El fracaso terapéutico en nuestro trabajo ocurrió entre las primeras 12-24h, y la cohorte OAF-10 fracasó hasta el 50% en las primeras 12h. En otros estudios el fracaso ocurrió en las primeras 6-12h15,26,29, lo que sugiere que optimizar el tratamiento en las primeras horas puede tener un impacto directo en la efectividad de la técnica.
Nuestro estudio tiene una serie de limitaciones. Se trata de un estudio preliminar, unicéntrico, con una n relativamente pequeña. No se trata de un ensayo clínico aleatorizado, sino que la asignación se ha hecho según la práctica clínica del facultativo encargado del paciente.
Además, no se ha realizado capnografía. Sin embargo, hemos obtenido datos importantes que sugieren que sería interesante plantear un ensayo clínico multicéntrico, aleatorizado y ciego para confirmar dichos hallazgos.
En conclusión, el uso de OAF en el tratamiento de la bronquiolitis en las PHP fue segura y eficaz, y los datos de nuestro estudio sugieren que utilizar desde el inicio flujos altos, a 15l/min, disminuye antes los parámetros clínicos de gravedad y tiene menor proporción de fracaso terapéutico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al personal de enfermería, a los pacientes y a sus familias.