La anemia falciforme, fenotipo FS, es la más común de las hemoglobinopatías estructurales. Es un trastorno hereditario causado por la presencia de hemoglobina S (HbS), resultado de una mutación puntual que afecta al codón 6 de la cadena betaglobina. En condiciones de hipoxia, se produce la polimerización de la HbS y da lugar a crisis vasoclusivas y a anemia hemolítica.
Debido a que los fenómenos de inmigración han aumentado considerablemente en España y a que la mayoría de los inmigrantes pertenecen a poblaciones de riesgo para distintas hemoglobinopatías, nuestro objetivo es determinar la incidencia de la anemia falciforme y de otras hemoglobinopatías estructurales en los recién nacidos de esta Comunidad Autónoma (Islas Baleares), mediante un estudio piloto no relacionado y evaluar la necesidad de incluir esta enfermedad dentro del programa de cribado neonatal.
Material y métodosPara esto, se ha utilizado el mismo espécimen de sangre capilar usado para la detección precoz de hipotiroidismo congénito, fenilcetonuria y fibrosis quística. La separación de variantes de hemoglobina (Hb) se llevó a cabo mediante cromatografía líquida de alta resolución y se utilizó el sistema automático Variant® (Bio-Rad).
ResultadosLa incidencia global de variantes de Hb ha sido de 9,9 por cada 1.000 recién nacidos analizados, con una incidencia de anemia falciforme (fenotipo FS) de uno cada 6.756 casos analizados y de portadores (fenotipo FAS) de uno cada 199 casos.
ConclusionesTanto la tasa global de variantes observadas como la incidencia de rasgo falciforme justifican plantearse la inclusión del estudio de hemoglobinopatías en el programa de cribado neonatal de la Comunidad.
Sickle cell disease (SCD) describes a group of inherited disorders caused by the presence of the sickle haemoglobin (HbS) which results from a point mutation affecting codon 6 of the β globin chain (β codon 6, Glu 6 Val).
The pathophysiology involves polymerisation of HbS under low oxygen conditions causing vaso-occlusion and chronic haemolysis and anaemia.
Due to increase in immigrants within our population and the majority of this group being a risk population for different haemoglobinopathies, the aim of our study is to determine the incidence of SCD and others structural haemoglobinopathies in the neonatal population of the Balearic Islands Autonomous Community, by means of an unrelated pilot study and determine the need to include this pathology in a newborn screening program.
Material and methodsThe study was performed with the same blood spot specimen dried on filter paper used for congenital hypothyroidism, phenylketonuria and cystic fibrosis screening. High-performance liquid chromatography (HPLC), using the VARIANTs (Biorad) automated system, was used to detect variants haemoglobin variants.
ResultsThe overall incidence was 9.9 per 1000 specimens. The incidence of SCD was 1/6756 (FS) and the incidence of sickle cell traits was 1/199 (FAS).
ConclusionThese results confirm the need to include screening for SCD and other haemoglobinopathies in our neonatal screening program.
Las alteraciones de la hemoglobina (Hb), o hemoglobinopatías, son un grupo de trastornos genéticos, autosómicos recesivos, con alto grado de morbimortalidad, que se producen por alteraciones relacionadas con la síntesis y la estructura de la Hb. Son una de las enfermedades genéticas más frecuentes en todo el mundo. Pueden clasificarse en 2 grandes grupos: talasemias (alteraciones cuantitativas), en las que hay un defecto de síntesis de al menos una de las cadenas de globina, que son estructuralmente normales, y las hemoglobinopatías estructurales (alteraciones cualitativas), en las que se sintetiza una cadena de globina anormal1,2. Suponen el error congénito más común en algunas poblaciones procedentes de África, el área mediterránea, el Caribe, América Central y América del Sur. No obstante, debido a los movimientos de población dados en los últimos años, su incidencia está aumentando mundialmente1, sobre todo en el sur y noroeste de Europa3.
En las talasemias, al producirse la deficiencia de una o más cadenas polipeptídicas de la molécula de Hb, se producen diversos grados de anemia crónica. Tienen una frecuencia variable según las zonas geográficas: tiene una especial predilección por las poblaciones mediterráneas en el caso de la betatalasemia y por las zonas de Oriente Medio, Sudeste Asiático y China en el caso de la alfatalasemia.
Las hemoglobinopatías estructurales son fruto de mutaciones de los genes que codifican las cadenas de globina, por lo que según sea el tipo de aminoácido alterado y el lugar que ocupe en la cadena pueden variar las propiedades fisicoquímicas de ésta. Las hemoglobinopatías estructurales más ampliamente extendidas por toda la geografía mundial son la Hb S (HbS) en África tropical y subtropical, la Hb C (HbC) en el Oeste de África, la Hb E (HbE) en el Suroeste de Asia y la Hb D (HbD) en Punjab, la India.
La anemia de células falciformes, o anemia drepanocítica, se caracteriza por la presencia de HbS y es consecuencia de una mutación puntual del sexto codón del exón 1 del gen de la betaglobina, localizado en el cromosoma 11. Esto se traduce en drásticas alteraciones en la estabilidad molecular y la solubilidad de la HbS que, en condiciones de hipoxia, tiende a formar polímeros insolubles que provocan la formación de hematíes falciformes, ocluyen los vasos y provocan crisis vasoclusivas, que pueden afectar a diferentes órganos4, a la vez que producir una anemia hemolítica por destrucción prematura de los hematíes5,6. El genotipo condiciona la gravedad clínica de la enfermedad, y se manifiesta en los individuos homocigotos (Hb SS) o en dobles heterocigotos para HbS con otra Hb anormal que afecte a la cadena de la betaglobina (Hb SC, Hb SD, HbS y betatalasemia) con distinta expresividad clínica. Puede ser que los heterocigotos no presenten manifestaciones clínicas, salvo en situaciones críticas, por lo que no deben considerarse enfermos7.
La detección precoz de hemoglobinopatías se inició en la década de 1980 en algunos estados de los EE. UU. a raíz de la inmigración procedente del norte de África e iba dirigida a estos colectivos de riesgo, pero en 1987 el Instituto Americano de Salud (ANHI) ya recomendó el cribado universal de la anemia falciforme8.
En los últimos años, debido al aumento de los fenómenos migratorios, se ha ido incorporando como parte de los programas de cribado neonatal en algunos países en los que la incidencia de estas enfermedades comienza a ser un problema de salud pública, como Reino Unido, Francia y Bélgica. El objetivo principal de estos programas es identificar aquellos recién nacidos afectados de una hemoglobinopatía clínicamente grave y evitar, en lo posible, la morbimortalidad que se produce en estos pacientes9,10.
En España, donde todas las Comunidades Autónomas disponen de un programa de cribado neonatal, el cribado de anemia falciforme sólo está implantado en 2 de éstas. El grupo de Dulín et al11 realizó en la Comunidad de Madrid el primer estudio preliminar sobre su incidencia. A éste lo siguió un estudio piloto, publicado en 200312 y a raíz del que decidieron ampliar el programa de cribado de su Comunidad para la detección de hemoglobinopatías. En el año 2006 se publicó otro estudio realizado en una cohorte del Hospital Clínico San Carlos de Madrid13 y otro realizado en Cataluña14, que distingue 2 grupos de poblaciones (una población autóctona y una población de inmigrantes) y que demuestra que el cambio poblacional al que se asiste deberá tenerse en cuenta en estos programas.
Está fuera de toda duda que la detección precoz de la anemia de células falciformes reduce la morbimortalidad de los neonatos a los que se les realiza el cribado15, pero uno de los dilemas que plantea es si este cribado ha de ser universal o selectivo7,16, es decir si es dirigido únicamente a recién nacidos procedentes de áreas con elevada prevalencia de estas enfermedades.
El objetivo de este estudio es determinar la prevalencia de la anemia falciforme y de otras hemoglobinopatías estructurales mediante un estudio piloto anónimo y no relacionado en la población neonatal de la Comunidad Autónoma de las Islas Baleares, ya que en los últimos años los fenómenos de inmigración han aumentado considerablemente en esta región.
Material y métodosSujetosSe han incluido en el estudio un total de 6.756 recién nacidos procedentes de todos los hospitales, tanto públicos como privados, del ámbito de la Comunidad. Este tamaño muestral corresponde al 57% de los cribados realizados durante el año 2007. Se ha utilizado el mismo espécimen de sangre capilar que se obtiene por punción del talón del recién nacido para la detección precoz de hipotiroidismo congénito, fenilcetonuria y fibrosis quística. Las muestras se seleccionaron de forma aleatorizada entre todas las que llegaron al Laboratorio de Neonatal del Hospital Universitario de Son Dureta durante 6 meses (2007) y de forma totalmente anónima, por lo que se desconocía el país de origen. El único criterio de inclusión en el estudio fue tener realizado, previamente, el análisis para el cribado de hipotiroidismo congénito, fenilcetonuria y fibrosis quística.
ProcedimientoSe taladra un disco de 3mm de diámetro de la sangre sobrante de la tarjeta mediante un cortador automático y se lo deposita sobre una microplaca de 96 pocillos.
Se añaden 250μl de agua desionizada y se agita durante 10min en agitador horizontal a temperatura ambiente hasta que libera la Hb. La placa se introduce en el inyector automático y se inyectan 5μl del eluato en la columna para realizar la cromatografía.
Análisis de variantes de la hemoglobinaLa separación de variantes de la Hb se lleva a cabo mediante cromatografía líquida de alta resolución, con la utilización del sistema automático Variant® (Bio-Rad). La columna utilizada es de intercambio catiónico con un gradiente preprogramado que va incrementando la fuerza iónica de la fase móvil, que es capaz de separar las variantes de Hb existentes. El tiempo de retención, característico de cada variante, es el tiempo que transcurre desde que se inyecta la muestra hasta que se obtiene el punto máximo de cada pico. La detección se realiza espectrofotométricamente a una longitud de onda de 415/690nm.
Este método es capaz de separar e identificar las siguientes variantes de Hb: Hb fetal (HbF), Hb glucosilada, Hb en adultos (HbA), Hb A2 (HbA2), HbE, Hb falciforme (S), HbC y HbD.
En todas las microplacas se procesan 2 controles de calidad interno. El control 1 contiene las HbF, las HbA, las HbA2, las HbE y las HbS, y el control 2 contiene las HbF, las HbA, las HbD y las HbC.
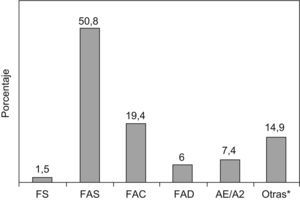
ResultadosSe han analizado un total de 6.756 recién nacidos de las distintas islas del Archipiélago Balear. El total de casos detectados con alguna variante hemoglobínica ha sido 67 (9,9 de cada 1.000 casos), de los cuales uno (0,15 de cada 1.000 casos) se clasificó como homocigoto para la HbS (anemia falciforme) con fenotipo neonatal FS, y 34 casos (5 de cada 1.000) fueron portadores de HbS (rasgo falciforme) con fenotipo neonatal FAS. De los 32 casos restantes, 13 casos fueron portadores de HbC (FAC), 4 casos fueron portadores de HbD (FAD) y 5 casos fueron posibles portadores de HbE (FAE y HbA2) (tabla 1).
Incidencia de variantes de hemoglobina en recién nacidos de la Comunidad Autónoma de las Islas Baleares
| Variantes de Hemoglobina (n: 67) | Número de recién nacidos (n: 6.756) | Incidencia |
| FS | 1 | 1/6.756 |
| FAS | 34 | 1/199 |
| FAC | 13 | 1/520 |
| FAD | 4 | 1/1.689 |
| FAE/A2 | 5 | 1/1.351 |
| FA más otras* | 10 | 1/676 |
También se detectó en 10 casos un pico que no se correspondía con ninguna de las variantes anteriores (3 fenotipos FAXE y HbA2 y 7 fenotipos FAX). La figura 1 representa la distribución de las distintas variantes estructurales de Hb encontradas en recién nacidos de las Islas Baleares.
Por tanto, la incidencia global de anemia falciforme (fenotipo FS) en la Comunidad es de uno cada 6.756 recién nacidos analizados y la incidencia global de rasgo falciforme (fenotipo FAS) es de uno cada 199 recién nacidos analizados.
DiscusiónA pesar de las múltiples variantes en la estructura de la Hb, sólo 3 grupos (la alfatalasemia, la beta talasemia y la anemia de células falciformes) son un problema de salud pública. El diagnóstico precoz de estas enfermedades y el tratamiento profiláctico reduce de forma significativa las muertes asociadas y las complicaciones, lo que supone un reto para los hematólogos9.
En España es poca la información contrastada sobre la verdadera incidencia de las diferentes formas de hemoglobinopatías (tabla 2)10–12,14,17.
Estudios realizados en España sobre cribado de hemoglobinopatías estructurales
| Autor y año | Localización y población seleccionada | Tamaño muestral | Incidencia de anemia falciforme y rasgo drepanocítico | Observaciones |
| Cela De Julián, 2007 | Madrid Universal | 190.238 | Homocigotos: 1/7.316 (0,14/1.000) | Estudio prospectivo de los 32 primeros meses de implantación del programa de cribado neonatal |
| Heterocigotos: 1/259 (3,9/1.000) | ||||
| Dulín, 2006 | Madrid Universal | 154.149 | Homocigotos: 1/6.165 (0,16/1.000) | Estudio prospectivo de los 24 primeros meses de implantación del programa de cribado neonatal |
| Heterocigotos: 1/294 (3,4/1.000) | ||||
| Manu-Pereira, 2006 | Cataluña Selectivo | Población autóctona: 1.569 | Homocigotos en población autóctona: no se detectan | El estudio se realizó en recién nacidos de población autóctona y población inmigrante |
| Población inmigrante: 1.620 | Homocigotos en población inmigrante: 1/810 (1,23/1.000) | |||
| Dulín, 2003 | Madrid Universal | 29.253 | Homocigotos: 1/5.851 (0,17/1.000) | Estudio piloto en recién nacidos |
| Heterocigotos: 1/412 (2,4/1.000) | ||||
| Dulín, 1997 | Madrid Universal | 3.550 | Homocigotos: no se detectan | Estudio piloto en recién nacidos |
| Heterocigotos: 1/710 (1,4/1.000) | ||||
| En este estudio | Islas Baleares Universal | 6.756 | Homocigotos: 1/6.756 (0,15/1.000) | Estudio piloto en recién nacidos |
| Heterocigotos: 1/199 (5/1.000) |
Ya en 1997, Dulín et al presentaron en la XXXIX Reunión Nacional de la AEHH y en el XIII Congreso de la SETH un estudio preliminar sobre el cribado neonatal de hemoblobinopatías en la Comunidad de Madrid, en el que encontraron una incidencia de rasgo falciforme de uno cada 710 recién nacidos analizados, sin ningún homocigoto y sugirieron realizar un estudio piloto que ampliara el número de muestras. En este estudio publicado en 200312 encontraron una incidencia de anemia falciforme de uno cada 5.851 casos y una incidencia de rasgo falciforme de uno cada 412 casos. En Cataluña, en un estudio selectivo, encontraron una incidencia de anemia falciforme de una cada 810 muestras analizadas en la población inmigrante y ningún caso en la población autóctona14, por lo que sugieren limitar el cribado de anemia falciforme a la población de riesgo. En la Comunidad de Madrid han realizado un estudio retrospectivo de los 3 primeros años de implantación del programa de cribado de hemoglobinopatías, que ha permitido en un tamaño muestral de 190.238 recién nacidos detectar 1.060 variantes de Hb y de éstas 26 casos graves de HbS en homocigosis (uno de cada 7.316) y 732 casos en heterocigosis (uno de cada 259)17. Al comparar estos datos con los obtenidos en este estudio, se observa una incidencia ligeramente superior, tanto de homocigotos (uno de cada 6.756) como de heterocigotos (uno de cada 199) para HbS en la Comunidad, resultados que pueden deberse a la diferencia del tamaño muestral.
En los países desarrollados, el cribado neonatal se configura en el contexto de medidas de medicina preventiva incluidas en los programas de salud pública, que deben conducir a la intervención médica en beneficio del neonato.
Para que una determinada enfermedad se incluya en un programa de cribado neonatal debe cumplir los criterios dictados en 1975 por el Comittee on Screening for Inborn Errors of Metabolism, Genetic Screening18, que consta de los 6 puntos siguientes: a) la enfermedad cursa con morbilidad mental o física grave o mortalidad si no se diagnostica en el período neonatal; b) un simple examen físico no identifica la enfermedad en este período; c) hay un tratamiento efectivo disponible; d) el tratamiento precoz mejora significativamente el pronóstico; e) la enfermedad tiene una incidencia relativamente elevada, superior a uno de cada 10.000 a 15.000 recién nacidos, y f) hay un test analítico de cribado, rápido, sencillo, fiable y de bajo coste.
El cribado de hemoglobinopatías en la Comunidad cumple estos criterios. Así, tanto la tasa global de variantes observadas como la incidencia de rasgo falciforme justifican plantearse la inclusión del estudio de hemoglobinopatías en el programa de cribado neonatal de la Comunidad y evitar la morbimortalidad con tratamientos preventivos de las crisis19 o con trasplante alogénico de médula ósea20, tras el que un 85% sobrevive curado de la enfermedad21.
Un tema para debatir es si debería ser selectivo o no. Si se tiene en cuenta que la mortalidad en niños menores de 5 años ronda el 30%, que por esto el ANHI ya en 1987 recomendó realizar el cribado de anemia falciforme de forma universal8 y que algunos grupos consideran ineficaz el cribado selectivo frente al cribado universal22,23, los autores de este artículo piensan que debería realizarse a toda la población, sobre todo si se tiene en cuenta la alta tasa de inmigración y los antecedentes históricos.
A los técnicos de laboratorio Carmen Toral (DUE) y Antonia Pardo (TEL).
Financiación: el laborario Bio-Rad cedió el analizador de cromatografía líquida de alta resolución Variant® mientras duró el estudio y colaboró con varios lotes de reactivo. El Real Patronato sobre Discapacidad (Ministerio de Trabajo y Asuntos Sociales) abonó los restantes. La Asociación Española de Cribado Neonatal (AECNE) gestionó esta ayuda.