Introducción
Epidemiología
La epidemiología del asma en España se conoce bien en los niños de más de 6 años, pero no hay estudios por debajo de esa edad. A diferencia de los países sajones, la prevalencia del asma en España es relativamente baja: aproximadamente un 9 % de los niños de 13-14 años reconocen haber tenido síntomas durante el año anterior, y el 10 % de padres de niños de 6-7 años informan que sus hijos han padecido sibilancias en el mismo período. Esta prevalencia ha permanecido constante en los niños mayores entre 1994 y 2002, mientras que ha aumentado ostensiblemente (de 7 a 10 %) en los niños de 6-7 años. Las sibilancias graves son mucho menos frecuentes en ambas edades (en torno al 2 %) aunque también han aumentado en el grupo de 6-7 años, mientras se mantienen en el grupo de 13-14 años. En estas edades, parece existir una mayor prevalencia y gravedad del asma en las zonas costeras con respecto a la meseta1-3.
Definición
El asma, en especial en la edad pediátrica, es probablemente un síndrome en el sentido clásico del término4. Es decir, un trastorno caracterizado por síntomas y signos similares, pero de etiología no bien especificada. Por ello es muy difícil enunciar una definición exacta de esta enfermedad.
Desde un punto de vista práctico, la definición más operativa para los pediatras puede ser la del III Consenso Internacional Pediátrico5 que define asma como la existencia de "sibilancias recurrentes y/o tos persistente en una situación en la que el asma es probable y se han descartado otras enfermedades menos frecuentes". Esta definición es más adecuada para el niño lactante y preescolar, en los que en muy pocas ocasiones se puede aplicar una definición más restrictiva de asma, como la siguiente:
"El asma es una enfermedad que se caracteriza clínicamente por episodios de sibilancias, disnea, tos y opresión torácica; fisiológicamente por procesos de obstrucción (generalmente reversible) de las vías aéreas e hiperreactividad bronquial; histológicamente por inflamación crónica de la vía aérea, en la que desempeñen un papel destacado determinadas células y mediadores; e inmunológicamente, en muchos casos, por la producción de anticuerpos IgE frente a algunos alérgenos ambientales". Ninguno de estos hechos es específico ni obligatorio del asma.
En este documento, se pretende distinguir entre "sibilancias recurrentes" y "asma", dejando el último término para aquellas situaciones en las que se dan las circunstancias antes mencionadas.
Sibilancias recurrentes: fenotipos
Aunque la fisiopatología del asma en la infancia está lejos de ser comprendida, parecen existir diferentes fenotipos clínicos de esta enfermedad que han sido bien caracterizados en diversas cohortes en varios países6-17. Son grupos heterogéneos con un componente común caracterizado por obstrucción bronquial recurrente con sibilancias. Aún con cierta cautela, es posible aplicar estos fenotipos a la población española. Este documento pretende establecer la mejor pauta de tratamiento para cada fenotipo de acuerdo con las evidencias científicas disponibles. La definición exacta de estos fenotipos es, por consiguiente, básica:
1. Sibilancias precoces transitorias:
a) El primer episodio se inicia generalmente antes de primer año y tiende a desaparecer a los 3 años. Supone entre el 40 y 60 % de todos los casos de sibilancias recurrentes del lactante.
b) No son atópicas (IgE total normal y/o pruebas cutáneas y/o IgE específica negativas, junto con ausencia de antecedentes personales o familiares atópicos).
c) Función pulmonar disminuida al nacimiento que mejora con el tiempo, aunque sus valores medios persisten bajos a los 16 años17.
d) Estudios de hiperreactividad bronquial y variabilidad del flujo espiratorio máximo (PEF) a los 11 años negativos.
e) Factores de riesgo: tabaquismo materno durante la gestación, sexo varón, prematuridad, convivencia con hermanos mayores y/o asistencia a guardería.
2. Sibilancias persistentes no atópicas:
a) Comienzan antes de los 3 años de vida (generalmente antes del primero y en relación con una bronquiolitis por virus respiratorio sincitial) y siguen persistiendo a los 6 años. Suponen alrededor de un 20 % de las sibilancias recurrentes del lactante.
b) Afectan por igual a ambos sexos.
c) IgE total normal y pruebas cutáneas negativas, sin estigmas ni antecedentes familiares atópicos.
d) La función pulmonar es normal al nacimiento y disminuida a los 6 y a los 11 años. Existe una buena respuesta al broncodilatador. Presentan hiperreactividad bronquial que va disminuyendo con la edad.
e) Suelen desaparecer a los 13 años.
3. Sibilancias atópicas:
a) Suponen alrededor del 20 % y el primer episodio suele aparecer después del año.
b) Predominio en varones.
c) IgE total elevada y/o pruebas cutáneas positivas, generalmente con rasgos y antecedentes familiares atópicos.
d) Función pulmonar normal al nacer con descenso hasta los 6 años, y posterior estabilización por debajo de la normalidad.
e) Existe hiperreactividad bronquial.
f) Suelen persistir a los 13 años.
Predicción del fenotipo asmático
Desde un punto de vista práctico, es importante intentar clasificar a un determinado niño que comienza en los primeros años con episodios sibilancias en un determinado fenotipo, con el fin de establecer un pronóstico. Los niños que presentan sibilancias recurrentes frecuentes por debajo de 3 años y cumplen al menos un criterio mayor o dos de los tres menores indicados a continuación, tendrá una probabilidad alta de padecer en el futuro un asma persistente atópica basándose en el algoritmo Índice Predictivo de Asma (IPA)18.
1. Criterios mayores:
a) Diagnóstico médico de asma en alguno de los padres.
b) Diagnóstico médico de eccema atópico.
2. Criterios menores:
a) Presencia de rinitis alérgica diagnosticada por un médico (a los 2-3 años).
b) Sibilancias no relacionadas con resfriados.
c) Eosinofilia en sangre periférica igual o superior al 4 %.
Los niños que cumplen el IPA, al llegar a los 6-13 años, tienen un riesgo 4,3 a 9,8 veces superior (odds ratio, OR) de tener asma activo que los que presentan un índice negativo. A la edad de 6 años el IPA tiene un valor predictivo positivo del 47 % (probabilidad de los niños con IPA positivo de tener asma en la edad escolar) y un valor predictivo negativo del 91 % (probabilidad de que los niños con IPA negativo no tengan asma en la edad escolar).
Estudios recientes han demostrado que la presencia de IgE específica frente al huevo durante el primer año de vida es un indicador de enfermedad atópica, siendo el principal y más precoz marcador serológico de una posterior sensibilización a alérgenos inhalantes y de desarrollo de patología alérgica respiratoria. Además, cuando la sensibilización al huevo se asocia a eccema atópico la probabilidad de presentar a los 4 años patología alérgica respiratoria se eleva al 80 %19-21.
Valoración del niño con sibilancias recurrentes
Menores de 3 años
Las sibilancias son un signo muy frecuente en este grupo de edad y aparecen en una gran cantidad de procesos con manifestaciones clínicas similares pero que varían en su etiología, pronóstico y respuesta al tratamiento.
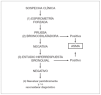
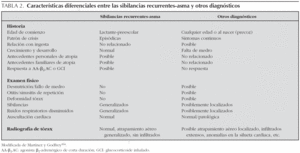
Por otro lado, determinados datos clínicos como el inicio de la sintomatología en el período neonatal, falta de medro, síntomas relacionados con la alimentación, vómitos, anomalías cardiovasculares, o historia familiar de enfermedad pulmonar sugieren una etiología diferente al asma. En el análisis de los posibles diagnósticos diferenciales resulta útil la separación por grupos de edad. Teniendo en cuenta que puede haber superposición entre los grupos, la división sólo debe servir de guía orientativa (tabla 1). La valoración conjunta de todos estos datos es lo que va a ayudar a orientar la actuación del pediatra (tabla 2).
En los niños con episodios recurrentes de sibilancias, en cuya historia o exploración clínica no existan datos que sugieran la existencia de otra patología subyacente, el número de exploraciones complementarias que se necesitan es bastante limitado. Se recomienda una radiografía simple de tórax y, en aquellos sin criterios mayores de IPA, recuento de eosinófilos y detección de criterios de atopia.
Mayores de 3 años
Valoración clínica
La historia clínica debe ir encaminada a esclarecer los aspectos más importantes relacionados con el asma, en especial en lo referente al diagnóstico diferencial (tabla 1). Deben constatarse los síntomas y signos y las características de las crisis, valorar los períodos intercrisis e identificar los factores precipitantes y agravantes.
Valoración funcional
La exploración funcional respiratoria sirve para confirmar el diagnóstico de asma, cuantificar la gravedad de la enfermedad, monitorizar la evolución y objetivar la respuesta al tratamiento. En los niños colaboradores debe realizarse mediante espirometría forzada que, por su sencillez y coste, es la prueba principal para objetivar la obstrucción bronquial. No se recomienda la utilización de medidores portátiles del PEF para el diagnóstico funcional de asma. En los niños no colaboradores se pueden utilizar otras pruebas, como pletismografía corporal, oscilometría por impulsos, resistencias por oclusión o compresión toracoabdominal.
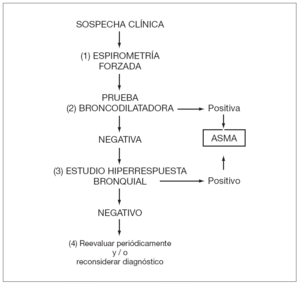
Se debe estudiar la reversibilidad de la obstrucción bronquial y/o el grado de hiperrespuesta. Para ello se utiliza la prueba de broncodilatación y de hiperrespuesta bronquial inespecífica (metacolina, ejercicio, etc.) (ver algoritmo diagnóstico en la fig. 1)22.
Figura 1. Algoritmo para el diagnóstico de asma (modificado de 22).
1. Prueba broncodilatadora:
a) Debe constituir una exploración habitual en todo niño con sospecha de asma, incluso cuando el volumen forzado en el primer segundo (FEV1) sea normal.
b) Consiste en realizar una espirometría forzada basal y repetirla a los 15 min de haber administrado un agonista β2-adrenérgico inhalado de corta duración (salbutamol 400 µg= 4 pulsaciones, o equivalente de terbutalina).
c) Hay distintos métodos o índices para expresar la respuesta broncodilatadora. De ellos, el más utilizado es el cambio porcentual respecto al valor inicial en el FEV1; es decir: Δ % = [(FEV1 post FEV1 pre) / FEV1 pre] × 100. Se considera positivo un incremento del FEV1 de un 12 % sobre el basal o un 9 % sobre el teórico8 (Evidencia C)23. Una función pulmonar normal con prueba broncodilatadora negativa no excluye el diagnóstico de asma.
2. Hiperrespuesta bronquial:
a) Se valora mediante las pruebas de provocación bronquial inespecífica y/o específica (a alérgenos). Habitualmente no son necesarias para el diagnóstico y seguimiento del niño asmático, pero en ocasiones pueden ser muy útiles.
Valoración alergológica
El objetivo de esta valoración es determinar si existe un alérgeno o alérgenos relevantes implicados en la patología del niño con asma. De este modo se podrían adoptar las adecuadas medidas de prevención.
La técnica fundamental en esta valoración son las pruebas cutáneas: el prick test (sencillo, rápido y seguro) que ocasiona algunos falsos negativos, por lo que ante una clínica sugestiva pueden estar indicadas otras pruebas, como la intradermorreacción. En ocasiones es preciso complementarlas con otras técnicas diagnósticas como la determinación de IgE antígeno específica (RAST o ImmunoCAP®). Otras veces puede ser necesaria la prueba de provocación bronquial específica, con el fin de detectar el alérgeno desencadenante implicado.
La positividad de unas pruebas cutáneas o una determinación de IgE específica sólo indica sensibilización alérgica.
Valoración de la inflamación
Cada vez con mayor frecuencia, se empiezan a utilizar los valores de algunos marcadores de la inflamación para el diagnóstico y, sobre todo, para el seguimiento y control del tratamiento del paciente con asma. Empieza a estar muy extendido el uso del óx ido nítrico en aire exhalado (ONE), cuya determinación, desde hace poco tiempo, puede hacerse de forma fácil y ambulatoria24. La medición de mediadores de la inflamación en ese aire exhalado, como interleucinas o interferón gamma, se realiza solamente con fines de investigación.
El recuento de eosinófilos en esputo, el análisis del condensado del aire exhalado y la determinación de ONE pueden servirnos para valorar, mediante métodos no invasivos, la inflamación de las vías aéreas. Los niveles de ONE están elevados en pacientes con asma alérgica en comparación con controles sanos, en especial cuando el asma no está controlada, y se reduce mediante el tratamiento con corticoides inhalados. Ninguno de los marcadores citados es diagnóstico de una enfermedad determinada. En la actualidad se está evaluando su posible utilidad para ajustar un tratamiento óptimo.
La concentraciones de ONE se miden en ppb (partes por billón). Existen diferencias en las cifras de referencia que varían según las publicaciones. Cifras de ONE < 25 ppb en asmáticos asintomáticos justificarían la reducción de los corticoides inhalados y, en pacientes sintomáticos, podrían sugerir la posibilidad de otras causas no alérgicas (rinosinusitis, reflujo gastroesofágico, etc.). Cifras de ONE > 45-50 ppb en pacientes asintomáticos no implican obligatoriamente la necesidad de un aumento terapéutico, ni predicen una próxima exacerbación. En pacientes sintomáticos puede significar: dosis inadecuada de corticoides inhalados, incumplimiento del tratamiento o mala técnica de inhalación; y justificarían la necesidad de aumentar las dosis de estos fármacos. Muy rara vez indica una verdadera resistencia al tratamiento con corticoides inhalados25,26.
Tratamiento del episodio agudo en pediatría
Consideraciones generales
1. El abordaje terapéutico del episodio agudo dependerá de su gravedad.
2. En los escasos protocolos existentes en el lactante, la utilización de fármacos se fundamenta en la experiencia clínica extrapolando los datos obtenidos en los niños más mayores.
3. Sería recomendable que los centros de salud dispusieran de un pulsioxímetro para mejorar la valoración de la gravedad de la crisis de asma.
4. A la hora de tratar el episodio agudo debe tenerse en cuenta:
a) El tiempo de evolución de la crisis.
b) La medicación administrada previamente.
c) El tratamiento de mantenimiento que esté recibiendo.
d) La existencia de enfermedades asociadas.
5. Las crisis leves y moderadas pueden tratarse en Atención Primaria.
6. Deberá derivarse al niño a Urgencias Hospitalarias cuando haya:
a) Crisis grave.
b) Sospecha de complicaciones.
c) Antecedentes de crisis de alto riesgo.
d) Imposibilidad de seguimiento adecuado.
e) Falta de respuesta al tratamiento.
7. Hay que modificar las dosis de los fármacos y los tiempos de administración en relación a la gravedad de la crisis y a la respuesta al tratamiento.
Valoración de la gravedad
La valoración de una crisis asmática se basa fundamentalmente en criterios clínicos, entre los cuales destacan la frecuencia respiratoria, presencia de sibilancias y existencia de retracciones del esternocleidomastoideo, variables que recoge el Pulmonary Score (PS) (tabla 3)27,28. Esta escala de valoración clínica tiene como ventajas su sencillez y aplicabilidad a todas las edades. La saturación de oxígeno determinada mediante pulsioximetría (SpO2), contribuye de manera importante a completar la estimación de la gravedad del episodio.
En la práctica, los síntomas, y la SpO2 se valoran conjuntamente y permiten clasificar a la crisis asmática en leve, moderada y grave (tabla 4).
Fármacos
β2-adrenérgicos de acción corta
Constituyen la primera línea de tratamiento. La vía inhalatoria es la de elección por su mayor efectividad y menores efectos secundarios (Evidencia A).
1. El sistema de inhalador presurizado con cámara espaciadora es tan efectivo, si no más, que los nebulizadores en el tratamiento del episodio agudo de asma29-31 (Evidencia A).
2. Las dosis recomendadas de broncodilatador dependen de la gravedad de las crisis y de la respuesta a las dosis iniciales. El broncodilatador debe administrarse en tandas de 2-10 pulsaciones de 100 mg de salbutamol hasta conseguir respuesta. En las crisis leves una tanda de 2-4 pulsaciones puede ser suficiente y en las crisis graves puede ser necesario administrar hasta 10 pulsaciones32,33.
3. Todas estas recomendaciones no se pueden aplicar al asma de riesgo vital que debe ser tratado con broncodilatadores nebulizados32,33.
Bromuro de ipratropio
En algunos estudios se ha mostrado útil asociado a los agonistas β2 de acción corta en las crisis moderadas y graves, aunque el beneficio es mayor en el niño con asma grave34-36. La evidencia de su uso en lactantes es limitada y contradictoria37-40. La dosis nebulizada es de 250 µg/4-6 h en menores de 30 kg y 500 µg/4-6 h en mayores 30 kg. La dosis con cámara es de 40-80 µg (2-4 pulsaciones)41. El efecto máximo, que no se mantiene, se da en las primeras dosis, por lo que sólo debe usarse en las primeras 24-48 h.
Corticoides
Han mostrado su beneficio cuando se usan precozmente42,43 (Evidencia B) siendo la vía oral la de elección, frente a la parenteral44,45. No existen aún evidencias suficientes para utilizar los corticoides inhalados en las crisis agudas46-48 (Evidencia B). Deben administrarse en todas las crisis moderadas y graves, y también en las crisis leves, donde normalmente no están indicados, si con la administración de broncodilatadores no se consigue una mejoría mantenida (necesidad de β2-adrenérgicos de acción corta antes de 4 h) o el niño tiene antecedentes de crisis graves. La dosis recomendada es de 1-2 mg/kg/día (máximo 60 mg) durante 3 a 5 días o hasta la resolución, suspendiéndose sin reducción de dosis si su administración se mantiene menos de 10 días.
Antibióticos
La mayoría de estos episodios son debidos a infecciones virales, por lo que la administración de antibióticos debe ser excepcional.
Tratamiento del episodio agudo
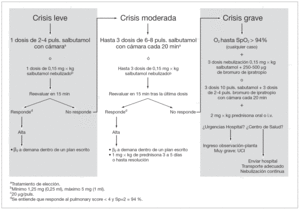
Oxígeno en todos los pacientes con SpO2 ≤ 94 %.
Broncodilatadores de acción corta a demanda, preferentemente utilizando un inhalador presurizado (IP) más espaciador, y corticoides sistémicos, al menos en todas las crisis moderadas y graves.
El algoritmo de tratamiento del episodio agudo de las crisis leves y moderadas de asma debe ser igual en Atención Primaria y en Urgencias del Hospital (fig. 2).
Figura 2. Tratamiento del episodio agudo de asma en pediatría.
Las crisis graves deben derivarse a un centro hospitalario en un transporte adecuado (ambulancia medicalizada) administrando durante el mismo oxígeno, broncodilatadores y corticoides (fig. 2).
Debe revisarse la técnica de inhalación (muchos de los fracasos del tratamiento se deben a defectos de esta técnica) y deberá ser controlado por su pediatra en las siguientes 24-48 h, quien valorará el plan de tratamiento.
Instrucciones al alta y seguimiento. Se ha comprobado el efecto beneficioso de un seguimiento estrecho del niño los días siguientes a la consulta en urgencias (Evidencia B)49-51.
Tratamiento de mantenimiento en pediatría
El tratamiento de mantenimiento consta de tres apartados:
1. Tratamiento farmacológico.
2. Inmunoterapia.
3. Educación del niño y su familia, así como control medioambiental.
Tratamiento farmacológico
Esta sección se divide en 2 apartados de acuerdo a la edad del paciente que hay que tratar: niños hasta 3 años y niños mayores de 3 años. La mayoría de las guías se centran en el adulto aunque tengan algún apartado dedicado al niño. Sólo el consenso previo SENP-SEICAP52 y la guía Suiza53 plantean, además, un tratamiento para el lactante de acuerdo con su clasificación fenotípica.
La clasificación del asma de un niño tiene el exclusivo interés de orientar el tratamiento a elegir en un primer momento. Posteriormente deberá ser la evolución clínica y la consecución de los objetivos de control los que dicten las modificaciones del tratamiento.
Independientemente de la clasificación de la gravedad o situación clínica del asma de un determinado paciente, el objetivo final es el buen control de la enfermedad (tabla 5).
Para valorar el grado de control del asma se utilizará el cuestionario de Control del Asma en Niños (CAN) que consta de 9 preguntas que se puntúan de 0 a 4 siendo la puntuación máxima de 36 y la mínima de 0 (tabla 6). Una mayor puntuación implica un peor grado de control. Se considera que un paciente está mal controlado cuando tiene una puntuación igual o mayor de 8. Además del control clínico que se valora con el cuestionario CAN, es importante evaluar la función pulmonar mediante espirometría y probablemente el control de la inflamación mediante la medición del ONE.
El tratamiento del asma es escalonado. Al igual que se sube de escalón cuando el control es insuficiente, es igualmente importante bajar de escalón para mantener un control adecuado con la mínima medicación efectiva.
Los fármacos antiasmáticos se dividen en 2 grupos fundamentales: broncodilatadores (utilizados habitualmente como aliviadores de síntomas) y antiinflamatorios (controladores de la enfermedad) (tabla 7).
Los fármacos fundamentales en el control del asma son los corticoides inhalados. Las dosis equipotenciales de estos fármacos se recogen en la tabla 8.
Es preferible añadir un segundo fármaco (agonistas β2 de larga duración54,55 o antileucotrienos56) que aumentar la dosis de corticoides en un niño no controlado.
La administración aislada de agonistas β2-adrenérgicos de larga duración no está actualmente recomendada: estos fármacos deben administrarse siempre asociados a corticoides inhalados.
La medicación inhalada debe ser administrada por medio de los sistemas más adecuados a cada edad (ver apartado sobre sistemas de inhalación).
Niños menores de 3 años
Consideraciones generales
Muchos de los lactantes con sibilancias durante los primeros meses de vida dejarán de tener síntomas (sibilantes transitorios) con independencia del tratamiento de mantenimiento que se instaure57.
La mayoría de estos episodios son secundarios a infecciones virales11.
La inflamación subyacente en estos casos es probablemente distinta a la del asma atópico del escolar o del adolescente58.
Existen pocos trabajos en los que se puedan apoyar con seguridad los criterios de tratamiento en estas edades, por lo que, en muchos casos, habrá que iniciar un tratamiento y modificarlo o interrumpirlo si no es efectivo59,60.
Las recomendaciones que se pueden hacer, por tanto, son en buena medida empíricas y de acuerdo con las siguientes suposiciones:
a) El lactante posee receptores β2 funcionantes61,62. La eficacia de los broncodilatadores es mayor en aquellos niños con factores de riesgo para desarrollar asma atópica63.
b) Los fármacos antiinflamatorios, tanto sistémicos como tópicos, poseen las mismas propiedades antiinflamatorias en todas las edades.
c) Los efectos secundarios de los fármacos antiasmáticos en el lactante son superponibles a los que acontecen en edades posteriores.
El tratamiento con corticoides inhalados no parece modificar el curso natural de la enfermedad64,65.
Se debe tener en cuen ta que en los lactantes se hace necesario un diagnóstico diferencial con otras patologías (tabla 1).
Fármacos
Glucocorticoides inhalados. En este grupo de edad, los niños con clínica de asma y con factores de riesgo de desarrollar un asma persistente pueden responder adecuadamente a este tratamiento60,65-73 (Evidencia A). Por otro lado, en los lactantes con sibilancias posbronquiolitis o con episodios de sibilancias relacionados únicamente con infecciones virales, la utilidad de los corticoides inhalados es dudosa74-77 (Evidencia B). El tratamiento con corticoides inhalados de forma intermitente no mejora el control de la enfermedad64.
Antagonistas de los receptores de los leucotrienos. Existen pocos trabajos en niños de esta edad. En uno de ellos, los niños tratados tuvieron menos recurrencias durante el mes posterior al episodio de bronquiolitis78; en otro, estos fármacos redujeron la inflamación bronquial en niños atópicos79. Podrían ser útiles para reducir el número de exacerbaciones inducidas por virus y para disminuir la inflamación bronquial en niños atópicos (Evidencia B)78-81.
Asociación de agonistas β2-adrenérgicos de larga duración y glucocorticoides inhalados. Sólo existe un trabajo no controlado en niños de esta edad82. Aunque sus resultados son positivos, se debería esperar a disponer de más estudios sobre el efecto sinérgico de los glucocorticoides y de los agonistas β2-adrenérgicos de larga duración en esta edad, para recomendar esta asociación en niños menores de 3 años.
Otros fármacos como las cromonas o las teofilinas no han demostrado su utilidad en lactantes83-90.
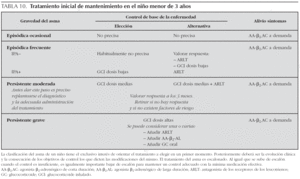
Clasificación. En la tabla 9 se indica el sistema de clasificación del asma en el niño de esta edad.
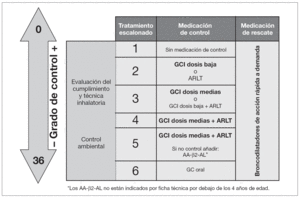
2>Tratamiento. La tabla 10 recoge el tratamiento de mantenimiento en el niño menor de 3 años, y la figura 3 el tratamiento escalonado según el grado de control.
Figura 3.Tratamiento escalonado del asma según el grado de control (v. tabla6) en niños menores de 3años.AA-β2-AL: agonista β2-adrenérgico de larga duración; ARLT: agonista de los receptores de los leucotrienos; GC: glucocorticoide; GCI: glucocorticoide inhalado.
Niños mayores de 3 años
Consideraciones generales
Hasta los 6 años se solapan niños que pertenecen al grupo de sibilancias transitorias con niños con sibilancias persistentes que tendrán asma persistente precoz. Otros niños comenzarán a tener asma por primera vez, constituyendo el grupo de asma persistente de comienzo tardío13.
El papel de la atopia a partir de esta edad debe ser aclarado por medio de una valoración alergológica adecuada ya que constituye el principal factor de riesgo de asma persistente11.
A partir de los 3 años probablemente son pocos los niños afectados de sibilancias transitorias, por lo que la mayoría van a sufrir sibilancias persistentes bien de comienzo precoz o de comienzo tardío11,13,17.
Fármacos
Glucocorticoides inhalados. Su eficacia en estas edades está bien contrastada47,60,91-103 (Evidencia A).
Antagonistas de los receptores de los antileucotrienos. Hay datos suficientes sobre su efectividad en estas edades, aunque su capacidad antiinflamatoria y su eficacia es menor que la de los corticoides inhalados56,104-107 (Evidencia A). Su asociación con corticoides inhalados mejora el control de los niños asmáticos56.
Asociación de agonistas β2-adrenérostrado eficaces para el control del asma en estas edades54,55,82,108-114 (Evidencia A) y permiten reducir las dosis de corticoides inhalados54,113, paliando los posibles efectos adversos de las altas dosis de éstos115. Aunque normalmente se usan a dosis fijas, algunos estudios han demostrado la eficacia de la combinación budesonida y formoterol cuando se utilizan a dosis ajustables en niños de más de 12 años109,110,112. Mientras no existan más estudios sobre la eficacia y seguridad de las combinaciones a dosis ajustables, no se recomienda que se utilicen en niños menores de 12 años; y por encima de esta edad, que se haga en casos muy seleccionados.
Recientemente se ha informado de la posibilidad de que los agonistas β2-adrenérgicos de larga duración se asocien a un incremento de la mortalidad en asmáticos adultos116,117. Sin embargo, los datos de que se dispone actualmente permiten afirmar, y así lo recoge la Agencia Española del Medicamento y Productos Sanitarios (AEMPS)118, que estos fármacos son seguros si se utilizan correctamente; es decir: si el β2-adrenérgico de larga duración se administra siempre con un corticoide inhalado, y nunca como medicación de rescate (para lo que deben emplearse los β2-adrenérgicos de corta duración). Se aconseja precaución y fijar una dosis máxima (100 µg/día de salmeterol y 36 µg/día de formoterol) cuando las asociaciones se usen de forma ajustable, ya que en determinadas circunstancias, como en una exacerbación, los pacientes podrían llegar a inhalar cantidades muy elevadas de agonistas β2-adrenérgicos de larga duración109.
Metilxantinas. Pueden tener una función como tratamiento agregado en el asma grave no controlado con glucocorticoides inhalados, pero se necesitan estudios adicionales para examinar esta función y para definir la relación riesgo-beneficio en comparación con otros fármacos más recientes (agonistas β2-adrenérgicos de larga duración y antagonistas de los receptores de los antileucotrienos). Como tratamiento de mantenimiento en monoterapia son menos eficaces que los glucocorticoides inhalados119.
Cromonas. Una revisión sistemática de 24 ensayos clínicos concluye que en el tratamiento a largo plazo, el efecto del cromoglicato sódico no es mejor que el del placebo, por lo que su utilización actualmente no está recomendada120 (Evidencia A).
Anticuerpos monoclonales anti-IgE. De uso exclusivamente hospitalario en casos muy seleccionados121-123.
La inmunoterapia específica (si se cumplen las indicaciones que se especifican en el apartado Inmunoterapia específica) puede desempeñar un papel en el control de la enfermedad.
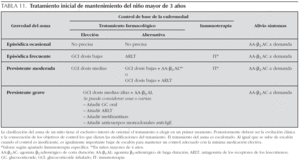
Clasificación. La clasificación del asma en el niño mayor de 3 años se realiza de la misma forma que en el niño menor de 3 años, tal y como de indica en la tabla 9.
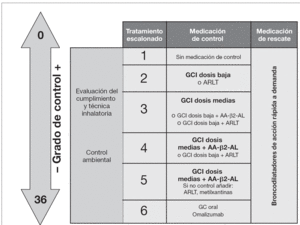
Tratamiento. La tabla 11 recoge el tratamiento de mantenimiento del niño mayor de 3 años, y la figura 4 el tratamiento escalonado según el grado de control.
Figura 4. Tratamiento escalonado del asma según el grado de control (v. tabla6) en niños mayores de 3 años. AA-β2-AL: agonista β2-adrenérgico de larga duración; ARLT: agonista de los receptores de los leucotrienos; GC: glucocorticoide; GCI: glucocorticoide inhalado.
Inmunoterapia específica
Un reciente metaanálisis (que incluye 3.003 pacientes, la mitad de ellos niños) pone de manifiesto un efecto beneficioso en términos de reducción de los síntomas, de la medicación de rescate y mantenimiento, y de la hiperrespuesta bronquial, tanto específica como inespecífica, pero sólo cuando se utilizan extractos estandarizados biológicamente124-127 (Evidencia A).
La inmunoterapia específica está indicada cuando se cumplen los siguientes criterios128 (Evidencia D):
a) Asma episódica frecuente o persistente moderada, mediada por IgE, cuando existe sensibilización a un único alérgeno, o a un alérgeno predominante, o a un grupo de alérgenos con reactividad cruzada.
b) Cuando los síntomas no se controlan de forma adecuada mediante la evitación del alérgeno y el tratamiento farmacológico.
c) Cuando el enfermo presenta síntomas tanto nasales como pulmonares.
d) Cuando el paciente (o sus padres, o tutores legales) no desean someterse a un tratamiento farmacológico a largo plazo.
e) Cuando el tratamiento farmacológico provoca efectos adversos.
La inmunoterapia específica está contraindicada128 (Evidencia D):
a) En niños con inmunodeficiencia o enfermedades autoinmunes graves o hepatopatía crónica.
b) En situaciones psicosociales que no permitan un adecuado seguimiento.
c) Como terapia de inicio en la adolescente embarazada, aunque se pueden administrar las dosis de mantenimiento correspondientes en pacientes que empezaron a ser tratadas antes del embarazo.
La edad no es un parámetro limitante del uso de inmunoterapia si se cumplen los criterios de indicación previos (Evidencia D).
Aunque no existen datos objetivos, se considera que el tiempo mínimo de tratamiento ha de ser de 3 años y el máximo de cinco128 (Evidencia D).
La inmunoterapia sublingual podría ser una alternativa a la subcutánea129,130 (Evidencia C) y no suele tener los efectos adversos sistémicos que en rarísimas ocasiones ha tenido la subcutánea131. En la actualidad su efectividad está sujeta a debate, por lo que se debería disponer de más datos antes de recomendarla de forma rutinaria132-134.
Tanto en la inmunoterapia específica subcutánea como sublingual sólo deben utilizarse extractos alergénicos que estén estandarizados biológicamente128 (Evidencia B).
La inmunoterapia subcutánea debe administrarse por personal entrenado. El paciente permanecerá en observación durante 30 min después de la inyección.
La educación en el manejo del niño con asma
Importancia y efectividad
La educación sanitaria del niño y adolescente con asma y de su familia es un componente esencial en el manejo del asma (Evidencia A). Su objetivo es conseguir un control de su enfermedad que le capacite para realizar una vida completamente normal para su edad, incluyendo la actividad física y deportiva diaria, la actividad escolar y su relación con el medio5,135,136.
Los planes de intervención en asma, que incluyen programas educativos encaminados al autocontrol en el domicilio, tienen una efectividad superior a los cuidados habituales (Evidencia A)137-139:
a) Mejoran la función pulmonar y la sensación de autocontrol.
b) Reducen el absentismo escolar y el número de días con actividad restringida.
c) Disminuyen el número de visitas al servicio de urgencias, y posiblemente el número de noches con síntomas de asma.
Los niños y adolescentes con asma moderada y grave son los que obtienen resultados más evidentes. Estos resultados se perciben ya a los 6 meses de establecer los planes educativos y son significativos a partir de los 12 meses (Evidencia A). Parecen ser más eficaces si se realizan cercanos al diagnóstico139,140.
Personal sanitario que debe involucrarse
El abordaje educativo del niño y adolescente con asma compete a todos los profesionales sanitarios (pediatras, neumólogos y alergólogos pediátricos, diplomados en enfermería, fisioterapeutas y farmacéuticos) que se ocupan de la asistencia al asma infantil; si bien por su posición de cercanía, accesibilidad y confianza, debe recaer de forma prioritaria sobre Atención Primaria. La enfermería pediátrica tiene un papel fundamental en esta tarea. Las actividades educativas las realizarán el binomio Pediatra-Enfermera de forma conjunta y coordinada141,142.
Niveles de educación
La educación debería llevarse a cabo tanto a nivel individual como grupal.
El conocimiento individual de los conceptos fundamentales en relación con el asma permite que el niño y su familia entiendan el diagnóstico y la base racional de las exploraciones complementarias y las intervenciones terapéuticas136. Los puntos clave sobre los que educar se especifican en la tabla 12.
En relación a la educación grupal, su principal aportación consiste en introducir el intercambio de experiencias, la expresión más libre de los temores, y permitir la "ayuda de grupo". Es un método complementario que sirve de refuerzo de la educación individual, pero nunca la puede sustituir.
Principios para su realización
Para que la educación sea eficaz, el sanitario debe de pasar de un "papel de experto" que transmite información a un niño pasivo, a un modelo mucho más "horizontal" en el que escucha las necesidades y la vivencia de la enfermedad del niño y su familia, establece una "alianza terapéutica" pactando cambios de hábitos y modificaciones de conducta, y permitiendo una mayor autonomía del niño143. Cuando la edad del niño sea adecuada se le permitirá integrarse en la toma de decisiones.
Para llevar a cabo estos planes se deben establecer unos objetivos concretos y las actividades necesarias para conseguirlos144,145.
Para que los resultados sean óptimos se requiere un abordaje combinado de información, educación en el autocontrol (a través de síntomas o PEF), planes de acción por escrito individualizados y revisiones periódicas regulares (Evidencia A)146,147.
Se considera básico un mínimo de 3 sesiones educativas para entrenar y capacitar al niño en la utilización de su propio plan de acción y fomentar la adherencia al tratamiento.
El objetivo es que este programa educativo básico se desarrolle durante los primeros 6 meses desde la confirmación diagnóstica. Posteriormente se programarán revisiones de seguimiento en función de la gravedad del asma y de la adherencia al tratamiento148. Se impartirá de forma escalonada desde los conocimientos y habilidades básicos hasta la consecución del autocontrol. El tiempo y la adquisición de los diferentes grados de autocontrol no serán los mismos para todas las familias149.
Al ser la educación un proceso continuado y progresivo, en cada contacto con el niño y sus cuidadores se incidirá en la adherencia al tratamiento, la técnica inhalatoria y el plan de actuación ante una crisis.
Se debe utilizar un lenguaje claro y comprensible, con técnicas de comunicación que sean capaces de motivar al niño y su entorno, basándose en información escrita, materiales gráficos, instrumentos (pico de flujo, placebos con pitos, etc.) o en cualquier otro elemento pedagógico que pueda ser útil en casos concretos.
Las últimas evidencias sugieren que los planes de acción por escrito basados en los síntomas, son superiores a los basados en la medición del pico flujo en lo que respecta al número de visitas no programadas a los servicios sanitarios, mientras que son similares en otros aspectos como en las exacerbaciones que requieren corticoides orales o ingresos, días de absentismo escolar, función pulmonar, calidad de vida y abandonos de la medicación. Por otra parte, la mayoría de los niños prefieren usar los planes de acción por escrito basados en síntomas que los basados en el pico flujo (Evidencia A)150. Sin embargo, la medición de éste puede ser útil en algunos casos, dependiendo del enfermo y/o de su familia.
Se recomienda evaluar los resultados para asegurar que el programa educativo consigue los objetivos previstos. Esta evaluación es útil como estrategia de mejora de la práctica clínica y debe realizarse de forma anual. Un método eficaz y objetivo de evaluación son las escalas de calidad de vida validadas para el asma infantil148.
Medios necesarios para la educación
Los medios necesarios indispensables para llevar a cabo los programas educativos se recogen en la tabla 13.
Se requiere, así mismo, que los profesionales sanitarios que tratan a niños con asma estén debidamente entrenados en la educación de estos pacientes.
Sistemas de inhalación
Consideraciones generales
La cantidad de fármaco que se administra a un niño con asma dependerá del tipo de medicación, del sistema de inhalación, de las características del paciente y de la interacción entre estos factores.
De las diferentes vías de administración de fármacos de que disponemos actualmente la vía inhalatoria es la de elección151,152 (aunque no todos los fármacos antiasmáticos están disponibles por esta vía, como los antileucotrienos y las metilxantinas).
La prescripción de cualquier sistema de inhalación debe hacerse solamente después de que el niño y sus padres hayan recibido entrenamiento en su uso y hayan demostrado una técnica satisfactoria (Evidencia B). Cada dispositivo específico debe tener su propio entrenamiento.
La reevaluación de la técnica debe formar parte de las visitas clínicas de control.
En niños de 0 a 5 años existe poca o ninguna evidencia en la que basar las recomendaciones que se indican.
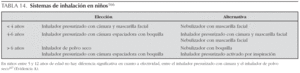
En general, y a priori, la edad es la que nos orientará a utilizar un tipo de sistema u otro, y la franja divisoria se sitúa entre los 4 y 6 años153 (tabla 14).
Inhaladores presurizados
Los problemas habituales con la técnica de administración provocan que más del 50 % de los niños que reciben tratamiento con un inhalador presurizado con aplicación directa (sin cámara) obtengan mucho menos beneficio que con otros sistemas154. Por tanto, los inhaladores presurizados con aplicación directa a la boca NO se deben utilizar durante la infancia; deben utilizarse siempre con cámaras espaciadoras.
Cámaras espaciadoras
La utilización de una cámara espaciadora con un inhalador presurizado soluciona el problema de la coordinación, disminuye la impactación orofaríngea y mejora la distribución y cantidad de fármaco que llega al árbol bronquial155 (Evidencia A). Su utilización con corticoides inhalados disminuye su biodisponibilidad y el riesgo de efectos sistémicos156 (Evidencia B).
Son múltiples los factores que influyen en la cantidad de fármaco que llegará a depositarse en los pulmones, como son la técnica de administración o el volumen de las cámaras: un retraso de 20 s entre el disparo del fármaco y el comienzo de las inhalaciones provoca una reducción del 80 % en la masa disponible de aerosol157. Las pulsaciones deben realizarse de una en una, agitando antes el presurizador. Las pulsaciones múltiples antes de inhalar disminuyen la cantidad de aerosol disponible debido a las turbulencias que se producen. Otros factores como el diseño de las válvulas de entrada y salida del espaciador, el espacio muerto, sobre todo si se utiliza mascarilla, y el material de la cámara (antielectrostático o no), condicionan la cantidad de aerosol disponible.
Hasta los 4 años se recomiendan cámaras de volumen pequeño, que son las que ya llevan acoplada una mascarilla facial. La respiración nasal que se produce en estos casos disminuye de forma importante el depósito pulmonar158, por ello, o en cuanto sea posible y colaboren de forma adecuada, hay que pasar a una cámara con pieza bucal159,160.
Inhaladores de polvo seco
Los inhaladores de polvo seco no contienen propelentes, las dosis son homogéneas, la técnica de inhalación es más fácil que con el inhalador presurizado, y su tamaño es pequeño y manejable, lo que facilita que el niño lo lleve consigo en sus actividades. El depósito pulmonar es superior al que produce el inhalador presurizado, pero los resultados son similares cuando éste se utiliza con cámara espaciadora.
La cantidad de fármaco que queda impactada en la orofaringe es superior a la de los inhaladores presurizados con cámara de inhalación, pero inferior a la que se produce con los inhaladores presurizados sin cámara161,162. El riesgo de efectos secundarios aumenta con la deposición orofaríngea. Los más utilizados son los de sistema multidosis (Accuhaler, Turbuhaler y Novolizer). Con estos sistemas suele ser suficiente un flujo inspiratorio de 30 l/min (algunos inhaladores requieren más). Estos dispositivos se recomiendan a partir de los 6 años de edad.
Nebulizadores
En el tratamiento de la crisis asmática se pueden usar tanto los nebulizadores de tipo "jet" como los ultrasónicos, siempre con fuentes de oxígeno. En la actualidad el uso de los nebulizadores en el domicilio queda restringido a casos especiales163. Los nebulizadores ultrasónicos no deben usarse para administrar suspensiones; para éstas deberán emplearse siempre los de tipo "jet".
Instrucciones para el uso de inhaladores
Las instrucciones para el uso de inhaladores presurizados y se polvo seco se pueden ver en la tabla 15.
Relación entre Atención Primaria y Especializada
Consideraciones generales
El modelo óptimo de atención al niño y adolescente con asma debe incluir los servicios debidamente coordinados, tanto de la Atención Primaria (AP) como de la Atención Especializada (AE).
Dado que la mayoría de los niños y adolescentes asmáticos presentan un asma leve o moderada y teniendo en cuenta el papel fundamental que desempeña la educación sanitaria y los controles periódicos a corto plazo, es lógico que los pediatras de AP tengan un papel primordial en la atención de gran parte de estos niños. La pediatría de AE tendría un mayor protagonismo en los niños con asma más grave o de control difícil.
Es necesario que exista una buena coordinación y comunicación entre los diferentes profesionales involucrados en la asistencia. La organización de planes de atención al niño asmático deberá llevarse a cabo contando siempre con la colaboración de AP y AE. De esta manera se obtendrán mejores resultados.
El médico de AP es el responsable de la detección de esos niños, y debe tomar la decisión respecto a la derivación a AE. La AP y AE deben trabajar con una estrategia común.
Cada Comunidad Autónoma tendría que contar con un Plan de formación para la Atención al niño y adolescente con asma. Este Plan incluiría 3 puntos básicos: correcta utilización de las pruebas diagnósticas (alergia y función pulmonar), puesta al día en el tratamiento, y formación en programas de educación. Para ello se debe garantizar la capacitación del personal sanitario y dotarlo de los recursos adecuados (tabla 13).
Consideramos necesario establecer un Plan Nacional que supere las fronteras autonómicas y que facilite la uniformidad en la organización de la atención al niño y adolescente con asma.
Coordinación entre Atención Primaria y Atención Especializada
Para ayudar a la coordinación entre los dos niveles es deseable que exista una buena comunicación mediante:
Reuniones periódicas presenciales.
Historia clínica informatizada que incluya un módulo específico y uniforme para asma.
Si no se dispone de historia informatizada compartida, sería necesario disponer de línea telefónica directa, intranet y correo electrónico.
Informes de derivación desde AP a AE en los que conste el motivo de la misma, medios diagnósticos empleados hasta ese momento y tratamientos realizados por el niño.
Informes de alta de AE con los resultados de las pruebas realizadas, la confirmación o no del diagnóstico de asma y la gravedad de la misma, el tratamiento recomendado.
Criterios de derivación a Atención Especializada
Cuando sea necesario confirmar o completar el diagnóstico, tras la valoración de la historia, la exploración física, y tras la realización de las pruebas disponibles en AP.
Cuando no se disponga de los recursos necesarios para valorar los posibles desencadenantes o la función pulmonar.
Cuando el niño con asma no lleve un buen control de su enfermedad o sufra un empeoramiento de la gravedad del asma, habiéndose comprobado previamente que la clasificación, el tratamiento indicado según la gravedad del asma, la técnica inhalatoria, y la adherencia a todos los aspectos terapéuticos son correctos.
Cuando los niños cumplan criterios de asma grave, de control difícil o de riesgo vital.
Cuando el niño con asma se pueda beneficiar de un tratamiento con inmunoterapia. Corresponderá a AE el estudio alergológico completo necesario para la iniciación o no de la inmunoterapia.
Criterios de alta por parte de Atención Especializada
Cuando la derivación fue motivada por la presencia de una duda diagnóstica, la AE mantendrá el control del niño hasta que se confirme o excluya el diagnóstico.
Cuando la derivación fue realizada por la gravedad del asma o por una evolución no favorable, el control se mantendrá hasta que mejore su gravedad o, como mínimo, mientras mantenga el tratamiento con corticoides orales de mantenimiento. Cuando ha habido un episodio de riesgo vital se aconseja el seguimiento en función del criterio del médico del hospital.
Cuando se precise inmunoterapia:
a) El especialista de AE explicará al niño y familiares cómo se va administrar la inmunoterapia.
b) La fase inicial del tratamiento con inmunoterapia, así como la primera dosis de los cambios de lote, se realizará bajo supervisión del equipo responsable.
c) En AP se administrará la inmunoterapia indicada por el alergólogo y/o neumólogo, en el período de mantenimiento, tras la fase de inicio administrada en AE.
d) Mientras dure la inmunoterapia se controlará al niño en AE, al menos una vez al año.
Correspondencia: Dr. L. García-Marcos
Instituto de Salud Respiratoria. Universidad de Murcia.
Campus Ciencias de la Salud. 30120 El Palmar. Murcia. España.
Correo electrónico: lgmarcos@um.es
Recibido en junio de 2007.
Aceptado para su publicación en junio de 2007.