Las dificultades para dormir en los niños y adolescentes son muy prevalentes en nuestro medio. El tratamiento se basa principalmente en terapias cognitivo-conductuales y modificación de hábitos. Sin embargo, el uso de medicamentos y sustancias para facilitar el sueño es elevado, sin existir guías clínicas que lo apoyen. La melatonina exógena es una neurohormona comercializada como suplemento nutricional que se utiliza cada vez más en los problemas de sueño, sin existir regulación sobre su uso.
Se presenta el documento de consenso sobre el uso de melatonina en el insomnio de inicio, elaborado por representantes de la Asociación Española de Pediatría, la Sociedad Española de Sueño, la Sociedad Española de Pediatría Extrahospitalaria y de Atención Primaria, la Sociedad Española de Medicina de la Adolescencia, la Sociedad Española de Psiquiatría Infantil y la Sociedad Española de Neurología Pediátrica.
Sleep problems are highly prevalent among our children and adolescents. Its treatment is mainly based on cognitive behavioural therapies and habit modification procedures. However, the use of sleep promoting drugs and substances is widespread without being supported by clinical guidelines. Exogenous melatonin is a neurohormone marketed as a nutritional supplement that is being increasingly used in the management of sleep problems, and with no control over its use.
The consensus document is presented on the use of melatonin in sleep-onset insomnia prepared by representatives of the Spanish Paediatric Association, the Spanish Society of Sleep, the Spanish Society of Paediatric Outpatients and Primary Care, the Spanish Society for Adolescent Medicine, the Spanish Society of Child Psychiatry, and the Spanish Society of Paediatric Neurology.
El sueño ejerce un papel fundamental en el desarrollo infantil, la conducta, el aprendizaje y el crecimiento.
El 30% de los niños presentan, en algún momento, un trastorno del sueño (TS); en niños con alteraciones del neurodesarrollo esta cifra se eleva al 80%1. En nuestro medio, un 11,3% de los lactantes de 6-12 meses tienen una latencia de sueño mayor de 30min, y el 17,7% de los adolescentes refieren síntomas de insomnio2–4.
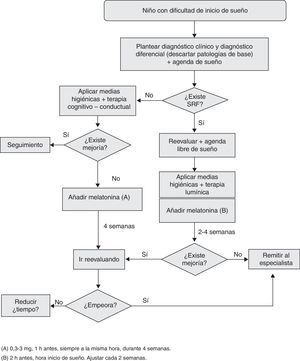
Uno de los TS más prevalentes es la dificultad de conciliación. La Guía de Práctica Clínica sobre Trastornos del Sueño en la Infancia y Adolescencia en Atención Primaria5 incluye entre los diagnósticos diferenciales del niño con dificultades al inicio del sueño: insomnio por higiene de sueño inadecuada, insomnio conductual, síndrome de piernas inquietas (SPI) y síndrome de retraso de fase (SRF). El más frecuente es el insomnio conductual, consecuencia de asociaciones conductuales incorrectas o ausencia de límites claros.
La Clasificación Internacional de Trastornos del Sueño (ICSD) no especifica la duración de la latencia del sueño para ser considerada patológica, lo que indica el carácter subjetivo del concepto de insomnio6.
Los adolescentes tienen, a menudo, dificultad para iniciar el sueño porque su curva de secreción de melatonina endógena está retrasada, circunstancia progresiva que se observa desde las primeras etapas y es más acusada en adolescentes7. Una deficiente higiene de sueño, el SPI, cuadros de ansiedad o la ingesta de algunos fármacos o de estimulantes también son causa de insomnio en esta edad.
Estos TS son motivo de consulta frecuente en Atención Primaria y muchos podrían resolverse en este nivel de atención8. La escasa formación en sueño probablemente condicione su infradiagnóstico y/o el uso de forma empírica de productos farmacológicos con escasa evidencia científica9.
En este contexto cobra importancia la melatonina, que es cada vez más utilizada10. Encuestas realizadas a profesionales sobre su uso en TS pediátricos muestran que aunque la mayor parte de los clínicos prefieren intervenciones no farmacológicas, las opiniones sobre el uso de melatonina son muy favorables (tercer fármaco más utilizado)11. Sin embargo, no siempre se utiliza de manera correcta; por ejemplo, algunos clínicos indican melatonina de liberación rápida en despertares nocturnos frecuentes, cuando sería, en todo caso, más recomendable la formulación de liberación prolongada.
Este incremento en el uso de melatonina unido a la frecuencia de TS en Atención Primaria hace necesario establecer un consenso sobre su utilización.
MelatoninaPropiedades de la melatoninaLa melatonina, o N-acetil-5-metoxi-triptamina, es una indolamina producida principalmente por la glándula pineal durante la noche. Su secreción nocturna es consecuencia de la actividad de un reloj circadiano localizado en el núcleo supraquiasmático del hipotálamo (NSQ). La luz es un potente inhibidor de su síntesis, de manera que puede ser total o parcialmente inhibida si el individuo se expone a luz durante la noche, especialmente de espectro blanco o azulada12,13.
Presenta contrastados efectos sobre el sistema circadiano, el sistema inmunitario, la actividad antioxidante (no solo neutraliza radicales libres, sino que potencia la actividad de otros antioxidantes)14,15, así como propiedades oncostáticas, tanto in vivo como in vitro, especialmente sobre tumores hormonosensibles. Cada vez son más los estudios que ponen de manifiesto su relación con numerosas enfermedades neurodegenerativas, autoinmunes, endocrinas y oncológicas16.
Posee moderada actividad hipnótica, que unida a su actividad cronobiótica17, justifica su utilización en diferentes situaciones en la que el reloj biológico está alterado (por ejemplo, jet lag, trabajos a turnos, etc.).
Metabolismo de la melatoninaLa glándula pineal sintetiza melatonina a partir del L-triptófano de la dieta, que tras ser sometido a hidroxilación y descarboxilación se convierte en serotonina; la enzima limitante es la triptófano-hidroxilasa. A su vez, la serotonina es transformada en N-acetil-serotonina por la N-acetil-transferasa; por acción de la hidroxiindol-O-metil-transferasa se forma la melatonina13.
La enzima N-acetil-transferasa determina si la serotonina se convertirá en melatonina. Su actividad depende de la liberación de noradrenalina de las terminales simpáticas que inervan la glándula pineal, efecto que tiene lugar durante la noche por la acción del NSQ; la luz nocturna y los bloqueantes betaadrenérgicos impiden su activación. Factores nutricionales como la disponibilidad de triptófano, piridoxina y folato en la dieta modulan la síntesis de melatonina12.
Es muy lipofílica, no se almacena en la glándula pineal, sino que es liberada a los capilares conforme se sintetiza. En sangre viaja mayoritariamente unida a la albúmina (60-70%). Su tiempo de semivida tras inyección intravenosa es de 30min, y de 45min tras administración oral. Más del 90% de la melatonina circulante se inactiva en el hígado por acción del citocromo P450 (CYP1A1 y CYP1A2), convirtiéndose en 6-hidroximelatonina, que es conjugada con sulfato para ser excretada en orina como 6-sulfatoxi-melatonina, forma bajo la que se elimina aproximadamente el 90% de la melatonina administrada12–15.
FarmacocinéticaLa farmacocinética dependerá del tipo de melatonina y de la dosis. Una dosis de 2mg de melatonina de liberación rápida alcanza concentraciones plasmáticas máximas entre 30-60min tras su ingestión (independientemente de si se ingiere con alimento). Sus valores permanecen elevados hasta 3-4h, en los que retornan a la concentración basal. Tiempo de semivida: 30-40min.
La melatonina de liberación lenta, a igual dosis, permanece elevada durante 5-7h tras su administración. Su cinética es muy dependiente de la ingesta, aumentando sus valores cuando se ingiere con alimento.
Los valores endógenos de melatonina plasmática se sitúan alrededor de los 100pg/ml en sujetos jóvenes durante la noche, mientras que los que se alcanzan tras la administración de 2mg de melatonina de liberación lenta son 5-10 veces los valores fisiológicos (500pg/ml para edades de 18-45 años). La misma dosis de liberación rápida produce un aumento entre 20-30 veces sobre la concentración endógena, con una concentración máxima de 2.000-3.000pg/ml18.
Uso de melatonina en Pediatría: evidencias científicasSi bien es evidente la relación y el papel que la melatonina tiene sobre el sueño y sus trastornos, los trabajos experimentales o ensayos clínicos sobre su uso en Pediatría son escasos. En una revisión publicada en 2011 (sobre estudios publicados entre 1975-2009), de un total de 16 estudios solo 4 se referían a niños con dificultades de inicio del sueño (213 niños de 3-13 años)19.
Los estudios muestran que la melatonina es eficaz reduciendo la latencia de sueño y adelantando su inicio. Estos efectos guardan más relación con el momento de administración (efecto cronobiótico) que con la dosis, ya que su administración adelanta el inicio de la dim light melatonin onset (DLMO, «secreción nocturna de melatonina»)20.
Las dosis efectivas muestran un amplio rango (0,3-10mg/día). Cuando el adelanto del inicio del sueño es significativo, el tiempo total de sueño también aumenta. Algunos estudios muestran una disminución de la fragmentación del sueño con melatonina, especialmente en niños con trastornos del neurodesarrollo21. Los moderados efectos hipnóticos de la melatonina tienen lugar mediante 3 mecanismos: aumento de oscilación del NSQ, potenciación del complejo GABA-BDZ e inhibición de la actividad excitatoria del glutamato, vasodilatación periférica y disminución de la temperatura central.
Efectos secundarios de la melatoninaDatos de estudios en ratas muestran que la concentración de melatonina sin efectos adversos observados es de 15mg/kg/día, equivalente a un valor de área bajo la curva 15.000 veces más elevado que tras administrar 2mg de melatonina de liberación lenta en humanos.
La administración en adultos de dosis diarias de hasta 300mg de melatonina no produce reacciones adversas importantes22. En caso de sobredosis el efecto esperado es el de un aumento de somnolencia. Estudios de seguimiento durante 10 años no muestran efectos secundarios23.
En adultos, la frecuencia de cefalea, mareos, náuseas y somnolencia no difiere del placebo. En pocas ocasiones se ha observado hipertransaminasemia puntual, que remite después del tratamiento24.
En niños, los datos son bastante más escasos. Su uso durante un corto período de tiempo (4 semanas) parece bastante seguro, sin que los efectos adversos difieran de los observados con placebo25–27. A largo plazo, sin embargo, no existe aún suficiente información. Estudios de seguimiento durante 3 años no evidencian ningún efecto adverso21,23,27.
La sospecha de efectos proconvulsionantes deriva de un artículo, en el que se observó un aumento de crisis en 4 de 6 casos tratados con 5mg de melatonina. El bajo número de casos y la heterogeneidad de las edades y de las lesiones cerebrales de estos 6 pacientes limitan la fortaleza de este estudio28. Los resultados de estudios posteriores acerca del efecto de la melatonina sobre la epilepsia son contradictorios, demostrando en algunos casos mejoría de la actividad epiléptica tras su administración29,30.
Otro riesgo potencial es su posible interacción con el desarrollo gonadal sustentada en varios casos publicados que mostraban un adelanto puberal en niños cuya glándula pineal no producía melatonina. Además, la pubertad se asocia, generalmente, a una reducción significativa en la producción de melatonina nocturna. Sin embargo, un estudio reciente en 51 niños mostró que los pacientes tratados con melatonina (0,3-10mg) durante un tiempo medio de 3,1 años no mostraban diferencias significativas al comparar su desarrollo sexual, peso y talla con la población control de la misma edad y sexo. La disminución de melatonina endógena durante la pubertad parece ser una mera asociación como resultado de la maduración del sistema endocrino31.
Estudios recientes en adultos evidencian una posible interferencia de la melatonina con el metabolismo de la insulina, provocando un aumento de la glucemia en la curva de tolerancia oral a la glucosa32,33.
Por tanto, en caso de usar melatonina en niños habría que tener especiales precauciones, entre otros casos, en presencia de enfermedades autoinmunes, tumores hematológicos, asma mal controlada, diabetes o epilepsia activa.
Metodología del consensoSe realizó una revisión sistemática en fuentes de información terciarias (TRIP Database, Cochrane Database of Systematic Reviews, National Guideline Clearinghouse, GuiaSalud, INHATA), fuentes de información secundarias (bases de datos internacionales, como PubMed, Embase y PsycINFO, y nacionales, como IME, IBECS y MEDES), así como fuentes de información primarias (búsqueda inversa a partir de las referencias bibliográficas de los estudios identificados).
El período de búsqueda comprendió desde enero de 2000 hasta mayo de 2013. La limitación idiomática fue el inglés y el español. La metodología adoptada fue el método Delphi modificado (2 rondas online y una sesión presencial). Los componentes del grupo de consenso fueron designados por las sociedades científicas entre sus asociados, buscando la persona más experta en esta área. Los miembros del consenso han firmado una declaración de conflicto de intereses.
En el diseño inicial se contó con la colaboración de un experto en MBE.
Las indicaciones derivadas de este consenso son de aplicación a partir de los 6 meses de edad.
Se establecieron las siguientes definiciones, basadas en la ICSD6:
- -
Insomnio infantil: dificultad mantenida, a pesar de la oportunidad de dormir, y en función de la edad, para iniciar o mantener el sueño o su calidad, y que provoca alteraciones funcionales en el niño y/o la familia.
- -
SRF: TS primario, caracterizado por un retraso mayor de 2h en los horarios de inicio del sueño y de despertar, en relación con los horarios socialmente aceptados.
- -
SPI: trastorno neurológico crónico sensitivo-motor, caracterizado por la necesidad urgente de mover las piernas en reposo, apareciendo o empeorando al final del día y aliviándose con el movimiento.
- -
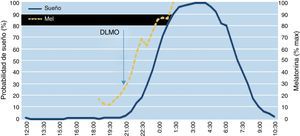
DLMO: en condiciones de luz tenue, el DLMO es considerado como el mejor marcador de la fase del reloj circadiano. Precede en aproximadamente 2h el momento del inicio del sueño. Se determina mediante el análisis de la melatonina en muestras de sangre o saliva tomadas cada 30min o mediante agenda libre de sueño (fig. 1).
Figura 1.Relación entre melatonina endógena, inicio de la secreción nocturna de melatonina y sueño libre. El inicio de la secreción nocturna de melatonina precede aproximadamente 2h al sueño.
DMLO: dim light melatonin onset («inicio de la secreción nocturna de melatonina»).
Fuente: Bonmati-Carrion MA, Middleton B, Revell V, Skene DJ, Rol MA, Madrid JA. Circadian phase assessment by ambulatory monitoring in humans: Correlation with dim light melatonin onset. Chronobiol Int. 2014;31:37-51.
Comparada con placebo, la melatonina disminuye la latencia del sueño en el insomnio de conciliación27,34 (fig. 2 y tabla 1).
Recomendaciones del grupo de consenso en niños
| Insomnio de inicio | ||
| Escenario | Niño con insomnio de inicio | |
| Objetivo | Reducción latencia de sueño | |
| Uso de melatonina | Adecuado | Nivel de evidencia: B |
| Dosificación | 1-3mg | Nivel de evidencia: C |
| Momento administración | Una hora antes de la habitual para irse a dormir. Siempre a la misma hora | Nivel de evidencia: Consenso |
| Duración | 3 semanas | Nivel de evidencia: Consenso |
| Síndrome de retraso de fase en niños | ||
| Escenario | Niño con SRF | |
| Objetivo | Adelantar DLMO | |
| Uso de melatonina | Adecuado | Nivel de evidencia: Consenso |
| Dosificación | 0,3-3mg | Nivel de evidencia: Consenso |
| Momento administración | 4-6h previas al sueño de manera progresiva* | Nivel de evidencia: Consenso |
| Duración | 3 semanas | Nivel de evidencia: Consenso |
| Síndrome de piernas inquietas | ||
| Escenario | Dificultad de inicio de sueño en niño con SPI | |
| Objetivo | Disminuir la latencia de sueño | |
| Uso de melatonina | Inadecuado | Nivel de evidencia: D |
DMLO: dim light melatonin onset («inicio de la secreción nocturna de melatonina»); SPI: síndrome de piernas inquietas; SRF: síndrome de retraso de fase.
Probablemente debido a las variaciones en los niveles basales de melatonina y a la diferente biodisponibilidad de las preparaciones orales, no se ha establecido un consenso sobre la dosis óptima.
Se ha propuesto iniciar con dosis de 1-3mg en lactantes y preescolares, y 2,5-5mg en niños mayores, y gradualmente ajustar la dosis según respuesta.
Dosis de 1-5mg producen en 1h concentraciones plasmáticas que son 10-100 veces mayores que las del pico máximo nocturno, para descender a los valores normales en 4-8h35,36.
En niños con alteraciones neurológicas la dosis más recomendada oscila entre 3-15mg.
Momento de administraciónBasándonos en las series de casos y ensayos clínicos publicados (todos en mayores de un año), debe administrarse a la misma hora y entre 30-60min antes de la hora habitual de ir a dormir35.
DuraciónNo se ha establecido con seguridad. En niños con insomnio de inicio que reciben melatonina la supresión del tratamiento ocasiona, al cabo de una semana, una vuelta al problema inicial en más del 90% de los casos.
Síndrome de retraso de faseEn el SRF no se observa una relación dosis-respuesta en cuanto al inicio del sueño, la disminución de la latencia de sueño o el DLMO. Los efectos de la melatonina exógena en relación con estos parámetros aumentan con una hora circadiana más precoz de administración, de manera que el mejor avance se produce cuando se administra entre 4-6h previas al DLMO.
El cambio del momento de secreción de melatonina endógena se correlaciona significativamente con el momento de administración, y no con la dosis administrada. Su administración eficaz requiere determinar previamente el DLMO37.
DosificaciónVaría de 0,5-5mg; la magnitud del cambio dependerá solo en parte de la dosis. El cambio de fase se atribuye a la acción del receptor MT2 de melatonina que está presente en el NSQ y su influencia directa en la actividad eléctrica y metabólica cerebral20.
Momento de administraciónEs más efectiva cuando se administra 5h antes del DLMO o 7h antes del inicio del sueño. Con ello, el 80% de los pacientes de 6-12 años de edad adelantan el inicio del sueño 1h. Hay que tener en cuenta que esta administración temprana puede originar somnolencia20.
DuraciónEn niños no se ha establecido la duración del tratamiento.
Un único estudio retrospectivo describe los efectos a los 6 meses con 3-5mg/día en 33 niños: avance en el inicio del sueño, aumento de su duración y reducción del porcentaje de pacientes con dificultades escolares20.
Este grupo de consenso recomienda reevaluar el tratamiento a las 3 semanas de iniciarlo y cree necesaria la determinación previa de DLMO mediante agenda libre de sueño durante 15 días o determinación salival o urinaria.
Síndrome de piernas inquietasExisten pocas referencias relativas al uso de melatonina en niños con SPI y estas muestran que no mejora significativamente la latencia del sueño38.
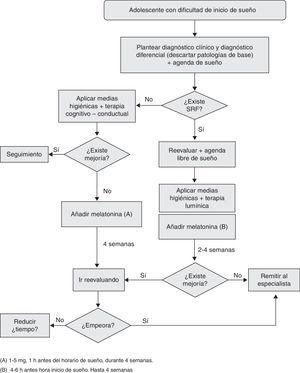
Uso de melatonina en adolescentesInsomnio de inicioEstudios y metaanálisis recientes que incluyen adultos, niños y adolescentes, y en los que se asume que el tratamiento del insomnio es multifactorial y no solo farmacológico, muestran la eficacia de la melatonina sobre el placebo como tratamiento del insomnio de inicio, con un efecto dependiente de la dosis sobre la duración total del sueño y la disminución de la latencia. Sin embargo, incluyen pocos estudios en menores de 18 años, presentan una gran variabilidad de dosis (0,05-0,15mg/kg o 0,5-5mg; aunque esta última es la más utilizada no hay evidencia de cuál es la mejor) y no aportan resultados específicos por edades ni diferencia de subtipos de TS (fig. 3 y tabla 2).
Recomendaciones del grupo de consenso en adolescentes
| Insomnio de inicio | ||
| Escenario | Adolescente con insomnio de inicio | |
| Objetivo | Reducción latencia de sueño | |
| Uso de melatonina | Adecuado | Nivel de evidencia: B |
| Dosificación | 1-5mg | Nivel de evidencia: Consenso |
| Momento administración | Una hora antes del horario de sueño determinado por agenda libre de sueño. Siempre a la misma hora | Nivel de evidencia: Consenso |
| Duración | 4 semanas | Nivel de evidencia: Consenso |
| Síndrome de retraso de fase en adolescentes | ||
| Objetivo | Adelantar DLMO | |
| Uso de melatonina | Adecuado | Nivel de evidencia: A |
| Dosificación | 1-5mg | Nivel de evidencia: Consenso |
| Momento administración | 4-6h previas al sueño de manera progresiva* | Nivel de evidencia: C |
| Duración | Hasta 4 semanas | Nivel de evidencia: Consenso |
| Síndrome de piernas inquietas | ||
| Escenario | Dificultad de inicio de sueño en adolescente con SPI | |
| Objetivo | Disminuir la latencia de sueño | |
| Uso de melatonina | Inadecuado | Nivel de evidencia: D |
DMLO: dim light melatonin onset («inicio de la secreción nocturna de melatonina»); SPI: síndrome de piernas inquietas.
Dependiendo del momento de su administración, la melatonina tendrá efecto cronobiológico (5-6h antes del DLMO) o hipnótico (coincidiendo con el DLMO o 1-2h antes del deseo de acostarse).
Mayores dosis y mayor duración del tratamiento se asocian con una mayor disminución de la latencia del sueño39,40.
Síndrome de retraso de faseAl menos 2 metaanálisis han demostrado que la melatonina es eficaz para el tratamiento del SRF, aunque la magnitud del efecto varía dependiendo del momento de administración25,41. Al analizar la eficacia de la melatonina sin considerar cuándo se administra, la eficacia es leve. En cambio, cuando se analiza el efecto de la melatonina 5-6h antes del DLMO en niños mayores de 6 años, la eficacia sobre el inicio, la latencia y el tiempo total de sueño es mucho mayor.
En los estudios existen diferencias respecto a los métodos de cuantificación de melatonina, las dosis (0,05-0,15mg/kg o 1-6mg, en general 5mg), el momento de administración (entre 3 y 6h antes del DLMO) y la duración de la administración (oscila entre 10-120 días); el grupo «adolescente» no se ha considerado de forma específica40.
En resumen, los estudios evaluados demuestran que la melatonina es eficaz en el tratamiento de adolescentes con SRF, a dosis de 5mg y administrada unas 5-6h antes del DLMO o de la hora preferida para acostarse. Este efecto cronobiológico se mantiene si se continúa su uso en el tiempo y no se observan efectos adversos o comorbilidades42.
Este grupo de consenso recomienda valorar el momento de administración y hacerlo de forma progresiva (iniciando 2h antes del DLMO según agenda libre de sueño).
Síndrome de piernas inquietasLa melatonina no se considera una opción terapéutica en el tratamiento del SPI en niños o adultos, sin embargo, y dado que es más segura que los agonistas de la dopamina, se ha utilizado a veces en niños con SPI, aunque la evidencia es muy débil.
El único estudio que evalúa la eficacia de la administración exógena de melatonina en el tratamiento del SPI en 8 pacientes adultos mostró un empeoramiento de los síntomas25,43.
Terapias cognitivo-conductualesEl tratamiento de TS exige una correcta instauración de medidas de higiene de sueño y un enfoque cognitivo-conductual. Este grupo de consenso recomienda el uso sistemático de terapias cognitivo-conductuales en niños y adolescentes con dificultades de inicio de sueño (tabla 3).
Medidas cognitivo-conductuales recomendadas en el manejo del insomnio de inicio en edad pediátrica
| Medidas complementarias en las dificultades de inicio de sueño |
| Medidas de higiene del sueño |
| Rutinas previas al sueño |
| Procure que los horarios de acostar y levantar sean lo más regulares posibles |
| Evite las siestas muy prolongadas y/o que terminen más allá de las 17.00h |
| No convierta el sueño en un castigo |
| Favorezca que el dormitorio del niño sea un lugar agradable, evite castigarlo «a su cuarto» |
| Medidas ambientales |
| Favorezca la actividad física y evite que sea a última hora del día |
| La luz que llega a los ojos durante las mañanas favorece un inicio de sueño más precoz |
| Una temperatura ambiental en el dormitorio entre 19 y 22°C favorece el sueño |
| Favorezca un ambiente silencioso |
| El uso de tecnología (Internet, ordenadores, juegos, móviles, etc.) debe finalizar al menos 1h antes del inicio de las rutinas del sueño |
| Alimentación |
| Separe, al menos media hora, la última toma del momento del inicio del sueño |
| Evite las bebidas excitantes-estimulantes (colas, té, café, preparados comerciales, vigorizantes, etc.) a partir de mediodía |
| Los hidratos de carbono y los alimentos ricos en triptófano (leche) favorecen el sueño tomados con moderación |
La melatonina, en metaanálisis recientes, se ha mostrado eficaz como herramienta de apoyo a la terapia cognitivo-conductual40,42,44,45.
FinanciaciónLa elaboración de este consenso ha sido posible gracias a una beca no condicionada de Humana Spain, S. L.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación previa: conclusiones preliminares de este consenso se presentaron en el XXVII Congreso Nacional de la SEPEAP, celebrado en Gran Canaria del 17 al 19 de octubre de 2013.