La enfermedad de Kawasaki es una vasculitis aguda autolimitada que afecta a vasos de pequeño y mediano calibre y es la causa más común de enfermedad cardiaca adquirida en niños en nuestro medio. Hasta un 25% de pacientes no tratados desarrollan aneurismas coronarios. Se sospecha que un agente infeccioso puede ser el desencadenante de la enfermedad, pero aún se desconoce el agente causal. En base a la evidencia previa, se proponen recomendaciones para el diagnóstico, tratamiento de la enfermedad aguda y manejo a largo plazo de estos pacientes, con el fin de unificar criterios. El diagnóstico debe ser rápido, basado en algoritmos de fácil manejo y con el apoyo de pruebas complementarias. Este documento recoge la indicación de las técnicas de imagen disponibles, así como la planificación de las revisiones cardiológicas en función de la afectación inicial. La inmunoglobulina intravenosa es la base del tratamiento inicial. El papel de los corticoides aún es controvertido, pero cada vez hay más estudios que avalan su uso como tratamiento adyuvante. Un equipo multidisciplinar ha elaborado un esquema con diferentes pautas de tratamiento en función de los factores de riesgo al diagnóstico, situación clínica del paciente y respuesta al tratamiento previo, incluyendo indicaciones sobre tromboprofilaxis en pacientes con afectación coronaria. La estratificación del riesgo para el tratamiento a largo plazo es esencial, así como las recomendaciones acerca del proceder en función de la afectación cardiológica inicial y su evolución. Los pacientes con aneurismas coronarios requieren un seguimiento cardiológico continuo e ininterrumpido de por vida.
Kawasaki disease is a self-limiting acute vasculitis that affects small and medium-sized vessels, and is the most common cause of acquired heart disease in children in our environment. Up to 25% of untreated patients develop coronary aneurysms. It is suspected that an infectious agent may be the trigger of the disease, but the causative agent is still unknown. Based on the previous evidence, recommendations are proposed for the diagnosis, treatment of acute disease, and the long-term management of these patients, in order to unify criteria. The diagnosis must be quick, based on easy-to-use algorithms and with the support of complementary tests. This document includes the indication of available imaging techniques, as well as the planning of cardiological examinations based on the initial involvement. Intravenous immunoglobulin is the basis of the initial treatment. The role of corticosteroids is still controversial, but there are studies that support its use as adjuvant treatment. A multidisciplinary working group has developed a scheme with different treatment guidelines depending on the risk factors at diagnosis, the patient's clinical situation, and response to previous treatment, including indications for thromboprophylaxis in patients with coronary involvement. The stratification of risk for long-term treatment is essential, as well as the recommendations on the procedures based on the initial cardiological involvement and its progression. Patients with coronary aneurysms require continuous and uninterrupted cardiological monitoring for life.
La enfermedad de Kawasaki (EK) es una vasculitis aguda autolimitada que afecta a vasos de pequeño y mediano calibre. Actualmente es la causa más común de enfermedad cardiaca adquirida en niños en países desarrollados y la segunda causa de vasculitis en la infancia, después de la púrpura de Schönlein-Henoch1. Aunque el proceso inflamatorio se resuelve espontáneamente en la mayoría de los pacientes, hasta un 25% de los pacientes no tratados presentan afectación de las arterias coronarias que se reduce al ≈4% en los niños tratados con inmunoglobulina intravenosa (IGIV) a altas dosis por un mecanismo aún desconocido2,3. Se sospecha que un agente infeccioso puede ser el desencadenante de la enfermedad pero aún no ha sido identificado el agente causal4. La EK es más prevalente en países asiáticos, especialmente en Japón, donde la incidencia ha ido en aumento hasta situarse en 265/100.000 niños menores de 5 años5; en Estados Unidos la incidencia se sitúa en torno a 25/100.000 niños menores de 5 años6 y en Europa entre 5,4 y 15/100.000 niños menores de 5 años7,8. En España se desconoce la incidencia general pero recientemente se ha descrito una incidencia en Cataluña de 8/100.000 niños menores de 5 años9 durante el periodo 2004-2013, similar a la incidencia en el Reino Unido (8,4/100.000)10.
El 85% de los casos sucede en menores de 5 años, con máxima incidencia entre los 18 y 24 meses de vida. La EK es menos frecuente en menores de 3 meses o mayores de 5 años, siendo en ambos grupos mayor el riesgo de desarrollo de aneurismas de arterias coronarias. La proporción entre varones y mujeres es de 1,5:1. Se ha observado una mayor incidencia en los meses de invierno y primavera11.
No se conoce la tasa de letalidad en nuestro medio, pero la mayor mortalidad tiene lugar entre el día 15 y 45 desde el inicio de la fiebre, momento en el que coinciden la vasculitis coronaria con trombocitosis y un estado de hipercoagulabilidad.
En España se desarrolla en la actualidad el estudio KAWA-RACE. Se trata de un estudio multicéntrico nacional retrospectivo y prospectivo de los factores epidemiológicos, clínicos, analíticos y microbiológicos determinantes de la respuesta al tratamiento de la EK y el riesgo del desarrollo de aneurismas coronarios en pacientes menores de 14 años. En su fase retrospectiva (2011-2016) se han reclutado 625 pacientes. Los resultados, pendientes de publicación a la fecha de redacción de este documento, ampliarán los conocimientos de esta enfermedad en nuestro país.
Etiología, patogenia y genéticaAunque los hallazgos clínicos, de laboratorio y las características epidemiológicas de la enfermedad sugieren un origen o desencadenante infeccioso, a día de hoy no se ha podido identificar un agente etiológico infeccioso único. Tampoco se ha podido demostrar que la enfermedad se asocie a la exposición a fármacos, o que se desarrolle en respuesta a un superantígeno12.
Una de las teorías actualmente más aceptadas sugiere que la enfermedad puede ser causada por un agente infeccioso que se inhalaría e infectaría células epiteliales bronquiales ciliadas de tamaño mediano13. Estudios recientes, basados en el análisis de las grandes epidemias de EK en Japón, sugieren que el agente causal podría ser un agente medioambiental transportado por vientos troposféricos, posiblemente una toxina fúngica14. Paralelamente, la alta incidencia en las comunidades asiáticas y el mayor riesgo entre hermanos de los casos, sugieren que los factores genéticos del huésped son importantes en la patogénesis de la EK. Se han publicado algunos estudios de asociación de genoma completo (GWAS) en EK11 y se han identificado varios loci biológicamente implicados en la inflamación, la respuesta inmunitaria y el estado cardiovascular. Así, una hipótesis razonablemente abierta, es que la EK está causada por un agente infeccioso aún por identificar, que produce enfermedad solo en individuos genéticamente predispuestos, particularmente asiáticos. Su rareza en los primeros meses de vida y en adultos sugiere un agente al que estos últimos son inmunes y del cual los lactantes muy pequeños están protegidos por anticuerpos maternos pasivos.
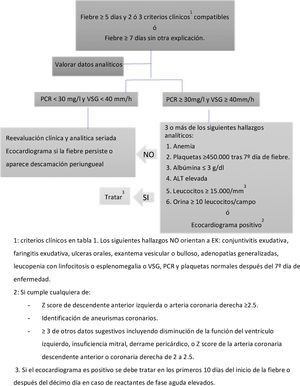
Diagnóstico de la enfermedadEl diagnóstico se basa en criterios clínicos y apoyan el diagnóstico los indicadores inflamatorios en las pruebas de laboratorio (tabla 1). La identificación de aneurismas coronarios o en otros territorios, confirma su diagnóstico; no obstante, los aneurismas coronarios no suelen detectarse hasta transcurrida la primera semana de enfermedad por lo que una ecocardiografía normal al inicio no descarta el diagnóstico11.
Criterios diagnósticos para enfermedad de Kawasaki completa
| Fiebre al menos durante 5 días y 4 de los 5 criterios clínicos principales. En presencia de > 4 criterios clínicos principales, especialmente si eritema, edema o hinchazón de manos y pies, el diagnóstico se podrá hacer con 4 días de fiebre (en casos puntuales y por clínicos expertos incluso con 3 días de fiebre) No todos los criterios tienen que estar presentes a la vez. Se pueden haber resuelto en el momento de la exploración | |
| En caso de no cumplir los criterios clínicos de EK completa, la presencia de anomalías coronarias confirma el diagnóstico | |
| Criterio principal | Descripción/nota |
| 1. Alteraciones de labios y/o mucosa oral | Eritema, fisuras, sangrado en los labios; lengua aframbuesada con papilas prominentes; eritema de mucosa oral o faríngea sin exudados ni ulceraciones |
| 2. Inyección conjuntival bulbar no supurativa | Típicamente deja libre el limbo corneal. Ocasionalmente puede aparecer hemorragia subconjuntival y queratitis punteada |
| 3. Exantema maculopapular, eritrodermia difusa. Puede ser urticariforme o micropustuloso | Sin vesículas/bullas, petequias ni costras. Es característico que se acentúe en región perineal con descamación precoz |
| 4. Eritema y edema de manos y pies en fase aguda y descamación periungueal en fase subaguda | A veces la induración es dolorosa. En 1-2 meses pueden aparecer líneas de Beau (ranuras transversales en la uña) |
| 5. Linfadenopatía cervical ≥ 1,5cm de diámetro, generalmente unilateral | Puede asociar edema retro/parafaríngeo |
| Apoyan el diagnóstico, marcadores de inflamación elevados (PCR, VSG, PCT, leucocitosis con neutrofilia), hiponatremia e hipoalbuminemia, transaminasas elevadas y piuria estéril. En la segunda semana desde el inicio de la fiebre es común la trombocitosis | |
PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
En pacientes con fiebre prolongada de causa inexplicada con menos de 4 de los criterios diagnósticos principales para la EK y con hallazgos de laboratorio o ecocardiográficos compatibles, se debe considerar el diagnóstico de EK incompleto o atípico (fig. 1)11.
Los niños menores de 6 meses tienen con más frecuencia fiebre prolongada sin otra clínica de EK y presentan mayor riesgo de desarrollar lesiones coronarias.
Afectacíon cardiológica en la enfermedad de KawasakiLas manifestaciones y complicaciones cardiológicas (tabla 2) representan la mayor causa de morbimortalidad en la EK, tanto en la fase aguda como a largo plazo. Se produce una inflamación a nivel del pericardio, miocardio, endocardio (incluyendo válvulas) y arterias coronarias.
Afectación cardiológica en la enfermedad de Kawasaki
| Clínica cardiológica | ||
|---|---|---|
| En el periodo agudo se puede objetivar precordio hiperdinámico y taquicardia. Puede aparecer ritmo de galope secundario a disfunción diastólica por edema e inflamación miocárdica. No es común la presencia de roce pericárdico o signos de taponamiento (si existe derrame pericárdico suele ser de escasa cuantía). Puede auscultarse soplo sistólico de insuficiencia mitral. El soplo diastólico de suficiencia aórtica es raro. Los signos y síntomas de isquemia miocárdica son atípicos y no específicos en niños | ||
| Lesión | Incidencia | Características |
| Anomalías coronarias | Hasta en un 25% de los pacientes sin tratamiento. El riesgo se reduce a < 5% tras recibir (IGIV). Fase retrospectiva KAWARACE: incidencia de aneurismas coronarios 9,6% | Marca el pronóstico. El 50%, dependiendo del tamaño, regresa a la normalidad después de 2 años. Los pacientes con aneurismas grandes/gigantes no tienen síntomas cardiológicos, salvo desarrollo de isquemia miocárdica por alteraciones severas del flujo o trombosis. La posibilidad de rotura de aneurismas es rara. Puede ocurrir en la fase aguda con el crecimiento rápido del mismo |
| Miocarditis | Casi universal (series con estudio de trazadores reflejan afectación en 50-70% de los casos) | Se produce antes de las alteraciones coronarias y sin que exista daño isquémico previo. No afectación celular ni necrosis de miocitos: carácter transitorio y rápida respuesta a la medicación antinflamatoria. Necesaria la evaluación de la función sistólica y diastólica en todos los pacientes |
| Shock cardiogénico | Forma de comienzo en aproximadamente el 5% de pacientes | La presencia de trombocitopenia y coagulopatía es común en estos casos. Los pacientes con esta presentación tienen más riesgo de resistencia a la IGIV, afectación coronaria y disfunción miocárdica prolongada |
| Valvulitis Insuficiencia mitral Insuficiencia aórtica | En fase aguda hasta el 25% de pacientes. Mucho menos frecuente (1%) | En fase precoz suele ser de rango moderado y no parece persistir con la evolución. Se correlaciona con otros marcadores analíticos de inflamación Su presencia parece secundaria a la pancarditis o al mecanismo inflamatorio global que se producen en la fase aguda de la enfermedad. Se asocia con la dilatación de la raíz aórtica, en el curso precoz de la enfermedad que se ha descrito en torno al 10% de pacientes durante la fase aguda de la enfermedad. Su presencia se relaciona con dilatación coronaria |
| Pericarditis | Entre el 6–24% de pacientes | La mayoría se limita a la fase aguda de la enfermedad, siendo generalmente leve y transitoria |
En estudios histológicos recientes se identifican tres procesos patológicos: el primero, autolimitado, con cese a las 2 semanas de enfermedad, consiste en una arteritis necrosante producida por infiltración de neutrófilos activados con afectación de la adventicia arterial causando aneurismas. El segundo proceso consiste en una vasculitis subaguda/crónica con infiltración de linfocitos, células plasmáticas, eosinófilos y macrófagos que comienza a las 2 semanas de inicio de la enfermedad y que puede continuar durante meses o años en algunos pacientes. El tercer proceso consiste en una proliferación miofibroblástica luminal derivada de las células musculares de la media que comienza en las primeras 2 semanas y que persiste meses o años, siendo la causa potencial de la estenosis arterial15.
Diagnóstico de la afectación cardiológicaEcocardiogramaLa ecocardiografía es la prueba de imagen de elección en la EK para la evaluación de las arterias coronarias, función ventricular, derrame pericárdico/pleural y regurgitaciones valvulares en la fase aguda de la enfermedad. En la tabla 3 se plantea una guía de valoración cardiológica en esta patología teniendo en cuenta las anormalidades cardiológicas más comunes previamente descritas11,16.
Valoración cardiológica en la enfermedad de Kawasaki
| En las revisiones cardiológicas realizar: historia clínica, exploración física, electrocardiograma y ecocardiograma | |||||
|---|---|---|---|---|---|
| Lesión | Valoración | ||||
| Anomalías coronarias | Ecocardiograma: Utilizar sondas con la frecuencia más alta posible, disminuir la profundidad y reducir el sector del área a estudiar con foco situado en la zona interesada. Compresión entre 50-60 y Gain 60-65%. Medir bordes internos de la coronaria evitando zonas de bifurcación. La afectación coronaria, de forma característica, ocurre inicialmente en los segmentos proximales con extensión distal 1. Según tamaño (Z- score): | ||||
| Coronarias normales | Dilatación /ectasia | Aneurismas pequeños | Aneurismas medianos | Aneurismas gigantes | |
| z-score: <2 | z-score ≥2 y <2,5 | z-score ≥2,5 a <5 | z-score ≥5 a <10 y diámetro < 8mm | z-score ≥10 y/o diámetro ≥ 8 mm | |
| 2. Localización: identificar la coronaria y el segmento afectado (proximal, medio o distal) Planos ecocardiográficos: -Coronaria izquierda: paraesternal eje corto a nivel de la válvula aorta, paraesternal eje largo (superior tangencial), subcostal eje largo -Descendente anterior: paraesternal eje corto a nivel de la aorta, paraesternal eje largo (superior tangencial), paraesternal eje corto del ventrículo izquierdo -Circunfleja: paraesternal eje corto a nivel de la aorta, eje apical 4 cámaras -Coronaria derecha: paraesternal eje corto a nivel de la válvula aórtica, paraesternal eje largo (inferior tangencial), subcostal eje corto a nivel del surco atrioventricular y subcostal coronal enfocado al tracto de salida derecho -Descendente posterior: eje apical 4 cámaras (inferior), paraesternal eje largo (inferior tangencial), subcostal (inferior) 3. Según morfología: -Saculares: cuando los diámetros axiales y laterales son casi iguales -Fusiformes: cuando la dilatación coronaria es simétrica con una disminución progresiva de calibre tanto proximal como distal | |||||
| Electrocardiograma: Según el compromiso miocárdico, el infarto puede ser: - Subepicárdico: cambios en la onda T - Subendocárdico: cambios en el S-T - Transmural: ondas Q patológicas En la fase aguda puede seguir la evolución de los cambios que suceden de forma habitual en este tipo de lesiones Localización aproximada de la arteria coronaria afecta en fase aguda: | |||||
| DEA proximal | Proximal a la primera septal | Elevación S-T V1-V6, aVL, BRD | |||
| DEA medial | Distal a la primera septal, pero proximal a la diagonal | Elevación S-T V1-V4, aVL | |||
| DEA distal | Distal a la diagonal | Elevación S-T V1-V4, o I, aVL | |||
| ACD o circunfleja | Inferior moderado o grande (posterior, lateral, VD | Elevación S-T II, III y aVF | |||
| ACD o rama circunfleja | Inferior estricto | Elevación S-T II, III y aVF | |||
| Miocarditis Shock cardiogénico | Ecocardiograma: valoración función sistodiastólica global y segmentaria: - Fracción de eyección (FE): en eje longitudinal largo calcular FE por Teicholz, y en 4 cámaras calcular FE por Simpson. Disfunción si: FE < 60% - Doppler tisular (en anillo mitral, tricuspídeo y tabique interventricular) en 4 cámaras: onda S, E’, A’, tiempo de contracción isovolumétrica, tiempo de relajación isovolumétrica y tiempo de eyección Electrocardiograma: descartar alteraciones nodo sinusal y auriculoventricular, prolongación PR, ondas Q profundas, intervalo QT prolongado, bajos voltajes, cambios ST-T, arritmias, y anomalías de la repolarización | ||||
| Insuficiencia mitral Insuficiencia aórtica | Ecocardiograma: valorar si existe o no insuficiencia valvular y el grado de severidad mediante doppler color y pulsado en el eje apical 4 cámaras Electrocardiograma: en casos severos descartar dilatación de aurícula izquierda Ecocardiograma: valorar si existe dilatación de la raíz aórtica en el plano paraesternal eje largo, y valorar si existe insuficiencia valvular y su severidad mediante el doppler color y pulsado en los planos paraesternal eje largo y apical 5 cámaras Electrocardiograma: en regurgitación moderada o severa, descartar datos de hipertrofia ventricular izquierda y, con enfermedad avanzada cambios de ST-T debido a la isquemia | ||||
| Pericarditis | Ecocardiograma: valorar presencia y severidad de líquido pericárdico en el eje apical 4 cámaras y subcostal Electrocardiograma: Estadio I: elevación del segmento ST con ondas T positivas y depresión del intervalo PR o PQ. Estadio II: aplanamiento del segmento ST y la onda T. Estadio III: inversión de la onda T. Estadio IV: normalización de la onda T | ||||
ACD: arteria coronaria derecha; BRD: bloqueo de rama derecha; DEA: descendente anterior; VD: ventrículo derecho.
Derivaciones del electrocardiograma plano frontal: I, II, III, aVR, aVF, aVL. Derivaciones precordiales: V1-V8.
De forma general, la ecocardiografía transesofágica, la coronariografía, la resonancia nuclear magnética cardiaca o la tomografía axial computerizada no están indicados de forma rutinaria en el diagnóstico y manejo de la enfermedad en fase aguda.
Cuando el estudio ecocardiográfico está limitado, por ejemplo, por presencia de trombos o estenosis, o niños mayores y/o adolescentes en los que la resolución ecocardiográfica no es adecuada, podría ser razonable la realización de estudios de imagen más avanzados sobre todo en aquellos pacientes con anomalías coronarias graves a nivel proximal en los que es necesario definir el lecho distal para tomar decisiones médicas (tabla 4)17,18.
Criterios de realización de otras pruebas de imagen distintas de la ecocardiografía
| Angio-TAC coronario |
| No está indicado de rutina Si existen aneurismas gigantes localizados en territorios arteriales proximales/distales (vistos por ecocardiografía), se utiliza con dos finalidades: Definir el tamaño de los aneurismas a ese nivel y valorar lecho distal Valorar la presencia/ausencia de trombos/estenosis en los mismos Idealmente se realizará estudio prospectivo («step-and-shoot mode») con betabloqueo para conseguir FC <70 lpm. Dosis 1,5-3 mSv. Pacientes <7-8 años pueden precisar sedación |
| Cardio-RM |
| No está indicada de rutina Ante pacientes con afectación coronaria por ecocardiografía incluidos en nivel de riesgo al menos 3 (tabla 6) y/o sospecha de miocarditis asociada (valorado por ecocardiografía) es útil para la determinación de la función sistólica global/segmentaria y caracterización del miocardio (estudio de perfusión miocárdica y realce tardío) La cardio-RM no es la técnica de elección para valorar la anatomía coronaria. Sin embargo, puede realizarse una aproximación de la misma si se realiza la cardio-RM por otro motivo En comparación con el TC: Es una técnica en la que no existe irradiación, pero precisa de mayores tiempos de adquisición de imágenes (sedación en muchos casos) y tiene peor definición de la anatomía coronaria |
| Coronariografía |
| - No se recomienda en la fase aguda de la enfermedad - No es necesaria en pacientes sin afectación coronaria ecográfica o con ectasias - Pacientes con único aneurisma pequeño o mediano tamaño, solo si los estudios de isquemia miocárdica son positivos o hay datos de estenosis en las pruebas de imagen - Pacientes con un aneurisma gigante o varios pequeños/medianos, realizar si test de isquemia miocárdica positivo, estenosis en las pruebas de imagen, datos de disfunción miocárdica o cambios clínicos/ECG sugestivos de síndrome coronario agudo |
La inflamación que se produce a nivel cardiaco en la fase aguda de la enfermedad de Kawasaki afecta mayoritariamente a las coronarias, aunque también puede producirse un cuadro de inflamación miocárdica clínica o subclínica y producir cambios en el electrocardiograma relacionados con la afectación miocárdica y/o la afectación coronaria (tabla 3).
TratamientoTratamiento de la EK en fase agudaEl tratamiento médico de primera línea en la EK es la infusión de inmunoglobulina intravenosa (IGIV)11. La eficacia de su uso en el periodo agudo para disminuir la prevalencia de aneurismas coronarios ha sido demostrada ampliamente19–21. La gammaglobulina es un producto biológico, consistente en una concentración de inmunogloblulina G (al menos 95%) y otras inmunoglobulinas humanas. Su mecanismo de acción aún es desconocido. Se debe administrar tan pronto como sea posible en los primeros 10 días de enfermedad o incluso más tarde si se mantiene el cuadro febril de origen desconocido, persistencia de la actividad inflamatoria constatada por el aumento de PCR o VSG o la presencia de aneurismas coronarios. El tratamiento estándar es una infusión única de 2g/kg de IGIV20,22 (tabla 5). Se debe iniciar tratamiento conjunto con ácido acetilsalicílico (AAS)23 a dosis moderadas (30-50mg/kg/día cada 6 h, VO) hasta que el paciente esté 48-72 h afebril, momento en que se cambia el AAS a dosis antiagregante (3-5mg/kg/día en una dosis, VO) manteniéndose esta dosis hasta 6-8 semanas del inicio de la enfermedad y hasta normalización de plaquetas, reactantes de fase aguda y ecocadiograma normal. A pesar de su actividad antinflamatoria, parece que el tratamiento con AAS no reduce la frecuencia de aparición de aneurismas coronarios, sin embargo, en los estudios que demostraron la eficacia de la IGIV, se utilizó como tratamiento adyuvante, por lo que clásicamente se asocia a su uso24.
Fármacos en la enfermedad de Kawasaki
| Tratamiento fase aguda | |||
|---|---|---|---|
| Fármacos de primera línea | |||
| Fármacos | Dosis | Reacciones adversas/precauciones | Forma de presentación |
| IGIV | Dosis única: 2g/kg IV | Relacionados con una alta velocidad inicial de infusión, 5-15% de los casos: fiebre, escalofríos, cefalea, mialgias, náuseas, vómitos. Durante o hasta 1-2 días tras la infusión. Puede aparecer una reacción anafiláctica en niños con déficit de IgA debido a la formación de anticuerpos anti-IgA por el receptor en una administración previa de IGIV. En estos casos debería elegirse un preparado con la menor cantidad posible de IgA. La vacunación frente a varicela, sarampión, parotiditis y rubeola debería posponerse hasta 11 meses tras administración IGIV Ritmo de infusión: monitorizar siempre la primera infusión de IGIV en los primeros 30min. Velocidad inicial si el preparado es al 5%: 0,5 ml/kg/hora en los primeros 30 min. Si es al 10%: 0,25 ml/kg/hora. Se podrá incrementar el ritmo de forma progresiva hasta alcanzar un máximo que depende del preparado comercial (consultar prospecto). Habitualmente se administra en 12 h. La primera vez que se administra IGIV a un paciente debe ser con un preparado al 5% | Viales 50 mg/ml: 0,5g, 1g, 2,5g, 5g, 10g, 20g. Viales 100 mg/ml: 1g, 2g, 2,5g, 5g, 10g, 20g. Viales con polvo liofilizado: 2,5g, 5g, 10g |
| AAS | Antiinflamatorio: 30-50 mg/kg/día cada 6 h, VO Antiagregante: 3-5mg/kg/día en una dosis, VO | A dosis antiinflamatorias puede producir salicilismo crónico leve que se caracteriza por tinnitus y sordera. Interrumpir tratamiento si aparecen estos síntomas. Hipoprotrombinemia, rinitis, espasmo bronquial paroxístico, alteraciones y hemorragia gastrointestinales La administración concomitante con ibuprofeno antagoniza el efecto de inhibición irreversible plaquetaria de AAS, por lo que el ibuprofeno no debe utilizarse en estos pacientes Precaución si paciente presenta infección activa por virus varicela o gripe por riesgo de síndrome de Reye. Si infección por virus de la gripe en fase aguda EK se debe evitar aspirina (utilizar paracetamol como antipirético y otro antiagregante p. ej. clopidogrel durante al menos 2 semanas). Se debe administrar la vacuna de gripe con virus inactivos en niños> de 6 meses. En caso de contacto con varicela se debe suspender el AAS e iniciar otro antiagregante. Después de la vacuna de varicela se debe valorar sustituir el AAS por otro antiagregante durante 6 semanas. No obstante, la dosis de 3-5mg/kg/d de AAS no se ha relacionado con síndrome de Reye | Comprimidos 100, 125, 150, 250, 300 y 500mg |
| Corticoides | Diversas pautas: - Metilprednisolona 30/mg/kg/día IV durante 3 días, posteriormente metilprednisolona, prednisolona o prednisona 2mg/kg/día IV o VO con retirada progresiva según evolución (fig. 2) -Metilprednisolona 2mg/kg/día IV hasta que desaparezca fiebre y descenso PCR con retirada progresiva según evolución (fig. 2) | Acné, hipopotasemia, retención hidrosalina, alcalosis, debilidad, miopatía con atrofia muscular, cataratas, aumento presión intracraneal, HTA, osteoporosis, síndrome de Cushing, supresión suprarrenal, úlcera péptica, intolerancia a la glucosa, hirsutismo, amenorrea, infecciones, retraso crecimiento | Metilprednisolona: viales 8, 20, 40, 125, 250, 500, 1000mg. Comprimidos: 4, 16, 40mg. Prednisolona suspensión: 7mg/ml. Prednisona: comprimidos 2.5, 5, 10, 30, 50mg |
| Fármacos de segunda línea (se recomienda supervisión por experto) | |||
| Infliximab | 6mg/kg IV en 2 h 1-2 dosis (si 2 dosis administrar una dosis por semana) | Muy frecuentes (> 1/10): riesgo de infecciones, cefalea, náuseas, dolor abdominal. Frecuentes (entre 1/10-1/100): neoplasias, neutropenia, leucopenia, anemia, linfadenopatías, síntomas alérgico respiratorio, depresión, insomnio, conjuntivitis, hipotensión, hipertensión, equimosis, sofocos, enrojecimiento facial, disfunción hepática, urticaria, erupción, prurito, hiperhidrosis, sequedad, cutánea, dermatitis fúngica, eczema, alopecia, artralgias, mialgia, dolor de espalda | Polvo para concentrado para solución perfusión 100mg |
| Anakinra | 2-6mg/kg/día SC, 15 días | Infecciones, neutropenia, trombocitopenia, cefalea, reacción local lugar inyección, hipercolestoleremia | Solución inyectable en jeringa 100mg. |
| Etanercept | 0,8 mg/kg/dosis IV semanal (3 dosis) | Reacción local en zona de inyección, riesgo infecciones, reacción alérgica, desarrollo de autoanticuerpos, fiebre, prurito | Solución inyectable para uso pediátrico 10mg polvo y disolvente |
| Ciclosporina | 3 mg/kg/día IV cada 12h 4–8 mg/kg/día VO cada 12h | Muy frecuentes (> 1/10): hiperlipidemia, hipercolesterolemia, HTA, temblores, cefalea, insuficiencia renal Frecuentes (entre 1/10-1/100): erupción cutánea, edemas, convulsiones, hirsutismo, hiperpotasemia, hipomagnesemia, hiperuricemia, diabetes, colestasis, hiperplasia gingival, síndromes linfoproliferativos, alteraciones hepáticas, gastrointestinales | Cápsulas 25, 50, 100mg. Solución 100mg/ml. Ampollas 50g/ml, 250mg/5ml |
| Ciclofosfamida | 2 mg/kg/día IV infusión única | Mielosupresión dosis-dependiente, cistitis hemorrágica, náuseas y vómitos, alopecia reversible, SIADH, fibrosis renal, esterilidad, aspermia o azoospermia y amenorrea | Polvo para solución inyectable: 50, 100, 200mg. |
| Fármacos antiagregantes, anticoagulantes y fibrinolíticos | |||
| Dipiridamol | Dosis antiagregante: 3-6 mg/kg/día cada 8 h VO Administrar con agua o leche y separado de las comidas 1 hora antes o 2 después | Vasodilatación, antihipertensor, mareos, cefalea (dosis dependiente), exantema, prurito, alteraciones gastrointestinales Mayor riesgo de hemorragia asociado a anticoagulantes, y fármacos con efecto antiplaquetario (ácidos grasos omega 3 y vitamina E, AINE y ácido valproico Aumenta los niveles y efecto de: adenosina, y sus efectos B-bloqueantes (bradicardia) Disminuye el efecto de los inhibidores de la colinesterasa | Comprimidos 100 mg Fórmula magistral: 10 mg/mL suspensión oral |
| Clopidogrel | -Neonatos y < 2 años: 0,2mg/kg/día cada 24 h VO ->2 años: 1 mg/kg/día VO titulando la respuesta Máx. 75mg Administrar sin relación con las comidas | Prurito, hemorragia gastrointestinal, epistaxis Aumenta el riesgo de sangrado unido a fármacos que alteran la hemostasia Disminuye su efectividad en metabolizadores lentos CYP2C19 | Comprimidos 75mg, 300 mg Fórmula magistral: 5 mg/mL suspensión oral |
| Abciximab | Dosis inicial: 0,25 mg/kg IV en bolo a pasar en 10-60min. seguido de infusión continua 0,125μg/kg/minuto (máximo 10μg/minuto durante 12 h IV) Concentración dilución en adultos: 28,8μg/ml o 36μg/ml diluido en glusosalino o salino fisiológico | Riesgo de sangrado, que aumenta con otros fármacos o factores que afecten a la hemostasia (4-17%) Otros (>10%): hipotensión, dolor torácico, dolor lumbar, náuseas. Puede presentar reacciones de hipersensibilidad. Administrar en vías venosas compresibles. No administrar si historia de hemorragia gastrointestinal reciente, cirugía o traumatismo mayor (menos de 6 semanas), accidente cerebrovascular, trombopenia (< 100.000 / μL). Monitorización de plaquetas a las 2-4 h del bolo y a las 12 h del inicio. Inicio acción a los 10 min, duración acción antiplaquetaria hasta las 72 h o incluso 7 días | Solución inyectable y para perfusión 2 mg/ml |
| Heparina de bajo peso molecular (enoxaparina sódica) | En pediatría no administrar cada 24 h por mayor aclaramiento del fármaco - <12 meses de edad: Tratamiento: 3 mg/kg/día SC cada 12 h Prevención: 1,5 mg/kg/día SC cada 12 h. - Niños y adolescentes: Tratamiento: 2 mg/kg/día SC cada 12 h Prevención: 1 mg/kg/día cada 12 h | Efectos adversos mayores: shock anafiláctico, sangrado, trombocitopenia, trombosis Nivel terapéutico: 0,5 – 1 U/ml Nivel profiláctico: 0,1- 0,3 U/ml Ajustar siguientes dosis según actividad antifactor Xa y nomograma específico. Ajustar dosis si insuficiencia renal grave Riesgo de hiperpotasemia | Jeringas precargadas, solución inyectable 100 mg/ ml Diversas presentaciones: 10.000 UI/ml y 15.000 UI/ml |
| Heparina sódica no fraccionada | Dosis inicial: 75 U/kg en bolo IV en 10min Mantenimiento: < 1 año: 28 UI/kg/h IV > 1 año: 20 UI/kg/h IV Control de TTPa a las 6 h, objetivo: 60-85 seg | Riesgo alto de sangrado Difícil manejo. Poca experiencia en Pediatría Gran variabilidad entre pacientes | |
| Acenocumarol | Primera dosis: -Neonatos: 0,2 mg/kg VO - < 1 año: 0,1 mg/kg/día VO -1- 5 años: 0,06 mg/kg día VO. Ajustar según INR (objetivo 2-3) Pico de acción a las 36- 48 h | Aumento del riesgo de sangrado. Suspender si INR>4 Su efecto puede verse afectado por la ingesta de vitamina K en la dieta | Comprimidos 1 y 4mg. |
| Alteplasa | Trombólisis IV: dois estándar: 0,5 mg/kg/h (0,1-0,6 mg/kg/h durante 6 h Dosis baja: 0,03 - 0,06 mg/kg/h de 12 a 48 h Máximo 2 mg/h | Alto riesgo de sangrado. Embolización de colesterol. Angioedema lingual | Polvo y disolvente para solución inyectable y para perfusión. Viales de 10mg, 20mg y de 50mg. Para preparar solución 1 mg/ml |
| Uroquinasa | Trombólisis IV: 1,0-1,6×104 U/kg En 30-60 min Trombólisis intracoronaria: 0,4×104 unidades/kg en 10 min Puede repetirse la administración hasta 4 veces | Alto riesgo de sangrado | Polvo y disolvente para solución para perfusión: viales de 100.000 UI. y de 250.000 UII. Para preparar solución 50.000UI/ml |
Aproximadamente entre 10-20% de los pacientes con EK, tienen fiebre persistente 36 h después del tratamiento con IGIV y AAS25. En estos pacientes persiste la inflamación y la posibilidad de daño coronario.
El uso de corticoides como tratamiento adyuvante de primera línea es controvertido, pero cada vez hay más estudios que apoyan su uso26,27.
En pacientes japoneses con scores de alto riesgo para la resistencia al tratamiento inicial con IGIV, los corticoides utilizados junto con IGIV y AAS, disminuyen la inflamación, mejoran el pronóstico coronario y acortan la duración de los síntomas26, y en sus guías están incluidos como tratamiento adyuvante de primera línea en dicho supuesto16.
Dos metaanálisis recientemente publicados, muestran que la terapia con corticoides ha sido efectiva para prevenir las lesiones coronarias, en población predominantemente japonesa28,29. En poblaciones de nuestro entorno, así como en Estados Unidos30, no se han validado los scores de riesgo japoneses. La American Heart Association considera su posible uso en pauta larga junto con IGIV en pacientes con factores predictores de no respuesta a la IGIV, así como la utilización de bolos de metilprednisolona para el tratamiento adicional de los que no responden a la dosis inicial o recurrente de IGIV y junto con la segunda dosis de IGIV en pacientes que no responden a la IGIV inicial en formas de pauta larga con disminución gradual11.
Los corticoides se pueden considerar como terapia preventiva para niños con EK grave y como terapia de rescate para pacientes que no responden inicialmente. Sin embargo, el uso sistemático de corticoides en todos los enfermos con EK precisa de más estudios, sobre todo fuera de Japón.
La terapia biológica con infliximab, anticuerpo monoclonal antifactor de necrosis tumoral alfa (TNFα), parece eficaz en disminuir la inflamación, pero no así en suprimir la vasculitis31. Su uso como adyuvante al tratamiento de primera línea parece seguro, pero no mejora el pronóstico coronario.
No hay datos evidentes de qué tratamiento utilizar en los pacientes resistentes a la primera dosis de IGIV. Muchos expertos recomiendan una segunda dosis de IGIV, aunque nunca se ha llevado a cabo un ensayo clínico para comprobar su efectividad3. Los corticoides también se han utilizado como tratamiento de segunda línea en estos pacientes como ya se ha descrito previamente. Parece que los ciclos prolongados de corticoides podrían suprimir la inflamación vascular, pero no existen ensayos clínicos que comparen diferentes regímenes de corticoides.
Se han realizado 2 estudios retrospectivos y un estudio multicéntrico randomizado que comparan el uso de infliximab en pacientes resistentes a la IGIV frente a una segunda dosis de la misma32. El infliximab disminuye el tiempo de hospitalización y la fiebre, pero no las secuelas cardiacas ni los efectos secundarios. Existen 3 casos publicados, con ensayos clínicos en marcha, que describen el uso exitoso de anakinra, agonista del receptor de la interleukina 1 (IL-1), en pacientes con EK altamente refractaria al tratamiento convencional33–36. Disminuye la fiebre y los parámetros analíticos con mejoría de las secuelas cardiacas a corto plazo, por lo que debe considerarse su uso como terapia en pacientes resistentes al tratamiento convencional.
La ciclosporina parece disminuir el tiempo de hospitalización y la fiebre, pero no las secuelas cardiacas. En la actualidad se realiza un ensayo clínico con el uso de la ciclosporina junto con IGIV37. La ciclofosfamida, muy utilizada en otras vasculitis, debería reservarse para casos muy severos por sus efectos secundarios, al igual que la plasmaféresis.
Existe la posibilidad de diagnóstico tardío de la enfermedad (más allá del 10 día de enfermedad) sin presencia ya de fiebre ni elevación de reactantes de fase aguda. En estos casos, sería recomendable instaurar tratamiento con AAS a dosis antiagregante (3-5mg/kg/día) que se mantiene hasta pasado el periodo agudo de la enfermedad (6-8 semanas) y comprobación de la normalidad ecocardiográfica y de la cifra de plaquetas.
En base a la evidencia previa, este consenso propone diferentes pautas de tratamiento en función de los factores de riesgo al diagnóstico, situación clínica del paciente y respuesta al tratamiento convencional y esteroideo previo (fig. 2).
Nota: este consenso recomienda la consulta a un experto/equipo de expertos ante la toma de decisiones en caso de duda y en determinados casos complejos.
Tratamiento de la disfunción miocárdica/shock en fase agudaLa función miocárdica suele recuperarse tras el tratamiento con IGIV porque mejora la inflamación y las manifestaciones sistémicas. En situaciones en las que exista inestabilidad hemodinámica leve, el paciente suele responder al tratamiento con diuréticos y vasopresores. El shock puede ser de causa cardiogénica, distributiva o mixta, similar al shock séptico, por vasodilatación producida por factores inflamatorios, hipovolemia absoluta y relativa y disfunción miocárdica. Se debe asociar al tratamiento con IGIV el uso de agentes inotrópicos y vasopresores (dobutamina, adrenalina, noradrenalina y dopamina) en estos casos11.
Prevención y tratamiento de la trombosis en pacientes con aneurismas coronariosAdemás de la rotura de un aneurisma coronario, muy poco frecuente, la oclusión trombótica de un aneurisma coronario y el infarto de miocardio secundario es la complicación más importante de la fase aguda de la EK.
Un empeoramiento rápido en la función ventricular o los cambios en el ECG deben hacer sospechar trombosis coronaria. En caso de aneurismas coronarios y aumento progresivo de sus dimensiones, se debe valorar incrementar el tratamiento antitrombótico (p. ej. añadir clopidogrel al AAS) puesto que la falta de adecuación del tratamiento antitrombótico a las lesiones coronarias constituye el factor más importante contribuyente al mal pronóstico durante la fase aguda de la enfermedad.
El manejo en este apartado se extrapola de la práctica en adultos con enfermedad coronaria o cerebrovascular (tablas 4 y 5).
Riesgo y seguimientoLos pacientes con EK son estratificados en varios grupos según el grado de afectación coronaria en cualquier momento de la enfermedad. Los factores de riesgo de isquemia a tener en cuenta, aparte del tamaño del aneurisma, son: mayor longitud del aneurisma y localización distal, ausencia de colaterales y obstrucción, antecedente de trombosis, infarto agudo de miocardio (IAM), revascularización o presencia de disfunción ventricular. A mayor afectación coronaria, mayor riesgo de presentar isquemia, por lo que el tratamiento y seguimiento será diferente en los diferentes grupos (tabla 6). Este calendario de seguimiento se inicia cuando finaliza la fase aguda (4-6 semanas) y el diámetro de las coronarias no progresa.
Seguimiento cardiológico en función del riesgo en pacientes con EK
| Riesgo | Seguimiento cardiológicoa | Pruebas en el seguimiento | Tratamiento farmacológico | Tratamiento no farmacológico y recomendaciones de ejercicio físico |
|---|---|---|---|---|
| 1. Nunca alteraciones coronarias (Zscore siempre <2) | No precisa. Alta a las 6 semanas del inicio de la enfermedad. Puede considerarse revisión a los 12 meses | - No necesarias. - Prevención factores riesgo cardiovascularb | AAS (3-5 mg/kg) hasta las 6 semanas del inicio de la enfermedad Posteriormente no precisa | No se recomienda limitar la actividad física más allá de 6-8 semanas |
| 2. Ectasia (ZS siempre de 2 a <2,5) | Alta a los 12 meses (Si persiste ectasia revisión cada 2-5 años) | Valorar continuar con AAS (3-5 mg/kg) si persiste ectasia | ||
| 3. Aneurisma pequeño (Z score ≥2,5 a <5) | ||||
| 3.1 Persisten | 6 y 12 meses (primer año), posteriormente una vez al año | - Pruebas de estrés miocárdicoc cada 2-3 años o si síntomas de isquemia o signos de disfunción ventricular - Valorar angiografíad cada 3-5 años - Prevención factores riesgo cardiovascularb | AAS (3-5 mg/kg) hasta regresión de aneurismas Considerar estatinas | < 11 años: No se recomienda limitar la actividad física más allá de 6-8 semanas > 11 años: valorar limitar la actividad física en función de los resultados de las pruebas de estrés miocárdico y de la capacidad funcional del paciente |
| 3.2 Disminuyen a dilatación o normal | 1-3 años | - Pruebas de estrés miocárdicoc cada 3-5 años o si síntomas de isquemia o signos de disfunción ventricular - Valorar angiografíadsi isquemia inducible - Prevención factores riesgo cardiovascularb | ||
| 4. Aneurisma mediano (Z score ≥5 a <10 y diámetro máximo < 8 mm) | ||||
| 4.1 Persisten | 3-6-12 meses (primer año). 6-12 meses | - Pruebas de estrés miocárdicoc cada 1-3 años o si síntomas de isquemia o signos de disfunción ventricular - Valorar angiografíad cada 2-5 años - Prevención factores riesgo cardiovascularb | AAS (3-5 mg/kg) Considerar anticoagulación (acenocumarol/HBPM) o doble antiagregación (clopidogrel) si persisten Considerar doble antiagregación (añadir clopidogrel) si disminuyen Considerar estatinas | < 11 años: No se recomienda limitar la actividad física más allá de 6-8 semanas > 11 años: valorar limitar la actividad física en función de los resultados de las pruebas de estrés miocárdico y de la capacidad funcional del paciente Si anticoagulación evitar deportes de contacto |
| 4.2 Disminuye a pequeño | 1 año | - Pruebas de estrés miocárdicoc cada 2-3 años o si síntomas de isquemia o signos de disfunción ventricular - Valorar angiografíad cada 3-5 años - Prevención factores riesgo cardiovascularb | ||
| 4.3 Disminuye a dilatación o normal | 1-2 años | - Pruebas de estrés miocárdicoc cada 2-4 años o si síntomas de isquemia o signos de disfunción ventricular - Angiografíad si isquemia inducible - Prevención factores riesgo cardiovascularb | ||
| 5. Aneurisma gigante (Z score ≥10 y/o ≥ 8 mm) | ||||
| 5.1. Persisten | 1-2-3-6-9-12 meses (primer año). 3-6 meses | - Pruebas de estrés miocárdicoc cada 6-12 meses o si síntomas de isquemia o signos de disfunción ventricular - Valorar angiografíad a los 6-12 meses y cada 1-5 años - Prevención factores riesgo cardiovascularb | AAS (3-5 mg/kg). Anticoagulación con acenocumarol o HBPM si persistentes o disminuyen a medianos Considerar si disminuyen a pequeños, con retirada si regresan Considerar doble antiagregación (AAS + clopidogrel) + anticoagulación si persisten, y en lugar de anticoagulación si disminuyen de tamaño o regresan Considerar tratamiento con betabloqueantes Considerar estatinas | Limitar la actividad física en función de los resultados de las pruebas de estrés miocárdico y de la capacidad funcional del paciente Si anticoagulacion evitar deportes de contacto |
| 5.2. Disminuyen a medianos | 6-12 meses | - Pruebas de estrés miocárdicoc cada año o si síntomas de isquemia o signos de disfunción ventricular - Valorar angiografíad cada 2-5 años - Prevención factores riesgo cardiovascularb | ||
| 5.3 Disminuyen a pequeños | 6-12 meses | - Pruebas de estrés miocárdicoc cada 1-2 años o si síntomas de isquemia o signos de disfunción ventricular - Valorar angiografíad cada 2-5 años - Prevención factores riesgo cardiovascularb | ||
| 5.4. Disminuyen a dilatación o normal | 1-2 años | - Valorar pruebas de estrés miocárdicoc cada 2-5 años o si síntomas de isquemia o signos de disfunción ventricular - Angiografíad si isquemia inducible - Prevención factores riesgo cardiovascularb | ||
| Estenosise y/o trombosis | Cada 6 meses | - Pruebas de estrés miocárdicoc cada año - Angiografía inicial y en el seguimiento según evolución | Anticoagulación Betabloqueantes | Cateterismo intervencionista en casos con estenosis severas 5 de las arterias coronarias Bypass coronario en casos con lesión oclusiva severa en arteria coronaria izquierda o en enfermedad de dos o tres vasos, siempre que exista miocardio viable |
La evaluación cardiológica incluye historia clínica y exploración física, electrocardiograma y ecocardiograma (no siendo obligada esta última en los pacientes con normalización coronaria (salvo síntomas de isquemia, signos de disfunción ventricular o isquemia inducible).
La prevención primaria de los factores de riesgo cardiovascular incluye: medir tensión arterial, vigilar índice de masa corporal (IMC) y circunferencia abdominal, educar en hábitos dietéticos adecuados, evitar hábito tabáquico y sedentarismo. En pacientes con antecedente de aneurismas se realizará un perfil lipídico cada 5 años. Este seguimiento puede ser realizado por el pediatra de atención primaria.
Pruebas de estrés miocárdico: ecografía de estrés, resonancia magnética (RM), medicina nuclear o tomografía por emisión de positrones (PET). La elección de una u otra técnica será por cada centro según experiencia y teniendo en cuenta someter al paciente al menor riesgo. En menores de 6 años asintomáticos, sin síntomas de isquemia o signos de disfunción ventricular se puede considerar realizar solo estudio anatómico coronario no invasivo en reposo.
El riesgo cardiovascular en pacientes sin aneurismas es similar al de la población general, por lo que estos pacientes pueden ser dados de alta de la consulta de cardiología tras comprobar la normalización de las arterias coronarias, haciendo hincapié en el control de factores de riesgo cardiovascular2.
Cuando existen aneurismas, la resolución en los primeros 3 meses es del 15%, con regresión de la mayoría en los 2 años siguientes, dependiendo del grado de afectación38. Pese a la regresión la zona aneurismática puede estenosarse de manera progresiva como resultado de la proliferación miofibroblástica luminal. Por este motivo, los pacientes con aneurismas en la fase aguda de la enfermedad, independientemente de que hayan regresado, precisan seguimiento cardiológico a largo plazo.
Los pacientes con afectación coronaria grave no suelen tener síntomas cardiológicos, salvo que se produzca isquemia miocárdica secundaria a obstrucción y trombosis.
Los síntomas y signos de IAM pueden ser atípicos e inespecíficos en niños, especialmente en lactantes. Existen pocos casos descritos de isquemia miocárdica en niños, debido al desarrollo de circulación colateral, y se han relacionado con la rotura de aneurismas en fase aguda por crecimiento exacerbado de los mismos.
Siempre que exista isquemia inducible durante el seguimiento, se recomienda realizar angiografía invasiva para detectar estenosis coronaria, aunque los pacientes estén asintomáticos.
Paciente adulto con enfermedad de KawasakiLa EK en fase aguda no suele presentarse en población adulta. Los pacientes con historia de EK fueron dados de alta o son aquellos que han tenido secuelas. El seguimiento se programa en función de la presencia y gravedad de la afectación coronaria, presente o pasada, centrándose en los cambios de dichas arterias, en la función valvular y en las anomalías miocárdicas (función, perfusión y cicatrices) (tabla 6).
Los aneurismas están localizados en las arterias coronarias a nivel epicárdico, siendo las localizaciones más frecuentes segmentos proximales de la arteria descendente anterior y la coronaria derecha, seguidas por el tronco de la coronaria izquierda y la arteria circunfleja, segmentos distales de la coronaria derecha, y arteria descendente posterior, siempre con predilección por las zonas de bifurcación.
La mortalidad a largo plazo entre pacientes japoneses afectos de la EK con secuelas cardiológicas es mayor que la población general39. Estudios recientes sugieren una alta prevalencia de eventos cardiacos adversos relacionados con EK en adultos jóvenes. En Estados Unidos, el 5% de los IAM en pacientes menores de 40 años ocurren en pacientes con historia conocida (1,5%) o sospechada (3,5%) de EK40. En Japón, hasta un 9% de los IAM y muerte súbita cardiaca en adultos jóvenes es atribuible a antecedentes de EK16.
La AHA recomienda la transición a cardiología de adultos en torno a los 18-21 años11. Los cardiólogos de adultos necesitan estar al tanto de esta cohorte creciente de adultos jóvenes con riesgo de secuelas cardiacas de su enfermedad infantil, haciendo esencial la colaboración entre el cardiólogo infantil y de adultos.
Nota: para participar en estudio KAWA-RACE, contactar con kawasaki.kawarace@gmail.com
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen al Dr. Masaru Miura, adjunto del Departamento de Cardiología de Tokyo Metropolitan Children's Medical Center, su inestimable colaboración en el desarrollo y revisión del presente documento.
Miembros del Grupo de Trabajo «Cardiología Clínica» de la Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas (SECPCC):
Colaboradores directos en la realización del presente documento:
Dra. Leticia Albert de la Torre (Hospital Materno Infantil Doce de Octubre. Madrid).
Dr. Carlos Alcalde Martín (Hospital Universitario Río Hortega. Valladolid).
Dra. María Álvarez-Fuente (Hospital Ramón y Cajal. Madrid).
Dra. Carolina Blanco Rodríguez (Centro de salud Infanta Mercedes. Madrid).
Dra. Gemma Giralt García (Hospital Materno Infantil de Vall d’Hebrón. Barcelona. Sociedad Española de Cardiología).
Dr. Federico Gutiérrez-Larraya (Hospital Universitario La Paz. Madrid. Sociedad Española de Cardiología).
Dra. Libertad Latorre Navarro (Hospital Universitario Infanta Sofía. San Sebastián de los Reyes, Madrid).
Dr. Antonio Sánchez Andrés (Hospital Universitario y Politécnico La Fe. Valencia. Sociedad Española de Cardiología).
Dra. Belén Toral Vázquez (Hospital Materno Infantil Doce de Octubre. Madrid. Sociedad Española de Cardiología).
Dra. Paula de Vera McMullan (Hospital Universitario Fundación Alcorcón. Alcorcón, Madrid).
Grupo de Trabajo «Cardiología Clínica» de la Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas (SECPCC):
Georges Akel Pérez (Hospital de Nens de Barcelona. Barcelona), Francisco Javier Alados Arboledas (Complejo Hospitalario de Jaén. Jaén), Carlos Alcalde Martín (Hospital Universitario Río Hortega. Valladolid), Josune Alegría Echauri (Hospital Universitario Marqués de Valdecilla. Santander. Cantabria), Patricia Aparicio García (Hospital Son LLàtzer. Palma de Mallorca, Mallorca), Paola Arévalo (Hospital San Francisco de Asís. Madrid), August Armengol Rofes (El Vendrell, Tarragona), María Arroyas Sánchez (Hospital Severo Ochoa. Leganés. Madrid), Enrique José Balbacid Domingo (Hospital La Paz. Madrid), Antonio Baño Rodrigo (Hospital Universitario Niño Jesús. Madrid), María Silvina Barcudi Abbona (Hospital Universitario de Mutua Terrassa. Tarrasa, Barcelona), Isabel Barranco Fernández (Hospital Universitario Príncipe de Asturias. Alcalá de Henares. Madrid), Ana Barrios Tascón (Hospital Universitario Infanta Sofía. San Sebastián de los Reyes, Madrid), Clara María Bernáldez Torralva (Hospital Perpetuo Socorro. Las Palmas de Gran Canaria, Las Palmas), Enrique Blanca Jover (Hospital Clínico San Carlos. Madrid), Carolina Blanco Rodríguez (Centro de Salud Infanta Mercedes. Madrid), Sonia Blázquez Trigo (Hospital Universitario de Cruces. Barakaldo. Vizcaya), María Jose Bravo Sayago (Hospital Costa del Sol. Marbella. Málaga), María Jesús Caldeiro Díaz (Hospital Infanta Elena. Valdemoro. Madrid), María Teresa Cantero Tejedor (Hospital Río Carrión. Palencia), José Ignacio Carrasco Moreno (Hospital Universitario y Politécnico La Fe. Valencia), Carmen Carreras Blesa (Hospital Universitario Virgen de las Nieves. Granada), Juan Manuel Carretero Bellón (Hospital Sant Joan de Déu. Barcelona), María Pia Cassanello (Hospital Universitari General de Catalunya. Sant Cugat del Vallés. Barcelona), Fernando Centeno Malfaz (Hospital Universitario Río Hortega. Valladolid), Adela Cristina Cis Spoturno (Centro Médico Mediterráneo. Almería), Rosa Collell Hernández (Hospital Universitario Sant Joan. Reus, Tarragona), Juan Antonio Costa Orvay (Hospital can Misses. Ibiza), David Crespo Marcos (Hospital Universitario Fundación Alcorcón. Alcorcón, Madrid), Héctor Augusto Cuéllar Manotas (Hospital Ciudad de Coria. Cáceres), Victorio Cuenca Peiro (Hospital Universitario Carlos Haya. Málaga), Adalgisa Patricia de Caro (Hospital la Vega. Murcia), María de la Parte Cancho (Hospital General de Villalba. Villalba. Madrid), Lucas Alberto Degano Iglesias (Hospital Vall D¿Hebron. Barcelona), Lucía Deiros Bronte (Hospital Universitario La Paz. Madrid), Beatriz del Pozo Menéndez (Hospital Universitario 12 de Octubre. Madrid), Laura del Rey Megías (Complejo Hospitalario Universitario de Albacete. Albacete), Juan José Díez Tomás (Centro Médico de Asturias. Oviedo, Asturias), Paola Dolader Colina (Hospital Vall D’Hebron. Barcelona), Olga Domínguez García (Hospital Virgen de la Salud. Toledo), María Nieves Domínguez Garrido (Fundación Jiménez Díaz. Madrid), Paula Domínguez Manzano (Hospital Universitario 12 de Octubre. Madrid), Jesús Duque Bedoya (Hospital Don Benito-Villa-Nueva. Don Benito, Badajoz), Javier Echeverría Espinosa (Hospital General Universitario Gregorio Marañon. Madrid), Fidel Ernesto Echeverría Nava (Hospital Virgen de la Peña. Fuerteventura, Las Palmas), Hemir David Escobar Pinela (Hospital Universitario de Torrejón. Torrejón. Madrid), María Esquivias Asenjo (Hospital Universitario Ramón y Cajal. Madrid), Ana Patricia Fariña Ruiz (Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife), Javier Fernández Aracama (Hospital Universitario Central de Asturias. Oviedo, Asturias), Javier Fernández Sarabia (Hospital Universitario de Canarias. La Laguna, Santa Cruz de Tenerife), María Teresa Fernández Soria (Hospital Universitario Infanta Cristina. Parla, Madrid), Natalia Fernández Suárez (Hospital Universitario de Cruces. Barakaldo. Vizcaya), Aina Ferré Belda (Hospital del Vinalopó. Elche. Alicante), Sergio Flores Villar (Hospital Universitari Mutua de Terrassa. Terrasa. Barcelona), Julio Fontenla García (Complejo Hospital Universitario de Ourense. Ourense), Ángeles Fuertes Moure (Hospital Maternoinfantil Teresa Herrera. A Coruña), Antonia Pastora Gallego García de Vinuesa (Hospital Universitario Virgen Macarena. Sevilla), Marta Gambra Arzoz (Hospital del Sureste. Arganda. Madrid), Francisco García Angleu (Hospital infantil Virgen del Rocío. Sevilla), Estefanía García Cerro (Hospital Universitario Príncipe de Asturias. Alcalá de Henares. Madrid), María Elvira Garrido-Lestache Rodríguez-Monte (Hospital Universitario Ramón y Cajal. Madrid), Nuria Gil Villanueva (Hospital Universitario Infanta Leonor. Madrid), Maribel Giner Crespo (Hospital Universitario y Politécnico La Fe. Valencia), Gema Giralt García (Hospital Vall D’Hebron. Barcelona), María Ersilia González Carrasco (Hospital Universitario Severo Ochoa. Leganés, Madrid), María Aránzazu González Marín (Hospital General de Ciudad Real. Ciudad Real), Cristina González Menchén (Hospital Clínico San Carlos. Madrid), Fernando Gran Ipiña (Hospital Universitario Vall d¿Hebron. Barcelona), Inmaculada Guillén Rodríguez (Hospital Virgen de Valme. Sevilla), María Teresa Guixeres Esteve (Hospital Universitario y Politécnico La Fe. Valencia), Manuel Haro Gómez (Hospital Universitario Virgen Macarena. Sevilla), Aida Hernández Blanco (Hospital Internacional Medimar. Alicante), Yolanda Herranz Sánchez (Hospital de la Marina Baixa. Villajoyosa, Alicante), Carmen Herrera del Rey (Hospital Universitario Virgen del Rocío. Sevilla), Aleida Ibañez Fernández (Hospital Universitario Central de Asturias. Oviedo, Asturias), Gema Iñigo Martín (Hospital Virgen de la Salud. Toledo), Ignacio Izquierdo Fos (Hospital General Universitario de Elche. Elche. Alicante), María Ángeles Izquierdo Riezu (Hospital Universitario Donostia. San Sebastián), María Soledad Jiménez Casso (Hospital general de Segovia. Segovia), Lorenzo Jiménez Montañés (Hospital Miguel Servet. Zaragoza), Carlos Labrandero de Lera (Hospital Universitario La Paz. Madrid), Libertad Latorre Navarro (Hospital Universitario Infanta Sofía. San Sebastián de los Reyes, Madrid), Bernardo López Abel (Hospital Clínico Universitario. Santiago de Compostela, La Coruña), María Lozano Balseiro (Hospital Maternoinfantil Teresa Herrera. A Coruña), José Luaces González (Hospital Marcide-Novoa Santos. Ferrol. A Coruña), Nazaret Macías Julián (Hospital UPS Marbella. Málaga), Jesús Antonio Mairal Cazcarra (Hospital de Terrassa. Barcelona), María José Maldonado Toral (Hospital General de Villalba. Villalba. Madrid), Alejandra Manchola Linero (Hospital Universitaru Vall D¿Hebron. Barcelona), Begoña Manso García (Hospital Universitario Vall d¿Hebron. Barcelona), María Maravall Llagaria (Hospital General de Valencia. Valencia), Sonia Marcos Alonso (Hospital Maternoinfantil Teresa Herrera. A Coruña), Cristina Marimón Blanch (Hospital Universitario Sant Joan. Reus, Tarragona), Ismael Martín de Lara (Hospital General Universitario de Alicante. Alicante), María Martínez del Villar (Hospital General Universitario de Alicante. Alicante), María Isabel Martínez Lorente (Hospital Rafael Méndez. Lorca. Murcia), Patricia Martínez Olorón (Hospital Virgen del Camino. Pamplona, Navarra), María Isabel Martínez Soto (Complejo Hospitalario Universitario de Santiago. Santiago de Compostela, La Coruña), Laura Marzo Checa (Clínica del Vallés. Sabadell. Barcelona), Miguel Ángel Matamala Morillo (Hospital General Mancha Centro. Alcázar de San Juan. Ciudad Real), Constancio Medrano López (Hospital Universitario Gregorio Marañón. Madrid), Paula Méndez Abad (Hospital Universitario Virgen del Rocío. Sevilla), Francisco Meza Ortiz (Hospital Nuestra Señora del Prado. Talavera de la Reina. Toledo), Ana Moriano Gutiérrez (Hospital Lluis Alcanyis. Játiva, Valencia), Antonio Moruno Tirado (Hospital Universitario Virgen del Rocío. Sevilla), Ángeles Ortega Montes (Complejo Hospitalario Torrecárdenas. Almería), Alfonso Ortigado Matamala (Hospital Universitario de Guadalajara. Guadalajara), Almudena Ortiz Garrido (The Royal Brompton Hospital. Londres. Reino Unido), Ignacio Oulego Erroz (Complejo Asistencial Universitario de León. León), Jorge Roberto Palacios Argueta (Corporación Sanitaria del Parc Tauli. Sabadell. Barcelona), Laura Parra Agüera (IMED Elche / CS Babel. Alicante), Esteban Peiró Molina (Hospital Universitario Politécnico La Fe. Valencia), Julio Ernesto Peralta Salas (Hospital del Tajo. Aranjuez. Madrid), César Jorge Perera Carrillo (Hospital Universitario de Canarias. La Laguna, Santa Cruz de Tenerife), Dolores Pérez Campos (Hospital Universitario de Fuenlabrada. Fuenlabrada, Madrid), Verónica Pérez Herrera (Consorci Sanitari del Maresme - Hospital de Mataró. Barcelona), María Ángeles Pérez Moneo Agapito (Hospital Universitario La Paz. Madrid), Alejandro Pérez Muñuzuri (Hospital Clínico Universitario. Santiago de Compostela, La Coruña), Ana María Pérez Pardo (Hospital General de Cataluña. Sant Cugat del Vallés. Barcelona), José María Pérez Roldán (Hospital Universitario de Cruces. Barakaldo. Vizcaya), Francisco Javier Pérez-Lescure Picarzo (Hospital Universitario Fundación Alcorcón. Alcorcón, Madrid), María Rosa Pérez-Piaya Moreno (HM Universitario Montepríncipe. Madrid), Francesca Perin (Hospital Universitario Virgen de las Nieves. Granada), Isabel Pinto Fuentes (Hospital Universitario Severo Ochoa. Leganés, Madrid), Beatriz Plata Izquierdo (Hospital Universitario de Salamanca. Salamanca), María Portoles Morales (Hospital de la Plana. Villareal. Castellón), María Ángeles Puigdevall Dalmau (Hospital Universitario Doctor Josep Trueta. Gerona), Erika Pulido Ovalle (Hospital Universitario Infanta Elena. Valdemoro. Madrid), María Teresa Raga Poveda (Hospital Universitario Infanta Sofía. San Sebastián de los Reyes, Madrid), Sara Rellán Rodríguez (Hospital Clínico Universitario de Valladolid. Valladolid), Susana María Rey García (Complexo Hospitalario Universitario de Ourense. Orense), Erika Rezola Arcelus (Hospital Universitario Donostia. San Sebastián), Bibiana Riaño Méndez (Hospital Universitario San Pedro. Logroño, La Rioja), Andrés Rico Armada (NE22HS. Newcatle Upon Tyne. Reino Unido), Natalia Rivero Jiménez (Hospital Universitario Ramón y Cajal. Madrid), Moisés Rodríguez González (Hospital Universitario Puerta del Mar. Cádiz), María Dolores Rodríguez Mesa (Hospital Universitario Infanta Cristina. Parla. Madrid), Raúl Rodríguez Serrano (Hospital Universitario de Basurto. Bilbao, Vizcaya), María Henar Rojo Sombrero (Hospital Universitario Príncipe de Asturias. Alcalá de Henares. Madrid), Violeta Román Barba (Hospital General de Ciudad Real. Ciudad Real), Carlos Romero Ibarra (Hospital Virgen del Camino. Pamplona, Navarra), Félix Romero Vivas (Hospital Universitario Materno-Infantil. Badajoz), Fernando Rueda Núñez (Hospital Maternoinfantil Teresa Herrera. La Coruña), Joaquín Rueda Soriano (Hospital Universitario La Fe. Valencia), Anna Sabaté Rotés (Hospital Universitario Vall d¿Hebron. Barcelona), Francisco Javier Salas Salguero (Hospital SAS de Jerez. Jerez de la Frontera, Cádiz), Julio Federico Saldaña Capuñay (Hospital Seguro Social del Perú. Trujillo. Perú), Carlos Salido Peracaula (Hospital SAS de Jerez. Jerez de la Frontera, Cádiz), Antonio Sánchez Andrés (Hospital Universitario y Politécnico La Fe. Valencia), Alberto Sánchez Calderón (Hospital del Henares. Coslada. Madrid), Cristina Sánchez Vaquerizo (Hospital Universitario 12 de Octubre. Madrid), Elena Sanz Pascual (Hospital Universitario La Paz. Madrid), María Isabel Serrano Robles (Hospital General de Elche. Elche. Alicante), Ana Siles Sánchez-Manjavacas (Hospital Universitario Puerta de Hierro. Majadahonda, Madrid), Adolfo Sobrino Baladrón (Hospital General Universitario Gregorio Marañón. Madrid), Ruth Solana García (Hospital Universitario Infanta Leonor. Madrid), Dolors Soriano Belmonte (Hospital Universitario de Mutua Terrassa. Tarrasa, Barcelona), Moisés Sorlí García (Hospital General Universitario Santa Lucía. Cartagena, Murcia), Pedro Suárez Cabrera (Hospital Universitario Materno-Infantil de Canarias. Las Palmas de Gran Canaria, Las Palmas), Amalia Tamariz-Martel Moreno (Hospital Universitario Niño Jesús. Madrid), Rocío Tamariz-Martel Moreno (Hospital Universitario Ramón y Cajal. Madrid), María Ángeles Tejero Hernández (Hospital Universitario Reina Sofía. Córdoba), María Torres Rico (Hospital Punta de Europa. Algeciras. Cádiz), Susana Uriel Prat (Hospital Universitario Doctor Josep Trueta. Gerona), Ana Isabel Usano Carrasco (Hospital Universitario Puerta de Hierro. Majadahonda, Madrid), Estíbaliz Valdeolmillos Padrino (Hospital Universitario Severo Ochoa. Leganés. Madrid), María Teresa Valero Adán (Hospital Obispo Polanco. Teruel), Sandra Villagrá Albert (Unidad de Cardiopatías Congénitas del Hospital Universitario Montepríncipe. Madrid), Javier Villalba Nogales (Centro de Salud de Guadarrama. Madrid), Carin Cristina Walter (Hospital Sant Joan de Dèu. Barcelona), Marta Yagüe Martín (Hospital Universitario 12 Octubre. Madrid), María Dolores Zambrano Casajona (Hospital Sant Joan de Dèu. Barcelona).
En el anexo se relacionan los nombres de todos los autores del artículo.
Este documento cuenta con el aval de las siguientes Sociedades Científicas: Asociación Española de Pediatría (AEP); Sociedad Española de Cardiología (SEC); Sociedad Española de Infectología Pediátrica (SEIP); Sociedad Española de Reumatología Pediátrica (SERPE); Asociación Española de Pediatría de Atención Primaria (AEPap).