Presentamos una revisión de la evidencia sobre la prevención de la bronquiolitis aguda. La prevención en la bronquiolitis aguda se deriva de tres enfoques básicos: tratamiento preventivo para disminuir las sibilancias recurrentes posteriores a un episodio bronquiolitis aguda, tratamiento preventivo para disminuir la frecuencia y gravedad de la bronquiolitis por virus respiratorio sincitial (VRS) en población de riesgo (prematuridad, displasia broncopulmonar, cardiopatía congénita, etc.) y medidas preventivas generales para disminuir la infección nosocomial por VRS. Existe suficiente evidencia sobre la falta de eficacia de los corticosteroides inhalados, corticoides orales y montelukast. La inmunoglobulina intravenosa frente al VRS presenta un balance riesgo-beneficios desfavorable, máxime con la disposición de anticuerpos monoclonales. Palivizumab es eficaz como tratamiento preventivo frente a la infección por VRS en población de riesgo (prematuros de alto riesgo y cardiopatías congénitas hemodinámicamente significativas), pero no respecto a la frecuencia y la gravedad (ingreso en cuidados intensivos, necesidad de ventilación mecánica y mortalidad) de la bronquiolitis aguda. Los beneficios de palivizumab (reducción de ingresos) parecen merecer la pena frente a los perjuicios (no diferencias significativas en los efectos adversos), pero no sabemos si frente a los costes. Las medidas de control y prevención frente a la infección nosocomial por VRS (aislamiento, lavado de manos, utilización de mascarillas, guantes, gorro y calzas) se apoyan en evidencias indirectas.
A review of the evidence on prevention of acute bronchiolitis is presented. Acute bronchiolitis prevention arises from three basic approaches: preventive treatment to reduce recurrent wheezing following an episode of acute bronchiolitis, preventive treatment to reduce the frequency and severity of RSV bronchiolitis in the population at risk (prematurity, bronchopulmonary dysplasia, congenital heart disease, etc.), and general preventive measures to reduce nosocomial infection with RSV. There is sufficient evidence on the lack of efficacy of inhaled corticosteroids, oral corticosteroids and montelukast. Intravenous RSV immunoglobulin has an unfavorable risk-benefit balance, particularly with the availability of monoclonal antibodies. Palivizumab is effective as preventive treatment of RSV infection in risk populations (high risk preterm infants and hemodynamically significant congenital heart disease), but not in the frequency and severity (ICU admission, need for mechanical ventilation and mortality) of the acute bronchiolitis. The benefits of palivizumab (less admissions) seem to be worth the adverse effects, but we do not know the cost–benefit ratio. The control and prevention measures of nosocomial transmission of RSV infection (isolation, hand washing, use of mask, gloves, cap and shoes) are based on indirect evidence.
Presentamos una revisión de la evidencia sobre prevención de la bronquiolitis aguda (BA). Esta revisión forma parte de la documentación elaborada para la «Conferencia de Consenso sobre bronquiolitis aguda», en el que se sustenta el estudio de idoneidad del proyecto titulado «Variabilidad e idoneidad del manejo diagnóstico y terapéutico de la BA aguda» (estudio «aBREVIADo»: BRonquiolitis-Estudio de Variabilidad, Idoneidad y ADecuación). La metodología de la revisión ha sido publicada en un artículo previo de esta serie1.
IntroducciónLa BA es la principal causa de ingreso por infección respiratoria de vías bajas en el niño menor de 2 años. El virus respiratorio sincitial (VRS) es el agente causal predominante, aunque otros virus están también implicados, tanto de forma aislada como en coinfección. El VRS es un virus RNA de cadena única, cuyo genoma está constituido por 10 genes y codifica 11 proteínas. Pese a su aparente simplicidad, el VRS pone en marcha mecanismos inmunopatogénicos complejos que han visto frustrado los intentos de desarrollar una vacuna para la prevención de esta enfermedad. El grado de afectación originado por el VRS es el resultado de una compleja interacción entre la agresión inducida directamente por el virus y el daño causado por la respuesta inmune, considerando además el papel que el propio virus tiene en la modulación de la respuesta inmunopatológica. Por otra parte, la infección no genera una respuesta inmunitaria que proteja frente a nuevas reinfecciones. Desde un punto de vista práctico, el espectro clínico-patológico de esta afectación oscilará entre dos patrones: la enfermedad obstructiva (BA por VRS) y la enfermedad restrictiva (neumonía por VRS), con importantes implicaciones en la respuesta al tratamiento y en la propia prevención.
La morbilidad aguda de la BA (consultas en Atención Primaria y Urgencias, ingreso hospitalario, necesidad de ingreso en UCI y ventilación mecánica en las formas más graves) y el riesgo de mortalidad se incrementa en los niños de menor edad y en aquellos que tienen problemas médicos previos (prematuridad, cardiopatía congénita, displasia broncopulmonar, inmunodeficiencia, etc.), dado que son más susceptibles de tener enfermedad grave. Además de la morbi-mortalidad causada por el VRS, estudios epidemiológicos y experimentales realizados en los últimos años sugieren la capacidad de este virus para causar patología pulmonar crónica, que se manifiesta fundamentalmente en forma de sibilancias recurrentes (enfermedad reactiva de las vías aéreas postronquiolitis) y que puede persistir hasta una década después de la infección aguda2–4. Otros virus podrían desencadenar efectos similares.
La prevención en la BA se plantea desde tres enfoques esenciales:
- a)
Tratamiento preventivo para disminuir las sibilancias recurrentes posteriores a un episodio de BA.
Es importante considerar que los niños menores de 3 años presentan una elevada incidencia y prevalencia de episodios de sibilancias recurrentes, con distintos subgrupos que expresan diferentes respuestas inflamatorias ante agentes desencadenantes diversos, subgrupos que difieren en etiopatogenia e inmunopatología. Identificar el fenotipo sibilante ayudaría a tomar decisiones terapéuticas, aunque en ocasiones se solapan características de distintos fenotipos en un mismo paciente, por lo que no está clara su utilidad predictiva. En general se distinguen tres fenotipos epidemiológicos en lactantes con sibilancias recurrentes, según los datos obtenidos a partir de la cohorte de Tucson5,6, que difieren en características, evolución y respuesta al tratamiento: sibilancias precoces transitorias (representa el 40–60%, cuyo principal factor de riesgo es la disminución de la función pulmonar al nacer), sibilancias persistentes no atópicas (el 20%, principalmente relacionado con infecciones virales) y sibilancias persistentes atópicas (el 20%, cuya principal característica es la atopia y la sensibilización precoz a alergenos). En el caso de la enfermedad reactiva de las vías aéreas postbronquiolitis, se encuadraría en el fenotipo de sibilancias persistentes no atópicas. Este fenotipo se inicia antes del año de edad y los episodios se prolongan más allá de los 3–5 años. El comienzo de la clínica se relaciona con infecciones virales, principalmente rinovirus y VRS, aunque se relaciona también con otros de reciente descripción (p. ej. metaneumovirus). En este grupo la función pulmonar es normal en el momento del nacimiento y se deteriora posteriormente. Se ha descrito la existencia de hiperrespuesta bronquial a la metacolina y se asume que en este grupo podría existir una respuesta exagerada del sistema immunitario, junto con alteraciones histológicas o funcionales de las vías aéreas.
En los lactantes que han presentado BA y tienen posteriormente sibilancias recurrentes nos enfrentamos a la incertidumbre de cómo actuar (a nivel del tratamiento agudo y del tratamiento de mantenimiento), pues no se dispone de marcadores biológicos que permitan predecir con certeza a cuál de los grupos fenotípicos descritos pertenece y distinguir a los lactantes con sibilancias recurrentes que van a ser futuros asmáticos atópicos. Para identificar a este grupo de lactantes se describió el índice predictivo de asma (IPA)7 o modificaciones de este8: los lactantes con más de 3 episodios de sibilancias al año, durante los primeros 3 años de vida, que además cumplieran con un criterio mayor o dos criterios menores, fueron denominados IPA positivos, con un valor predictivo positivo del 77% y un valor predictivo negativo del 68%, para desarrollar asma. Los lactantes con un IPA positivo tuvieron siete veces más riesgo de ser asmáticos en la edad escolar que aquellos con un índice negativo (OR=7,1; IC95%: 3,5–14,1). No obstante, no está clara la utilidad predictiva individual del IPA, por lo que con frecuencia tenemos que recurrir a ensayos terapéuticos.
Hasta el momento solo dos documentos de consenso9,10 han dedicado una atención específica al tratamiento del preescolar con sibilancias recurrentes, de acuerdo a su clasificación por fenotipos y/o al índice predictivo de asma. En general, las recomendaciones actuales sugieren que tanto el diagnóstico como la terapia iniciada en los niños de esta edad deben revisarse regularmente, de tal modo que si el beneficio no está claro, el tratamiento debe suspenderse y considerar un diagnóstico o tratamiento alternativo. Muchos niños con síntomas leves pueden ser controlados de forma conservadora con una simple información de la naturaleza del proceso. La introducción escalonada de fármacos de rescate y preventivos sigue las mismas líneas que para los niños mayores. La respuesta al tratamiento parece ser distinta en función del predominio de células inflamatorias (eosinófilos o neutrófilos) en el árbol bronquial: los corticoides inhalados ofrecen mejor respuesta cuando el fenotipo inflamatorio es de predominio eosinofílico y los antagonistas de los receptores de los leucotrienos cuando el fenotipo inflamatorio es de predominio neutrofílico; sin embargo, tampoco está clara la utilidad de estos fenotipos sobre la predicción de éxito de los distintos tratamientos en un paciente concreto.
La decisión de cuándo iniciar un tratamiento de mantenimiento preventivo en niños menores de 3 años con sibilancias recurrentes resulta difícil11,12, pues es posible que tratemos como asmáticos a preescolares que no lo son o, por el contrario, que no tratemos de forma apropiada a preescolares que si van a ser asmáticos, pensando que serán sibilantes transitorios. A estas edades se ha planteado el papel de los corticoides y de los inhibidores de los leucotrienos, así como de otras opciones terapéuticas (macrólidos, cromonas, etc.).
- b)
Tratamiento preventivo para disminuir la frecuencia y gravedad de la BA por VRS en población de riesgo (prematuridad, displasia broncopulmonar, cardiopatía congénita, etc.).
Junto a las medidas higiénicas básicas, en los últimos años, ha surgido un especial interés por la inmunoprofilaxis parenteral (inmunoglobulinas IV y, principalmente, anticuerpos monoclonales frente al VRS). Respecto a las indicaciones de su uso se dispone de un amplio abanico de recomendaciones de sociedades científicas (con especial consideración a las de la American Academy of Pediatrics y la Sociedad Española de Neonatología)13–17, sustancialmente congruentes en la voluntad de identificar factores de riesgo de BA grave, en relación con la disponibilidad de intervenciones preventivas de alto coste (principalmente palivizumab) y para las que se propone un uso racional.
No obstante, se observa cierta heterogeneidad en la utilización de palivizumab entre países, regiones y hospitales, debido principalmente a la diferente valoración de su eficiencia en los distintos grupos de riesgo. Por ello, su aplicación a la práctica clínica plantea retos al médico especialista (que debe integrar la evidencia científica al cuidado del paciente) y al gestor (que debe integrar la evidencia científica en la evaluación económica) y cuyo fin es lograr una terapia racional y coste-efectiva y la posibilidad de estratificar las indicaciones para hacer el uso más adecuado del medicamento18–20. Un reciente artículo en España, siguiendo el método Delphi, plantea un consenso multidisciplinar español sobre la profilaxis de la infección respiratoria por VRS21.
- c)
Medidas preventivas generales para disminuir la infección nosocomial por VRS.
Desde la descripción del VRS como patógeno responsable principal de la BA en 1956, el tema de la infección nosocomial es bien reconocido y consistente en el tiempo. La infección nosocomial por VRS es un problema con elevado coste económico, que afecta tanto en las unidades de hospitalización pediátrica como en la unidades de cuidados intensivos neonatales22.
Es bien reconocida la importancia de una labor educativa en este sentido (dirigida al personal sanitario y a la familia) y la importancia de las medidas de aislamiento en el paciente con BA ingresado, con la instauración de normas básicas reconocidas (restricción de visitas, lavado de manos, uso de guantes, etc.), pero no siempre establecidas con pruebas científicas sólidas.
Se ha postulado la introducción precoz de los corticoides inhalados con el objetivo de modificar la historia natural de las sibilancias recurrentes al asma e impedir el remodelado de las vías aéreas. Sin embargo, en recientes ECA23–25 se ha podido constatar que los corticoides inhalados administrados muy precozmente no modifican la historia natural del asma, aunque sí son capaces de controlar los síntomas de la enfermedad mientras se mantiene su administración.
Por el contrario, otros estudios en lactantes afectados de sibilancias postbronquiolitis o con episodios de sibilancias relacionados con infecciones virales, han cuestionado la utilidad de los corticoides. La evidencia que apoya el uso de los corticoides como fármacos preferentes para el tratamiento en los episodios de sibilancias recurrentes en lactantes pequeños es bastante limitada, debido a la heterogeneidad de los fenotipos. Sería fundamental distinguir los preescolares con sibilancias recurrentes relacionados con infecciones respiratorias virales de los preescolares con riesgo de sibilancias persistentes o asma, aunque esta distinción resulta problemática en muchos pacientes. En las sibilancias de preescolares desencadenadas exclusivamente por virus (enfermedad reactiva de las vías aéreas posbronquiolitis) no está claro que los corticoides inhalados sean eficaces. En las sibilancias de preescolares producidas por múltiples desencadenantes (incluido infecciones víricas) y/o con IPA positivo, se sugiere un uso prudente de los corticoides inhalados26: un ensayo durante 3 meses y suspender sino se observa mejoría, en vez de subir de escalón terapéutico; si hay respuesta satisfactoria, retirarlos cuando el niño esté libre de síntomas y reintroducirlos si reaparecen de nuevo.
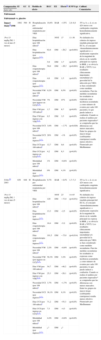
Cabe diferenciar dos vías de administración de los corticoides en BA en la intervención preventiva, según los ECA publicados: principalmente corticoides nebulizados y, en algún caso, corticoides orales. En la tabla 1 se exponen los resultados de todos los ECA sobre corticoides en el tratamiento preventivo de la BA.
Tabla simplificada de prevención: corticoides
| Comparación | GI | GC | E | Medida de efecto | RGC | EE | Efecto¿ | IC95% (p) | Calidad. Comentarios |
| Autor año | |||||||||
| Corticoides nebulizados | |||||||||
| Carlsen31 1988 | 22 | 22 | H | Tiempo 1.er episodio broncoconstricción (sem) | 4 | DM | 3,5 | (p=0,035) | 2/5 (c, d); mayoría no BA habituales (solo 20% VRS+), sino más bien asma del lactante (edad media elevada, 14–17 meses, y con episodios repetidos de broncoconstricción) |
| Beclometasona, 100mcg/6h (2sem) y 100mcg/12h (6 sem) | Episodios broncoespasmo | 9 | DM | −4,5 | (p<0,005) | ||||
| Tiempo broncodilatadores (sem) | 20 | DM | −13 | (p<0,005) | |||||
| Reijonen32 1996 | 34 | 32 | H | ≥1 episodio sibilancias a 16 sem | 47% | RAR | 30% | 8−53 | 2/5 (a, d); no diferencias significativas entre grupos cuando se excluyen pacientes atópicos |
| Budesonida, 500mcg/12h (8 sem) y 250mcg/12h (8 sem) | ≥2 episodios sibilancias 16 sem | 40% | RAR | 21% | 2−43 | ||||
| Ingreso por broncoespasmo | 43% | RAR | 30% | 10−50 | |||||
| Richter28 1998 | 21 | 19 | H | Cambio puntuación clínica (máx. 9) | −1 | DM | −1 | (p=0,92) | 4/5 (a, b, c, d); <12 meses con primer episodio BA |
| Budesonida 1mg/12h (5 días) y 0,5mg/12h (6 sem) | Días oxigenoterapia | 3 | DM | −1 | (p=0,65) | La única diferencia estadísticamente significativa es desfavorable a la intervención (más reingresos en el GI) | |||
| Prevalencia sibilancias 6 meses | 79% | RAR | 4% | -22−30 | |||||
| Reingreso p. respiratoria 6 meses | 10,5% | IAR | 39,5% | 14−65 | |||||
| Fox33 1999 | 26 | 28 | H | Síntomas a los 12 meses | 50 | IAR | 34% | 19−59 | 3/5 (a, c, d); no explicación farmacológica para el empeoramiento en el GI, lo que no resulta consistente con otros estudios |
| Budesonida 200mcg MDI/12h (8 sem) | Ingreso a los 12 meses | 25% | RAR | 5% | −19−28 | ||||
| Cade29 2000 | 83 | 82 | H | Al menos un episodio sintomático en 12 meses | 99% | RAR | 0% | −3−3 | 4/5 a, c, d, e);<12 meses con primer episodio BA VRS+. No diferencias ni a corto ni a largo plazo. Financiado por industria |
| Budesonida 1mg/12h (14 días) | Readmisión por problemas respiratorios en 12 meses | 18% | RAR | 2% | −14−10 | ||||
| Callen Blecua36 2000 | 47 | 47 | AP | Episodios de sibilancias 15 meses | 66% | IAR | 3% | −16−22 | 3/5 (a, b, d); no modifica los episodios de sibilancias durante los 3 meses de tratamiento ni durante los 12 meses de seguimiento |
| Beclometasona, 250mcg/12h (3 meses) | >3 episodios sibilancias 15 meses | 21% | RAR | 7% | −9−22 | ||||
| Kajosaari34 2000 | 1/5 (d); en lactantes muy pequeños (media de 2,6 meses) y con dosis de budesonida elevadas para la práctica habitual. Criterio de definición de asma poco objetivo | ||||||||
| Budesonida 500mcg/8h (7 días) | 40 | 41 | H | Tto inhalador asma a 2 años | 37% | RAR | 19% | −0,6–38 | |
| Budesonida 500mcg/8h (2 meses) | 36 | 41 | H | Tto inhalador asma a 2 años | 37% | RAR | 24,3% | 5–43 | |
| Wong35 2000 | 24 | 24 | H | Tos nocturna | 86% | IAR | 2% | (p>0,05) | 4/5 (a, c, d, e); la única diferencia estadísticamente significativas encontrada (menor uso de broncodilatadores/ corticoides) tiene un interés clínico relativo y no consistente con el resto de resultados. Financiado por industria |
| Fluticasona 150mcg/12h MDI (3 meses) | Días con síntomas en 12 meses | 83,5% | IAR | 0,5% | (p>0,05) | ||||
| Uso broncodilatadores/ corticoides | 33% | RAR | 25% | 3–47 | |||||
| Bentur30 2005 | 29 | 32 | H | Cambios puntuación clínica ingreso-alta | 6,1 | DM | 5,8 | (p>0,05) | 4/5 (a, b, c, d); 3–12 meses con primer episodio BA VRS+. La única diferencia significativa (tiempo de ingreso menor en prematuros tratados con dexametasona) debe interpretarse con cautela en el análisis de subgrupos y condicionado por un tamaño muestral muy pequeño |
| Dexametasona 0,25mg+adrenalina 1mg/6h (hasta alta) | Hospitalizaciones a 3 meses | 44% | RAR | 2,4% | −22–27 | ||||
| Recurrencia sibilancia a 3 meses | 53% | RAR | 1,4% | −23–26 | |||||
| Ermers27 2009 | 119 | 124 | H | Días con sibilancias (en 15 meses) | 6,3% | RAR | 1,1% | (p=0,31) | 5/5 (a, b, c, d, e); supera limitaciones de ECA anteriores, incluidas en la RS de Blom et al. Solo el grupo de niños con ITRS por VRS no ventilados presentan un modesto beneficio. Entre GI y GC no diferencias en niños con sibilancias (61 vs. 62%), tos (83 vs. 86%), uso de corticoides (25 vs. 26%) y uso de broncodilatadores (40 vs. 42%) |
| Beclometasona 200mcg/12h (3 meses) | Días con sibilancias (en 15 meses) en no ventilados | 6,4% | RAR | 2,1% | 1,7–2,4 | ||||
| Días con tos (en 15 meses) | 26,2% | RAR | 4,4% | 3,7–5,0 | |||||
| Corticoides orales | |||||||||
| Berger39 1998 | 20 | 18 | U | Mejoría clínica 3 días | 83% | RAR | −3,3% | −28–21 | 3/5 (a, b, c); 1–18 meses con primer episodio BA |
| Prednisolona 1mg/kg/dosis cada 12h (3 días) | Mejoría clínica a 7 días | 94% | RAR | −4,4% | −21–14 | ||||
| Síntomas respiratorios recurrentes a 2 años | 28,4% | IAR | 7,1% | −41–27 | |||||
| Bülow93 1999 | 73 | 74 | H | Días hospitalización | 4 | RAR | 0,4 | (p>0,05) | 4/5 (a, b, c, d); población son lactantes ingresados por infección respiratoria VRS+, no solo BA, con distinta gravedad (incluido un 10% con CPAP) |
| Prednisolona 2mg/kg/día (5 días) | N.° medio noches con tos a las 6 semanas | 7 | DM | 1 | (p>0,05) | ||||
| Diagnóstico asma al año | 64% | RAR | 6% | (p>0,05) | |||||
| Van Woensel40 2000 | 24 | 23 | H | Sibilancias durante 1.er año | 48% | IAR | 2% | −26–30 | 4/5 (a, b, c, d);<24 meses con primer episodio de BA VRS+. No efectivo para prevenir sibilancias posbronquiolitis a medio ni a largo plazo (incluso tendencia a empeorar) |
| Prednisolona 1mg/kg/día cada 12h (7 días) | Sibilancias persistentes 5 años | 31% | IAR | 11,2% | −16–38 | ||||
| Zhang41 2003 | 28 | 24 | H | Sibilancias a 1 mes | 83% | RAR | 8% | −14–30 | 3/5 (a, b, d);<12 meses con primer episodio de BA |
| Prednisolona 1mg/kg/día (5 días) | Sibilancias a 12 meses | 58% | RAR | 8% | −19–35 | ||||
| Días hospitalización | 5 | DM | 1 | (p=0,7) | |||||
AP: atención primaria ambulatoria; BA: bronquiolitis aguda; CP: cohortes prospectivo; CR: cohortes retrospectivo; DAR: diferencia absoluta del riesgo; DBP: displasia broncopulmonar; DM: diferencia de medias; E: entorno asistencial; Ec: estudio ecológico; ECA: ensayo clínico aleatorizado; EE: estimador de efecto; EPC: enfermedad pulmonar crónica; GI: grupo intervención; GC: grupo control; H: hospital; HR: hazard ratio; IAB: incremento absoluto del beneficio; IAR: incremento absoluto del riesgo; IO: índice de oxigenación; IV: índice ventilatorio; ns: no significativo; P: poblacional; Prev: prevalencia; Pvz: palivizumab; RDAI: Respiratory Distress Assessment Instrument; RGC: riesgo grupo control; RAB: reducción absoluta del beneficio; RAR: reducción absoluta del riesgo; RRR: reducción relativa del riesgo; SC: serie de casos; SG: semanas de gestación; SF: suero fisiológico; SS: suero salino; U: servicio de urgencias; VM: ventilación mecánica; VRS: virus respiratorio sincitial.
Volumen de la evidencia: existen 10 ECA con calidad media-baja (solo 4 estudios presentaron una calidad 4/5) y publicados entre 1988–2009. Todos los ECA previamente analizados en el apartado de tratamiento, salvo el publicado más recientemente27.
Pacientes: el tamaño muestral de los estudios es pequeño (grupo intervención [GI] entre 22–83 y grupo control [GC] entre 19–82 pacientes), salvo el estudio de Ermers et al (119 vs. 124)27. Edad<24 meses en todos los casos (principalmente en<12 meses). Tres estudios especifican primer episodio de BA28–30, que son los estudios que permiten no considerar asma del lactante entre la población. Tres estudios consideran infecciones exclusivas por VRS27,29,30. Nueve ECA en niños hospitalizados27–35 y uno en atención primaria36.
Intervención: se han empleado distintos corticoides nebulizados, dosis e intervalos: 5 con budesonida (entre 1.000mcg/12h–200mcg/12h)28,29,32–34, 3 beclometasona (entre 100mcg/6h–250mcg/12s)27,31,36, 1 dexametasona (0,25mg/6h [con adrenalina])30 y 1 fluticasona (150mcg/12h)35. La duración del tratamiento osciló entre 7 días y 3 meses. El estudio de Bentur et al30 solo aplica tratamiento durante el ingreso, pero mide hospitalizaciones y recurrencia de sibilancias en 3 meses.
Comparación: se ha comparado con placebo, en algún caso no tratamiento o tratamiento estándar.
Medidas principales: se ha empleado diferentes medidas de efecto, pero principalmente síntomas (sobre todo sibilancias) y rehospitalizaciones.
Tiempo: el tiempo de seguimiento ha sido entre 3–15 meses principalmente, en algún caso a 2 años34.
Intensidad del efecto o fuerza de la asociación: cuatro ECA no encuentran diferencias. Tres ECA encuentran diferencias significativas a favor del GI, siendo las de más interés clínico: reducción de un 30% de reingreso por broncoespasmo a 16 semanas32 y reducción de un 25% de tratamiento inhalador a los 1235 y 24 meses34. El reciente estudio de Ermers et al27 solo encuentra en niños no ventilados un modesto efecto en el número de días con sibilancias (no en el conjunto global). Dos ECA encuentran diferencias significativas en contra del GI: incremento de un 39,5% de reingresos a los 6 meses28 y un 34% de incremento de síntomas a los 12 meses33. Diferencias clínica y estadísticamente poco importantes y no consistentes.
La RS publicada en 2006 por Blom et al37 revisa cinco ECA o cuasialeatorizados de buena calidad, en la que compara corticoides inhalados vs placebo en <2 años con BA (el tratamiento debía haberse iniciado durante la fase aguda de la infección y seguimiento mínimo de 3 meses) y apoya la ausencia de efecto de los corticoides inhalados para prevenir las sibilancias postbronquiolitis, si bien el número de participantes incluidos y la incapacidad para agrupar los resultados clínicos impide el poder hacer recomendaciones sólidas. El posterior estudio de Ermesr et al27 de mayor tamaño muestral y calidad apoya los datos de su falta de eficacia como tratamiento preventivo de las sibilancias recurrentes.
Castro Rodríguez et al38 han publicado recientemente una RS con MA sobre el papel de los corticoides inhalados en los niños <5 años con sibilancias recurrentes y/o asma, en el que se analizan 29 ECA (3.592 pacientes). Para valorar las reagudizaciones se obtuvieron datos de 16 estudios (2.805 niños), encontrando una menor incidencia en el grupo de corticoides inhalados que en el grupo placebo (el 18 en comparación con el 32,1%; RR=59 (IC95%: 0,52–0,67), NNT (IC95%: 6–9). En el análisis de sensibilidad se comprueba que aunque los pacientes con sibilantes recurrentes muestran una significativa reducción de reagudizaciones, esta es significativamente menor que en el caso de los niños diagnosticados de asma. Una importante limitación del estudio es la falta de información sobre los criterios de inclusión de cada estudio, principalmente cómo se definió la existencia de asma o sibilantes recurrentes, lo que limita la interpretación del análisis de sensibilidad. Paradójicamente, no se encontraron diferencias entre los pacientes atópicos y no atópicos. Para las variables secundarias se muestra mejoría significativa en las escalas de valoración clínica, disminución en el uso de salbutamol y aumento de los parámetros FEV1 y PEF en los pacientes que reciben corticoides frente a los que recibieron placebo. Según este estudio, los corticoides inhalados son útiles en lactantes y preescolares con sibilantes recurrentes/asma para reducir las reagudizaciones al comparar con placebo, independientemente de la edad, diagnóstico, presencia de atopia, modo de dispensación y tipo de corticoide utilizado; no obstante la aplicabilidad de estos resultados al seguimiento del lactante con BA es dudosa.
Consistencia entre estudios: la consistencia entre estudios es escasa. De los cinco ECA de mayor calidad (≥4/5) en 2 se obtiene algún resultado significativo a favor del GI27,35, en otro en contra del GI28 y en 2 ningún resultado significativo29,30. El estudio de Fox et al33 ofrece un efecto potencialmente perjudicial de budesonida como tratamiento preventivo, lo que no resulta consistente con otros estudios: no explicación farmacológica para el empeoramiento (posible error tipo I por mayor número de varones en este grupo, los cuales presenta más síntomas y precisan más broncodilatador). También el estudio de Richter et al28 es desfavorable al GI (más reingresos por patologías respiratorias a los 6 meses). En la RS37 solo el estudio de Wong et al35 encuentra algún beneficio: menor uso de broncodilatadores/corticoides.
Precisión de las estimaciones: la precisión es escasa, por el pequeño tamaño muestral de la mayoría de los ECA, salvo el estudio de Ermers et al27, pero mejora en los resultados expuestos en la RS37.
Estimación de sesgos: existe un riesgo alto de sesgos, derivados de la baja calidad de la mayoría de los estudios, así como de la posible interacción de casos de BA y de casos con asma del lactante, fisiopatológicamente diferentes. Dos estudios financiados por la industria farmacéutica29,35.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta debido al tipo y magnitud del efecto observado, mayoritariamente basado en pequeños cambios a medio plazo (12–24 meses, y en relación con reingresos y síntomas), pero no consistente en todos los ECA. Los pacientes parecen apropiados, aunque en algunos trabajos pueden haberse incluido niños con asma (solo 3 de los 10 ECA incluían primeros episodios), y en todo caso serían representativos de los pacientes atendidos principalmente a nivel hospitalario. Los tipos de corticoides, así como sus dosis y pautas de administración son muy heterogéneos.
Validez externa y aplicabilidad de la evidencia: los pacientes son representativos de los atendidos en el medio hospitalario, si bien la duración del tratamiento osciló entre el tiempo de ingreso y hasta 3 meses. Especial validez en los tres estudios que especifican primer episodio de BA28–30, que son los estudios que permiten no considerar asma del lactante entre la población; en estos ECA no se encuentran diferencias significativas o, bien, son desfavorables a la intervención28. Los resultados de los ECA individuales y de la RS37 no apoyan el uso de corticoides nebulizados como tratamiento de mantenimiento preventivo para la enfermedad de las vías aéreas postbronquiolitis.
Balance riesgo-beneficio-coste: en 3 ECA se estudian los efectos adversos, que son escasos y poco significativos. No obstante existe un predominio de riesgos (exposición a medicación innecesaria, con potenciales efectos adversos) frente a beneficios (posibilidad de mejoría en el seguimiento de algunos pacientes, pero datos contradictorios y no consistentes). No disponemos de estudio de costes.
Estimación del impacto de futuros estudios: parece necesaria la realización de estudios con una mejor definición de pacientes (<12 meses con primer episodio de BA y excluir posible asma del lactante), intervención (principalmente budesonida a dosis habituales 200–400mcg/12h) y variables clínicas de interés (recurrencia sibilancias, uso de medicación de rescate y reingresos) a largo plazo (mejor >2 años) y con mayor tamaño muestral. El estudio de Ermers et al27, publicado tras la revisión sistemática, cumple buena parte de estas premisas.
Probablemente, el fondo del problema estriba en que hay que tomar una decisión terapéutica en un momento concreto (primero o segundo año de vida) en el que no disponemos de todos los datos como para catalogar con exactitud al niño asmático. Por la importante prevalencia de este grupo de lactantes y preescolares con sibilancias recurrentes con enfermedad reactiva de las vías aéreas postbronquolitis es muy conveniente poder hacer recomendaciones precisas. Ante el hecho de que las últimas guías de práctica clínica cuestionan la indicación del corticoide inhalado profiláctico en este grupo de niños, y ante la incapacidad para predecir la respuesta en un niño concreto, si los hallazgos observados por la RS de Castro Rodríguez et al38 fueran aplicables a los lactantes con sibilantes recurrentes ya instaurados cabría valorar su propuesta de realizar una prueba terapéutica, pero solo cuando dicha recurrencia esté ya establecida.
Corticoides oralesVolumen de la evidencia: existen 4 ECA con calidad media (2 estudios presentaron una calidad de 3/5 y 2 de 4/5) y publicados entre 1998–2003. Todos estos ECA previamente analizados en el apartado de tratamiento, que se analizan por incluir medidas de efecto a medio-largo plazo.
Pacientes: el tamaño muestral de los estudios es pequeño (GI entre 20–73 y GC entre 18–74). Edad <24 meses. Tres estudios especifican primer episodio de BA39–41, que son los estudios que permiten no considerar asma del lactante entre la población. Dos estudios consideran infecciones exclusivas por VRS, en un caso solo BA40 y en otro con cualquier tipo de infección respiratoria42. Tres ECA en niños hospitalizados40–42 y uno en urgencias39.
Intervención: prednisolona en todos los ECA, entre 1–2mg/kg/día cada 12 o 24h. La duración del tratamiento entre 3–7 días.
Comparación: con placebo o con tratamiento estándar.
Medidas principales: síntomas respiratorios recurrentes (principalmente sibilancias/asma).
Tiempo: seguimiento durante un año41,42, 2 años39 y 5 años40.
Intensidad del efecto o fuerza de la asociación: ninguno de los 4 ECA encuentra diferencias significativas en las variables analizadas.
Consistencia entre estudios: suficiente en contra de la intervención.
Precisión de las estimaciones: escasa, condicionada por el tamaño muestral.
Estimación de sesgos: riesgo de sesgos derivados del bajo tamaño muestral y de la posible interacción de casos de BA y de casos con asma del lactante (si esto último solo acaece en un ECA42, pues el resto de ECA consideran como criterio de inclusión ser el primer episodio de BA).
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse parcialmente directa, pues bien definida la población (generalmente lactantes hospitalizados con primer episodio de BA), intervención (prednisolona oral entre 3–7 días) y medidas de interés (principalmente, síntomas respiratorios recurrentes: sibilancias/asma), si bien los 4 ECA son de baja calidad y pequeño tamaño muestral.
Validez externa y aplicabilidad de la evidencia: los pacientes corresponden a lactantes hospitalizados. Los corticoides orales no son útiles como tratamiento de mantenimiento preventivo para la enfermedad de las vías aéreas postbronquiolitis.
Balance coste-beneficio-riesgo: solo en un ECA se estudian los efectos adversos, no presentes. Predominio de riesgos (exposición a medicación innecesaria, con potenciales efectos adversos) frente a beneficios (ausente). No estudio de costes.
Estimación del impacto de futuros estudios: poco probable, ya que la ausencia de efecto de los corticoides orales en el tratamiento preventivo, hace que las líneas de investigación se dirijan a los corticoides nebulizados.
Inhibidores de leucotrienos (montelukast)Montelukast es el único fármaco de este grupo terapéutico con el que se han realizado algunos estudios en menores de tres años. Aunque la eficacia de los antagonistas de los receptores de los leucotrienos es contradictoria, hay razones para pensar que pueden ser útiles en esta edad, en la que la mayoría de las sibilancias están asociadas a infecciones víricas de las vías respiratorias, donde se libera gran cantidad de leucotrienos que, además de actuar como potentes broncoconstrictores, favorecen la inflamación neutrofílica en la vía aérea y la hiperreactividad bronquial. Constituyen una alternativa a los corticoides inhalados en niños con asma leve y podrían utilizarse (solos o combinados con corticoides) para disminuir las exacerbaciones inducidas por virus.
En la tabla 2 se exponen los resultados de todos los ECA sobre montelukast en el tratamiento preventivo de la BA.
Tabla simplificada de prevención: montelukast
| Comparación | GI | GC | E | Medida de efecto | RGC | EE | Efecto¿ | IC95% (p) | Calidad. Comentarios |
| Autor año | |||||||||
| Montelukast | |||||||||
| Montelukast vs. placebo | |||||||||
| Bisgaard432003 | 65 | 65 | H | Ausencia síntomas en 24h | 4% | IAB | 18% | (p=0,015) | 2/5 (b, c); falta de potencia estadística (pocos casos estudiados). No se describe adecuadamente cómo se calculó el tamaño de la muestra. Muchas pérdidas, sobre todo en el periodo postintervención (33,1%). No análisis por intención de tratar. Financiado por MSD |
| Montelukast 5mg/día (28 días) | Exacerbaciones | 18% | RAR | 11% | −0,3–23,6 | ||||
| Uso corticoides | 15% | RAR | 10% | −1,2–20,4 | |||||
| Días sin tto con beta-2 | 89% | RAB | 14% | −4,9–28,5 | |||||
| Noches sin tto con beta-2 | 89% | IAB | 7% | −1,7–17 | |||||
| Bisgaard44 2008 | 327 | 328 | H | Porcentaje medio días libres de síntomas (DLS) en 4 semanas | 37% | IAB | 1,6% | (p>0,05) | 4/5 (a, b, c, d); estudio del mismo grupo, que mejora limitaciones de estudio anterior. En el análisis posthoc de 523 pacientes con síntomas persistentes (≤30% DLS en semanas 1–2) sí se apreciaron diferencias entre los GI y GC en las semanas 3–24 en el porcentaje de DLS: 5,7 (0,0–11,3) entre GI1 y GC y 5,9 (0,1–11,7) entre GI2 y GC. Dado que pérdidas postaleatorización altas (24%), las diferencias significativas encontradas en el análisis posthoc deben ser confirmadas en futuros estudios. Financiado por MSD |
| GI1: Montelukast 4mg/día (28 días) | Porcentaje medio días libres de síntomas (DLS) en 20 semanas | 58,2% | IAB | 2,6% | (p>0,05) | ||||
| Exacerbaciones | 33,3% | RAR | 1,9% | (p>0,05) | |||||
| Uso corticoides | 19,2% | IAR | 3,3% | (p>0,05) | |||||
| GI2: Montelukast 8mg/día (28 días) | 324 | 328 | H | Porcentaje medio días libres de síntomas en 4 semanas | 37% | IAB | 1,5% | (p>0,05) | |
| Porcentaje medio días libres de síntomas (DLS) en 20 semanas | 58,2% | IAB | 2,5% | (p>0,05) | |||||
| Exacerbaciones | 33,3% | RAR | 1,6% | (p>0,05) | |||||
| Uso corticoides | 19,2% | IAR | 0,2% | (p>0,05) | |||||
AP: atención primaria ambulatorio; BA: bronquiolitis aguda; CP: cohortes prospectivo; CR: cohortes retrospectivo; DAR: diferencia absoluta del riesgo; DBP: displasia broncopulmonar; DM: diferencia de medias; E: entorno asistencial; Ec: estudio ecológico; ECA: ensayo clínico aleatorizado; EE: estimador de efecto; EPC: enfermedad pulmonar crónica; GI: grupo intervención; GC: grupo control; H: hospital; HR: hazard ratio; IAB: incremento absoluto del beneficio; IAR: incremento absoluto del riesgo; IO: índice de oxigenación; IV: índice ventilatorio; ns: no significativo; P: poblacional; Prev: prevalencia; Pvz: palivizumab; RDAI: Respiratory Distress Assessment Instrument; RGC: riesgo grupo control; RAB: reducción absoluta del beneficio; RAR: reducción absoluta del riesgo; RRR: reducción relativa del riesgo; SC: serie de casos; SG: semanas de gestación; SF: suero fisiológico; SS: suero salino; U: servicio de urgencias; VM: ventilación mecánica; VRS: virus respiratorio sincitial.
Volumen de la evidencia: existen dos ECA realizados por el mismo grupo investigador, uno con calidad media-baja y pequeño tamaño muestral publicado en 200343 y otro con calidad media-alta y mayor tamaño muestral publicado en 200844 (con resultados contradictorios).
Pacientes: el tamaño muestral de los 2 ECA es diferente: el inicial con 65 en GI y 65 en GC43 frente al posterior con 327 y 324 en los dos GI (montelukast 4mg/día y 8mg/día, respectivamente) y 32844 en GC. La edad de los pacientes era de 3–36 meses con primer episodio de BA43 o de 3–24 meses con primer o segundo episodio de BA44. Los 2 ECA eran con niños hospitalizados.
Intervención: se comparáo montelukast, 5mg/día43 o bien, 2 grupos de intervención con 4 u 8mg/día44, vía oral y durante 28 días.
Comparación: placebo.
Medidas principales: las medidas principales fueron ausencia de síntomas durante 24h43 o bien días libres de síntomas en 4 semanas (fase de intervención) y 20 semanas (fase de seguimiento)44. Como variables secundarias se consideran exacerbaciones, uso de corticoides, etc.
Tiempo: se realizó un seguimiento durante la fase de intervención (4 semanas) y durante la fase de seguimiento (bien 12 semanas43 o 20 semanas44).
Intensidad del efecto o fuerza de la asociación: en el ECA inicial se observó una diferencia estadísticamente significativa en la ausencia de síntomas durante 24h en los cincos ítems en la fase de intervención (el 22% en el GI en comparación con el 4% en el GC), con una reducción de 18 días/100 tratados (IC95%: 15,5–20,4), lo que equivale a tratar 5,5 días para obtener 1 día libre de síntomas43. No se encontraron diferencias significativas en el ECA posterior, de mayor calidad y tamaño muestral y que mejoraba las limitaciones del estudio anterior44. En el análisis post hoc de 523 pacientes con síntomas persistentes (≤30% días libres de síntomas en semanas 1–2) sí se apreciaron diferencias entre los GI y GC en las semanas 3–24 en el porcentaje de días libres de síntomas: 5,7 (0,0–11,3) entre el tratamiento a 4 mg/día y el GC y 5,9 (0,1–11,7) entre el tratamiento a 8 mg/día y el GC; dado que hubo pérdidas postaleatorización altas (24%), las diferencias significativas encontradas en el análisis post-hoc deben ser confirmadas en futuros estudios44.
Consistencia entre estudios: el ECA más actual, de mayor calidad y tamaño muestral44, contradice los resultados del primer ECA43.
Precisión de las estimaciones: la precisión solo fue correcta en el ECA de mayor tamaño muestral44.
Estimación de sesgos: hay un riesgo alto de sesgos en el primer ECA43, por la baja calidad, pequeño tamaño muestral y elevadas pérdidas en el período postintervención (33,1%). El riesgo de sesgos fue bajo en el segundo ECA44, por elevadas pérdidas en el período postintervención (24%). Ambos estudios estaban financiados por la industria farmacéutica.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse parcialmente directa, pues está bien definida la población (generalmente lactantes hospitalizados con primer o segundo episodio de BA), intervención (montelukast oral a distintas dosis) y medidas de interés (principalmente ausencia de síntomas), especialmente tras la publicación del ECA más actual.
Validez externa y aplicabilidad de la evidencia: los pacientes son representativos de los atendidos en el medio hospitalario, planteando la intervención con diferentes dosis de montelukast. Con la información clínica disponible no se puede aconsejar su uso para prevenir la enfermedad de vías respiratorias postbronquiolitis.
Balance riesgo-beneficio-coste: en los 2 ECA se estudian los efectos adversos: todas las dosis de tratamiento fueron bien toleradas y con efectos adversos similares al GC. Hay un balance entre ausencia de beneficios (confirmado en el segundo ECA, de mayor calidad) y ausencia de riesgos, por lo que la ausencia de eficacia y los costes asociados condicionan la decisión terapéutica en la prevención de la enfermedad reactiva vías aéreas postbronquiolitis.
Estimación del impacto de futuros estudios: sería deseable la realización de ECA independiente de la industria farmacéutica que confirme estos hallazgos y que valore los resultados de su utilización en lactantes con BA, a diferencia del asma.
Otras intervencionesEn relación con el papel que puedan desempeñar otro tipo de fármacos, si tenemos en cuenta que la inflamación de tipo neutrofílico es la que predomina en este tipo de pacientes, es posible que fármacos como los macrólidos, por su efecto antiinflamatorio, puedan contribuir al tratamiento eficaz de determinados pacientes. Si bien es cierto que no se dispone de pruebas que justifiquen el uso universal de macrólidos en pacientes con sibilancias recurrentes45 su efecto inmunomodulador se ha descrito en diferentes estudios resumidos. En lactantes con sibilancias recurrentes, la administración de claritromicina ha demostrado conseguir una reducción de la concentración de IL 1β, IL-10 y TNF-α en la mucosa nasofaríngea46.
Ni las cromonas ni la teofilina son fármacos recomendados en este grupo de edad. Tampoco los agonistas beta-2-adrenérgicos de acción prolongada están indicados, salvo en los casos en los que la necesidad de administrar broncodilatadores sea muy frecuente y haya buena respuesta, en particular si los pacientes son atópicos.
InmunoglobulinasEstudios realizados hace más de 30 años en investigación con animales sugerían que la inmunización pasiva con inmunoglobulinas podría ser un método de prevención frente a la infección por VRS. A lo largo de la siguiente década se inició el desarrollo de inmunoglobulinas enriquecidas con anticuerpos frente VRS para uso humano (IgIV-RespiGam®), con capacidad de neutralizar in vitro las cepas subtipo A y B del virus.
En la tabla 3 se exponen los resultados de todos los ECA sobre inmunoglobulinas en el tratamiento preventivo de la BA.
Tabla simplificada de prevención: inmunoglobulina
| Comparación | GI | GC | E | Medida de efecto | RGC | EE | Efecto¿ | IC95% (p) | Calidad. Comentarios |
| Autor año | |||||||||
| Inmunoglobulina intravenosa | |||||||||
| Inmunoglobulina vs. placebo | |||||||||
| Groothuis471993 | 81 | 89 | H | Infecciones respiratorias inf por VRS | 22,4% | RAR | −13,8% | (p=0,01) | 2/5 (a, d); secuencia de aleatorización no descrita y solo cegamiento para seguimiento telefónico. Efectos adversos leves, pero mayor problema con el acceso intravenoso. Diferencias significativas con IgIV alta dosis; en el caso de IgIV baja dosis solo diferencia en días de UCI. Financiado parcialmente por MedImmune |
| IgIV 750mg/kg/mes | Reducción infección VRS mod-grave | RRR | 72% | (p=0,03) | |||||
| Hospitalización | 20,2% | RAR | −12,8% | (p=0,02) | |||||
| Días de hospitalización | 128 | DM | −85 | (p=0,002) | |||||
| IgIV 150mg/kg/mes | 79 | 89 | H | Infecciones respiratorias inf por VRS | RRR | 27% | (p=0,35) | ||
| Reducción infección VRS mod-grave | RRR | 53% | (p=0,13) | ||||||
| Hospitalización | (p>0,05) | ||||||||
| Días de hospitalización | (p>0,05) | ||||||||
| PREVENT Study Group491997 | 250 | 260 | H | Hospitalización por enfermedad respiratoria por VRS | 13,5% | RAR | −5,5% | 0,1–10,8 | 4/5 (a, b, c, d); no definidos los criterios de ingreso (medida principal del ECA) e insuficiente expresión de la magnitud de efecto en la variable principal (se expresa la RRR, y se obvia la RAR y NNT) Para las medidas secundarias los resultados se expresan como incidencia acumulada y como número de eventos por cada 100 pacientes, lo que puede inducir a confusión. Cuando se realiza el análisis por pacientes ingresados se comprueba que las diferencias son menos marcadas¿. Destacan las complicaciones secundarias a la sobrecarga de volumen infundida, principalmente en DBP. El balance riesgo-beneficios es desfavorable respecto a palivizumab. Liderado por MedImmune |
| IgIV 750mg/kg/mes | NNT | 18 | 9–100 | ||||||
| Días hospitalización (por 100 niños) | 129 | DM | −69 | (p=0,045) | |||||
| Días hospitalización (por ingreso)¿ | 9,5 | DM | −2 | (p>0,05) | |||||
| Días oxigenoterapia (por 100 niños) | 85 | DM | −51 | (p=0,007) | |||||
| Días oxigenoterapia (por ingreso)¿ | 6,3 | DM | −2,1 | (p>0,05) | |||||
| Necesidad VM (por 100 niños) | 1,9% | DM | 0,1% | (p>0,05) | |||||
| Necesidad VM (por ingreso en UCI)¿ | 14,2% | DM | 10,8% | (p>0,05) | |||||
| Necesidad UCI (por 100 niños) | 4,6% | DM | −1,4% | (p>0,05) | |||||
| Necesidad UCI (por ingreso)¿ | 34% | DM | 6% | (p>0,05) | |||||
| Días UCI (por 100 niños) | 50 | DM | −22 | (p>0,05) | |||||
| Días UCI (por ingreso en UCI)¿ | 3,7 | DM | −0,2 | (p>0,05) | |||||
| Días con LRI ≥3: (por 100 niños) | 106 | DM | −57 | (p=0,049) | |||||
| Días con LRI ≥3: (por ingreso)¿ | 7,8 | DM | −1,7 | (p>0,05) | |||||
| Simoes48 1998 | 202 | 214 | H | Hospitalización por enfermedad respiratoria por VRS | 15% | RAR | −5% | −1,8–10,9 | 3/5 (a, b, d); solo cegamiento para seguimiento telefónico |
| IgIV 750mg/kg/mes | Días hospitalización (por 100 niños)a | 107 | DM | −35 | (p=0,15) | No definidos los criterios de ingreso (medida principal del ECA) e insuficiente expresión de la magnitud de efecto en la variable principal (se expresa la RRR, y se obvia la RAR y NNT). Para las medidas secundarias los resultados se expresan como incidencia acumulada y como número de eventos por cada 100 pacientes, lo que puede inducir a confusión. Cuando se realiza el análisis por pacientes ingresados se comprueba que las diferencias son menos marcadas¿ Mayor incidencia de episodios cianóticos en cardiopatías cianógenas (28 vs. 8,5% GC; p=0,009), por lo que se desaconseja en esta población. La única diferencia significativa es la reducción de hospitalización por enfermedad respiratoria por VRS en <6 meses. Financiado por MedImmune | |||
| Días hospitalización (por ingreso)¿¿ | 7,1 | DM | −0,2 | (p ?) | |||||
| Necesidad VM (por 100 niños)a | 2% | DM | −1% | (p=0,51) | |||||
| Necesidad VM (por ingreso en UCI)¿¿ | 19% | DM | 5% | (p ?) | |||||
| Días VM (por 100 niños)a | 55 | DM | −9 | (p=0,59) | |||||
| Días VM (por ingreso en UCI)¿¿ | 3,9 | DM | 0.5 | (p ?) | |||||
| Necesidad UCI (por 100 niños)a | 5% | DM | −3% | (p=0,23) | |||||
| Necesidad UCI (por ingreso)¿¿ | 31% | DM | 7% | (p ?) | |||||
| Días UCI (por 100 niños)a | 68 | DM | −18 | (p=0,24) | |||||
| Días UCI (por ingreso en UCI)¿¿ | 14,5 | DM | −1,9 | (p ?) | |||||
| Días con LRI ≥3: (por 100 niños)a | 86 | DM | −29 | (p=0,54) | |||||
| Días con LRI ≥3: (por ingreso)¿¿ | 5,87 | DM | −0,4 | (p ?) | |||||
| Mortalidad (por 100 niños)a | 6,1% | DM | 0,3 | (p>0,05) | |||||
| Mortalidad (por ingreso en UCI)¿¿ | 37% | DM | 25% | (p ?) | |||||
AP: atención primaria ambulatoria; BA: bronquiolitis aguda; CP: cohortes prospectivo; CR: cohortes retrospectivo; DAR: diferencia absoluta del riesgo; DBP: displasia broncopulmonar; DM: diferencia de medias; E: entorno asistencial; Ec: estudio ecológico; ECA: ensayo clínico aleatorizado; EE: estimador de efecto; EPC: enfermedad pulmonar crónica; GI: grupo intervención; GC: grupo control; H: hospital; HR: hazard ratio; IAB: incremento absoluto del beneficio; IAR: incremento absoluto del riesgo; IO: índice de oxigenación; IV: índice ventilatorio; ns: no significativo; P: poblacional; Prev: prevalencia; Pvz: palivizumab; RDAI: Respiratory Distress Assessment Instrument; RGC: riesgo grupo control; RAB: reducción absoluta del beneficio; RAR: reducción absoluta del riesgo; RRR: reducción relativa del riesgo; SC: serie de casos; SG: semanas de gestación; SF: suero fisiológico; SS: suero salino; U: servicio de urgencias; VM: ventilación mecánica; VRS: virus respiratorio sincitial.
Volumen de la evidencia: existen 3 ECA, de diferente calidad y publicados entre 1993–98. Dos estudios47,48 realizados por el mismo grupo de trabajo.
Pacientes: el tamaño muestral de los estudios es adecuado: GI entre 79–250 y GC entre 89–260. Un ECA considera ≤24 meses con factor de riesgo de prematuridad y/o DBP49, otro ≤48 meses con cardiopatía congénita48 y el tercero ≤48 meses con cardiopatía, prematuridad y/o DBP47. Los tres ECA en niños hospitalizados.
Intervención: IgIV a 750mg/kg (15ml/kg) cada mes; el ECA de Groothuis et al47 también considera un grupo de IgIV a dosis bajas (150mg/kg).
Comparación: placebo (albúmina 1% IV)49 o no tratamiento47,48.
Medidas principales: hospitalización por enfermedad respiratoria por VRS48,49 o infecciones respiratorias inferiores por VRS47. Las medidas secundarias son días de hospitalización, UCI, ventilación mecánica, etc.
Tiempo: seguimiento durante la fase de intervención y durante la fase de seguimiento tras la última administración (30 días49, 16 semanas48 o segunda estación epidémica47).
Intensidad del efecto o fuerza de la asociación: en el ECA de Simoes et al48 no se encuentran diferencias significativas (en el análisis de subgrupos, la única diferencia significativa es la reducción de hospitalización por enfermedad respiratoria por VRS en <6 meses) y se desaconseja expresamente su uso en cardiopatías cianógenas. Los otros 2 ECA detectan diferencias significativas en la menor hospitalización por enfermedad respiratoria por VRS, con reducción del riesgo entre el 5,549–12,8%47 (en este último estudio solo cuando se usa IgIV a dosis estándar, no a la dosis baja), así como en la intensidad de la enfermedad por VRS.
La RS de Wang et al50 del año 2000 (actualmente retirada de la Colaboración Cochrane) recogía estos 3 ECA con IgIV policlonal y también el Impact Study con anticuerpos monoclonales IM (palivizumab), lo que dado el gran tamaño muestral y potencia del ECA con palivizumab51, distorsionaba los propios datos de la IgIV exclusivamente. Los datos significativos de esta RS eran menor hospitalización (OR=0,48; [IC95%: 0,37–0,64]; NNT=17) y menor ingreso en UCI (OR: 0,47 (0,20–0,77); NNT=50). En esta RS ya se destacaba la importante variación en la tasa de hospitalización basal de los estudios (menor a medida que pasa el tiempo), entre el 20,2% de Groothuis et al47 en el año 1993 y el 10,6% del Impact Study51 en el año 1998.
Consistencia entre estudios: dos de los 3 ECA encuentran resultados favorables a la intervención con IgIV47,49, pero en todos los estudios se destacan los inconvenientes de la infusión IV y sobrecarga de volumen. Destacar que el ECA de Simoes et al48 realiza la expresa recomendación de no usar en cardiopatías cianógenas (por sus efectos adversos).
Precisión de las estimaciones: correcta en los 2 ECA de mayor tamaño muestral48,49.
Estimación de sesgos: riesgo intermedio de sesgos, pues no definidos los criterios de ingreso (medida principal del ECA) y porque todos los ECA están financiados, parcial o totalmente, por MedImmune, empresa fabricante de la IgIV. Asimismo, el autor principal de la RS había participado en Impact Study y era consultor de laboratorios MedImmune y Abbot.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse parcialmente directa, pues bien definida la población (generalmente lactantes ≤48 meses hospitalizados con algún factor de riesgo de infección por VRS: prematuridad, DBP y/o cardiopatía), intervención (IgIV a similar dosis) y medidas de interés (principalmente hospitalización por enfermedad respiratoria por VRS).
Validez externa y aplicabilidad de la evidencia: los pacientes son representativos de lactantes de riesgo frente a la infección por VRS atendidos en el medio hospitalario. Su aplicabilidad está condicionada por los efectos adversos de la administración IV de la inmunoglobulina policlonal y la disponibilidad de anticuerpos monoclonales IM.
Balance riesgo-beneficio-coste: en los 3 ECA se estudian los efectos adversos y en todos se destacan los problemas relativos a la infusión IV y la sobrecarga de volumen (15ml/kg), especialmente en los pacientes con DBP. El ECA de Simoes et al48 describe mayor incidencia de episodios cianóticos en cardiopatías cianógenas (el 28 vs. 8,5% GC; p=0,009), por lo que lo contraindica específicamente en estos pacientes.
El balance entre beneficios (disminución hospitalización) y riesgos (acceso IV, sobrecarga de volumen, crisis de cianosis en cardiópatas, etc.) es desfavorable, máxime con la disponibilidad de anticuerpos monoclonales. Existen estudios de evaluación económica: aunque palivizumab es una medicación más cara que la IgIV, se prefiere por su perfil de eficacia y seguridad. Asimismo, es preferible la vía IM de los anticuerpos monoclonales que la vía IV de la inmunoglobulina frente VRS, máxime en una medicación que se pauta mensualmente durante la época epidémica.
Estimación del impacto de futuros estudios: Improbable, dado que la investigación sobre IgIV frente al VRS se ha relegado frente al campo de los anticuerpos monoclonales (palivizumab y otros).
Anticuerpos monoclonales (palivizumab)La gravedad de la BA52 y la mortalidad53 se encuentran relacionadas con la presencia de factores de riesgo (prematuros con o sin enfermedad pulmonar crónica, cardiópatas y/o inmunodeficientes). Las controversias sobre las medidas preventivas han sido especialmente valoradas en la inmunoprofilaxis pasiva (bien con inmunoglobulina policlonal hiperinmune (Respigam®) o bien con palivizumab (Synagis®) que, por su elevado coste, se debería indicar de forma muy selectiva a población de alto riesgo54,55, que es donde se detecta una tasa de ingreso más alta y la gravedad de la enfermedad es mayor (estimada por el porcentaje de ingresos en cuidados intensivos, la necesidad de ventilación mecánica, duración de la oxigenoterapia y tiempo de estancia)52. Pero, globalmente, la mayor parte de las BA son leves, pueden manejarse a nivel ambulatorio, y solo un pequeño porcentaje (variable entre las series publicadas) precisarán ingreso. Un problema asociado es que no existe consenso respecto a los criterios de ingreso de los lactantes con BA (criterio de eficacia habitual) y se detecta una importante variabilidad en la práctica clínica; asimismo, la mayoría de los lactantes hospitalizados por BA por VRS no pertenecen a un grupo de alto riesgo y no se beneficiarían de las pautas recomendadas de inmunoprofilaxis pasiva56.
La inmunoprofilaxis pasiva más utilizada frente a la BA es el palivizumab (anticuerpos antiglucoproteína F monoclonales murinos humanizados frente al VRS) que, al ser un fármaco biotecnológico de elevado coste, plantea siempre retos al médico (en términos de eficacia, seguridad y efectividad), al paciente (en términos de satisfacción y aceptabilidad) y al gestor (en términos de eficiencia, accesibilidad y equidad)19,57. En este sentido, el palivizumab ha sido valorado principalmente en los grupos de riesgo: lactantes con antecedente de prematuridad, con o sin enfermedad pulmonar crónica asociada, y lactantes con cardiopatías congénitas.
- a)
Ensayos clínicos:
En la tabla 4 se exponen los resultados de todos los ECA sobre palivizumab en el tratamiento preventivo de la BA.
Tabla 4.Tabla simplificada de prevención (ECA): palivizumab
Comparación GI GC E Medida de efecto RGC EE Efecto¿ IC95%(p) Calidad. Comentarios Autor año Palivizumab Palivizumab vs. placebo Impact Study511998 1002 500 H Hospitalización por enfermedad respiratoria por VRS 10,6% RAR −5,8% 2,8–8,8 5/5 (a, b, c, d, e); en ≤24 meses con cardiopatía congénita hemodinámicamente significativa. Pvz 15mg/kg IM, 1 vez al mes (5 meses) Días hospitalización (por 100 niños)a NNT 17 11–36 No definidos los criterios de ingreso (medida principal del ECA), el concepto «hemodinámicamente significativo» e insuficiente expresión de la magnitud de efecto en la variable principal (se expresa la RRR, y se obvia la RAR y NNT). Los resultados clínicamente importantes (mortalidad y/o gravedad de la infección por VRS) se han considerado como medidas secundarias. Para las medidas secundarias los resultados se expresan como incidencia acumulada y como número de eventos por cada 100 pacientes, lo que puede inducir a confusión. Cuando se realiza el análisis por pacientes ingresados* se comprueba que las diferencias son menos marcados. Entre los grupos de mayor riesgo (cardiopatías cianógenas) resulta menos efectivo. Financiado por MedImmune Días hospitalización (por ingreso)¿¿ 62,6 DM −26,2 (p<0,001) 5,9 DM 1,7 (p>0,05) Días oxigenoterapia (por 100 niños)a 50,6 DM −20,3 (p<0,001) Días oxigenoterapia (por ingreso)¿¿ 4,8 DM 1,5 (p>0,05) Necesidad VM (por 100 niños)a 0,2% DM 0,5% (p>0,05) Necesidad VM (por ingreso en UCI)¿¿ 7% DM 47% (p<0,05) Días VM (por 100 niños)a 1,7 DM 6,7 (p>0,05) Días VM (por ingreso con VM)¿¿ 8,5 DM 3,5 (p>0,05) Necesidad UCI (por 100 niños)a 3,0% DM −1,7% (p=0,026) Necesidad UCI (por ingreso)¿¿ 28% DM −1% (p>0,05) Días UCI (por 100 niños)a 12,7 DM 0,6 (p>0,05) Días UCI (por ingreso en UCI)¿¿ 4,2 DM 6,3 (p>0,05) Mortalidad (por 100 niños)a 1% DM −0,6% (p>0,05) Mortalidad (por ingreso)¿¿ 0% DM 4,1% (p>0,05) Feltes58 2003 639 648 H Hospitalización por enfermedad respiratoria por VRS 9,7% RAR −4,4% 1,7–7,3 5/5 (a, b, c, d, e); en ≤24 meses con cardiopatía congénita hemodinámicamente significativa. Pvz 15mg/kg IM, 1 vez al mes (5 meses) NNT 23 14–67 No definidos los criterios de ingreso (medida principal del ECA), el concepto «hemodinámicamente significativo» e insuficiente expresión de la magnitud de efecto en la variable principal (se expresa la RRR, y se obvia la RAR y NNT). Los resultados clínicamente importantes (mortalidad y/o gravedad de la infección por VRS) se han considerado como medidas secundarias. Para las medidas secundarias los resultados se expresan como incidencia acumulada y como número de eventos por cada 100 pacientes, lo que puede inducir a confusión. Cuando se realiza el análisis por pacientes ingresados* se comprueba que las diferencias son menos marcados. Entre los grupos de mayor riesgo (cardiopatías cianógenas) resulta menos efectivo. Financiado por MedImmune Días hospitalización (por 100 niños)a 129 DM −71,6 (p=0,03)) Días hospitalización (por ingreso)¿¿ 13,3 DM −2,5 (p>0,05) Días oxigenoterapia (por 100 niños)a 10,4 DM −5,2 (p>0,05) Días oxigenoterapia (por ingreso)¿¿ 101,5 DM −73,6 (p=0,014) Necesidad VM (por 100 niños)a 2,2% DM −0,9% (p>0,05) Necesidad VM (por ingreso en UCI)¿¿ 58,3% DM 3,2% (p<0,05) Días VM (por 100 niños)a 54,7 DM −48,2 (p>0,05) Días VM (por ingreso con VM)¿¿ 25,3 DM −20,1 (p>0,05) Necesidad UCI (por 100 niños)a 3,7% DM −1,7% (p>0,05) Necesidad UCI (por ingreso)¿¿ 38,1% DM 0,1% (p>0,05) Días UCI (por 100 niños)a 71,2 DM −55,3 (p>0,05) Días UCI (por ingreso en UCI)¿¿ 7,3 DM −4,3 (p>0,05) Mortalidad (por 100 niños)a 4,2% DM −0,9% (p>0,05) Mortalidad (por ingreso)¿¿ ¿? DM ¿? Ver siglas en el pie de la tabla 1.
Volumen de la evidencia: existen solo 2 ECA, ambos con calidad alta (5/5) y con similar diseño: el publicado en 1998 en lactantes prematuros (con o sin DBP)51 y el publicado en 2003 en lactantes con cardiopatías congénitas (hemodinámicamente significativas)58.
Pacientes: el tamaño muestral es importante: 1.002 pacientes en GI y 500 en GC en el estudio Impact (prematuros <35 SG y ≤6 meses de vida y prematuros con DBP y ≤24 meses de vida y que han requerido tratamiento médico en los últimos 6 meses)51; 639 en GI y 642 en GC en el ECA de Feltes et al (≤24 meses con cardiopatía congénita hemodinámicamente significativa en el que no se ha realizado cirugía correctora o solo se ha realizado una cirugía paliativa)58. Los dos ECA son en niños hospitalizados.
Intervención: se administró palivizumab IM, 15mg/kg una vez al mes y durante 5 meses (octubre–marzo).
Comparación: placebo.
Medidas principales: las medidas principales fueron hospitalización por enfermedad respiratoria por VRS. Como medidas secundarias se consideraron: días hospitalización, días oxigenoterapia, necesidad y días de ventilación mecánica, necesidad y días de UCI, mortalidad.
Tiempo: seguimiento durante 150 días (hasta 30 días después de última dosis).
Intensidad del efecto o fuerza de la asociación: en Impact Study51 la hospitalización en el GI es el 4,8% en comparación con el 10,6% en el GC; reducción absoluta del riesgo (RAR): el 5,8% (IC95%: 2,8–8,8), reducción relativa del riesgo (RRR): el 55% (IC95%: 38–72) y NNT=17 (IC95%: 11–36). En Feltes et al58 la hospitalización en el GI es el 5,3% en comparación con el 9,7% en el GC; RAR: 4,4 (IC95%: 1,7–7,3), RRR: 45 (IC95%: 23–67) y NNT=23 (IC95%: 14–67). En ambos estudios para las medidas secundarias los resultados se expresan como incidencia acumulada y como número de eventos por cada 100 pacientes, lo que puede inducir a confusión; cuando se realiza el análisis por pacientes ingresados (en los que se constatan las variables secundarias) se comprueba que las diferencias son menos marcadas58 o, incluso, contrapuestas51: en el GI se ingresa menos, pero estos están más graves.
Consistencia entre estudios: los resultados de ambos estudios, realizados con el mismo diseño y patrocinio, son consistentes en sus resultados. Sin embargo, en Impact Study51 los dos únicos pacientes ingresados que fallecen están en el GI y se constata que entre los grupos de mayor riesgo (<32 SG y con DBP) resulta menos efectivo. De forma similar, en el ECA de Feltes et al58 entre los grupos de mayor riesgo (cardiopatías cianógenas) resulta menos efectivo.
Precisión de las estimaciones: la precisión de los estudios es correcta, dado el amplio tamaño muestral de ambos ECA para la medida principal de efecto, pero no para otras medidas de importancia clínica.
Estimación de sesgos: podrían existir algún sesgo relacionado con la no definición de los criterios de ingreso (medida principal del ECA), así como del concepto «hemodinámicamente significativo» en el estudio de Feltes et al58. Ambos estudios están financiados por MedImmune, empresa fabricante del palivizumab.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse parcialmente directa debido a la correcta definición de pacientes y de la intervención, así como por la calidad de los ECA y tamaño muestral. El único inconveniente es la no definición de los criterios de ingreso (medida principal de los ECA), el que los resultados clínicamente importantes (mortalidad y/o gravedad de la infección por VRS) se han considerado como medidas secundarias, así como la insuficiente expresión de la magnitud de efecto en la variable principal (se expresa la RRR, y se obvia la RAR y NNT) y secundarias (eventos por 100 pacientes en lugar de eventos por pacientes ingresado).
Validez externa y aplicabilidad de la evidencia: según los resultados de los 2 ECA, palivizumab parece útil como tratamiento preventivo para disminuir la hospitalización por VRS en lactantes con factores de riesgo (prematuros con o sin DBP y en recién nacidos con cardiopatías hemodinámicamente significativas). Cabe recordar que el NNT en IMpact Study51 es de 17 pacientes prematuros (IC95%: 11–36) y en el ECA de Feltes et al58 es de 23 lactantes cardiópatas (IC95%: 16–67), y que estos resultados son peores en los pacientes más graves: prematuros <32 SG, prematuros con DBP y cardiopatías cianógenas. Sin duda, el aumento del NNT empeora el análisis coste-efectividad del producto en estudio; este aspecto no se aborda en ninguno de los ECA realizados con palivizumab, pero dado que el objetivo principal en ambos estudios es que los pacientes tratados ingresen menos, en buena parte lo que parece buscarse es una reducción de costes. La evaluación económica es esencial a la hora de la aplicabilidad de este anticuerpo monoclonal.
Balance riesgo-beneficio-coste: en los 2 ECA se estudian los efectos adversos, sin diferencias significativas entre los GI y GC. La única diferencia significativa observada ha sido en el ECA de Feltes et al58: mayor presencia de graves eventos adversos en el GC (63,1%) que en el GI (55,4%), aunque no se detalla en el texto a qué se refiere y si tuvo relación con la aplicación de la medicación.
Los beneficios del palivizumab parecen merecer la pena frente a los perjuicios (no diferencias significativas en los efectos adversos), pero no sabemos si frente a los costes (no se aborda en los ECA). El balance riesgo-beneficios estará muy condicionado por los costes elevados de este anticuerpo monoclonal (existen numerosos estudios de evaluación económica con resultados contradictorios) y la potencial necesidad de redefinir las indicaciones de uso en aquellas poblaciones de mayor riesgo.
Estimación del impacto de futuros estudios: sería deseable la realización de ECA independiente de la industria farmacéutica que confirmen estos hallazgos y que valoren los resultados especialmente dependientes de los criterios de ingreso y de la tasa basal de hospitalización por BA en la región de estudio (de donde se obtienen los cálculos de RRA, NNT y estudios de coste-efectividad y coste-beneficio, fundamentales en un fármaco de elevado coste).
- b)
Estudios observacionales:
En la tabla 5 se exponen los resultados de todos los estudios observacionales sobre palivizumab en el tratamiento preventivo de la BA.
Tabla 5.Tabla simplificada de prevención (estudios observacionales): palivizumab
Comparación CE CC D Medida de efecto RGC EE Efecto¿ IC95% (p) Calidad. Comentarios Autor año Efectividad de palivizumab en estudios observacionales Prevención contagio nosocomial UCIN Cox79 2001 8 SC Riesgo adquisición de VRS IA 0% 2/5; dos exitus no relacionados entre tratados Abadesso80 2004 19 41 SC Riesgo adquisición de VRS 10,5% RAR 10,5% 2/5; no estimable el efecto atribuible a Pvz Antes-después palivizumab Singleton64 2003 3/5; nativos de Alaska (alto riesgo de BA) Cohorte completa – – CR Ingresos IRA /1.000 RN/año 312 RAR −96 <36 SG de bajo riesgo y 36 SG; cohorte de referencia no detallada; disminución de 1.a IRA VRS+ pero aumento del total de ingresos por IRA Ingresos 1.a IRA VRS+/1000 RN/año 154 RAR 10 <36SG de alto riesgo 60 41 CR Ingreso 1.a IRA VRS+ 43,9% RR 0,34 0,17–0,68 Alto riesgo: candidatos a Pvz >36SG 1.805 1.740 CR Ingreso 1.a IRA VRS+ 14,8% RR 0,96 0,82–1,13 No se aportan datos de ingresos total IRA Pedraz62 2003 1.583 1.919 CR Ingreso por IRA baja 20% RAR 10,9% 8,5–13,2% 2/5; ≤32 SG; financiado por Abbott; criterios de Pvz SEN 2000–02; bajo riesgo en grupo control de IRA baja VRS− (sugiere registro diferencial de casos VRS+) Ingreso por IRA baja VRS− 5,2% RAR 1,5% 0–3,1% Ingreso por IRA baja VRS+ 13,2% RAR 9,3% 7,4–11,2% Singleton65 2006 1/5; no se detalla la población de referencia; criterio de tratamiento: ≤32 SG, 32–36 SG y >36 SG con enfermedad pulmonar grave <1 año – – Ec Ingresos IRA baja/1.000 RN/año 284 RR 0,99 (p=0,89) Ingresos IRA VRS+/1.000 RN/año 178 RR 0,58 (p<0,001) <1 año prematuros – – Ec Ingresos IRA baja/1.000 RN/año 472 RR 0,90 (p=0,14) Los resultados sugieren un cambio en el perfil etiológico o en la detección del VRS Ingresos IRA VRS+/1.000 RN/año 317 RR 0,39 (p<0,001) Mitchell61 2006 1.338 1.188 CP Ingreso por infección VRS+ 4,5% RR 0,62 0,42–0,93 3/5; <36 SG; grupos de población (no indican los tratados globales); financiado por Abbott; Riesgo medio post-pre 842 907 CP Ingreso por infección VRS+ 3,3% RR 0,83 0,48–1,41 diferencias a expensas de subgrupo alto riesgo Riesgo alto post-pre 496 411 CP Ingreso por infección VRS+ 7,3% RR 0,41 0,23–0,76 Riesgo medio: 33–35 SG; alto: <33 SG; 33-los tratados globales); financiado por Abbott; Riesgo alto tratados/no tratados 274 216 CP Ingreso por infección VRS+ 4,6% RR 0,39 0,14–1,14 Grimaldi60 2007 108 88 CR Ingreso por BA VRS+ 14,8% RAR 13,7% 6,7–20,7% 2/5; ≤30 SG, sin DBP, edad <6 meses; criterios de Pvz de estudio IMpact NNT 6 4–11 Giebels59 2008 35 40 CR Ingreso por enf. Respiratoria 17,5% RR 0,49 0,14–1,75 2/5; fibrosis quística; <18 meses al diagnóstico; cohortes heterogéneas Tratados vs. no tratados coetáneos Henckel66 2004 Criterio de indicación de tratamiento no claro, con cumplimiento irregular; implantación de Pvz el 2.o año; 1.er año discrecional Prematuros ≤32 SG sin EPC 75 567 CR Ingreso por BA VRS+ 3,9% RAR 1,2% −2,8–5,2% Enfermedad pulmonar crónica 151 44 CR Ingreso por BA VRS+ 6,8% RAR 0,5% −8,1–9 Lacaze-Masmonteil94 2004 376 2.370 CP Ingreso por infección VRS+ 7,2% RR 0,85 0,56–1,3 4/5; prematuros ≤33 SG; cohortes heterogéneas; análisis no ajustados por lo que no es valorable la ausencia de reducción del riesgo en grupo tratado; posible aumento de IRA VRS negativas; financiado por Abbott Ingreso por cualquier causa 27,4% RR 1,59 1,39–1,82 Ingreso por IRA baja 15% RR 1,9 1,6–2,6 Ingreso por IRA baja VRS− 5,8% RR 3,65 2,8–4,7 Mitchell61 2006 1.338 1.318 CP Ingreso por infección VRS+ 3,8% RR 0,73 0,47–1,13 3/5; <36 SG; financiado por Abbott; Calgary (tratados) vs. Edmonton de 1999–2002 Riesgo medio (33–35 SG) 842 834 CP Ingreso por infección VRS+ 2,1% RR 1,27 0,69–2,33 Riesgo alto (<33 SG; ≤35+EPC) 496 425 CP Ingreso por infección VRS+ 7% RR 0,43 0,23–0,79 Solo diferencias en subgrupo alto riesgo Pautas correctas vs. incorrectas Parnes68 2003 1.577 472 CP Ingreso 1.a infección por VRS 4,4% RAR 2% (p=0,02) 2/5; <32 SG 46,6%; 32–35 SG 45,2%; >35 SG 8,1%; UCIN: 46%; EPC 24%; cardiopatía 5%; fibrosis quística (1%) Resch69 2006 90 148 CP Ingresos por infección VRS+ 8,1% RAR 4,8% −1–10,5% 1/5; prematuros >29 y ≤32 SG tratado con Pvz; bajo riesgo de ingreso; no se menciona si tratado en mes previo al ingreso Medrano70 2007 647 113 CP Ingresos por IRA VRS+ 7,08% RR 3,05 2,14–4,35 4/5; cardiopatías congénitas hemodinámicamente significativas; financiado por Laboratorios Abbott Días protegidos vs. no protegidos Singleton64 2003 335 ‐ CP Ingresos 1.a IRA VRS+/1000 d 1,07 RR 0,52 0,28–0,93 3/5; nativos de Alaska (alto riesgo de BA); protegidos: <1 mes de la dosis Otras comparaciones Prais82 2005 167 129 CR Ingreso en UCI por BA VRS+ 81,4% RAR 7,7% (p=0,127) 1/5; ingresos en UCIP de Israel; Escaso impacto de Pvz en los ingresos en UCI; Los casos con VM eran un 16% tras Pvz Ingreso UCI antes-después Pvz Ingresos con criterios AAP de Pvz 17% RAR 0% Mansbach81 2007 32 561 CP Ingreso desde urgencias 39% RR 1,4 0,97–1,9 2/5; cohortes heterogeneas; solo el 49% de los que cumplían criterios recibieron Pvz; la peor evolución no puede atribuirse a Pvz Casos de BA con/sin Pvz previo Tratados corticoides en urgencias 15% RAR −16% (p=0,02) Ingreso en UCI 3% RAR 0% Tratados con Pvz sin control Sorrentino78 2000 1.839 CP Ingreso 1.a infección por VRS IA 2,3% 2/5; financiado MedImmune Inc.; <32 SG 57,4%: (26); antecedente UCIN: 51,5%; EPC (21,9%), cardiopatía (2,2%) Ingreso enf. respiratorias VRS− IA 8,1% G.H. Benazuza73 2002 283 CP Ingreso por BA IA 10,6% 6,8–14,3% 3/5; ≤32 SG 86,9%; DBP 38,4%; cardiopatías 5,9% Ingreso por BA VRS+ IA 3,9% 1,4–6,3% Oh75 2002 480 CP Ingreso por IRA baja VRS+ IA 2,4% 2/5; ≤32 SG <6 meses o DBP <2 años Parnes68 2003 2/5; financiado MedImmune. Global 2.116 CP Ingreso 1.a infección por VRS IA 2,4% <32 SG 46,6%; 32–35 SG 45,2%; >35 SG 8,1%; UCIN: 46%; EPC 24%; cardiopatía 5%; fibrosis quística: 1% <32 SG 986 CP Ingreso 1.a infección por VRS IA 4,5% 32–35 SG 957 CP Ingreso 1.a infección por VRS IA 1,6% EPC 508 CP Ingreso 1.a infección por VRS IA 5,8% Romero76 2003 2/5; financiado MedImmune Inc. Centros EE. UU. (por años: 9, 12, 50 y 116) 1998–1999 (Sorrentino 2000) 1.839 CP Ingreso 1.a infección por VRS IA 2,3% 1999–00 2.830 CP Ingreso 1.a infección por VRS IA 2,4% <32 SG 40–57,8% (por años 57,4; 57,8; 46 y 40%); EPC (22,8–24%); cardiopatía 4,3–5,7%; antecedente de UCIN (en 1998–99 51,5%; 2000–01: 46%) 2000–01 2.116 CP Ingreso 1.a infección por VRS IA 2,9% 2001–2002 5.091 CP Ingreso 1.a infección por VRS IA 1,5% Entre el 20–33% de los ingreso UCI Naver74 2004 390 CP Ingreso infección por VRS IA 4,1% 2/5; <26 SG Saji77 2005 108 CR Ingreso infección por VRS IA 4,6% 2/5; cardiópatas; cianosis 25%, congestión pulmonar 21,3% e hipertensión pulmonar 7,4%; colaboración en recogida de datos de Abbott Boivin71 2007 116 CP BA IA 31% 3/5; <33 SG 64,7%; 33–35 SG 14,7%; EPC 6%; cardiópatas 6%; financiado por MedImmune Ingreso por BA IA 3,4% BA VRS+ IA 6,9% Ingreso por BA VRS+ IA 0,8% Medrano70 2007 760 CP 4/5; cardiopatías congénitas hemodinámicamente significativas; financiado por Laboratorios Abbott Global Ingreso por IRA IA 10,4% 8,2–12,6% Ingreso por IRA VRS+ IA 3,6% Cohen72 2008 2/5; financiado por MedImmune Total cardiopatías 1.500 CP Ingreso 1.a infección por VRS IA 1,9% Cardiopatías congénita; de 2000–04 riesgo global por años: 4,3; 2,8; 1,4 y 1,5% Cardiopatía acianóticas 1.072 CP IA 1,6% Cardiopatía acianóticas 428 CP IA 2,6% Cianóticas por años: 19,6, 23,7, 19,3 y 37,5%; hemodinámicamente inestables 2002–03: 32,7%; 2003–04 50,9% AP: atención primaria ambulatoria; BA: bronquiolitis aguda; CP: cohortes prospectivo; CR: cohortes retrospectivo; DAR: diferencia absoluta del riesgo; DBP: displasia broncopulmonar; DM: diferencia de medias; E: entorno asistencial; Ec: estudio ecológico; ECA: ensayo clínico aleatorizado; EE: estimador de efecto; EPC: enfermedad pulmonar crónica; GI: grupo intervención; GC: grupo control; H: hospital; HR: hazard ratio; IAB: incremento absoluto del beneficio; IAR: incremento absoluto del riesgo; IO: índice de oxigenación; IV: índice ventilatorio; ns: no significativo; P: poblacional; Prev: prevalencia; Pvz: palivizumab; RDAI: Respiratory Distress Assessment Instrument; RGC: riesgo grupo control; RAB: reducción absoluta del beneficio; RAR: reducción absoluta del riesgo; RRR: reducción relativa del riesgo; SC: serie de casos; SG: semanas de gestación; SF: suero fisiológico; SS: suero salino; U: servicio de urgencias; VM: ventilación mecánica; VRS: virus respiratorio sincitial.
Tras la publicación del IMpact-RSV Study Group en 199851 (único ECA realizado hasta la fecha sobre la eficacia del palivizumab en la prevención del ingreso por BA VRS+ en prematuros con o sin displasia broncopulmonar) y del ECA de Feltes et al en 200358 (único ECA realizado hasta la fecha sobre la eficacia del palivizumab en la prevención del ingreso por BA de lactantes con cardiopatía congénita), se han derivado distintos estudios que muestran las diferencias existentes entre la eficacia de los ECA y la menor efectividad descrita en la mayoría de los estudios observacionales, así como la gran importancia que en estos resultados tiene el diferente riesgo basal de hospitalización por infección VRS en cada estudio (que varía ampliamente en las series, entre un el 3–45%).
Volumen de la evidencia: siete trabajos comparan la incidencia de ingreso por infección respiratoria aguda (IRA) baja, BA o enfermedad respiratoria con o sin infección por VRS en cohortes antes y después de la introducción de palivizumab59–65. Tres estudios comparan la incidencia de cohortes coetáneas tratadas o no tratadas61,66,67. Cuatro trabajos evalúan el riesgo de ingreso por infección por VRS en cohortes con pautas de tratamiento adecuadas o inadecuadas o en días protegidos respecto no protegidos64,68–70. Ocho estudios evalúan el riesgo de ingreso en cohortes tratadas sin GC71–78. Dos estudios valoran la efectividad de palivizumab en el control de brotes nosocomiales en UCI neonatales79,80. Dos estudios evalúan series de pacientes con BA, valorando el riesgo de ingreso o ingreso en UCI en función de haber recibido previamente o no palivizumab81,82. Un estudio valora si existe diferencia en la carga viral de los pacientes que ingresan con infección por VRS en función de haber recibido previamente o no palivizumab83. Una revisión sistemática valora el coste-efectividad de la administración de la primera dosis de palivizumab antes del alta hospitalaria neonatal en comparación con ambulatoria84, no encontrando estudios que respondan a esta cuestión.
Pacientes: la mayoría de los trabajos incluyen muestras de prematuros o niños con enfermedad pulmonar crónica, aunque algunos incorporan cardiópatas70,77, fibróticos quísticos59 o población general64,65,81,82. Un estudio analiza pacientes con fibrosis quística59 y tres estudios pacientes con cardiopatía congénita70,72,77. El tamaño muestral de los trabajos es variado, presentando algunos de ellos limitaciones relacionadas con el escaso número de eventos (ingresos); no obstante, diversas cohortes de prematuros multicéntricas son lo suficientemente grandes para ofrecer estimaciones precisas del riesgo de ingreso. Parte de las diferencias en los resultados son atribuibles al mayor o menor riesgo de la cohortes estudiadas.
Exposición: las cohortes expuestas reciben palivizumab, una inyección mensual durante la epidemia de infección por VRS (según el área geográfica; la mayoría de noviembre a marzo). La inclusión en las cohortes se hace habitualmente por indicaciones de riesgo relacionadas con la prematuridad o la asociación de enfermedad pulmonar crónica, existiendo una gran variación entre países y épocas en los criterios de indicación. Algunas cohortes expuestas incluyen pacientes que no cumplen criterios de indicación de palivizumab y algunas cohortes control pacientes con criterios de indicación que no lo recibieron. El número de dosis depende del mes de incorporación a la cohorte. Algunos estudios analizan el impacto a nivel poblacional del inicio del programa de profilaxis con palivizumab, considerando en las cohortes expuestas sujetos con y sin la intervención61,64,65.
Comparación: la comparación se realiza con niños no tratados o incorrectamente tratados con palivizumab. En los estudios de base poblacional la comparación se hace entre áreas o épocas sin programa de profilaxis61,64,65.
Medidas principales: la mayoría de los estudios han considerado como medida de efecto los episodios de hospitalización con infección por VRS, con o sin criterios clínicos de IRA; solo en 7 de ellos se han recogido el conjunto de hospitalizaciones por IRA, con o sin VRS62,64,65,67,71,73,78. Pocos estudios han detallado la frecuencia de BA60,66,71,73 y solo uno los episodios ambulatorios71. Los trabajos en los que la medida de efecto es el primer ingreso por IRA baja en menores de 1–2 años podrían ser representativos del riesgo de ingreso por BA, ya que es la forma clínica más habitual en esos episodios. La consideración como medida de efecto de los ingresos por cualquier enfermedad respiratoria en la que se haya detectado VRS, implica un alto riesgo de error, ya que pueden perderse numerosos episodios de hospitalización sin determinación de VRS o con VRS negativo. Teniendo en cuenta que la medida de efecto es la hospitalización y no el diagnóstico de BA o la adquisición del virus, parece lógico tratar de detectar cambios en el perfil etiológico o en la detección del VRS, relacionados con la profilaxis. Las BA por VRS pueden constituir en torno a un 35–50% de todas las BA hospitalizadas, por lo que cualquier cambio en esta proporción tiene interés a la hora de valorar la efectividad de la profilaxis, especialmente si queremos asegurarnos que el registro diferencial de las infecciones por VRS influya en los resultados. A pesar de que la mayoría de los trabajos no ofrecen información al respecto, al menos en dos estudios se sugiere un aumento de las IRA con VRS negativo o no identificado64,67.
Tiempo: la mayoría de los estudios presentan seguimientos de las cohortes a lo largo de las estaciones de infección por VRS (otoño-invierno), presentando algunos de ellos datos de cohortes de varios años agrupadas o por separado.
Intensidad del efecto o fuerza de la asociación: en los estudios que evalúan la reducción del riesgo tras la introducción del programa de profilaxis con palivizumab, con respecto controles históricos, se ha observado una reducción de ingresos por infección por VRS en niños prematuros de un 40–60%, con RAR muy variadas en función del nivel de riesgo de las cohortes. La disminución relativa del riesgo es similar a la observada en los ensayos clínicos; aunque en términos absolutos la magnitud del efecto es discreta, especialmente en ciertos países.
El efecto para el conjunto de IRA bajas o BA, varía entre una disminución del riesgo (equivalente al efecto observado con los casos por VRS62) a un mantenimiento o incluso aumento del riesgo64,65. En los trabajos que comparan cohortes tratadas con no tratadas coetáneas, dos estudios muestran un riesgo similar o incluso mayor en los tratados, debido, probablemente, al mayor riesgo basal de las cohortes tratadas66,67. Una comparación entre áreas de población similares con o sin programa de profilaxis solo encuentra una disminución del riesgo en un análisis del subgrupo de prematuros de alto riesgo (<33 SG; 33–35 SG con enfermedad pulmonar crónica)61.
La comparación de pacientes con pautas de palivizumab correctas o incorrectas muestra una disminución del efecto asociado al incumplimiento o retraso de las dosis (en torno al 50%)64,68,69. Otros estudios que han valorado la utilidad de palivizumab en la prevención del contagio nosocomial de la infección UCI neonatales o la diferente evolución de ingresos por BA previamente tratadas, no ofrecen información de interés. Un trabajo ha recogido el potencial impacto de la profilaxis sobre la casuística de ingresos en UCI pediátricas, encontrando que la mayoría de los pacientes con BA que requieren ingreso en UCI y ventilación mecánica no cumplen criterios de tratamiento con palivizumab82.
Por último, las diferentes cohortes publicadas de niños prematuros o con cardiopatía congénita, tratados con palivizumab, sin grupo control, han encontrado incidencias acumuladas de ingreso variadas, en función del diferente nivel de riesgo de las muestras incluidas. La mayoría de los trabajos se limitan a describir los ingresos por infección por VRS, con intervalo de resultados entre el 0,8–4,6%. Algunas series que presentan estaciones sucesivas encuentran riesgos decrecientes, que parecen debidos a la progresiva inclusión de niños de menor riesgo en las cohortes tratadas76. Considerando tres estudios con estimaciones del riesgo de ingreso por IRA o BA por cualquier causa, los casos por VRS representan entre una cuarta parte y un tercio del total71,73,78. Además, las BA que originan ingreso hospitalario suponen menos del 10% de las BA que presentan estos pacientes71.
En nuestro país, el estudio IRIS ha encontrado en la cohorte de prematuros de ≤32 SG tratada con palivizumab una reducción de riesgo de ingreso por infección por VRS, con respecto a la cohorte histórica, superior a la del ensayo clínico original (riesgo de ingreso en la cohorte tratada: el 3,9%; en la cohorte control histórica: el 13,2%). No obstante, podría haber diferencias epidemiológicas o en las características de los ingresos con el estudio IMPACT, ya que en el ensayo clínico el riesgo de ingreso por enfermedad respiratoria no relacionada con el VRS era en el GC del 14% (en comparación con el 10% por VRS), mientras que en el estudio IRIS los ingresos no relacionados con el VRS solo alcanzaban en el GC el 5,2% (en comparación con el 13,2% por VRS).
En Andalucía, el estudio del Grupo de Hospitales Benazuza, encuentra en una cohorte de recién nacidos tratados con palivizumab un riesgo de ingreso por BA por VRS del 3,9% (para los ingresos por BA no relacionadas con el VRS el riesgo fue del 6,5%). En un estudio retrospectivo realizado años antes en la misma área geográfica85, se había encontrado un riesgo para el conjunto de BA del 10,6% en prematuros de <32 SG y del 9,8% en cardiopatías con hiperaflujo pulmonar.
El estudio CIVIC ha encontrado en niños españoles con cardiopatías congénitas hemodinámicamente significativas, mayoritariamente tratados con palivizumab, un riesgo de ingreso por infección por VRS del 3,2% (el 2,32% entre los casos con profilaxis completa y el 7,08% entre los que tuvieron profilaxis incompleta; no obstante, no detallan si el ingreso se produjo en periodo de cobertura de la profilaxis), inferior al observado en el ensayo clínico original (5,3%).
Consistencia entre estudios: teniendo en cuenta las diferencias metodológicas existentes entre los diferentes estudios resulta difícil valorar la consistencia de los resultados observados. No obstante, podemos considerar relativamente consistentes los resultados de las estimaciones de riesgo de ingreso por infecciones por VRS. Existen importantes diferencias, cuando lo que se consideran son el conjunto de BA o IRA bajas.
Precisión de las estimaciones: las estimaciones de riesgos parecen suficientemente precisas, si exceptuamos algunos trabajos con escaso tamaño muestral59,60,69. Solo las cohortes tratadas con alto riesgo de ingreso previo (<33 SG o con enfermedad pulmonar crónica) presentan una reducción significativa del riesgo de ingreso por infección por VRS60–62,64,65. En dos estudios no se observó reducción significativa del riesgo66,67, por ser la reducción muy discreta66 o comparar cohortes heterogéneas67. Se ha encontrado un significativo mayor riesgo en los pacientes en los que había transcurrido más de un mes de la última dosis64; de otros 2 estudios en los que solo se comparó la incidencia acumulada en función de que la pauta fuera en conjunto correcta solo uno encontró diferencias significativas, aunque este análisis puede resultar inapropiado68,69.
Estimación de sesgos: los estudios incluidos en esta revisión presentan un alto riesgo de diferentes tipos de sesgos. Tras la publicación de los ensayos clínicos originales sobre eficacia de palivizumab en prematuros y cardiópatas, no contamos con ningún estudio de diseño experimental que haya reproducido los resultados inicialmente observados, ni que haya tratado de demostrar la eficacia de palivizumab, considerando otras medidas de efecto. La falta de asignación aleatoria de la intervención evaluada limita la validez de los resultados. Los trabajos en los que se comparan muestras antes y después de la implantación del programa de profilaxis, tanto si es en grupos de pacientes como en muestras poblacionales, no pueden controlar los cambios epidemiológicos espontáneos, ni modificaciones en otras medidas preventivas o en los hábitos asistenciales que pueden influir en los resultados. Los estudios que han evaluados muestras coetáneas expuestas o no a palivizumab, ofrecen resultados sesgados en contra de palivizumab, por el mayor nivel de riesgo de los pacientes a los que se indicó la profilaxis. Tan solo un trabajo ha realizado una comparación coetánea entre poblaciones similares; encontrando exclusivamente diferencias en el subgrupo de más alto riesgo.
Por otra parte, como se ha comentado anteriormente, al considerar en muchos estudios como medida de efecto los ingresos asociados a infección VRS, pueden perderse numerosos episodios de hospitalización sin determinación de VRS o con VRS negativo. Teniendo en cuenta que la medida de efecto es la hospitalización y no el diagnóstico de BA o la adquisición del virus, parece lógico tratar de detectar cambios en el perfil etiológico o en la detección del VRS relacionados con la profilaxis en los pacientes que ingresan. Hubiera sido deseable contar con procedimientos objetivos y exhaustivos de detección de BA en las cohortes, al margen de la identificación etiológica, lo que apoyaría la validez de los resultados, especialmente si tenemos en cuenta los numerosos estudios que ha promovido la empresa que produce o comercializa palivizumab61,62,67,68,71,72,77,78.
Grado de relación con la pregunta clínica: la evidencia aportada por estos estudios debe ser considerada indirecta, ya que, aunque la población e intervención que se han evaluado son apropiadas, la medida de efecto habitual es una medida intermedia y potencialmente sesgada. Para que el riesgo de ingreso por infección por VRS pueda ser considerado una medida válida de infección grave debería acompañarse de un efecto proporcional en otras variables relacionadas con gravedad (complicaciones, ingreso en UCI, ventilación mecánica o mortalidad) y controlar posibles sesgos de clasificación, controlando otras IRA bajas o BA no relacionadas con VRS.
Validez externa y aplicabilidad de la evidencia: entre los trabajos revisados se recogen muestras de pacientes que son representativos de nuestro entorno, aunque existen dudas por la gran variedad de criterios empleados en la indicación de tratamiento entre países o sistemas sanitarios. En cuanto a la aplicabilidad de los resultados, considerando las limitaciones metodológicas de los estudios y las dudas sobre la adecuación de las medidas de efecto empleadas, estos estudios no ofrecen información de interés para juzgar el impacto clínico de la profilaxis, al margen de la concordancia con lo observado en los ensayos clínicos originales. Las estimaciones de efectividad podrían ser aplicables a grandes prematuros o pacientes con cardiopatías complejas pero existen dudas sobre su aplicabilidad a niños con riesgo medio (33–35 semanas de gestación).
Balance coste-beneficio-riesgo: en los estudios valorados no se ofrece información sobre la relación coste-beneficio de la profilaxis con palivizumab. Las cohortes revisadas no presentan efectos adversos mayores asociados. La magnitud del efecto en términos absolutos, menor en muchos países que lo observado en los ensayos clínicos originales, deberá ser tenida en cuenta en los estudios de coste-beneficio.
Estimación del impacto de futuros estudios: parece necesaria la realización de estudios de ámbito poblacional y promovidos desde instituciones públicas, empleando procedimientos objetivos y exhaustivos de detección de BA, tanto ingresadas como no, de cualquier etiología, valorando la gravedad de los pacientes e incluyendo en el análisis medidas alternativas como formas complicadas y mortalidad. Por otra parte, teniendo en cuenta las dudas sobre la conveniencia de tratar prematuros nacidos entre 33–35 semanas y el variado criterio seguido en múltiples países, sería conveniente reproducir un estudio con diseño experimental en este grupo de pacientes.
El campo de investigación en anticuerpos monoclonales ya está desarrollando nuevos fármacos que superen al palivizumab en inmunogenicidad, tolerancia, seguridad y propiedades farmacocinéticas y, probablemente también, en precio. El propio laboratorio que ha investigado palivizumab ya ha lanzado los primeros datos de ECA en fase I y II sobre motavizumab86.
Ninguna de las tres GPC más importantes sobre BA recomiendan el uso rutinario de palivizumab, sino condicionado a diferentes factores de riesgo: la AAP concreta en prematuros (<35 SG), enfermedad pulmonar crónica o cardiopatía congénita87; SIGN es más restrictiva y lo indica en <12 meses con extrema prematuridad, cardiopatía congénica cianógena, significativa enfermedad pulmonar (congénita o adquirida) e inmunodeficiencia88; en la tercera GPC no se especifica en concreto la población de riesgo en la que estaría indicada89.
La infección nosocomial por VRS continúa siendo un problema importante. El tiempo de supervivencia del VRS en las manos es generalmente de menos de una hora, pero en las superficies de los materiales (cunas, estetoscopio, etc.) puede exceder las 24h.
En los pacientes hospitalizados (con BA en general, pero por VRS en particular) son importantes las medidas de aislamiento y de prevención de la transmisión de la infección. En la revisión de la literatura se confirma que las medidas de control y prevención de transmisión hospitalaria de la infección (aislamiento, lavado de manos, utilización de mascarilla, guantes, gorro y calzas), no se apoyan en diseños robustos (ECA) y la mayoría de los estudios no presentan suficiente poder para detectar diferencias significativas que demuestren que reducen la transmisión nosocomial90. La mayoría de estas recomendaciones se apoyan en evidencias indirectas, pues no parece ético realizar estudios aleatorios controlados en técnicas bien establecidas en la reducción de infecciones cruzadas (ej. lavado de manos).
Las 3 GPC87–89 consideran que el lavado de manos es la medida más efectiva para la prevención de la infección nosocomial por VRS. La AAP especifica que el lavado de manos debe realizarse antes y después del contracto con el paciente, después de tocar objetos en contacto con el paciente y tras quitarse los guantes87. Otras medidas son recomendadas específicamente por solo alguna guía, tal como la mascarilla89, batas desechables88 o el aislamiento del paciente y la restricción de visitas88.
Algunas recomendaciones, basadas en la experiencia clínica y el consenso, son:
- •
Aislamiento: habitación para enfermos con VRS+, evitar visitas, personal de enfermería común.
- •
Lavado de manos con agua y jabón (de 15–30 segundos) y estetoscopio antes y después del contacto con cada paciente y tras retirar guantes. También es posible el lavado con preparados con contenido alcohólico, frotando palma contra palma y dedos/muñecas hasta que estén secas.
- •
Uso de guantes (no reemplaza el lavado de manos), y considerar bata y mascarilla (si previsible contacto directo con paciente), que se deben quitar antes de salir de la habitación.
- •
Educación sanitaria continuada.
Las medidas aquí comentadas deberían ser de aplicación generalizada en las plantas de hospitalización a todo paciente con BA, con o sin VRS identificado, considerando el riesgo de contagio, tanto de VRS (no detectado por las pruebas de diagnóstico rápido), como de otros virus implicados.
Existen experiencias aisladas sobre el uso de palivizumab en brotes de infección nosocomial por VRS en unidades de cuidados intensivos neonatales79,80,91,92, pero es preciso disponer de ECA controlados antes de extender su recomendación.
Las tres GPC87–89 consideran también la importancia de evitar la inhalación pasiva de tabaco, como un factor agravante de la situación respiratoria del paciente, que puede conducir a su hospitalización, y el apoyo a la lactancia materna como factor protector.
Conflicto de interesesTodos los autores implicados en la elaboración de este documento han realizado una declaración explícita de los conflictos de intereses por escrito. No constan conflictos de intereses que puedan influir en el contenido de este documento. No obstante, algunos autores (JFS, JMEB y SLLA) han declarado su participación en ponencias, congresos y proyectos patrocinados por distintas empresas de la industria farmacéutica relacionadas con el tema tratado (ALK-Abello, GSK y MSD fundamentalmente).
FinanciaciónFinanciado con una beca de la Fundación-Hospital Torrevieja (código de protocolo: BECA0001).
Jesús M. Andrés de Llano, Servicio de Pediatría, Complejo Asistencial de Palencia, Palencia
María Aparicio Rodrigo, Centro de Salud Entrevías, Área 1 de Atención Primaria, SERMAS, Madrid
Ana Fe Bajo Delgado, Servicio de Pediatría, Hospital Virgen Concha Zamora
Albert Balaguer, Servicio de Pediatría, Hospital General de Catalunya, Universitat Internacional de Catalunya, Barcelona
Antonio Bonillo, Servicio de Pediatría, Hospital de Torrecárdenas, Almería
José Cristóbal Buñuel Álvarez, Centro de Salud, ABS Girona-4, ICS, Gerona
Andrés Canut Blasco, Sección Microbiología, Hospital Santiago Apóstol, Osakidetza-Servicio Vasco de Salud, Vitoria
José María Eiros Bouza, Servicio de Microbiología, Hospital Clínico Universitario de Valladolid, Facultad de Medicina de Valladolid, Valladolid
Jordi Fàbrega Sabaté, Servicio de Pediatría, Hospital Universitari Germans Trias i Pujol, Badalona
José Elviro Fernández Alonso, Servicio de Pediatría, Complejo Asistencial de Palencia, Palencia
Mercedes Fernández Rodríguez, Centro de Salud EAP Potes, SERMAS, Madrid
Santiago Lapeña López de Armentia, Servicio de Pediatría, Complejo Asistencial de León, León
Javier López Ávila, Centro de Salud San Bernardo Oeste, Salamanca
Cristina Molinos Norniella, Servicio de Pediatría, Hospital de Cabueñes, Gijón
Gloria Orejón de Luna, Centro de Salud General Ricardos, Área 11 de Atención Primaria, SERMAS, Madrid
Svetlana Todorcevic, Servicio de Pediatría, Hospital Materno Infantil de Gran Canaria, Las Palmas de Gran Canaria
María García-Puente Sánchez, Hospital de Torrevieja, Alicante
Beatriz Muñoz Martín, Complejo Asistencial, Zamora.
Avalado por la Asociación Española de Pediatría (AEP), Asociación Española de Pediatría de Atención Primaria (AEPap), Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP), Sociedad Española de Urgencias Pediátricas (SEUP), Sociedad Española de Infectología Pediátrica (SEIP), Sociedad Española de Neumología Pediátrica (SENP), Sociedad Española de Inmunología Clínica y Alergia Pediátrica (SEICAP), Sociedad Española de Cuidados Intensivos Pediátricos (SECIP), Sociedad Española de Neonatología (SEN) y Sociedad Española de Cardiología Pediátrica (SECPCC).