Nuestro objetivo fue investigar la correlación entre patrones de crecimiento cefálico y discapacidad intelectual entre distintas presentaciones etiológicas de microcefalia.
Pacientes y métodosSe revisaron 3.269 gráficas de perímetro cefálico (PC) de una unidad de neuropediatría terciaria, seleccionándose 136 participantes con microcefalia. Utilizando las puntuaciones Z de las medidas de PC registradas definimos las variables: PC mínimo, caída de PC y recuperación de PC. Los pacientes se clasificaron según la existencia o no de discapacidad intelectual (CI inferior a 71) y la causa de la microcefalia (idiopática, familiar, sindrómica, sintomática y mixta).
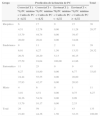
ResultadosEl uso del análisis discriminante permitió definir una función C como C=PC mínimo + caída de PC con un nivel de corte de puntuación Z de C=–4,32. En nuestra muestra, el 95% de los pacientes con resultados por debajo de este nivel, microcefalia severa, presentaban discapacidad intelectual. La concordancia global entre la función de PC y la presencia de discapacidad intelectual fue del 66%. En el grupo de sintomáticas y mixtas, esta concordancia alcanzó el 82%, en contraste con solo el 54% del grupo de idiopáticas y sindrómicas (p=0,0002).
ConclusionesLa utilización de una función de crecimiento del PC discrimina la discapacidad intelectual en pacientes con microcefalia mejor que mediciones aisladas de PC, especialmente en etiologías secundarias y mixtas.
Our aim was to investigate the correlations between patterns of head growth and intellectual disability among distinct ætiological presentations of microcephaly.
Patients and methods3,269 head circumference (HC) charts of patients from a tertiary neuropædiatric unit were reviewed and 136 microcephalic participants selected. Using the Z-scores of registered HC measurements we defined the variables: HC Minimum, HC Drop and HC Catch-up. We classified patients according to the presence or absence of intellectual disability (IQ below 71) and according to the cause of microcephaly (idiopathic, familial, syndromic, symptomatic and mixed).
ResultsUsing Discriminant Analysis a C-function was defined as C=HC Minimum + HC Drop with a cut-off level of C=-4.32 Z-score. In our sample 95% of patients scoring below this level, severe microcephaly, were classified in the disabled group while the overall concordance was 66%. In the symptomatic-mixed group the concordance between HC function and outcome reached 82% in contrast to only 54% in the idiopathic-syndromic group (P-value=0.0002).
ConclusionsWe defined a HC growth function which discriminates intellecutal disability of microcephalic patients better than isolated HC measurements, especially for those with secondary and mixed ætiologies.
La medición del perímetro cefálico (PC) es un método sencillo para evaluar el crecimiento de la cabeza. La microcefalia, definida como un PC anormalmente bajo con respecto al promedio, está relacionada con el retraso mental, un hecho ampliamente constatado desde el siglo xix1. Esta relación se estudió extensamente en la segunda mitad del siglo xx2–10, estableciéndose que, en la población general, un PC inferior a 2 desviaciones estándar (DE) de la edad y el sexo correspondientes está asociado a un CI por debajo de 70 en el 10% de los niños, y un PC inferior a 3 DE a un CI por debajo de 70 en el 51% de los niños9.
Los patrones de crecimiento cefálico se han propuesto como una herramienta importante para evaluar la microcefalia11,12. No obstante, su definición se ha basado en la forma de las curvas de crecimiento y no en modelos matemáticos. Es obvio que cuanto menor sea el PC del niño, mayor será la probabilidad de que presente deficiencias neurológicas9. Pero no se sabe qué niveles de desaceleración del crecimiento del PC están asociados a una evolución equiparable en microcefalias con distintas etiologías.
Son muchas las alteraciones neurológicas susceptibles de poder causar microcefalia o un retraso del crecimiento cefálico, y algunas de ellas han sido ya objeto de estudio. En la encefalopatía hipóxica isquémica, las desaceleraciones leves del crecimiento van asociadas a deficiencias neurológicas incluso antes de llegar al rango de la microcefalia13 y el patrón de las lesiones observadas mediante resonancia magnética (RM) se relaciona con el crecimiento del PC y la condición neurológica del paciente14. Un estudio sobre la rubéola congénita15 mostró una capacidad intelectual normal en presencia de microcefalia cuando se excluyó a niños con pérdidas de audición y visión. Por el contrario, en un estudio de la infección congénita por citomegalovirus se observó que la microcefalia era el predictor precoz más específico de retraso mental16, mientras que la mayoría de los niños con infecciones congénitas no desarrolló trastornos neurológicos17. En su estudio de recién nacidos de muy bajo peso, Hack y Breslau18 observaron que el PC a los 8 meses de edad era el factor relacionado con el crecimiento que mejor predecía el coeficiente intelectual a los 3 años de edad. En otro estudio, la recuperación de PC antes de los 6 meses de edad estaba relacionada con un número menor de alteraciones motoras a los 12 meses19. Se ha observado que PC normal a los 12 meses se asocia a una evolución más favorable en prematuros con hemorragia intracraneal20. Regev y Dubowitz21 descubrieron que el crecimiento cefálico lento tras la hemorragia intracraneal iba asociado a una evolución desfavorable del desarrollo neurológico. La exposición a radiación ionizante22, la malnutrición23, la exposición a medicamentos durante el embarazo24 y la microcefalia primaria o genética25,26 son otras de las causas conocidas de tamaños reducidos de cabeza y de retraso mental. La microcefalia también es una manifestación clínica de cientos de síndromes polimalformativos.
Un estudio retrospectivo hospitalario de 58 pacientes con microcefalia concluyó que los estudios de neuroimagen son el tipo de prueba complementaria más indicado para establecer la etiología de la microcefalia27. En otro estudio de 55 niños con microcefalia, la RM fue anormal en el 80% de los pacientes28.
El objetivo de este estudio fue investigar la concordancia de una función de crecimiento de PC con la discapacidad intelectual en distintas presentaciones etiológicas clínicas en una muestra de lactantes y niños con microcefalia.
Pacientes y métodosEstudio retrospectivo de pacientes vistos en la unidad de neurología pediátrica de un hospital terciario español con un área de referencia de 3 millones de habitantes. Desde el año 1982, en la primera cita del paciente, independientemente del motivo por el que hubiera sido derivado, se incluyó sistemáticamente una gráfica de Nellhaus11 correspondiente a su sexo para su seguimiento. En más de la mitad de las citas, el neurólogo pediátrico midió el PC máximo (en centímetros con un decimal) con una cinta flexible y lo marcó en la gráfica. El protocolo no incluía la medida del PC de los padres ni de la altura del paciente. Desde el año 1989 el hospital cuenta con servicios de RM que pasa a formar parte de la valoración de casi todos los niños con microcefalia.
La recogida de datos comenzó cuando el protocolo llevaba ya una década en uso. Se revisaron los historiales médicos de los pacientes atendidos en nuestra unidad entre 1987 y 2001. Consultamos las gráficas del PC de los 3.269 pacientes y revisamos el historial completo de todos aquellos que tenían una o más medidas de PC por debajo de 2 DE para la media por edad y sexo. Los criterios de inclusión para seleccionar a los pacientes fueron: una o más medidas de PC por debajo de 2 DE para la edad y sexo del paciente según la gráfica de Nellhaus; seguimiento en nuestra unidad superior a 3 años; edad igual o superior a 3 años al efectuar la evaluación cognitiva o del desarrollo; registro de 3 o más medidas de PC; y que se hubiera realizado una investigación etiológica, incluyendo RM cuando fuese necesario. Ciñéndonos a las recomendaciones de Brandt29, excluimos prematuros con edades gestacionales inferiores a las 34 semanas cuyo PC estuviera dentro de los rangos normales a partir de los 18 meses de edad. El PC de los padres se registró en aquellos casos en que se sospechó la existencia de una microcefalia hereditaria.
Se marcaron todos los puntos de PC disponibles para cada paciente en la gráfica de Nellhaus. Se calcularon como sigue las puntuaciones Z (número de DE) de todas las medidas de PC: Z=(medida PC – PC medio para la edad)/DE para la edad. Tras calcular todas las puntuaciones Z, se definieron las siguientes variables para describir el patrón de la curva de crecimiento del PC del paciente:
- –
PC estandarizado mínimo (PC mínimo): es la puntuación Z más baja registrada en cada participante. Dado que todos los pacientes eran microcéfalos, el valor de esta variable fue siempre negativo e inferior a –2.
- –
Caída de PC estandarizado (caída de PC): se calcularon en todos los pacientes cuyas puntuaciones Z bajaron con el paso del tiempo, restándole al menor valor Z registrado el mayor valor Z anterior a aquel. El valor de esta variable siempre fue negativo. Todas las caídas de PC de 0 a –0,2 se consideraron despreciables e iguales a 0.
- –
Recuperación de PC estandarizado (recuperación de PC): se calculó en todos los pacientes cuyas puntuaciones Z aumentaron tras la puntuación Z mínima registrada, restando al mayor valor Z final el menor valor Z registrado previamente. El valor de esta variable fue, en todos los casos, positivo. Todas las recuperaciones de PC inferiores a 0,2 se consideraron despreciables e iguales a 0.
Para evaluar la evolución neurológica, se revisó el nivel de deficiencia intelectual de cada paciente en colaboración con su neurólogo pediátrico. Se tuvieron en consideración las pruebas WISC-R en niños mayores de 6 años con la suficiente capacidad mental preservada para cooperar en las pruebas, informes de colegios y padres en niños con funcionamiento normal mayores de 6 años, así como las pruebas del desarrollo de Terman Merrill o Leiter en niños mayores de 3 años.
Distribuimos a los pacientes en 2 grupos de acuerdo con su evolución:
- –
Con discapacidad intelectual: CI inferior a 71 y/o niveles graves o profundos de deficiencia intelectual en la evaluación neurológica a los 3 años de edad o edades superiores.
- –
Sin discapacidad intelectual: CI igual o superior a 71, y/o funcionamiento normal a los 6 años o edades superiores corroborado por informes escolares
Se establecieron grupos clínicos en función de la causa más probable de la microcefalia. De acuerdo con los criterios propuestos por Baxter et al.12, distribuimos a los participantes en 5 presentaciones: 1) idiopática, es decir, no se pudo reconocer una causa a partir de la historia, la exploración física o los exámenes complementarios, y no hubo otros hallazgos anormales; 2) familiar, es decir, uno de los padres y/o hermanos tuvo un PC en el segundo percentil o por debajo de este; 3) sindrómica, es decir, con anomalías asociadas (que no fuesen del sistema nervioso central); 4) sintomática, es decir, posterior a un acontecimiento patológico, o 5) mixta, 2 o más de las anteriores.
Análisis estadísticoSe analizaron meticulosamente las variables descriptoras —PC mínimo, caída de PC, y recuperación de PC— y se estudió su distribución. La tendencia central y la dispersión de los datos se expresaron mediante la media, la mediana, la desviación estándar y el rango intercuartílico. Se hizo una comparación gráfica del grupo con discapacidad y el grupo sin discapacidad mediante diagramas de caja. En estos diagramas, los lados inferior y superior corresponden a los percentiles 25 (Q1) y 75 (Q3) de la muestra, la longitud de la caja es el rango intercuartílico (RIQ=Q3 – Q1), la línea horizontal en el centro corresponde a la mediana de la muestra, y las barras de error que salen de la caja indican los percentiles 90 y 10. Se recurrió a la prueba no paramétrica de suma de rangos Wilcoxon en las variables originales y al test exacto de Fisher en las variables categóricas resultantes de la codificación en 2 categorías (0, < 0) para evaluar las diferencias estadísticas entre los grupos de discapacidad intelectual. El límite de significación estadística se fijó en p<0,05. Se hizo un análisis multivariante discriminante para estudiar conjuntamente las variables descriptoras del patrón de crecimiento del PC y su influencia en la asignación de los pacientes a los grupos con discapacidad y sin discapacidad. El análisis estadístico se hizo con el programa SAS/STAT versión 9.1 (SAS Institute Inc, Cary, EE. UU.).
ResultadosTras revisar 3.269 historiales, encontramos 136 pacientes que cumplían los criterios de inclusión. La ratio de sexo masculino-femenino era 60:76. La edad media en la que se obtuvo el primer PC (medido por el neurólogo pediátrico) fue de 20 meses (mediana: 10 meses). La duración media del seguimiento del PC fue de 56 meses (mediana: 38 meses) y la media del número de medidas de PC registradas fue 5,65 (mediana: 5 medidas). Se incluyó a 16 niños nacidos antes de la semana 34 de gestación porque continuaban siendo microcéfalos a los 18 meses de edad. Los historiales de 112 pacientes incluían estudios de RM.
El 75% de los pacientes (102/136) cubiertos por nuestra muestra tenían discapacidad intelectual, y de ellos, el 48% (49/102) tenía un diagnóstico de parálisis cerebral con niveles entre el iii y el iv del Sistema de Clasificación de la Función Motora Gruesa (GMFCS)30. Por lo tanto, el 25% (34/136) de los pacientes incluidos no tenían discapacidad intelectual, aunque 3 de ellos también estaban afectados de parálisis cerebral de nivel iii según la escala de GMFCS.
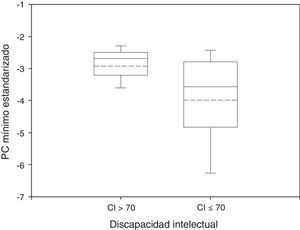
Los grupos con discapacidad y sin discapacidad mostraron distintos patrones de crecimiento del PC. El PC mínimo medio fue –2,93 en pacientes sin discapacidad y –3,99 en pacientes con discapacidad (fig. 1). Estas diferencias alcanzaron significación estadística (p<0,05, prueba de suma de rangos Wilcoxon).
Diagrama de caja del PC mínimo estandarizado por evolución neurológica. La mediana y la media están representadas en la caja por medio de líneas continuas y discontinuas, respectivamente. Grupo sin discapacidad: n=34; media=–2,93; desviación estándar=0,64; mediana=–2,69; RIQ=0,68. Grupo con discapacidad: n=102; media=–3,99; desviación estándar=1,50; mediana=–3,58; RIQ=1,97. Prueba de suma de rangos Wilcoxon: p<0,05.
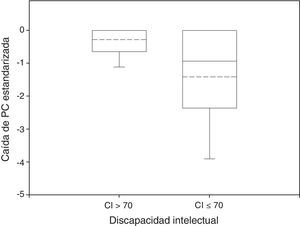
En el 51% de los pacientes la caída de PC fue significativamente distinta de 0. En el grupo sin discapacidad, tan solo el 29% de los pacientes experimentaron caídas de PC, con una media de caída de –0,29, mientras en el grupo con discapacidad el 42% de los pacientes registró una caída significativa de PC, con una caída de PC media de –1,42 (fig. 2). Estas diferencias alcanzaron también significación (p<0,05 en la prueba de suma de rangos Wilcoxon para la caída de PC por grupo de discapacidad intelectual, y en la prueba exacta de Fisher para la proporción de caída de PC distinta de 0 por grupo de discapacidad intelectual).
Diagrama de caja de caída de PC estandarizado por evolución neurológica. La mediana y la media se han representado en las cajas como líneas continuas y de puntos, respectivamente. Grupo sin discapacidad: n=34; media=–0,29; desviación estándar=0,50; mediana=0, RIQ=0,64. Grupo con discapacidad: n=102; media=–1,42; desviación estándar=1,66; mediana=–0,94; RIQ=2,34. Prueba de suma de rangos Wilcoxon: p<0,05.
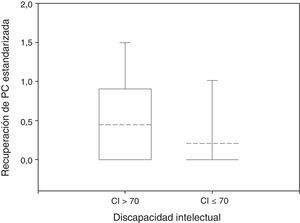
Solo un 23% de los participantes tuvieron una recuperación de PC significativamente distinta de 0, correspondiendo al 38% del grupo sin discapacidad y al 14% del grupo con discapacidad (prueba exacta de Fisher: p<0,05). La media de la recuperación de PC fue 0,45 en el grupo sin discapacidad y 0,21 en el grupo con discapacidad, como se muestra en la figura 3 (prueba de suma de rangos Wilcoxon: p<0,05).
Diagrama de caja de recuperación de PC estandarizado por evolución neurológica. La mediana y la media están representadas en las cajas como líneas continuas y discontinuas, respectivamente. Grupo sin discapacidad: n=34; media=0,45; desviación estándar=0,64; mediana=0; RIQ=0,88. Grupo con discapacidad: n=102; media=0,21; desviación estándar=0,56; mediana=0; RIQ=0. Prueba de suma de rangos Wilcoxon: p<0,05.
El análisis multivariante discriminante, para el que se utilizaron el PC mínimo, la caída de PC y la recuperación de PC como variables predictoras, mostró que el PC mínimo era la variable más informativa. El método de inclusión por pasos en el análisis discriminante incorporó la caída de PC en el segundo paso, pero rechazó la recuperación de PC porque no contribuía a la capacidad discriminante.
Se obtuvo la función lineal discriminante de Fisher31 para la discapacidad intelectual, Z=–0,4 PC mínimo –0,4, caída de PC, e incorporando los valores medios para cada variable predictora en cada grupo (con discapacidad y sin discapacidad) se estableció el punto de corte en 1,73. Al aplicar la función, el 91% (31/34) de los pacientes que, de hecho, no tenían discapacidad obtuvieron puntuaciones por debajo del valor de corte, y el 58% (59/102) de los pacientes con discapacidad registraron puntuaciones superiores. Proponemos la función Z’, con Z’=Z/(–0,4), que se puede expresar como: Z’=PC mínimo + caída de PC. Sustituyendo las variables predictoras por los valores de sus medias en el grupo con discapacidad, obtenemos el punto de corte C=–4,32. Así, cuando la suma del PC mínimo y la caída de PC es inferior a –4,32, el patrón de crecimiento del PC del paciente es indicativo de discapacidad intelectual: microcefalia severa. Cuando la suma del PC mínimo y la caída de PC es superior a –4,32, el patrón de crecimiento del PC se define como microcefalia leve y concuerda con la ausencia de discapacidad intelectual.
Se analizaron las diferencias en concordancia entre la predicción de evolución de la función y el nivel de capacidad intelectual real. La concordancia fue del 66% para toda la muestra, y del 91% (31/34) para el grupo sin discapacidad. El 95% (59/62) de los participantes con microcefalia severa se clasificaron correctamente al aplicar la función. No obstante, solo hubo concordancia entre nuestra función y la evolución real en el 58% (59/102) de los pacientes con discapacidad y en el 42% (31/74) de los pacientes con microcefalia leve (tabla 1).
Evolución sobre la base de la función de crecimiento del PC
| Microcefalia leve | Microcefalia severa | ||
|---|---|---|---|
| Evolución | PC mínimo + Caída de PC ≥ –4,32 | PC mínimo + Caída de PC < –4,32 | Total |
| Sin discapacidad | 31 | 3 | 34 |
| CI ≥ 71 | 22,79 | 2,21 | 25,00 |
| 91,18 | 8,82 | ||
| 41,89 | 4,84 | ||
| Con discapacidad | 43 | 59 | 102 |
| CI < 71 | 31,62 | 43,38 | 75,00 |
| 42,16 | 57,84 | ||
| 58,11 | 95,16 | ||
| Total | 74 | 62 | 136 |
| 54,41 | 45,59 | 100,00 |
En cada celda, empezando por arriba: frecuencia absoluta, porcentaje, porcentaje de fila, porcentaje de columna.
También se analizaron las diferencias en la concordancia para cada uno de los 5 grupos clínico-etiológicos propuestos por Baxter et al.12. Solo había 3 casos en el grupo familiar y se decidió descartarlos. Como se muestra en la tabla 2, las presentaciones con la mayor concordancia fueron la sintomática y la mixta. Se decidió combinarlas en un solo grupo, ya que en todos los pacientes con presentación mixta se había registrado al menos un acontecimiento patogénico que contribuyó a la microcefalia. El resto de los participantes, con presentaciones idiopáticas y sindrómicas, se combinaron en un segundo grupo, teniendo en cuenta que casi todos los pacientes con microcefalias primarias o genéticas pertenecían a una de esas 2 presentaciones.
Predicción de evolución por grupo etiológico
| Grupo | Predicción de la función de PC | Total | |||
|---|---|---|---|---|---|
| CorrectaCI ≥ 71yPC mínimo + Caída de PC ≥ –4,32 | CorrectaCI < 71yPC mínimo + Caída de PC <–4,32 | ErróneaCI ≥ 70yPC mínimo + Caída de PC < –4,32 | ErróneaCI < 71yPC mínimo + Caída de PC ≥ –4,32 | ||
| Idiopático | 6 | 17 | 0 | 15 | 38 |
| 4,51 | 12,78 | 0,00 | 11,28 | 28,57 | |
| 15,79 | 44,74 | 0,00 | 39,47 | ||
| 20,69 | 28,81 | 0,00 | 34,88 | ||
| Sindrómico | 8 | 11 | 2 | 18 | 39 |
| 6,01 | 8,27 | 1,50 | 13,53 | 29,32 | |
| 20,51 | 28,20 | 5,13 | 46,15 | ||
| 27,59 | 18,64 | 100,00 | 41,86 | ||
| Sintomático | 11 | 25 | 0 | 9 | 45 |
| 8,27 | 18,80 | 0,00 | 6,77 | 33,83 | |
| 24,44 | 55,55 | 0,00 | 20,00 | ||
| 37,93 | 42,37 | 0,00 | 20,93 | ||
| Mixto | 4 | 6 | 0 | 1 | 11 |
| 3,01 | 4,51 | 0,00 | 0,75 | 8,27 | |
| 36,36 | 54,54 | 0,00 | 9,09 | ||
| 13,79 | 10,17 | 0,00 | 2,33 | ||
| Total | 29 | 59 | 2 | 43 | 133 |
| 21,80 | 44,36 | 1,50 | 32,33 | 100,00 | |
En cada celda, empezando por arriba: frecuencia absoluta, porcentaje, porcentaje de fila, porcentaje de columna.
Los 2 grupos compuestos resultantes mostraron una diferencia estadísticamente significativa en la concordancia entre la predicción de la función y la evolución, que alcanzó un nivel del 82% (46/56) en el grupo sintomático-mixto, y de solo el 52% (42/77) en el grupo idiopático-sindrómico (p=0,0002; tablas 3 y 4).
Grupo idiopático-sindrómico
| Evolución | Microcefalia leve | Microcefalia severa | Total |
|---|---|---|---|
| Sin discapacidad | 14 | 2 | 16 |
| 18,18 | 2,60 | 20,78 | |
| 87,50 | 12,50 | ||
| 29,79 | 6,67 | ||
| Con discapacidad | 33 | 28 | 61 |
| 42,86 | 36,36 | 79,22 | |
| 54,10 | 45,90 | ||
| 70,21 | 93,33 | ||
| Total | 47 | 30 | 77 |
| 61,04 | 38,96 | 100,00 |
En cada celda, empezando por arriba: frecuencia absoluta, porcentaje, porcentaje de fila, porcentaje de columna.
Grupo sintomático-mixto
| Evolución | Microcefalia leve | Microcefalia severa | Total |
|---|---|---|---|
| Sin discapacidad | 15 | 0 | 15 |
| 26,79 | 0,00 | 26,79 | |
| 100,00 | 0,00 | ||
| 60,00 | 0,00 | ||
| Con discapacidad | 10 | 31 | 41 |
| 17,86 | 55,36 | 73,21 | |
| 24,39 | 75,61 | ||
| 40,00 | 100,00 | ||
| Total | 25 | 31 | 56 |
| 44,64 | 55,36 | 100,00 |
En cada celda, empezando por arriba: frecuencia absoluta, porcentaje, porcentaje de fila, porcentaje de columna.
La medición seriada del PC puede utilizarse para identificar marcadores de la evolución neurológica. Los resultados de nuestro estudio corroboran la importancia de considerar no solo el nivel de microcefalia, reflejado en el PC mínimo, sino también la desaceleración del crecimiento cefálico que representa la caída de PC. Aunque se trata de una estrategia ya utilizada en algunas afecciones susceptibles de causar microcefalia, como la encefalopatía hipóxica isquémica13, hemos ampliado este concepto para incluir casi todas las afecciones en las que la microcefalia es una manifestación clínica relevante. En un informe reciente basado en la revisión sistemática de la evidencia científica, la American Academy of Neurology32 estableció un punto de corte de –3 DE para definir la microcefalia severa y un alto riesgo de trastornos del desarrollo. En este estudio afinamos la definición añadiendo el valor predictivo de la magnitud de la caída de la puntuación Z del PC que a menudo precede al valor mínimo de la puntuación Z alcanzado por el paciente. Así, pudimos clasificar casos de niños con PC entre –2 y –3 DE como microcefalias severas porque experimentaron una caída significativa en los percentiles antes de alcanzar estas medidas, y también pudimos clasificar casos con DE entre –3 y –4,32 como microcefalias leves por la ausencia de dicha caída. Debemos destacar que, con este método, el nivel de concordancia alcanzado por el grupo compuesto de presentaciones sintomáticas y mixtas de nuestra muestra fue del 82%, similar al alcanzado en la revisión de Ashwal et al., un nivel que no se pudo alcanzar en nuestra muestra utilizando exclusivamente el PC mínimo, tal como explicamos en los resultados del análisis multivariante discriminante.
Una característica común de los datos del PC mínimo y de la caída de PC fue que los valores de la media y la mediana en el grupo con discapacidad fueron más bajos (más negativos; figs. 1 y 2). Las medidas estadísticas de dispersión (desviación estándar o rango intercuartílico) fueron mayores en el grupo con discapacidad intelectual que en el grupo sin discapacidad para ambas variables. En lo concerniente a la recuperación de PC (fig. 3), solo la media, y no la mediana, fue mayor en el grupo sin discapacidad, y la distribución de esta variable tuvo una mayor dispersión en el grupo sin discapacidad que en el grupo con discapacidad, reflejada por el RIQ.
En nuestra población hospitalaria, solo el 25% de los pacientes evaluados tenía una inteligencia normal, lo que contrasta con los niños del Proyecto Colaborativo, en el que el CI de los niños con PC inferiores a 2 DE era superior a 70 en el 90% de los casos9. Cabe mencionar que cuando solo se consideraron niños con PC inferiores a 3 DE, la proporción de los pacientes del Collaborative Project con puntuaciones de CI superiores a 70 se redujo al 49%. Este hallazgo está en concordancia con lo observado en nuestro estudio, que apunta a una relación significativa entre el PC mínimo y la discapacidad intelectual. Teniendo en cuenta la mayor proporción tanto de discapacidad intelectual como de microcefalia en nuestra población hospitalaria en comparación con la población general, la aplicación de nuestros resultados a los niños de esta última requeriría el ajuste de estas proporciones según el teorema de Bayes.
La presencia en un 23% de los pacientes de una recuperación del crecimiento tras alcanzar el valor Z de microcefalia más bajo de los registrados estaba asociada de manera significativa a una evolución más favorable. Curiosamente, esta variable no aportó información adicional a la del PC mínimo y de caída de PC para distinguir a los pacientes discapacitados de los normales, ya que el análisis discriminante lo rechazó en el proceso de elaboración de la función de predicción de la discapacidad intelectual. El hecho de que la recuperación de crecimiento tenga lugar tarde en el desarrollo neurológico del niño, cuando ya se ha alcanzado el PC mínimo, también reduce su capacidad para predecir la evolución.
Aunque utilizamos una clasificación clínica para niños con microcefalia adquirida, encontramos sus definiciones de grupos útiles para nuestra muestra global. De hecho, el estudio británico12 que propuso esta clasificación no pudo establecer asociaciones entre los patrones de crecimiento y el CI, algo que nuestro análisis multivariante discriminante sí consiguió. Algunas de las diferencias entre ambos estudios son: el número de participantes (51 pacientes en comparación con 136 en nuestra muestra), el número de estudios de RM disponibles (29 pacientes en comparación con 112 en nuestra muestra) y la medición de la altura de los pacientes y del PC de los padres en el estudio de Baxter et al., que no se requerían en nuestro protocolo clínico.
Proponemos la hipótesis de que el uso de patrones de crecimiento cefálico para predecir deficiencias neurológicas es más fiable en las microcefalias secundarias o sintomáticas que en las microcefalias primarias o idiopáticas. Es posible que la mayor concordancia entre el crecimiento cefálico y la evolución en etiologías como la encefalopatía hipóxica isquémica, la hemorragia, el infarto y la infección se deba al daño parenquimatoso extenso y la muerte celular masiva resultantes, que a su vez llevarían a la pérdida de potencial de desarrollo cerebral y las deficiencias neurológicas asociadas.
Este estudio contribuye a un mayor entendimiento del crecimiento cefálico patológico y apoya la definición de un síndrome de fallo del crecimiento cefálico en el que patrones de crecimiento cefálico definidos por variables que tienen en cuenta cambios de percentil a lo largo del tiempo son mejores herramientas de pronóstico que la microcefalia en sí.
En conclusión, en una muestra de pacientes microcéfalos de un hospital terciario la concordancia entre la función de crecimiento del PC y la evolución neurológica fue mayor en pacientes con microcefalia secundaria que en pacientes con microcefalia idiopática o asociada a síndromes polimalformativos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo se presentó en la primera presentación oral del Parallel Session 12: Fetal and Neonatal Neurology del X Congreso de la Sociedad Europea de Neurología Pediátrica, Bruselas, 25-28 de septiembre del 2013. «Concordance between head circumference growth and neurological impairment among four clinical presentations of microcephaly» Eur J Paediatr Neuro. 2013;17 Suppl 1:S23.