El deterioro cognitivo es una consecuencia común de la epilepsia en niños. El objetivo del estudio fue evaluar el cociente de los niveles de ácidos grasos omega-6 y omega-3 y su impacto en el funcionamiento cognitivo de niños con epilepsia idiopática.
Pacientes y métodosEstudio de casos y controles en 30 niños con epilepsia idiopática y 20 niños sanos. Se midieron los niveles plasmáticos de ácido alfa-linolénico (omega-3) y de ácido linoleico (omega-6) mediante cromatografía de gases. El funcionamiento cognitivo se evaluó mediante la versión en árabe de la cuarta edición de la escala de Stanford-Binet y la onda P300 en potenciales relacionados con eventos. Todos los participantes tenían un cociente intelectual superior a 70.
ResultadosLos niños con epilepsia tenían niveles más bajos de omega-3 y más altos de omega 6 y un cociente omega-6/omega-3 anormal en comparación con los niños sanos. Se observó que el nivel plasmático de omega-3 se correlacionaba positivamente y el nivel de omega-6 negativamente, ambos de manera significativa, con las puntuaciones del funcionamiento cognitivo y la latencia de la onda P300 en niños con epilepsia.
ConclusiónLos niños con epilepsia tienen un cociente alterado de los niveles plasmáticos de ácidos grasos omega-6 y omega-3 que se asocia al deterioro cognitivo en este grupo.
Cognitive impairment is a common consequence of epilepsy in children. This study aimed to assess the ratio of omega-6 to omega-3 fatty acid levels and its impact on cognitive function in children with idiopathic epilepsy.
Patients and methodsWe performed a case-control study in 30 children with idiopathic epilepsy and 20 healthy children. We measured levels of alpha-linolenic acid (omega-3) and linoleic acid (omega-6) by means of gas-liquid chromatography. We assessed cognitive function with the Arabic version of the fourth edition of the Stanford-Binet test and the P300 component of event-related potentials. All children had an intelligent quotient greater than 70.
ResultsChildren with epilepsy had lower levels of omega-3 and higher levels of omega-6 fatty acids and an abnormal omega-6/omega-3 ratio compared to non-epileptic children. We found a significant positive correlation of serum omega-3 levels and a significant negative correlation of serum omega-6 levels with cognitive function scores and P300 latency in children with epilepsy.
ConclusionChildren with epilepsy have abnormal ratios of omega-6 to omega-3 fatty acid serum levels, which is associated with impaired cognitive function in these children.
La epilepsia es un trastorno neurológico heterogéneo caracterizado por una predisposición sostenida a padecer crisis en ausencia de un desencadenante1. El deterioro cognitivo es una consecuencia común de la epilepsia en niños. Se ha descrito que hasta un 40% de niños con epilepsia presentan trastornos cognitivos2. El proceso continuo de la epileptogénesis puede producir daño cerebral irreversible, especialmente en cerebros aún en desarrollo, incluso si la epilepsia está controlada, dando lugar a déficits cognitivos e intelectuales permanentes. Pese a tener un cociente intelectual en el rango normal, el 25% de los niños con epilepsia tienen déficits cognitivos sutiles, en muchos casos infradiagnosticados. Los déficits cognitivos pueden tener un impacto negativo en la evolución social y académica del niño. La identificación temprana de factores de riesgo modificables y una intervención apropiada son necesarias para prevenir el deterioro cognitivo y mejorar la calidad de vida de estos pacientes3.
El efecto de la nutrición en la función neurológica y la salud cerebral es un área de gran interés, especialmente con respecto a los ácidos grasos de la serie omega. El campo de la neurociencia nutricional está creciendo a gran velocidad, y la evidencia emergente sugiere que la suplementación con omega-3 tiene efectos beneficiosos en muchos trastornos neuropsiquiátricos. El ácido linoleico (omega-6) y el ácido alfa-linolénico (omega-3) son ácidos grasos esenciales que deberían obtenerse mediante la dieta. Son precursores de los ácidos araquidónico, eicosapentaenoico y docosahexaenoico, importantes para el desarrollo y la función cerebrales4.
Los ácidos grasos omega-3 son esenciales para mantener la integridad celular neuronal, en la diferenciación celular y en la neurogénesis del cerebro en desarrollo. Se requiere una aportación adecuada de ácidos grasos omega-3 para el buen funcionamiento neurológico, incluyendo la plasticidad cerebral y la transmisión sináptica5. Lo que importa no es solo la disponibilidad de los ácidos grasos, sino su equilibrio adecuado en la dieta. Idealmente, el cociente de ácidos grasos omega-6:omega-3 (cociente n6:n3) no debería exceder 4:1. La mayoría de las dietas modernas contienen cantidades excesivas de ácidos grasos saturados y omega-6, y cantidades insuficientes de ácidos grasos omega-3. Hay una preocupación creciente sobre las posibles repercusiones negativas del aporte inadecuado de omega-3 en la dieta moderna sobre la función cognitiva y la atención6. Estudios experimentales en animales han demostrado que la suplementación equilibrada con ácidos grasos omega-3 y omega-6 puede ser efectiva para mejorar el aprendizaje, incrementar el umbral del dolor y mejorar la calidad del sueño y la termorregulación7. El desequilibrio de estos ácidos grasos en el cerebro se ha asociado a varios trastornos neurológicos y psiquiátricos8. En consecuencia, la dieta equilibrada está emergiendo como una posible estrategia no invasiva y efectiva en el manejo de trastornos neurológicos y cognitivos9. No obstante, los datos sobre la asociación entre el cociente n6:n3 y la función cognitiva en niños con epilepsia son escasos.
En nuestro estudio evaluamos el cociente de los niveles séricos de ácidos grasos omega-6 y omega-3 en niños con epilepsia y su impacto en la función cognitiva.
Pacientes y métodosEstudio unicéntrico en un grupo de 30 niños con epilepsia idiopática y un grupo de 20 controles sanos emparejados por edad y sexo. Se reclutó a los niños con epilepsia a través de la clínica de neuropediatría y a los controles de entre los pacientes que visitaron la clínica de pediatría ambulatoria del Hospital Universitario Alzahraa de la Universidad de Al-Azhar (El Cairo, Egipto) entre diciembre de 2014 y enero de 2016. El estudio fue aprobado por el Comité de Ética de la Universidad de Al-Azhar y se llevó a cabo tras obtener el consentimiento informado de los padres o tutores de los participantes.
Los criterios de inclusión para los casos fueron: diagnóstico confirmado de epilepsia idiopática y edad entre 5 y 15 años. El grupo de control lo conformaron 20 niños emparejados con el grupo de epilepsia por edad, sexo, nivel educativo de los padres y los pacientes, dieta y nivel socioeconómico. Todos los participantes tenían cocientes intelectuales superiores a 70, evaluados por medio de la escala de Stanford-Binet.
Se excluyeron niños con trastornos psiquiátricos, físicos o del desarrollo, discapacidad intelectual, enfermedad crónica de base (como errores congénitos del metabolismo, trastornos genéticos, endocrinos o hepáticos o déficits visuales o auditivos) o trastornos neurológicos que no fueran epilepsia. También fueron excluidos niños con obesidad o tratados con fármacos o fórmulas magistrales que pudieran afectar sus niveles de ácidos grasos.
Se recogió una historia clínica detallada de todos los participantes, incluyendo la edad al inicio de los síntomas, la frecuencia de las crisis, la medicación antiepiléptica, el rendimiento escolar, el control de las crisis en el último año, el nivel socioeconómico, la historia nutricional, de desarrollo y perinatal, y el nivel educativo de pacientes y padres. El diagnóstico de epilepsia se basó en la historia reportada por testigos fiables y se confirmó mediante electroencefalografía (EEG). Se categorizó a los pacientes de acuerdo con la clasificación de epilepsia y síndromes epilépticos de la Liga Internacional contra la Epilepsia10.
Los pacientes recibieron evaluaciones sistémicas y neurológicas exhaustivas. Se realizaron evaluaciones psiquiátricas y de audición para descartar trastornos psiquiátricos y déficits auditivos. El cociente intelectual se midió mediante la versión en árabe de la cuarta edición de la escala de inteligencia de Stanford-Binet11. Se realizaron estudios de neuroimagen en los niños con epilepsia para excluir la presencia de lesiones estructurales en el cerebro.
La función cognitiva se evaluó mediante la versión en árabe de la cuarta edición de la escala de inteligencia de Stanford-Binet, un instrumento estandarizado y validado que evalúa 4 habilidades cognitivas principales (razonamiento verbal, razonamiento visual/abstracto, memoria a corto plazo y razonamiento cuantitativo) mediante varias subescalas, además de medir el cociente intelectual. El número de subpruebas administradas depende de la edad y la capacidad de cada niño. En el estudio que nos ocupa se administraron las mismas subpruebas que conforman el núcleo de la prueba a todos los participantes. Se empleó un formato corto de la prueba, consistente en 6 subpruebas que evalúan 4 aspectos de la cognición, calculándose también la puntuación total.
Se investigó la onda P300 en potenciales relacionados con eventos (PREs) en todos los niños participantes en la unidad de neuropediatría del Hospital Universitario Alzahraa para evaluar el procesamiento cognitivo y la atención en respuesta a estímulos auditivos. Se explicó la tarea a realizar a los niños, garantizando su comprensión y el desempeño correcto de la tarea. Para asegurar que los niños se mantuviesen atentos, se les pidió que contaran el número de estímulos infrecuentes, que se comparó con el número registrado por el sistema. La onda P300 es el pico positivo más alto tras las ondas N1, P2 y N2, y su latencia oscila entre 225 y 396ms. La latencia representa la capacidad de discernir un estímulo infrecuente entre varios estímulos estándar. La amplitud de la onda P300 oscila entre 5 y 40μV. La amplitud es la distancia entre el valor más positivo y el valor más negativo de la onda, y varía en función de la improbabilidad del estímulo12.
Nivel sérico de ácidos grasos omegaMediante técnica aséptica, se obtuvieron muestras de 5ml de sangre venosa de cada paciente tras un ayuno nocturno de 12h. Las muestras se centrifugaron nada más recogerse y el suero resultante se almacenó a –80°C. Los niveles séricos de los principales ácidos grasos omega (ácido alfa-linolénico [18:3 omega-3], ácido linoleico [18:2 omega-6]) se midieron mediante cromatografía líquida de alta resolución (HPLC, por sus siglas en inglés).
Cada fracción estándar de ácidos grasos se disolvió en acetonitrilo y se sometió a diluciones seriadas, de las que se inyectaron 20μl en el sistema de HPLC. Se generó la curva estándar para cada fracción. Para cada muestra de los participantes, se homogeneizó el plasma en una mezcla de ácido acético y éter etílico al 2% (2:1 v/v). La solución resultante se filtró y centrifugó a 500×g, y se evaporó el solvente de la fase orgánica bajo flujo de nitrógeno gaseoso. A continuación, el residuo seco se disolvió en 500μl de acetonitrilo para su inyección posterior en el sistema de HPLC13.
El análisis se realizó en un equipo de HPLC Agilent de la serie 1100. Los ácidos grasos se separaron en una columna de cromatografía Phenomenex de acero inoxidable con una superficie de sílice 300-390mesh (con partículas esféricas de 10μm). El proceso se llevó a cabo de acuerdo con una versión modificada del método descrito por Aveldano et al.14, con una columna C18 (250×4,6, tamaño de partícula 5μl), una fase móvil consistente en una mezcla de acetonitrilo y agua al 70/30 v/v con elución isocrática, un flujo de 1ml/min y un detector ultravioleta a una longitud de onda de 200nm. Se inyectó una alícuota de 20μl de cada fracción en el sistema.
Análisis estadísticoEl análisis estadístico se realizó con el software Statistical Package for Social Sciences, versión 21 (Chicago, EE.UU.). Hemos descrito los datos cualitativos mediante frecuencias absolutas y porcentajes, y los datos cuantitativos a través de la media y la desviación estándar. Las diferencias entre grupos se analizaron por medio de la prueba t para muestras independientes. Se estudió la correlación entre puntuaciones cognitivas, niveles séricos de ácidos grasos omega y medidas de la onda P300 mediante el coeficiente de correlación de Pearson. Se estableció p<0,05 como nivel de significación estadística.
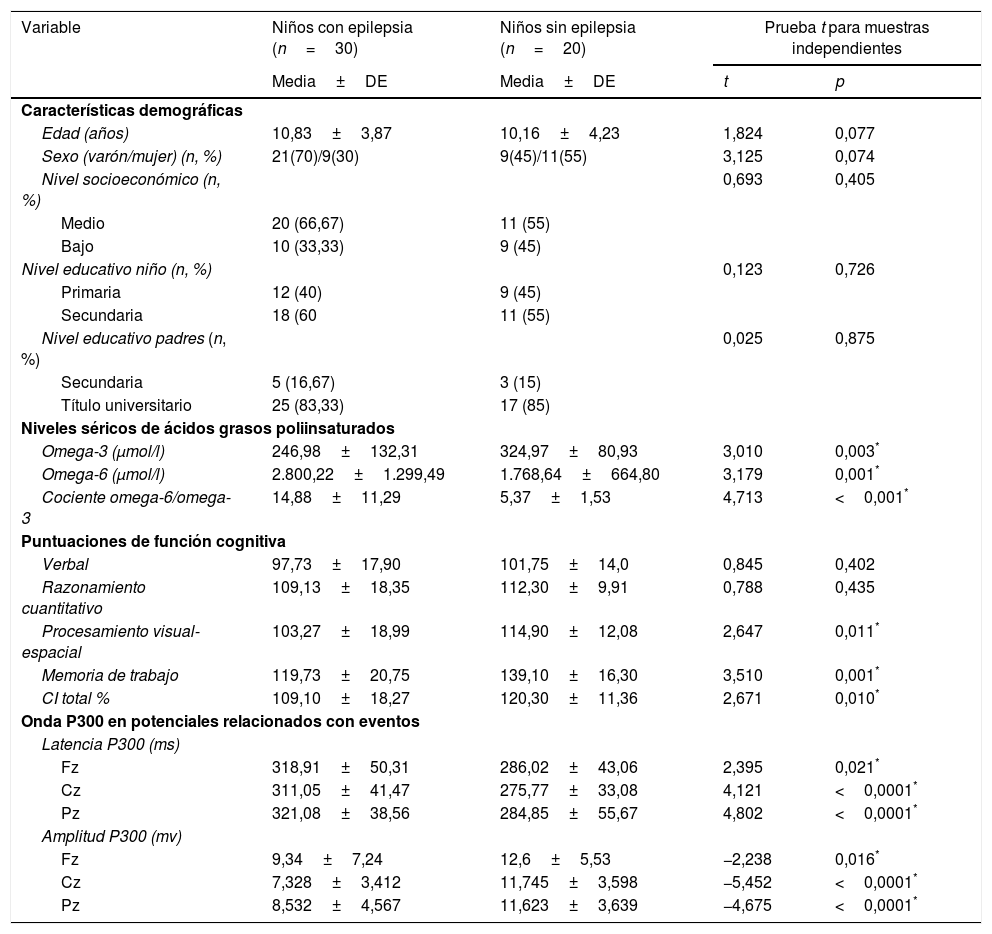
ResultadosEl estudio incluyó 30 niños con epilepsia (21 varones, 9 mujeres) de 5 a 15 años de edad. La edad de inicio de la epilepsia osciló entre 1 y 10 años (3,54±1,85 años), y el tiempo de evolución de la enfermedad, entre 6 meses y 11 años (6,78±2,81 años). En cuanto a la presentación clínica y los hallazgos encefalográficos, 17 pacientes (56,7%) tenían crisis generalizadas, 2 (6,7%) crisis focales, y 3 (10%) crisis focales secundariamente generalizadas, mientras que los hallazgos encefalográficos fueron normales en 8 pacientes (26,7%). El tratamiento farmacológico consistió en monoterapia con un solo fármaco antiepiléptico (carbamazepina, ácido valproico o levetiracetam) en 20 pacientes (66,7%) y politerapia con varios en 6 (20%), consiguiéndose controlar las crisis en 23 pacientes (76,7%), mientras que las crisis siguieron sin controlarse en el resto de los pacientes, a pesar de haber recibido dosis óptimas de fármacos en politerapia (confirmada por niveles séricos de los fármacos) durante un mínimo de 6 meses. El grupo control incluyó a 9 niños y 11 niñas. Los grupos de casos y de controles fueron homogéneos en cuanto a la edad y el sexo. Los controles se emparejaron con respecto a otras variables de confusión susceptibles de afectar al cociente intelectual, tales como el nivel educativo de los padres, el nivel socioeconómico, la dieta y el nivel educativo del niño (tabla 1). Todos los participantes del estudio seguían dietas similares de alimentos tradicionales comunes.
Comparación de características demográficas, niveles séricos de ácidos grasos omega y onda P300 de potenciales relacionados con eventos de niños con epilepsia y controles sanos
| Variable | Niños con epilepsia (n=30) | Niños sin epilepsia (n=20) | Prueba t para muestras independientes | |
|---|---|---|---|---|
| Media±DE | Media±DE | t | p | |
| Características demográficas | ||||
| Edad (años) | 10,83±3,87 | 10,16±4,23 | 1,824 | 0,077 |
| Sexo (varón/mujer) (n, %) | 21(70)/9(30) | 9(45)/11(55) | 3,125 | 0,074 |
| Nivel socioeconómico (n, %) | 0,693 | 0,405 | ||
| Medio | 20 (66,67) | 11 (55) | ||
| Bajo | 10 (33,33) | 9 (45) | ||
| Nivel educativo niño (n, %) | 0,123 | 0,726 | ||
| Primaria | 12 (40) | 9 (45) | ||
| Secundaria | 18 (60 | 11 (55) | ||
| Nivel educativo padres (n, %) | 0,025 | 0,875 | ||
| Secundaria | 5 (16,67) | 3 (15) | ||
| Título universitario | 25 (83,33) | 17 (85) | ||
| Niveles séricos de ácidos grasos poliinsaturados | ||||
| Omega-3 (μmol/l) | 246,98±132,31 | 324,97±80,93 | 3,010 | 0,003* |
| Omega-6 (μmol/l) | 2.800,22±1.299,49 | 1.768,64±664,80 | 3,179 | 0,001* |
| Cociente omega-6/omega-3 | 14,88±11,29 | 5,37±1,53 | 4,713 | <0,001* |
| Puntuaciones de función cognitiva | ||||
| Verbal | 97,73±17,90 | 101,75±14,0 | 0,845 | 0,402 |
| Razonamiento cuantitativo | 109,13±18,35 | 112,30±9,91 | 0,788 | 0,435 |
| Procesamiento visual-espacial | 103,27±18,99 | 114,90±12,08 | 2,647 | 0,011* |
| Memoria de trabajo | 119,73±20,75 | 139,10±16,30 | 3,510 | 0,001* |
| CI total % | 109,10±18,27 | 120,30±11,36 | 2,671 | 0,010* |
| Onda P300 en potenciales relacionados con eventos | ||||
| Latencia P300 (ms) | ||||
| Fz | 318,91±50,31 | 286,02±43,06 | 2,395 | 0,021* |
| Cz | 311,05±41,47 | 275,77±33,08 | 4,121 | <0,0001* |
| Pz | 321,08±38,56 | 284,85±55,67 | 4,802 | <0,0001* |
| Amplitud P300 (mv) | ||||
| Fz | 9,34±7,24 | 12,6±5,53 | −2,238 | 0,016* |
| Cz | 7,328±3,412 | 11,745±3,598 | −5,452 | <0,0001* |
| Pz | 8,532±4,567 | 11,623±3,639 | −4,675 | <0,0001* |
CI: cociente intelectual; DE: desviación estándar.
La comparación de los datos demográficos, los niveles séricos de ácidos grasos omegas, las puntuaciones cognitivas y las medidas de la onda P300 en PREs en niños con epilepsia y en controles sanos revelaron que los niños con epilepsia tenían niveles significativamente menores de omega-3 y significativamente mayores de omega-6, déficits en el procesamiento visual y la memoria de trabajo y cocientes intelectuales significativamente menores, una latencia de la P300 significativamente mayor y una amplitud de la P300 significativamente menor en comparación con los controles (tabla 1).
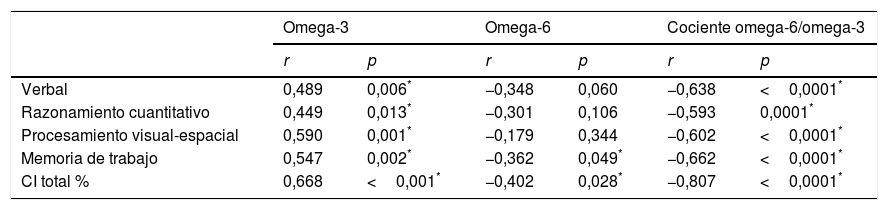
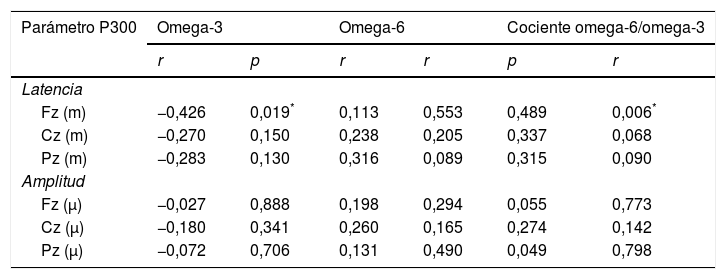
Se observó que la latencia de la P300 en el córtex frontal y las puntuaciones en la escala Stanford-Binet estaban correlacionadas de manera significativa y negativa con los niveles séricos de omega-3 y de manera significativa y positiva con los niveles séricos de omega-6 (tablas 2 y 3).
Correlación entre los niveles de omega-3, niveles de omega-6 y cociente omega-6/omega-3 y puntuaciones de función cognitiva en niños con epilepsia (n=30)
| Omega-3 | Omega-6 | Cociente omega-6/omega-3 | ||||
|---|---|---|---|---|---|---|
| r | p | r | p | r | p | |
| Verbal | 0,489 | 0,006* | −0,348 | 0,060 | −0,638 | <0,0001* |
| Razonamiento cuantitativo | 0,449 | 0,013* | −0,301 | 0,106 | −0,593 | 0,0001* |
| Procesamiento visual-espacial | 0,590 | 0,001* | −0,179 | 0,344 | −0,602 | <0,0001* |
| Memoria de trabajo | 0,547 | 0,002* | −0,362 | 0,049* | −0,662 | <0,0001* |
| CI total % | 0,668 | <0,001* | −0,402 | 0,028* | −0,807 | <0,0001* |
CI: cociente intelectual.
Correlación entre los niveles de omega-3, niveles de omega-6 y cociente omega-6/omega-3 y parámetros de la onda P300 en niños con epilepsia (n=30)
| Parámetro P300 | Omega-3 | Omega-6 | Cociente omega-6/omega-3 | |||
|---|---|---|---|---|---|---|
| r | p | r | r | p | r | |
| Latencia | ||||||
| Fz (m) | −0,426 | 0,019* | 0,113 | 0,553 | 0,489 | 0,006* |
| Cz (m) | −0,270 | 0,150 | 0,238 | 0,205 | 0,337 | 0,068 |
| Pz (m) | −0,283 | 0,130 | 0,316 | 0,089 | 0,315 | 0,090 |
| Amplitud | ||||||
| Fz (μ) | −0,027 | 0,888 | 0,198 | 0,294 | 0,055 | 0,773 |
| Cz (μ) | −0,180 | 0,341 | 0,260 | 0,165 | 0,274 | 0,142 |
| Pz (μ) | −0,072 | 0,706 | 0,131 | 0,490 | 0,049 | 0,798 |
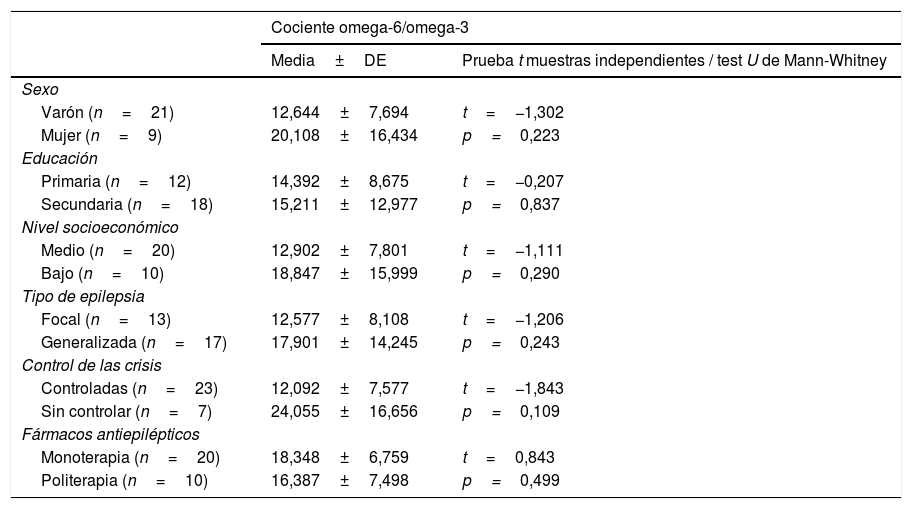
No se detectó una asociación significativa entre el cociente n6:n3 y el sexo, el nivel educativo de los padres, el nivel socioeconómico, el tipo de epilepsia, el nivel de control de las crisis o el tratamiento farmacológico empleado (tabla 4).
Asociación entre el cociente omega-6/omega-3 y distintas variables clínicas y demográficas
| Cociente omega-6/omega-3 | ||
|---|---|---|
| Media±DE | Prueba t muestras independientes / test U de Mann-Whitney | |
| Sexo | ||
| Varón (n=21) | 12,644±7,694 | t=−1,302 |
| Mujer (n=9) | 20,108±16,434 | p=0,223 |
| Educación | ||
| Primaria (n=12) | 14,392±8,675 | t=−0,207 |
| Secundaria (n=18) | 15,211±12,977 | p=0,837 |
| Nivel socioeconómico | ||
| Medio (n=20) | 12,902±7,801 | t=−1,111 |
| Bajo (n=10) | 18,847±15,999 | p=0,290 |
| Tipo de epilepsia | ||
| Focal (n=13) | 12,577±8,108 | t=−1,206 |
| Generalizada (n=17) | 17,901±14,245 | p=0,243 |
| Control de las crisis | ||
| Controladas (n=23) | 12,092±7,577 | t=−1,843 |
| Sin controlar (n=7) | 24,055±16,656 | p=0,109 |
| Fármacos antiepilépticos | ||
| Monoterapia (n=20) | 18,348±6,759 | t=0,843 |
| Politerapia (n=10) | 16,387±7,498 | p=0,499 |
DE: desviación estándar.
La epilepsia es un trastorno crónico con un impacto significativo en la función cognitiva15; no obstante, la relación entre la epilepsia y el deterioro cognitivo es compleja. El estudio que nos ocupa solo incluyó a niños con epilepsia idiopática. Se excluyó a niños con trastornos neurológicos, psicológicos o de desarrollo de base y a aquellos que estuvieran recibiendo medicación a largo plazo aparte de fármacos antiepilépticos, ya que se pretendía aislar los efectos de la epilepsia en ausencia de posibles factores de confusión que también pudiesen causar deterioro cognitivo en este grupo pediátrico.
En nuestro estudio se observó que los niños epilépticos tenían puntuaciones más bajas en el procesamiento visual, la memoria de trabajo y el cociente intelectual total en comparación con los controles sanos. Esto concuerda con el estudio de Dahab et al.16, quienes encontraron puntuaciones significativamente menores en habilidades cognitivas en niños con epilepsia en comparación con niños sin epilepsia. Sarhan et al.17 concluyeron que la epilepsia infantil se asocia a déficits cognitivos y deterioro intelectual, que son comorbilidades multifactoriales. Los niños con epilepsia exhibieron retrasos significativos en su desarrollo cognitivo, social y de la comunicación, puntuaciones inferiores en el cociente intelectual y una probabilidad mayor de presentar trastornos de atención. Barr18 observó que más de la mitad de los pacientes con epilepsia reportaron una percepción subjetiva de problemas cognitivos y de memoria, mientras que las pruebas objetivas detectaron deterioro en una proporción similar.
Nuestro estudio también detectó latencias significativamente más prolongadas y amplitudes más bajas en la onda P300 de los PREs en niños con epilepsia, lo que es indicativo de deterioro en el procesamiento auditivo basado en la atención. Esto fue consistente con los hallazgos de Casali et al.19, que reportaron latencias prolongadas y amplitudes reducidas en niños con epilepsia. Takhirovna y Gafurovich20 observaron aumentos significativos en las latencias de las ondas N200 y P300 y en el intervalo P300-N200, lo que sugiere la presencia de trastornos cognitivos en la epilepsia.
El componente P300 de los PREs puede utilizarse en pruebas psicométricas para evaluar el aprendizaje y la recuperación de información, especialmente en instituciones educativas para predecir el desempeño académico21. El componente P300 proporciona información sobre el sustrato neurofisiológico de procesos cognitivos como la memoria, la atención, la discriminación auditiva, el procesamiento secuencial y la toma de decisiones. Esta onda no depende de las características físicas del estímulo sensorial, sino de la tarea cognitiva que se está llevando a cabo22. La latencia de la onda P300 está directamente correlacionada con la velocidad de procesamiento de la información. Por otro lado, la amplitud de la onda P300 indica la cantidad de recursos dedicados a desempeñar un proceso neurocognitivo específico, ya que refleja el número de fibras activadas en la tarea. Una amplitud reducida o una latencia prolongada de la onda P300 son indicativas de déficits en el procesamiento cognitivo de los estímulos sensoriales12.
El deterioro cognitivo en niños con epilepsia puede derivar de la misma epileptogénesis o de efectos secundarios de los fármacos antiepilépticos23. En nuestro estudio, emparejamos los controles a los casos con base en factores de confusión que podrían afectar a la cognición, tales como el nivel educativo de los padres, el nivel socioeconómico, la dieta y el nivel educativo del niño.
Los datos disponibles de estudios previos realizados en animales24 y seres humanos25 sugieren que la deficiencia de ácidos grasos omega-3 podría ser un mecanismo de deterioro cognitivo. Estudios en animales han demostrado que los ácidos grasos omega-3 podrían estar involucrados en el desarrollo cognitivo y que su deficiencia repercute de forma negativa en la capacidad de responder a estímulos ambientales, objetivándose un desempeño pobre en tareas de aprendizaje y memoria en varias pruebas realizadas en ratas con deficiencia de omega-326. Esto se ve apoyado por los hallazgos en estudios en humanos, en los que se han observado mejoras en la función cognitiva con la suplementación con omega-327. La ingesta adecuada de ácidos grasos poliinsaturados se ha asociado a mejoras posteriores en varios aspectos, tales como la resolución de problemas y la actividad funcional de las redes corticales de la atención en escolares28. En otro estudio realizado en niños de 7 a 9 años de edad tratados con una dieta enriquecida en ácidos grasos omega-3 durante 6 meses se observaron mejoras significativas en las puntuaciones de aprendizaje verbal, ortografía y lectura29.
No obstante, las alteraciones en el cociente n6:n3 pueden tener un efecto más pronunciado sobre el sistema nervioso que los niveles de omega-3 u omega-6 por separado7. En nuestro estudio detectamos cocientes n6:n3 significativamente alterados en niños con epilepsia que no estaban asociados a las manifestaciones de la enfermedad. Además, todos los niños que participaron en el estudio llevaban dietas similares. El cociente n6:n3 alterado en niños con epilepsia puede deberse a una suplementación inadecuada o a una utilización mayor de ácidos grasos omega-3 para combatir el estrés oxidativo y reducir la inflamación neuronal. La dieta moderna está muy desequilibrada, con un promedio estimado del cociente n6:n3 de 20:1. Los datos disponibles en la actualidad sugieren que hay una asociación entre los desequilibrios en el cociente n6:n3 en el tejido cerebral y varios trastornos neuropsiquiátricos30. No hay datos que sugieran que el uso de fármacos antiepilépticos afecte al metabolismo o la utilización de los ácidos grasos omega-3 u omega-6. En cambio, varios estudios han destacado el efecto beneficioso de la suplementación con omega-3 y omega-6 a dosis apropiadas, mejorando el control de las crisis en casos de epilepsia resistente a fármacos31.
Nuestro estudio encontró una correlación positiva significativa entre los niveles de omega-3 y las puntuaciones de función cognitiva, y una correlación negativa positiva entre las puntuaciones de cognición y tanto los niveles de omega-6 como el cociente n6:n3. Jumpsen et al.32 observaron que incluso cambios pequeños en el cociente n6:n3 en la dieta podían tener un impacto considerable en el desarrollo neuronal y de las células gliales. Su estudio mostró que el cociente óptimo para el desarrollo del córtex frontal, hipocampo, cerebelo y número de células gliales es de 4:1. A su vez, Yehuda33 observó que la mezcla de ácidos linoleico (omega-6) y alfa-linolénico (omega-3) en una proporción de 4:1 era la más efectiva para mejorar el aprendizaje.
Encontramos una correlación significativa negativa entre los niveles de omega-3 y la latencia P300, y positiva entre el cociente n6:n3 y la latencia P300. Hemos de puntualizar que esta correlación solo fue significativa para la región frontal del córtex. El lóbulo frontal es responsable de las funciones ejecutivas y las habilidades cognitivas de orden superior, incluyendo la atención sostenida, la planificación y la resolución de problemas. Por lo tanto, es crucial mantener niveles y cocientes óptimos de ácidos grasos en esta región del cerebro34.
Konagai et al.35 compararon medidas de PREs antes y después de un protocolo de suplementación con aceite de pescado durante 35 días, y describieron mejoras en las funciones de atención tras la ingesta de ácidos grasos omega-3, especialmente en aquellas que requieren un procesamiento cortical complejo. Estos resultados reflejan el impacto de los ácidos grasos omega-3 en la actividad del sistema nervioso central mediante la mejora del tiempo de respuesta, la atención y el desempeño cognitivo, así como mejoras en el estado de ánimo y cambios en ciertos parámetros neuroeléctricos36.
Nuestro estudio presenta varias limitaciones a considerar en la interpretación de sus hallazgos, como por ejemplo su reducido tamaño muestral, que limita la validez de los resultados. Otra limitación es que no pudimos comparar la función cognitiva en participantes con un cociente n6:n3 óptimo con la de participantes con un cociente desequilibrado, ya que todos los niños con epilepsia de la muestra tenían cocientes mayores que 4:1. Por lo tanto, se requieren estudios longitudinales adicionales para evaluar el impacto de intervenciones nutricionales dirigidas a mantener un cociente n6:n3 equilibrado en la función cognitiva de niños con epilepsia. Entre las fortalezas del estudio se encuentra el haber evaluado la función cognitiva mediante dos pruebas psicológicas diferentes para reducir el riesgo de sesgos resultantes de diferencias entre observadores.
ConclusiónCon base en nuestros hallazgos, cabe concluir que los niños con epilepsia tienen cocientes n3:n6 alterados, lo que se asocia a déficits cognitivos. La detección temprana del deterioro cognitivo seguida de un manejo adecuado son necesarios para mejorar la calidad de vida y prevenir el desarrollo de trastornos de aprendizaje y problemas sociales en estos niños. Se requieren estudios adicionales para evaluar el efecto de la suplementación con ácidos grasos omega-3 en el funcionamiento cognitivo de niños con epilepsia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.