En el postoperatorio de la cirugía cardíaca se produce una respuesta inflamatoria sistémica que dificulta la identificación de complicaciones. El objetivo fue estudiar el comportamiento de la proteína C reactiva (PCR) y la procalcitonina (PCT), valorando su relación con la gravedad y analizando su utilidad para detectar complicaciones.
MétodosSe estudió prospectivamente a 59 niños intervenidos mediante cirugía cardíaca abierta. Se determinaron la PCR y la PCT al ingreso en una unidad de cuidados intensivos pediátricos, a las 24, a las 48 y a las 72h. Se analizó la relación de la PCR y la PCT con la gravedad clínica valorada mediante las escalas Pediatric Risk Mortality y Therapeutic Intervention Scoring System, y el desarrollo de complicaciones (infecciosas y hemodinámicas).
ResultadosLa PCR y la PCT aumentaron en las primeras 24h, disminuyendo progresivamente en los 2 días posteriores. La PCR no se relacionó con la gravedad ni con la aparición de complicaciones. La PCT tras la cirugía, a las 24 y a las 48h presentó una moderada correlación con el Pediatric Risk Mortality (r=0,548; 0,434 y 0,446, respectivamente) y una baja con el Therapeutic Intervention Scoring System. Se obtuvieron unos puntos de corte para la PCT>0,17ng/ml (sensibilidad del 73,3%, especificidad del 72,2%) al ingreso y >1,98ng/ml (sensibilidad del 57,1%, especificidad del 87%) a las 48h para detectar complicaciones. No existieron diferencias en la PCR ni en la PCT entre los pacientes con complicaciones infecciosas y hemodinámicas.
ConclusionesEn el postoperatorio de la cirugía cardíaca pediátrica la PCR no se correlaciona con la gravedad ni con la presencia de complicaciones. La PCT se correlaciona con la gravedad y puede detectar complicaciones posquirúrgicas.
The systemic inflammatory response syndrome developed after cardiac surgery impedes the detection of complications. The aim of our study was to examine the behaviour of C-reactive protein (CRP) and procalcitonin (PCT), as well as to evaluate its relationship with severity and to analyse its usefulness in the identification of complications.
MethodsA total of 59 children who underwent cardiac surgery with cardiopulmonary bypass were prospectively studied. CRP and PCT were determined after surgery and at 24, 48 and 72 hours. The relationships between both parameters and the clinical severity were analysed (evaluated with PRISM and TISS scoring systems), as well as with the incidence of complications (infectious and haemodynamics).
ResultsSerum concentrations of CRP and PCT increased in the first 24 hours after surgery, with a gradual decrease over the following days. There was no association between CRP and severity or development of complications. A moderate correlation was observed between PCT after surgery, at 24 and 48 hours, and PRISM (r=0.548; 0.434 and 0.446) and a low correlation between PCT and TISS. When studying the identification of complications, we obtained cut-off values of PCT>0.17ng/ml (Ss 73.3%; Sp 72.2%) and PCT>1.98ng/ml (Ss 57.1%; Sp 87%) immediately and 48 hours after surgery. No differences were found in CPR and PCT levels among patients with infectious and haemodynamics complications.
ConclusionsCPR does not correlate with the severity or the incidence of complications after paediatric cardiac surgery. PCT correlates with clinical severity and may be able to detect post-surgical complications.
Una agresión grave desencadena en el organismo humano la activación de una cascada inflamatoria, dando lugar al denominado síndrome de respuesta inflamatoria sistémica (SRIS)1. El SRIS de causa infecciosa, denominado sepsis, es el más conocido, aunque el inducido por otros desencadenantes no infecciosos provoca una parecida respuesta inflamatoria, alterando de forma similar los parámetros clinicoanalíticos empleados para el diagnóstico de infección2,3. Por ello, en ciertas situaciones clínicas como traumatismos graves, grandes quemaduras o postoperatorios, la detección de complicaciones infecciosas es muy difícil. El retraso en el diagnóstico y el inicio del tratamiento puede implicar la evolución progresiva de SRIS a fallo multiorgánico (FMO) e, incluso, a fallecimiento4.
Por este motivo se están estudiando diversos marcadores analíticos que puedan servir para diferenciar la respuesta inflamatoria sistémica de origen infeccioso del resto de las causas.
En la práctica clínica, los más utilizados son el recuento leucocitario y la proteína C reactiva (PCR). No obstante, es muy frecuente observar aumentos significativos de ambos marcadores, tanto en el SRIS de origen infeccioso como no infeccioso. Además, la PCR se empieza a elevar a las 4–6h tras el estímulo y alcanza valores máximos tras las 36–50h, lo que en ocasiones retrasa el inicio del tratamiento antimicrobiano3.
La procalcitonina (PCT) es la prohormona de la calcitonina. Numerosos estudios han demostrado la utilidad de la PCT para el diagnóstico, el pronóstico y la monitorización terapéutica en la sepsis en niños5–7, y se considera que la PCT es un parámetro analítico más útil que la PCR para detectar de forma precoz infecciones bacterianas6,7.
En el postoperatorio se pueden observar cifras de PCT de hasta 1ng/ml en la cirugía menor y la neurocirugía, 2ng/ml en la cirugía torácica e, incluso, 10ng/ml en la cirugía mayor abdominal8,9. En general, el valor máximo se alcanza a las 24h, permaneciendo estable unas 24–48h y disminuyendo después de forma progresiva. Hiperprocalcitonemias por encima de lo mencionado o persistentes sugieren firmemente la presencia de complicaciones infecciosas8.
Varios trabajos han estudiado la cinética de la PCT en el postoperatorio de la cirugía cardíaca en adultos10–26 y niños27–34, aunque los resultados de estos estudios no han sido concordantes. Algunos no han encontrado cambios en la PCT12,31; otros, ligeros aumentos menores de 2ng/ml14,16,17,23,24,28,30,32,34, mientras que otros describen valores de 3,5–5ng/ml13,22. Se han referido aumentos de la PCT tanto secundarios a infecciones como a complicaciones hemodinámicas15,17,18,20. Finalmente, algunos autores han encontrado asociación entre valores elevados de PCT con mayor incidencia de FMO y mortalidad más alta15,20,33.
El objetivo de este trabajo fue estudiar la cinética de la PCR y la PCT en los primeros días del postoperatorio de la cirugía cardíaca abierta en niños y valorar su relación con la gravedad clínica del paciente y la aparición de complicaciones infecciosas y hemodinámicas.
Pacientes y métodosSe realizó un estudio prospectivo observacional en una unidad de cuidados intensivos pediátricos (UCIP) de un hospital de tercer nivel, que es centro de referencia de cirugía cardíaca infantil, entre junio de 2004 y abril de 2005.
Se incluyó en el estudio, tras obtener el consentimiento informado de los padres, a 59 niños que fueron intervenidos de forma consecutiva de cirugía cardíaca abierta con circulación extracorpórea (CEC), hipotermia y ultrafiltración modificada. Se registraron las siguientes variables: edad al ingreso, diagnóstico, técnica quirúrgica empleada, puntuación de riesgo de mortalidad mediante la escala Pediatric Risk Mortality (PRISM, Índice Pediátrico de Riesgo de Mortalidad) —considerando el peor valor durante las primeras 24h de la estancia del paciente en la unidad—, nivel de asistencia recibido (mediante la escala Therapeutic Intervention Scoring System [TISS], realizando evaluación diaria) y aparición de complicaciones infecciosas (según los criterios de Goldstein et al2) y hemodinámicas (definidas como la presencia de alteración hemodinámica importante con hipotensión que precise tratamiento con dosis altas de fármacos vasoactivos —dopamina>10μg/kg/min y/o perfusión de adrenalina— u Oxigenacíon mediante membrana extracorpórea (ECMO); arritmia que precise para su tratamiento cardioversión, hipotermia o marcapasos; derrame pericárdico con repercusión hemodinámica que precise pericardiocentesis).
Los pacientes se dividieron en 5 grupos según la técnica quirúrgica empleada:
- •
Grupo 1: cierre de cortocircuitos intracardíacos como comunicación interauricular o interventricular, y extracardíacos como ductus arterioso persistente.
- •
Grupo 2: reparación de estenosis (a nivel valvular, perivalvular y arterial) o insuficiencia valvular.
- •
Grupo 3: conductos extracardíacos; se incluyó en este grupo a aquellos niños intervenidos en el segundo estadio (cirugía tipo Glenn: anastomosis cavopulmonar) o en el tercer estadio (cirugía tipo Fontan: anastomosis cavocava) de la corrección univentricular.
- •
Grupo 4: técnicas mixtas; fueron incluidos los niños que precisaron durante el mismo tiempo quirúrgico al menos 2 de los procedimientos considerados en los 3 grupos anteriores.
- •
Grupo 5: cirugías complejas; pacientes en cuyas correcciones quirúrgicas se emplearon técnicas que no cumplían los requisitos para ser incluidos en los 4 grupos previos.
Se realizaron las determinaciones analíticas de PCR y PCT. Se consideraron el momento de ingreso del niño en la UCIP como el tiempo 0, y los tiempos 1, 2 y 3 las 8h del primer, segundo y tercer día de estancia en la UCIP.
La PCR se determinó mediante turbidimetría (Turbitimer®, Dade Behring Marburg GmbH, Marburg). La PCT se determinó mediante un analizador KRYPTOR® (Brahms Diagnostika, Berlín, Alemania) que utiliza la tecnología time resolved amplified cryptate emission. Los límites de detección fueron de 0,02ng/ml y de 0,5mg/dl para la PCT y la PCR, respectivamente.
Para el análisis estadístico se utilizaron los programas informáticos SPSS 12.0 (SPSS Inc., 2003, EE.UU.) y Medcalc® 3.0 (MedCalc Software, 2003, Bélgica). Ni los valores de PCT y PCR ni sus logaritmos se ajustaron a la distribución normal (prueba de Shapiro-Wilk), por lo que se emplearon pruebas no paramétricas. Para la comparación entre grupos se utilizaron la prueba U de Mann-Whitney y la prueba de Kruskal-Wallis. La correlación entre variables cuantitativas se evaluó con la rho de Spearman. Se aplicaron las curvas Características Operativas del Receptor (COR) de diagnóstico para la detección de complicaciones, estudiando los puntos de corte más favorables. Los datos se expresan como mediana y rango intercuartílico. El nivel de significación estadística se estableció en p<0,05.
ResultadosDescripción de la muestraLos 59 niños incluidos en el estudio tenían una edad (mediana) de 10 meses (P25–75: 6–90), unos valores de PRISM de 10 (P25–75: 7–13) y de TISS de 37 (P25–75: 33–43). La distribución de los pacientes en los 5 grupos establecidos en función de la técnica quirúrgica empleada fue la siguiente: en el grupo 1 (cierre de cortocircuitos), n=15; en el grupo 2 (reparación de estenosis/insuficiencia), n=8; en el grupo 3 (conductos extracardíacos), n=14; en el grupo 4 (técnica mixta), n=8, y en el grupo 5 (cirugía compleja), n=14.
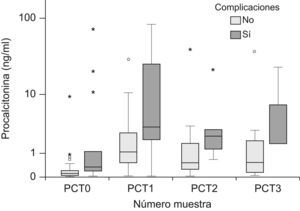
Cinética de la procalcitoninaLos niveles plasmáticos de PCT fueron de 0,15ng/ml (mediana), (P25–75: 0,06–0,36) al ingreso, de 1,82ng/ml (P25–75: 0,52–4,09) a las 24h, de 0,88ng/ml (P25–75: 0,28–2,05) a las 48h y de 1,52ng/ml (P25–75: 0,2–2,77) a las 72h. La figura 1 recoge la evolución de los valores de la PCT los tres primeros días tras la cirugía, diferenciando a los niños que desarrollaron complicaciones frente al resto de los pacientes. Los niños con complicaciones presentaron niveles plasmáticos de PCT más altos que el resto de los pacientes (tabla 1), siendo las diferencias significativas al ingreso (p=0,016) y a las 48 h (p=0,042). No existieron diferencias en la PCT entre los pacientes con complicaciones hemodinámicas e infecciosas.
Valores de procalcitonina en pacientes con y sin complicaciones
| PCT0 | PCT1 | PCT2 | PCT3 | |
| Mediana | Mediana | Mediana | Mediana | |
| (P25–75) | (P25–75) | (P25–75) | (P25–75) | |
| Pacientes con complicaciones | 0,11 (0,04–0,23) | 1,08 (0,47–2,91) | 0,52 (0,25–1,70) | 0,54 (0,11–2,48) |
| Pacientes sin complicaciones | 0,34 (0,19–3,53) | 3,28 (1,34–30,29) | 2,31 (1,13–7,56) | 1,68 (1,66–15,07) |
| p | 0,016 | 0,061 | 0,042 | 0,248 |
PCT0: procalcitonina al ingreso en la unidad de cuidados intensivos pediátricos; PCT1: procalcitonina a las 24h; PCT2: procalcitonina a las 48h; PCT3: procalcitonina a las 72h.
Los valores de PCT al ingreso en la UCIP (PCT0) fueron significativamente menores a los de las 24 h (p=0,0001), las 48 h (p=0,0001) y las 72h (p=0,002). No se observaron diferencias significativas en ninguno de los momentos al comparar los 5 grupos diagnósticos.
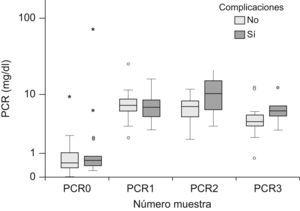
Cinética de la proteína C reactivaLos niveles plasmáticos de la PCR fueron de 0,6mg/dl (mediana) (P25–75: 0,3–1) al ingreso, de 6,9mg/dl (P25–75: 5,2–8,5) a las 24h, de 6,85mg/dl (P25–75: 5,05–8,82) a las 48h y de 4,2mg/dl (P25–75: 3,3–6,5) a las 72h. La figura 2 recoge la evolución de la PCR los tres primeros días tras la cirugía, diferenciando a los niños que desarrollaron complicaciones frente a los que no. No existieron diferencias significativas en los niveles de PCR entre los pacientes con y sin complicaciones (tabla 2), y tampoco entre los que desarrollaron complicaciones infecciosas y los que presentaron complicaciones hemodinámicas. Los valores de PCR al ingreso en la UCIP fueron significativamente menores a los del resto de la evolución (p=0,0001 en los 3 casos).
Valores de proteína C reactiva en pacientes con y sin complicaciones
| PCR0 | PCR1 | PCR2 | PCR3 | |
| Mediana | Mediana | Mediana | Mediana | |
| (P25–75) | (P25–75) | (P25–75) | (P25–75) | |
| Pacientes con complicaciones | 0,55 (0,30–1,15) | 6,90 (5,40–8,50) | 6,65 (4,35–8,12) | 3,90 (3,30–5,60) |
| Pacientes sin complicaciones | 0,60 (0,40–1,10) | 6,50 (4,47–8,55) | 10,62 (5,32–16,62) | 5,70 (3,80–9,50) |
| p | 0,819 | 0,644 | 0,477 | 0,517 |
PCR0: proteína C reactiva al ingreso en la unidad de cuidados intensivos pediátricos; PCR1: proteína C reactiva a las 24h; PCR2: proteína C reactiva a las 48h; PCR3: proteína C reactiva a las 72h.
Los valores de PCR fueron mayores en los pacientes con conductos extracardíacos que en los sometidos a reparación de cortocircuitos (p=0,045) y cirugía mixta (p=0,011). La PCR fue también más alta en las cirugías complejas que en las cirugías mixtas (p=0,022).
Correlación de la proteína C reactiva y la procalcitonina con la gravedad clínicaNo existió correlación entre la PCR y las puntuaciones de PRISM y TISS. Existió una correlación moderada entre la PCT y el PRISM en los tiempos de PCT0 (r=0,548; p=0,0001), de PCT a las 24h (PCT1) (r=0,434; p=0,006) y de PCT a las 48h (PCT2) (r=0,446; p=0,013), y una correlación baja entre la PCT y el TISS en los tiempos PCT0 (r=0,354; p=0,011) y PCT2 (r=0,374; p=0,042). Al estratificar a los pacientes en dos grupos de acuerdo a su nivel de gravedad (PRISM≤10 y PRISM>10) (tabla 3), no se encontraron diferencias en los valores de PCR entre los dos grupos. Por el contrario, los pacientes con PRISM mayor de 10 presentaron valores de PCT significativamente más elevados que el resto (tabla 3).
Valores de procalcitonina (ng/ml) en el postoperatorio de la cirugía cardíaca en función del nivel de gravedad
| Gravedad | PCT0 | PCT1 | PCT2 |
| Mediana (P25–75) | Mediana (P25–75) | Mediana (P25–75) | |
| PRISM≤10 | 0,09 (0,04–0,17) | 0,98 (0,40–2,57) | 0,55 (0,09–1,64) |
| PRISM>10 | 0,34 (0,12–0,87) | 3,65 (1,03–28,50) | 1,59 (0,40–2,81) |
| p | 0,003 | 0,009 | 0,063 |
PCT0: procalcitonina al ingreso en la unidad de cuidados intensivos pediátricos; PCT1: procalcitonina a las 24h; PCT2: procalcitonina a las 48h; PRISM: ‘Índice Pediátrico de Riesgo de Mortalidad’ (Pediatric Risk Mortality).
Quince pacientes desarrollaron complicaciones, 6 infecciosas (3 sepsis y 3 infecciones localizadas —2 infecciones de vías respiratorias y 1 otitis media aguda—) y 9 hemodinámicas (6 taquicardias ectópicas de la unión, 1 rechazo hiperagudo de trasplante cardíaco, 1 derrame pericárdico grave y 1 shock cardiogénico con necesidad de ECMO).
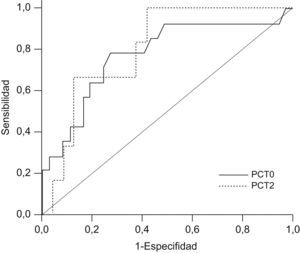
Al construir las curvas COR de rendimiento diagnóstico (fig. 3) se obtuvieron áreas bajo la curva para PCT0 de 0,780 (intervalo de confianza [IC]: 0,642–0,884; error típico: 0,080) y para PCT2 de 0,806 (IC: 0,621–0,926; error típico 0,115). En la tabla 4 se muestran los valores óptimos de corte y sus principales estadísticos. Al analizar el momento de PCT1, se obtuvieron un área bajo la curva de 0,709 (IC: 0,496–0,921; error típico; 0,108), con tendencia a la significación estadística (p=0,061), y unos valores óptimos de corte para la PCT>1,82ng/ml (sensibilidad [S] del 77,8%, especificidad [E] del 58,6%) y >2,84ng/ml (S del 66,7%, E del 75,9%).
Curvas COR de procalcitonina al ingreso en la unidad de cuidados intensivos pediátricos y procalcitonina a las 48h para el desarrollo de complicaciones en el postoperatorio de la cirugía cardíaca. Área bajo la curva de 0,780 (intervalo de confianza: 0,642–0,884) para procalcitonina al ingreso en la unidad de cuidados intensivos pediátricos y de 0,806 (intervalo de confianza: 0,621–0,926) para procalcitonina a las 48h. PCT0: procalcitonina al ingreso en la unidad de cuidados intensivos pediátricos; PCT2: procalcitonina a las 48h.
Sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo, cociente de probabilidades del positivo y cociente de probabilidades del negativo para los valores con mayor poder de discriminación para el desarrollo de complicaciones en la procalcitonina al ingreso en la unidad de cuidados intensivos pediátricos y en la procalcitonina a las 48h
| Criterio | PCT0>0,17 | PCT2>1,98 |
| S | 73,3% (44,9–92%) | 57,1% (18,8–89,6%) |
| E | 72,2% (55,9–86,2%) | 87% (66,4–97,1%) |
| VPP | 52,4 | 57,1 |
| VPN | 86,7 | 87 |
| CPP | 2,64 | 4,38 |
| CPN | 0,37 | 0,49 |
Entre paréntesis se expresan los intervalos de confianza para el 95%.
CPN: cociente de probabilidades del negativo; CPP: cociente de probabilidades del positivo; E: especificidad; PCT0: procalcitonina al ingreso en la unidad de cuidados intensivos pediátricos; PCT2: procalcitonina a las 48h; S: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Fallecieron solo 3 pacientes, por lo que no se pudo estudiar la relación entre la PCR y la PCT con la mortalidad.
DiscusiónLos hallazgos de nuestro trabajo en cuanto a la elevación de la PCT y la PCR en el postoperatorio de la cirugía cardíaca abierta coinciden con algunos estudios previos realizados tanto en niños como en adultos12–14,16,17,19,22–24,30,31,34.
La respuesta inflamatoria desencadenada por la cirugía cardíaca puede ser debida a múltiples factores10,11: la traslocación bacteriana a causa de hipoperfusión intestinal, el fenómeno de isquemia-reperfusión y el traumatismo quirúrgico que liberan citocinas, y el contacto de la sangre con superficies no endoteliales que induce la activación de la vía alternativa del complemento. El efecto de la CEC es discutible ya que se han descrito valores similares de PCT en pacientes con CEC y cirugía cerrada21.
En nuestro estudio, los pacientes sin complicaciones presentaron los máximos valores de PCT1 con descenso posterior y los máximos valores de PCR a las 24h, que permanecieron estables a las 48h. Estos hallazgos coinciden con lo referido en otros trabajos9,13,14,30,33,34.
Los niveles máximos de PCR y PCT encontrados en nuestro estudio (medianas de PCT1 de 1,82ng/ml y de PCR al ingreso en la UCIP de 6,9mg/dl) son similares a los descritos en la mayoría de las series publicadas14,17,23,30,33,34, en que se citan medianas de PCT inferiores a 2ng/ml y de PCR en torno a 7mg/dl. Algunos autores han encontrado incrementos más pronunciados de PCT en procedimientos que incluían ventriculotomía en comparación con aquellos en los que se realizaba atriotomía29, y en correcciones de la tetralogía de Fallot en relación con el cierre de la comunicación interauricular o la comunicación interventricular27. En nuestro estudio no encontramos diferencias significativas al dividir los pacientes en función de la técnica quirúrgica empleada. Sin embargo, observamos niveles séricos de PCR superiores al ingreso en los conductos extracardíacos frente al cierre de cortocircuitos en la cirugía mixta, y en la cirugía compleja frente a la cirugía mixta. No hemos encontrado otros estudios que hayan estudiado la correlación entre la PCR y el tipo de intervención quirúrgica.
Algunos autores han encontrado que la PCT puede tener capacidad pronóstica, habiéndose relacionado valores muy elevados de esta con un peor pronóstico, mayor incidencia de FMO y mortalidad15,20,25,33. En nuestro estudio encontramos una correlación moderada entre los niveles de PCT y el riesgo de mortalidad valorado por la puntuación PRISM. Ningún estudio pediátrico previo había analizado esta relación, aunque en adultos se ha encontrado correlación entre la PCT y las escalas de gravedad Simplified Acute Physiology Score II (SAPS II), Acute Physiology and Cronic Health Evaluation (APACHE) y Sequential Organ Failure Assessment (SOFA)14,17. Por el contrario, no encontramos correlación entre la PCR y el nivel de gravedad13,14,17,30,34.
En nuestro estudio, al igual que lo encontrado por otros autores en adultos y niños, no existieron diferencias en la PCR entre los niños con complicaciones y sin ellas, confirmando su escasa utilidad diagnóstica durante los tres primeros días del postoperatorio de la cirugía cardíaca14,17,23,30,34.
Meisner et al17 en un estudio en 208 adultos encontraron que aquellos que presentaban niveles de PCT por encima de 2ng/ml durante las primeras 48h del postoperatorio presentaban una mayor incidencia de complicaciones (95%) que los que presentaban valores inferiores (59%). En nuestra serie, los puntos de corte más favorables para identificar el desarrollo de complicaciones fueron niveles de PCT0 superiores a 0,17ng/ml (S del 73,3%; E del 72,2%) y superiores a 1,98ng/ml (S del 57,1%; E del 87%) a las 48h. Existe gran controversia en cuanto al papel de la PCT en la detección precoz de complicaciones infecciosas en el postoperatorio de la cirugía cardíaca. Algunos autores han descrito su utilidad, habiendo establecido puntos de corte muy variables (entre 0,9 y 5ng/ml)12,14,19,23,34. De Werra et al35 encontraron que la PCT es el mejor marcador biológico para diferenciar entre shock séptico y cardiogénico, con valores muy superiores en el primero. Sin embargo, otros trabajos15,17,18,20,26 no han encontrado diferencias en los valores de PCT en los pacientes que desarrollaron complicaciones infecciosas y no infecciosas, habiéndose sugerido recientemente la utilidad del análisis bifásico de la morfología de onda, prueba derivada del tiempo parcial de tromboplastina activada, para discernir entre el SRIS no infeccioso y el infeccioso en el postoperatorio de la cirugía cardíaca abierta26. En nuestro estudio no encontramos diferencias en los valores de PCT en ninguna de las determinaciones al comparar los niños que desarrollaron complicaciones infecciosas frente a los que no desarrollaron complicaciones no infecciosas, si bien el análisis está limitado debido al escaso número muestral. Además, hay que valorar nuestros resultados con precaución debido a que se incluyeron complicaciones infecciosas y hemodinámicas muy diversas. Por tanto, es necesario realizar estudios más amplios para poder definir el papel de la PCT como marcador de infección en el postoperatorio de la cirugía cardíaca en niños.
En conclusión, la cirugía cardíaca abierta en niños produce un aumento precoz de PCR y PCT que disminuye durante las primeras 72h. La PCR no se correlaciona con la gravedad clínica y no es útil en la detección de complicaciones postoperatorias. La PCT se correlaciona de forma moderada con el riesgo de mortalidad, y puede ser capaz de detectar complicaciones posquirúrgicas.
Son necesarios estudios más amplios que analicen la capacidad de la PCT para discriminar entre complicaciones infecciosas y hemodinámicas.
FinanciaciónAyuda a la Investigación Clínica y Epidemiológica en Pediatría de la Fundación Ernesto Sánchez Villares (VII Convocatoria, 2004). Beca de Investigación de la Fundación Hospitales Castrillo, Universidad Complutense de Madrid, 2004.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.