Introducción
Aunque la presencia de una sola arteria en el cordón umbilical del niño se conoce desde el siglo xv, cuando fue descrita por Gabrielle Falopio 1-3, su significado, su importancia y su implicación en el desarrollo prenatal siguen siendo bastante desconocidos, aunque se ha considerado como un posible indicador de la existencia de malformaciones congénitas y alteraciones cromosómicas 4-15. Sin embargo, la inmensa mayoría de los datos que hoy existen sobre esta anomalía del cordón, provienen de series de casos o poblaciones altamente seleccionadas, lo que, sin duda, influye en la gran variabilidad que se observa en los resultados y en las cifras de la frecuencia de arteria umbilical única (AUU) que ofrecen los distintos trabajos 16-19. Sólo hemos encontrado 3 estudios epidemiológicos, publicados antes de 1994, que han analizado los niños con AUU sobre una base poblacional 14,15,19. Por otra parte, en la mayoría de esos trabajos se ha sugerido que existe una importante relación entre la presencia de la AUU y algunos tipos de malformaciones, aunque no se han podido ofrecer unas pautas claras de actuación tras su identificación prenatal.
Por todo ello, y dado el gran desarrollo que se viene produciendo en las técnicas de diagnóstico prenatal y su aplicación a toda la población de mujeres embarazadas, la detección de AUU es una fuente de preocupación tanto para el ecografista, como para la mujer embarazada.
En este trabajo mostramos los resultados de un análisis epidemiológico, que es el primero que analiza por separado dos series consecutivas de neonatos: una constituida por recién nacidos con defectos congénitos (casos), y otra de recién nacidos sin defectos (controles). El objetivo de este estudio se ha centrado en tratar de identificar características relacionadas con la AUU que pudieran ofrecer pautas sobre su etiología y/o las posibles vías patogénicas para su posterior investigación.
Material y métodos
Hemos utilizado los datos del Estudio Colaborativo Español de Malformaciones Congénitas (ECEMC). Este es un programa de investigación clínico-epidemiológica sobre las causas de los defectos congénitos, que está organizado con un diseño de casos y controles y de base hospitalaria. El ECEMC se constituyó, desde sus inicios en abril de 1976, como lo que hoy día se considera una red temática de investigación multicéntrica, multidisciplinaria y translacional sobre defectos y malformaciones congénitas.
La metodología del ECEMC, que ha sido previamente descrita 20,21, incluye la recogida de información de todos los recién nacidos con algún defecto congénito mayor y/o menor, diagnosticable durante los primeros 3 días de vida, en cada uno de los hospitales que participan en el estudio. Por cada caso, se selecciona un recién nacido como control, que se define como el siguiente nacimiento que tenga el mismo sexo y no tenga defectos congénitos. Una vez que se han seleccionado el caso y su control, el mismo médico (en general pediatras/neonatólogos) entrevista a ambas madres recogiendo la información (la misma para los casos y los controles) en unos protocolos estandarizados y siguiendo la misma metodología. La información obtenida incluye datos demográficos, historia familiar, historia obstétrica, datos sobre fertilidad, exposiciones a diferentes factores como medicamentos, alcohol, tabaco, sustancias ocupacionales maternas y paternas, entre otros, hasta un total de 312 datos por cada niño.
Para este trabajo se han utilizado los datos del ECEMC correspondientes a dos períodos. Para el cálculo de la frecuencia de AUU, tanto sobre el total de los recién nacidos como por períodos de tiempo, se utilizó la información correspondiente a los años 1980 a 2003, ya que la recogida de los datos sobre cordón y placenta se generalizó en todos los hospitales en el año 1980. Por tanto, las muestras disponibles para el análisis de las frecuencias son: 18.540 recién nacidos malformados y de 17.861 controles. Sin embargo, para el análisis de las diferentes variables, se utilizó la información acumulada desde abril de 1976 hasta diciembre de 2003, consistente en 19.909 casos y 19.148 controles que tenían especificados los datos sobre el cordón y la placenta.
Las variables que se han analizado son: sexo, peso, edad gestacional, perímetro cefálico, talla, parto por cesárea, prematuridad, longitud del cordón, peso de la placenta, supervivencia en los primeros días de vida, primiparidad materna, existencia de oligohidramnios y polihidramnios. Los totales para las diferentes variables pueden ser distintos porque en cada variable se analizaron los casos y los controles con ese dato especificado.
La metodología estadística utilizada fue diferente dependiendo del tipo de comparación. Así, para las variables discretas, incluyendo la "frecuencia relativa (FR)", se aplicaron la prueba de la chi cuadrado, cuya hipótesis nula establece que no existen diferencias entre los grupos de comparación, o la p de Fisher cuando algún esperado fuera menor de 5. Para cuantificar la diferencia entre las frecuencias de 2 grupos, se calculó la FR, que consiste en dividir la frecuencia observada en uno de los grupos por la del otro, y cuyo resultado indica cuántas veces es mayor (o menor) la frecuencia del primer grupo en relación con la del segundo. Para la comparación de las variables continuas, se utilizó la prueba de la t de Student, cuya hipótesis nula establece que no hay diferencias entre los valores medios de los grupos de comparación. Para la estimación de la magnitud de la asociación entre las distintas variables discontinuas y la presencia de AUU, se calculó el odds ratio (OR), y sus intervalos de confianza del 95 % (IC 95 %), que nos indica cuánto mayor es el riesgo de que se dé la asociación estudiada en un grupo que en el otro. Para estos análisis se han utilizado los paquetes estadísticos de Epi-Info (Centers for Disease Control, versión 6.04, 2001) y Saber (Statistical Analysis Blackbox for Epidemiological Research, versión 1.4).
Resultados
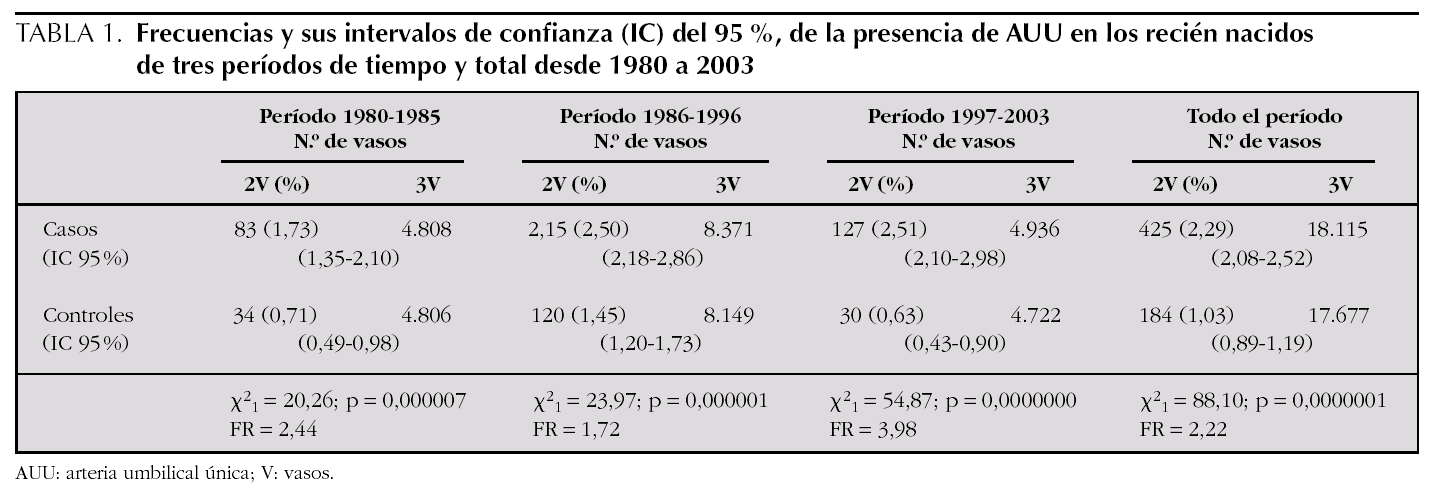
La frecuencia de AUU en niños recién nacidos con defectos congénitos fue del 2,29 % (IC 95 %: 2,08-2,52), frente al 1,03 % (IC 95 %: 0,89-1,19) observado en el grupo de los controles (tabla 1), siendo la diferencia estadísticamente muy significativa (p = 0,0000001). Con objeto de analizar si las interrupciones voluntarias del embarazo (IVE) cuando el feto tiene defectos, han influido en la frecuencia de AUU en los recién nacidos, en la misma tabla 1, se muestran las frecuencias en tres períodos de tiempo, siendo el primero anterior a la posibilidad legal de realizar una IVE (1980-1985). En el grupo de los niños con defectos congénitos, la frecuencia de AUU muestra una tendencia creciente que, aunque se hace menos intensa en el último período, es estadísticamente significativa (χ 2 1 = 7,20; p = 0,007). En el grupo de controles sólo se observan diferencias significativas entre los años. La comparación de la frecuencia de AUU entre los casos y los controles dentro de cada período de tiempo (análisis vertical de cada período), muestra diferencias que son también estadísticamente muy significativas en los tres períodos, siendo siempre mayor la frecuencia de AUU en los niños con defectos congénitos que en los controles, como se especifica al pie de la tabla 1, junto con los valores de las FR. El resultado de la FR en el primer período (cuando no existía posibilidad de hacer una IVE), indica que la AUU es 2,44 veces más frecuente entre los casos que entre los controles, valor que disminuye un poco en el segundo período, pero que es casi cuatro veces mayor en el tercero.
Aunque uno de los criterios de selección de los controles en la metodología del ECEMC es que tengan el mismo sexo que el niño malformado, se consideró que esa selección del sexo no tiene relación con el número de vasos del cordón de los controles. En el análisis de la proporción sexual de los niños con AUU en los casos y en los controles en relación con la de la población general (1,06), no se observaron diferencias entre ellos. No obstante, sobre el total de casos hay 76 niños con genitales ambiguos y, de éstos, 12 (15,79 %) tenían AUU, que comparados con los varones y mujeres con defectos congénitos y con AUU, las diferencias son muy significativas (p = 0,0000001), sugiriendo una asociación entre estos defectos y la AUU.
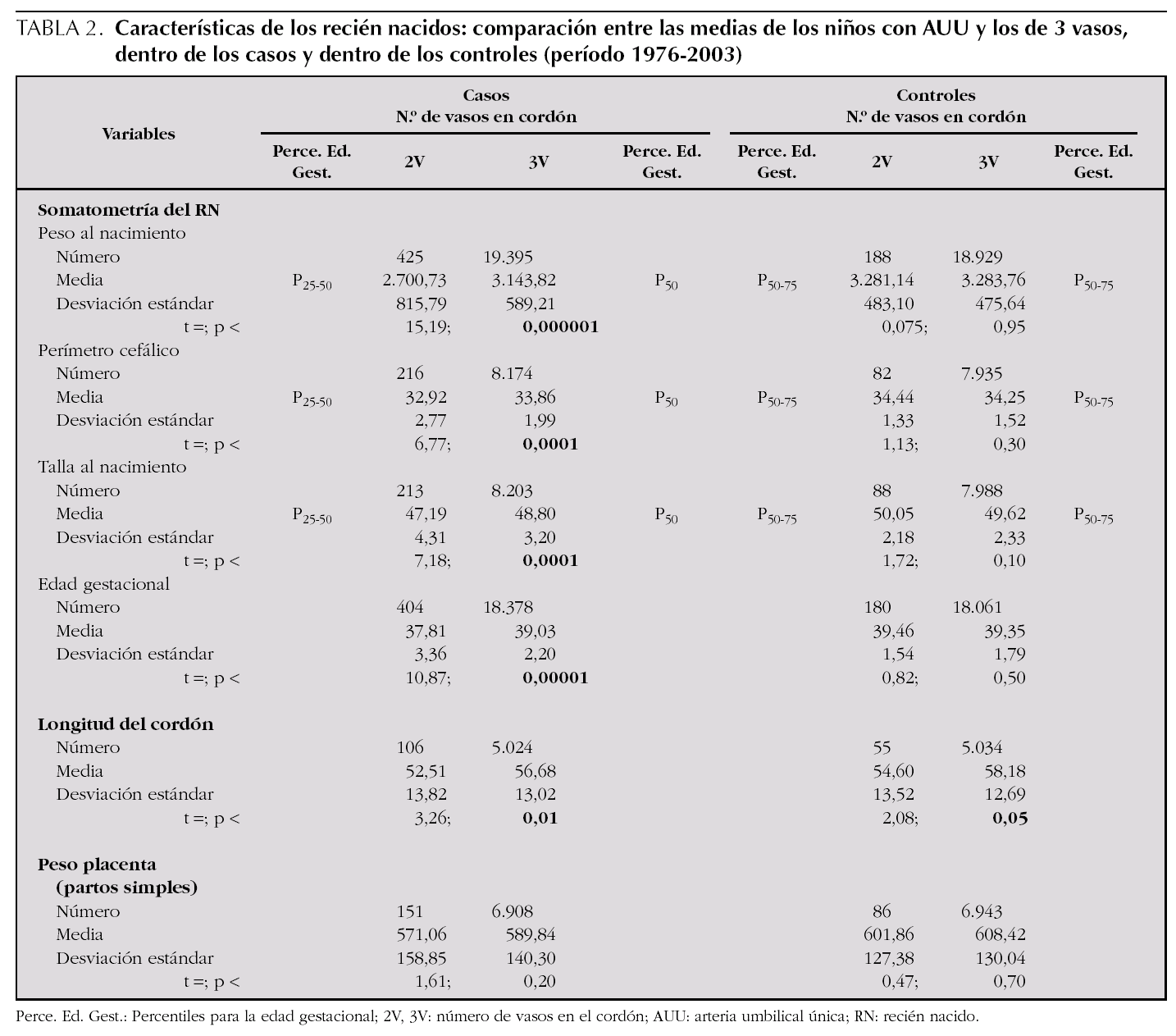
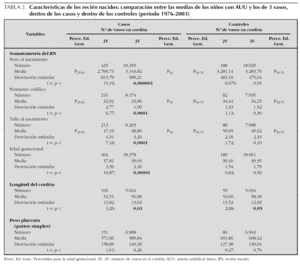
Para determinar si las variables que se relacionan con la AUU son las mismas en los niños con defectos congénitos y en los controles, el análisis se analizó por separado en casos y en controles. En la segunda columna de la tabla 2 se muestran los resultados obtenidos para las variables continuas en los casos comparando los que tenían AUU con los que no la tenían. En la tercera columna de la tabla se presentan los mismos resultados para el grupo de niños controles. La única variable que muestra diferencias significativas en los 2 grupos de neonatos (casos y controles), es la longitud del cordón umbilical, que es menor en los niños que tienen AUU, en los 2 grupos. Además, en los controles, la menor longitud del cordón (un promedio de 3,58 cm), es la única variable de todas las analizadas, cuya diferencia es estadísticamente significativa. Por el contrario, en los niños con malformaciones todas las variables analizadas en la tabla 2, menos el peso de la placenta, son significativamente menores en los casos que tienen AUU. Sin embargo, los resultados relacionados con la somatometría fetal, podrían ser secundarios al hecho de que los niños malformados con AUU tuvieran menor edad gestacional que los niños que no tienen AUU.
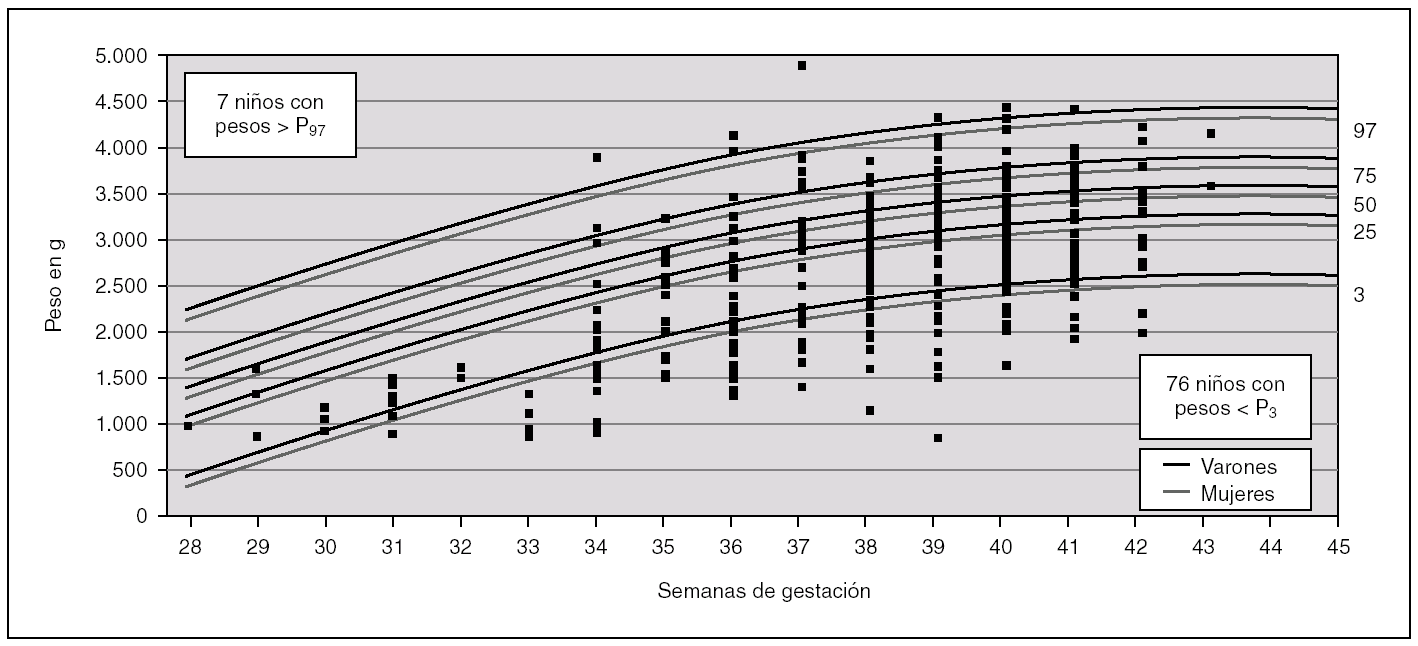
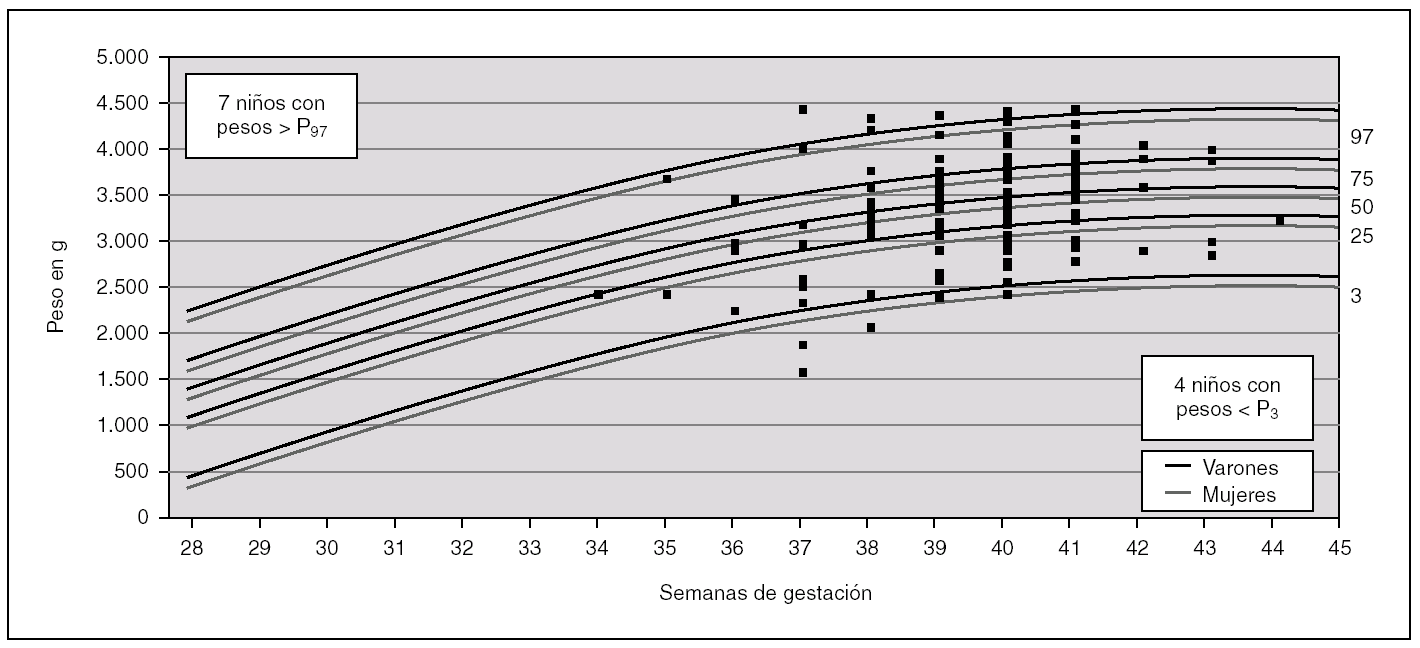
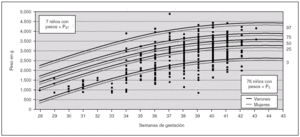
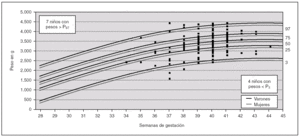
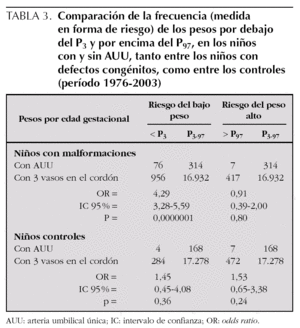
Para analizar esa posible relación, se han utilizado las curvas de los percentiles de peso por edad gestacional de nuestra población 22 (fig. 1) para distribuir cada uno de los niños con defectos congénitos y AUU según su peso y su edad gestacional (un mismo punto puede incluir a varios niños). Igualmente, en la figura 2, se muestra la distribución para los niños controles con AUU. Para cuantificar la relación de los percentiles del peso por edad gestacional, en la segunda columna de la tabla 3, se presentan los resultados de la comparación del número de niños con pesos por debajo del P3 en relación con los de peso adecuado, tanto entre los que tenían AUU como en los que no la tenían, mientras que en la última columna, se analizan los niños con pesos por encima del P97. Los resultados muestran que los recién nacidos con malformaciones y AUU, tienen un riesgo para nacer con un peso por debajo del P3, que es 4,29 veces mayor que en los casos sin AUU. Sin embargo, no tienen más riesgo para nacer con un peso por encima del P97 (OR = 0,91). Por el contrario, en los controles, no se observan esas diferencias. El mismo análisis se hizo para la prematuridad (tabla 4), y se encontró que los nacimientos antes de las 37 semanas, son tres veces más frecuentes en los casos con AUU que en los casos sin AUU (p = 0,0000001), mientras que no ocurre lo mismo en los controles con AUU (OR = 0,78; p = 0,48). Por otra parte, si comparamos la frecuencia de nacimientos antes de la semana 37 entre los casos frente a los controles (análisis vertical de la tabla 4), las diferencias son estadísticamente muy significativas tanto entre los recién nacidos con AUU como entre los que no la tienen. Esto indica que sólo por el hecho de que el feto tenga malformaciones, se incrementa el riesgo de un parto prematuro, igual que ocurría con el bajo peso para la edad gestacional.
Figura 1. Distribución del peso por edad gestacional, de los 397 niños con defectos congénitos y arteria umbilical única (AUU) que tenían el peso y la edad gestacional especificados. En cada punto puede haber más de un niño representado.
Figura 2. Distribución del peso por edad gestacional, de los 179 niños controles con arteria umbilical única (AUU) con peso y edad gestacional especificados. En cada punto pudo haber más de un niño representado.
También se ha evaluado el perímetro cefálico (PC), distribuyendo los casos y controles con AUU en los percentiles establecidos por Hall et al 23 y se ha podido determinar que entre los 199 casos con AUU y el PC especificado, 29 niños tenían un PC < P10, y 140 entre el P10 y el P90, mientras que en los 80 controles con los datos especificados, ninguno tenía un PC < P10, diferencia que es muy significativa (χ 21 = 12,57; p = 0,0004). Por otro lado, 28 niños con malformaciones y AUU, tenían un PC > P90, y en los controles con AUU, 15 tenían el PC > P90, diferencia que no es estadísticamente significativa (χ 2 1 = 0,20; p = 0,66).
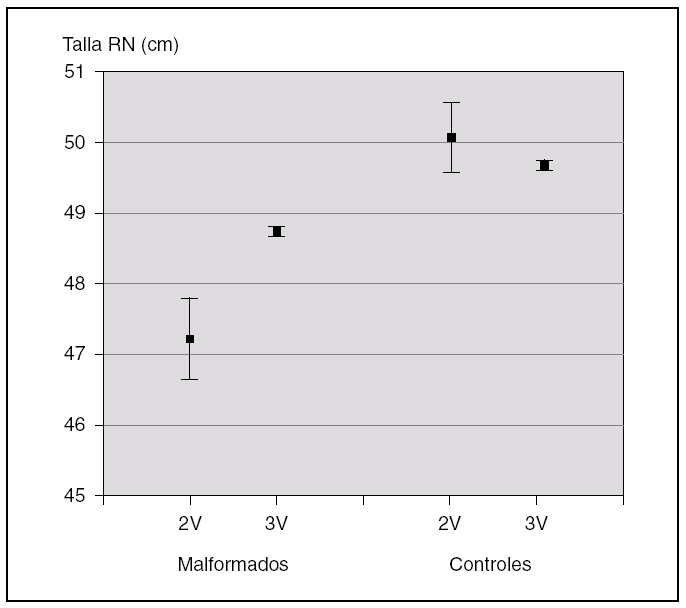
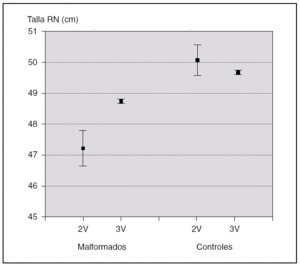
En la figura 3, se muestran los datos referidos a la talla de los recién nacidos mediante la representación de las medias ± 2 errores estándar (DE). De esta forma, a través de los intervalos de confianza, se pueden visualizar no sólo las diferencias que existen en los niños con AUU y los que tienen 3 vasos en el cordón dentro de cada grupo de recién nacidos (casos o controles), sino cada uno de los dos valores del grupo de casos con cada uno de los dos valores del grupo de controles.
Figura 3. Talla al nacimiento.
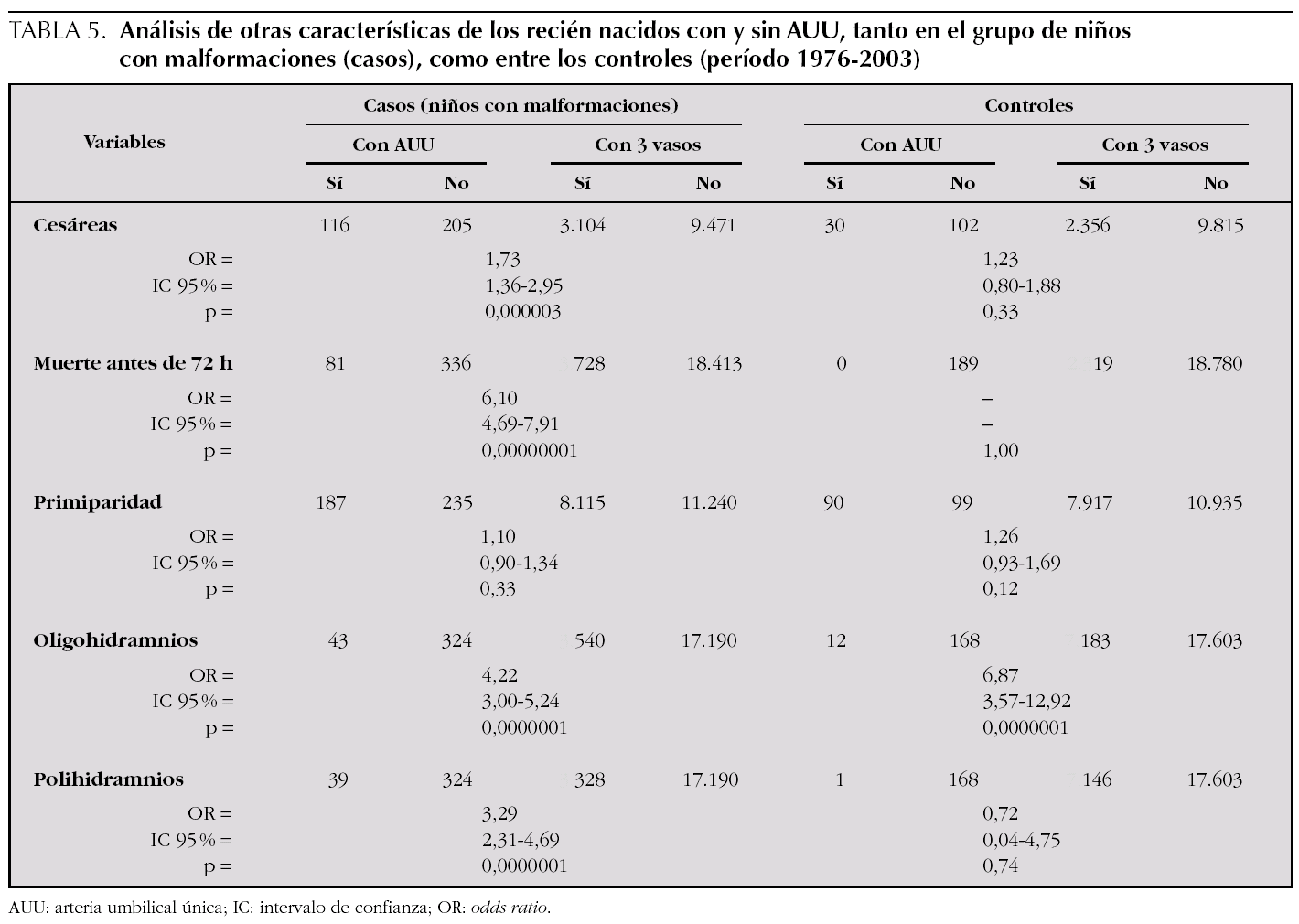
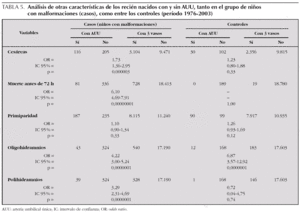
En la tabla 5, se muestran los resultados obtenidos para el resto de variables discretas, en 2 columnas, una para los niños con malformaciones y otra para los controles. El análisis se realizó a través del cálculo del riesgo que supone, para cada variable estudiada, que el niño tenga AUU, con relación a los niños que no tienen AUU. Tanto las alteraciones del líquido amniótico (por exceso y por defecto), como el parto por cesárea y la mortalidad a los 3 días de vida, muestran un riesgo significativamente mayor (el valor de los OR indica cuántas veces más), entre los niños con malformaciones y AUU, en relación con los que tienen 3 vasos en el cordón umbilical. Sólo el hecho de que sea el primer hijo de la familia no difiere entre los 2 grupos de niños malformados. Por el contrario, en los niños controles con y sin AUU (última columna de la tabla), sólo la presencia de oligohidramnios se relaciona en forma estadísticamente significativa con la AUU (casi siete veces más).
Discusión
Desde el trabajo de Benirschke y Brown en 1955 3, han sido muchos los estudios en los que se ha tratado de determinar la frecuencia de la AUU, su significado y su relación con defectos congénitos, aunque los resultados no fueron concordantes ni totalmente comparables debido a las diferencias entre las muestras estudiadas 4-19. De hecho, la mayoría de los estudios han analizado muestras de diferentes tamaños y procedencia, como series obtenidas del diagnóstico prenatal de fetos con AUU, autopsias de fetos malformados, fetos abortados por malformaciones, informes hospitalarios de niños seleccionados por placentas con y sin AUU, series de fetos/niños con malformaciones y, sobre todo, realizados en distintos años por lo que también difiere la resolución de las técnicas de detección 4-13,24,25. Todo esto influye en que las cifras de frecuencia abarquen un amplio rango, que va desde valores de 0,13 y 3 % en recién nacidos (sin tener en cuenta si tenían o no malformaciones), y de 0,5 y 2,5 % de neonatos sin complicaciones, a un valor del 7 % en IVE por malformaciones 10,12,14. En los pocos estudios realizados sobre series consecutivas de nacimientos o fetos, los valores también muestran variaciones. Así, en un trabajo retrospectivo sobre 18.425 nacimientos realizado en 1995 26, se obtuvo una frecuencia de 0,47 %. En un reciente artículo realizado en un hospital de España 27, sobre un total de 5.987 mujeres embarazadas a las que se les realizó un examen ecográfico sobre la semana 20 de embarazo, 42 fetos tenían AUU, lo que da una frecuencia de 0,70 %. Sin embargo, Volpe et al 28, en el año 2005, analizando también una población no seleccionada de 3.750 mujeres embarazadas en las que se realizó un diagnóstico ecográfico, observaron una frecuencia de 1,07 % de fetos con AUU. Por otra parte, algunos estudios han detectado que la AUU es más frecuente en gemelos 12,14,29.
El presente trabajo tiene la ventaja de haber analizado las dos series más grandes de niños recién nacidos consecutivos publicadas hasta la fecha, y de que una sea de nacimientos de niños que presentaban defectos congénitos, y la otra de recién nacidos consecutivos sin anomalías (controles). Además, se ha analizado, por primera vez en forma comparativa, no sólo la frecuencia de la AUU en recién nacidos con y sin defectos congénitos, sino ciertas características de los niños con y sin AUU entre los malformados y entre los controles, así como entre los casos frente a los controles. Esto, ha permitido demostrar que la frecuencia de AUU entre los niños recién nacidos con defectos congénitos, es el doble que la que se observa en los recién nacidos sin defectos congénitos (un promedio del 2,29 %, frente al 1,03 %). Esta diferencia podría explicar la diversidad de valores que se obtuvieron en los trabajos previos en los que los fetos o recién nacidos con AUU no se separaron en los que tuvieran y no tuvieran malformaciones; porque dependiendo del tamaño de las muestras, y de la procedencia de las mismas (diagnóstico prenatal, abortos, recién nacidos, etc.), el grupo de los malformados con AUU tendría más o menos impacto sobre la frecuencia global de cada muestra.
Revisando los trabajos que pudieran ser más comparables con el nuestro, observamos que recientemente, Prucka et al 12 estudiando placentas de fetos con patologías, detectaron la existencia de AUU en el 2 % (97/4.846), lo que es concordante con la frecuencia observada en los niños malformados de este trabajo. Por otra parte, las frecuencias de AUU detectadas en los trabajos realizados en mujeres embarazadas a las que se les hizo una ecografía 27,28, mostraron valores entre 0,70 y 1,07 %, cifras que son más parecidas a las que hemos obtenido en nuestro grupo de controles. Esto se debe, muy posiblemente, a que los tamaños de las muestras de esos trabajos no son grandes, por lo que el número de niños/fetos con malformaciones debe ser tan pequeño que no afecta a la frecuencia global que debe tener la población de recién nacidos sin defectos. No obstante, diferencias en cuanto al momento del embarazo en que se realizó la ecografía (que también varía, incluso dentro de un mismo estudio), igualmente podría haber influido en los resultados.
En todo trabajo epidemiológico existen limitaciones que aunque no siempre es posible evitar, deben considerarse en la interpretación de los resultados, tratando de determinar el modo en que pueden haber afectado a los mismos. En este trabajo una de esas limitaciones podría ser el denominado sesgo de identificación. Es decir, que en los niños que nacen sanos, sea más fácil que no se confirme si existen 3 vasos en el cordón, mientras que si el recién nacido tiene defectos congénitos, al ser la exploración más exhaustiva es más probable que se detecte la presencia de AUU. Como no es posible descartar totalmente este potencial sesgo de identificación, su efecto podría ser, al menos en parte, responsable de la diferencia que observamos al comparar la frecuencia de AUU en casos y en controles. De hecho, consideramos que el incremento de la frecuencia que se produce en el segundo período de tiempo (tabla 1) en los casos, se relaciona con una mejor identificación de esta anomalía del cordón, debido a la generalización de la ecografía prenatal para la detección de anomalías fetales, y la posibilidad de utilización del Doppler en el examen ecográfico. La falta de incremento en el tercer período, podría ser el resultado de dos tendencias de sentido opuesto: un incremento en la detección de la AUU relacionado con las mejoras del diagnóstico prenatal, y una reducción debida a las interrupciones del embarazo tras el diagnóstico prenatal de defectos fetales. Por el contrario, en los controles, las diferencias entre los tres períodos son estadísticamente muy significativas (χ 22 = 26,89; p = 0,000001), y sus límites de confianza indican que esas diferencias pueden estar en función tanto al incremento que se produce en el segundo período, como al descenso en el tercer período de tiempo. Sin embargo, resulta, difícil considerar que en estos últimos años la detección de la AUU sea menos eficiente en los controles, ya que el diagnóstico prenatal ecográfico (que está más generalizado) tiene mayor resolución que en los períodos anteriores, detectándose perfectamente la presencia de la AUU desde antes del nacimiento. Por tanto, aunque el sesgo de detección no se puede descartar por completo, también es posible que ciertos embarazos en los que sólo se detectara la AUU, se interrumpieran por miedo a la existencia de otros defectos que no se pudieran detectar mediante la ecografía. A pesar de todo, para controlar ese posible sesgo, hemos realizado los distintos análisis por separado en niños con malformaciones y en los controles.
Algunos estudios previos habían descrito una relación entre la AUU y el bajo peso para la edad gestacional, prematuridad, abortos espontáneos, muertes perinatales, y mayor frecuencia de malformaciones 9,15,16,18,27, por lo que gran parte de los autores han sugerido que esta anomalía del cordón podría dar lugar por sí misma a un efecto deletéreo sobre el desarrollo fetal, así como a un pobre resultado perinatal en comparación con los fetos con 3 vasos en el cordón. No obstante, para interpretar correctamente los resultados de esos estudios, es necesario considerar que la gran mayoría se realizó sobre series seleccionadas de fetos, de placentas, o niños con AUU y, además, sin analizar por separado los que tenían la AUU y malformaciones, de los que tenían sólo AUU sin otros defectos congénitos 26-28.
De hecho, en este trabajo, hemos podido constatar que la existencia de AUU en niños sin defectos congénitos no afecta al crecimiento fetal en ninguno de sus parámetros de peso, talla y perímetro cefálico. Incluso las proporciones de los controles que tienen bajo peso para la edad gestacional y los que son prematuros, son similares entre los que tienen AUU y los que tienen 3 vasos en el cordón. Estos resultados confirman las sugerencias de algunos autores que habían analizado un pequeño grupo de niños o fetos con AUU que no tenían otros defectos identificables 26,29. Más aún, en un trabajo muy reciente, Predanic et al 30, consideran que los fetos con AUU aislada tienen el mismo riesgo de ser pequeños para la edad gestacional que los que tienen 3 vasos en el cordón.
La ausencia de relación entre la presencia de AUU y la somatometría fetal, así como con las otras variables estudiadas en niños sin defectos congénitos, apoya nuestra consideración de que las diferencias observadas entre los niños malformados con y sin AUU para esas mismas variables, se deban más a los tipos de malformaciones presentes, que al hecho de que tengan AUU. Es decir, que la AUU debe tender a asociarse a ciertos tipos de malformaciones, y deben ser esas malformaciones las que se relacionan con las características que son significativamente distintas entre los que tienen AUU y los que tienen 3 vasos en el cordón.
En nuestros datos, sólo la existencia de oligohidramnios y la longitud del cordón umbilical se asocia con la AUU en los niños controles, en los que el cordón es un promedio de 3,58 cm más corto en los que tienen AUU que en los que no la tienen, y no se observa alteración en el peso de la placenta. Por tanto, el hecho de que la longitud del cordón sea significativamente menor en los niños con AUU, independientemente de que tengan o no defectos congénitos, sugiere que debe existir una relación directa entre el crecimiento del cordón y la existencia de AUU.
El cordón umbilical se forma entre los días 13 y 38 desde el momento de la fecundación y está constituido por 2 arterias y una vena. Existen tres teorías etiopatogénicas sobre la aparición de la AUU 11,17,31. La primera teoría considera que la AUU se debe a una agenesia primitiva (o ausencia de formación) de una de las 2 arterias definitivas. La segunda teoría estima que se produce por atrofia/atresia secundaria de una de las 2 arterias previamente bien desarrolladas. Por último, se piensa que puede ser debida a la persistencia de la arteria alantoidea original del tallo de fijación (arteria vitelina). En este sentido, los resultados obtenidos en este primer análisis de nuestros datos, sugieren que el origen y/o mecanismos de producción de la AUU en los niños que tienen también otras malformaciones puede ser diferente de los que la producen en los niños sin otras alteraciones. De hecho, parece sensato considerar que la segunda teoría podría explicar la presencia de una AUU en recién nacidos sin defectos congénitos ni problemas de crecimiento, ya que la atrofia/atresia de una de las 2 arterias previamente bien desarrolladas, se puede producir cuando ha terminado el período de embriogénesis y en diferentes momentos del resto del embarazo. Incluso se puede sospechar que cuando ocurre esa atresia se produce también una alteración del crecimiento del cordón y de la producción de líquido amniótico, que son las dos características que en este trabajo se han relacionado con la AUU en niños con y sin malformaciones.
No obstante, la situación debe ser más compleja, ya que Sepúlveda et al 32 describieron 5 fetos a los que prenatalmente se les detectó una fusión de las 2 arterias umbilicales cerca de la placenta mientras que había 2 arterias normales en la parte fetal del cordón. Uno de los fetos tenía también agenesia renal unilateral, y al nacimiento presentó un cuadro correspondiente a un síndrome génico, mientras que los otros cuatro que tenían AUU fueron completamente normales. Posteriormente, Gamzu et al 33, describieron un caso en el que por ecografía prenatal se observó que presentaba una única arteria procedente de la aorta abdominal. Este tipo de alteración corresponde a la persistencia de la arteria vitelina, que se considera muy frecuente en la sirenomelia.
Todos estos aspectos proporcionan la base suficiente para considerar que la AUU debe ser estudiada en relación con los diferentes tipos de malformaciones, con objeto de detectar a cuáles se asocian preferentemente, lo que será objeto de un próximo trabajo. Sin embargo, creemos que, en los recién nacidos con AUU, explorar la existencia de esa AUU en diferentes partes del cordón umbilical, podría ofrecer una información de gran utilidad.
Grupo Periférico del ECEMC por Comunidades Autónomas
Andalucía: Barcia JM (Cabra), Cózar JA (Huércal Overa), Esteban MV (Jaén), Fernández E (Antequera), Gallardo FL (Montilla), Gomar JL (La Línea), Lara A (Úbeda), Rodríguez A (Motril), Tapia JM (Puerto Real). Aragón: Calvo MJ (Barbastro), Muñoz MS (Teruel), Oliván del Cacho MJ (Huesca). Baleares: Jiménez F (Manacor), Gómez F (Mahón). Canarias: López S (Tenerife). Cantabria: Canduela V (Laredo), Gómez-Ullate J (Santander). Castilla-La Mancha: Félix V (Toledo), García A (Guadalajara), García MJ (Cuenca), Huertas H (Valdepeñas), Sánchez C (Puertollano), Suay M (Cuenca), Vázquez MS (Albacete), Salvat F (Hellín). Castilla y León: Aparicio P (Burgos), Burón E (Valladolid), Centeno F (Valladolid), Marugán V (Zamora), Mousallem AG (Medina del Campo), Nieto C (Segovia). Cataluña: Alsina MN (Calella), Caubet I (Vielha), Foguet A (Olot), García MM (Figueres), Marco JJ (Lleida), Martí JJ (Sta. Coloma de Gramanet), Martínez S (Girona), Moral A (Terrassa), Puig I (Girona), Rosal J (Tortosa), Serrano A (Mora d'Ebre), Torres S (Palamós). Comunidad de Madrid: Conde JF (Madrid), Gallego S (El Escorial), Martín F (Madrid), Martínez MN (Leganés). Comunidad Valenciana: Andrés M (Valencia), Beseler B (Denia), Climent S (Xativa y Ontinyent), García C (Valencia), González de Dios J (Alicante), Jovani C (Vila-Real), Martínez A (Requena), Pi G (Alzira), Sanchís A (Valencia), Vizcaíno C (Elche). Extremadura: Arroyo I (Cáceres), Galán E (Badajoz), Contreras J (Coria), Gómez H (Llerena), Rota L (Navalmoral de la Mata). Galicia: Blanco M (Vigo), Martínez MA (Vilagarcía de Arousa), Silveira M (Burela). La Rioja: Garijo C (Calahorra). Navarra: Egüés J (Pamplona). País Vasco: Paisán L (San Sebastián), Pérez JL (Basurto), Zuazo E (Zumárraga). Principado de Asturias: Mayoral B (Cangas del Narcea), Rodríguez MC (Riaño), Suárez ME (Avilés). Región de Murcia: Contessotto C (Santiago de la Ribera), Hernández F (Murcia), López JA (Lorca), Martín JM (Murcia), Peñas A (Yecla), Rubio MJ (Murcia).
Agradecimientos
Queremos expresar nuestro agradecimiento a la Fundación Raúl González-Salas y a Carolina Vincelli, su presidenta, por haber financiado este proyecto.
Correspondencia: Dra. M.ªL. Martínez-Frías.
CIAC. Instituto de Salud Carlos III.
Sinesio Delgado, 4. 28029 Madrid. España.
Correo electrónico: mlmartinez.frias@isciii.es
Recibido en febrero de 2006. Aceptado para su publicación en julio de 2006.