Los parechovirus humanos (HPeV) son virus de la familia Picornaviridae, recientemente descritos, a los que se atribuyen cuadros de fiebre sin foco (FSF), sepsis clínica, gastroenteritis, meningitis o encefalitis fundamentalmente en lactantes pequeños. Nuestro objetivo fue describir la epidemiología y las características clínicas de las infecciones por HPeV en nuestro medio.
Pacientes y métodosEstudio multicéntrico prospectivo, llevado a cabo en 12 hospitales a nivel nacional, entre 2013-2015, en niños<3 años con FSF, sepsis clínica o patología neurológica. Se realizó determinación de HPeV mediante RT-PCR en el Centro Nacional de Microbiología en suero, heces o líquido cefalorraquídeo.
ResultadosSe analizan 47 infecciones por HPeV de un total de 850 muestras (5,52%), siendo HPeV-3 el más frecuente (29 casos), con predominio en mayo y julio, con una distribución bienal. El 57% eran neonatos y solo 2>3 meses. Todos los pacientes presentaron fiebre, el 45% irritabilidad, el 18,6% exantema y el 14% diarrea. No se observa ninguna alteración específica en las pruebas bioquímicas. El diagnóstico final más frecuente fue FSF (61%) seguido de sepsis clínica (29%). Aunque un 29% de los niños precisaron ingreso en cuidados intensivos, solo un paciente presentó secuelas.
ConclusionesLos HPeV circulan en nuestro país, afectando fundamentalmente a lactantes < 2 meses y se asocian a FSF y sepsis clínica, con un predominio en primavera y verano. Sería de interés implementar las técnicas moleculares de diagnóstico en todos los hospitales para reconocer y manejar adecuadamente estas infecciones.
Human parechovirus (HPeV) is one of the recently described picornaviridae viruses that have been associated with fever of unknown origin (FUO), clinical sepsis, gastroenteritis, meningitis, or encephalitis in very young infants. The aim of this study is to describe the epidemiology and clinical features of these viruses.
Patients and methodsA prospective multicentre 3-year study was conducted in 12 hospitals in Spain. Out of 850 specimens examined, 47 were positive (5.52%), with HPeV-3 being the most frequent (29 cases). Infections occurred throughout the year, but mainly in May and July, and a biennial distribution was observed. More than half (57%) were neonates, and only 2 children were older than 3 months. Fever was present in all children, with irritability in 45%, rash in 18.6%, and diarrhoea in 14%. The results of biochemical tests were all in normal range. The most common final diagnosis was FUO (61%), followed by clinical sepsis (29%). Up to 29% of infants were admitted to the intensive care unit, but only one patient had sequelae.
ResultsOut of 850 specimens examined, 47 were positive (5.52%) for HPeV, with HPeV-3 being the most frequent (29 cases). Infections occurred throughout the year, but mainly in May and July, and a biennial distribution was observed. More than half (57%) were neonates, and only 2 children were older than 3 months. Fever was present in all children, with irritability in 45%, rash in 18.6%, and diarrhoea in 14%. The results of biochemical tests were all in normal range. The most common final diagnosis was FUO (61%), followed by clinical sepsis (29%). Up to 29% of infants were admitted to the intensive care unit, but only one patient had sequelae
ConclusionsHPeV circulates in our country, mainly during spring and summer, and affects young infants with a FUO and clinical sepsis. Molecular diagnostic techniques in all hospitals could help in improving the management of patients with these infections.
Los parechovirus humanos (HPeV) son virus RNA de pequeño tamaño, de los cuales actualmente se conocen 16 tipos distintos (HPeV-1 al 16)1,2. Los tipos HPeV-1 y 2 fueron descritos por primera vez en 1945, siendo clasificados inicialmente como echovirus 22 y 23, dentro del género de los Enterovirus. En el año 1999 se reclasificaron como un género diferente, el género Parechovirus dentro de la familia Picornaviridae, basándose en sus características biológicas y genómicas. Las infecciones por HPeV-1 y 2 se habían asociado a cuadros gastrointestinales y respiratorios leves. Sin embargo, los tipos 3-16, descritos en los últimos 10-12 años, parece que son capaces de producir infecciones neurológicas y sistémicas más o menos graves. Los estudios publicados en los últimos años otorgan a los HPeV, pero sobre todo al tipo 3, un importante papel en las infecciones graves de lactantes pequeños3, aunque todavía no se conoce con precisión las características epidemiológicas y patogénicas de estos virus. Los HPeV son, junto con los enterovirus humanos (EV), agentes causales de meningitis aséptica y síndromes febriles en la infancia4,5. Sin embargo, en nuestro país todavía hay pocos datos publicados sobre la incidencia y la circulación de HPeV6. Así, el objetivo de este trabajo fue describir las características clínicas de las infecciones sistémicas y neurológicas por HPeV recogidas en un estudio multicéntrico de ámbito nacional sobre las infecciones por enterovirus y parechovirus en población infantil.
Pacientes y métodosSe realizó un estudio prospectivo en el que participaron 12 hospitales españoles entre los años 2013 y 2015. El estudio fue financiado por la AES (PI12-00904) y aprobado por el Comité de Ética del Instituto Carlos III. Los padres o tutores firmaron un consentimiento informado.
Se incluyó a los niños menores de 3 años hospitalizados en los servicios de Pediatría o Neonatología de los hospitales incluidos en el estudio, que presentaron cuadros compatibles con fiebre sin foco (FSF), meningitis aséptica, encefalitis o meningoencefalitis, miocarditis o sepsis clínica. Se definió FSF como temperatura axilar superior a 37,9°C sin aparente causa tras una completa exploración física y análisis de laboratorio (según los protocolos habituales de diagnóstico de FSF aplicados en cada centro). Se consideró el diagnóstico de meningitis aséptica cuando existía pleocitosis mayor de 30 células/mm3 en neonatos o mayor de 5 células/mm3 en niños mayores de un mes, con cultivo de líquido cefalorraquídeo (LCR) negativo para bacterias. El diagnóstico de encefalitis fue realizado sobre la base de la presentación clínica de disminución del nivel de consciencia, con otros síntomas de afectación neurológica, sin precisar necesariamente la presencia de pleocitosis en el LCR, o alteración en la resonancia magnética o el electroencefalograma, a pesar de que estos estudios complementarios sirvieron para apoyar el diagnóstico. La meningoencefalitis comparte datos clínicos de meningitis y encefalitis. Se definió la sepsis clínica como la presencia datos clínicos y marcadores biológicos de síndrome de respuesta inflamatoria sistémica, sin confirmación bacteriológica en los cultivos. Los datos clínicos y analíticos de los pacientes se recogieron en un cuestionario diseñado al efecto.
Se recogieron muestras de LCR, exudado faríngeo (EF), heces o suero. Las muestras fueron remitidas a los laboratorios de microbiología de los hospitales donde se descartó infección por herpesvirus neurotropos (HHV simple 1, 2 y VZV).También se analizó la presencia de EV mediante técnicas moleculares y aquellas muestras que resultaron EV negativas fueron enviadas a la Unidad de Enterovirus del Centro Nacional de Microbiología, donde se realizó la detección de HPeV mediante una RT-PCR diseñada específicamente7. Los HPeV así detectados fueron genotipificados usando una RT-PCR en la región VP3/VP1 previamente descrita7, secuenciación y análisis filogenético.
El análisis estadístico se realizó mediante el Statistical Package for the Social Sciences (SPSS), Version 13.0. Los valores fueron expresados como porcentajes para las variables discretas y como media y desviación estándar (DE) para las variables continuas. Las características clínicas y las variables de laboratorio fueron comparadas empleando el test t de Student, el test U de Mann-Whitney, el test de la χ2 y el test exacto de Fisher. Un valor de p<0,05 fue considerado como estadísticamente significativo.
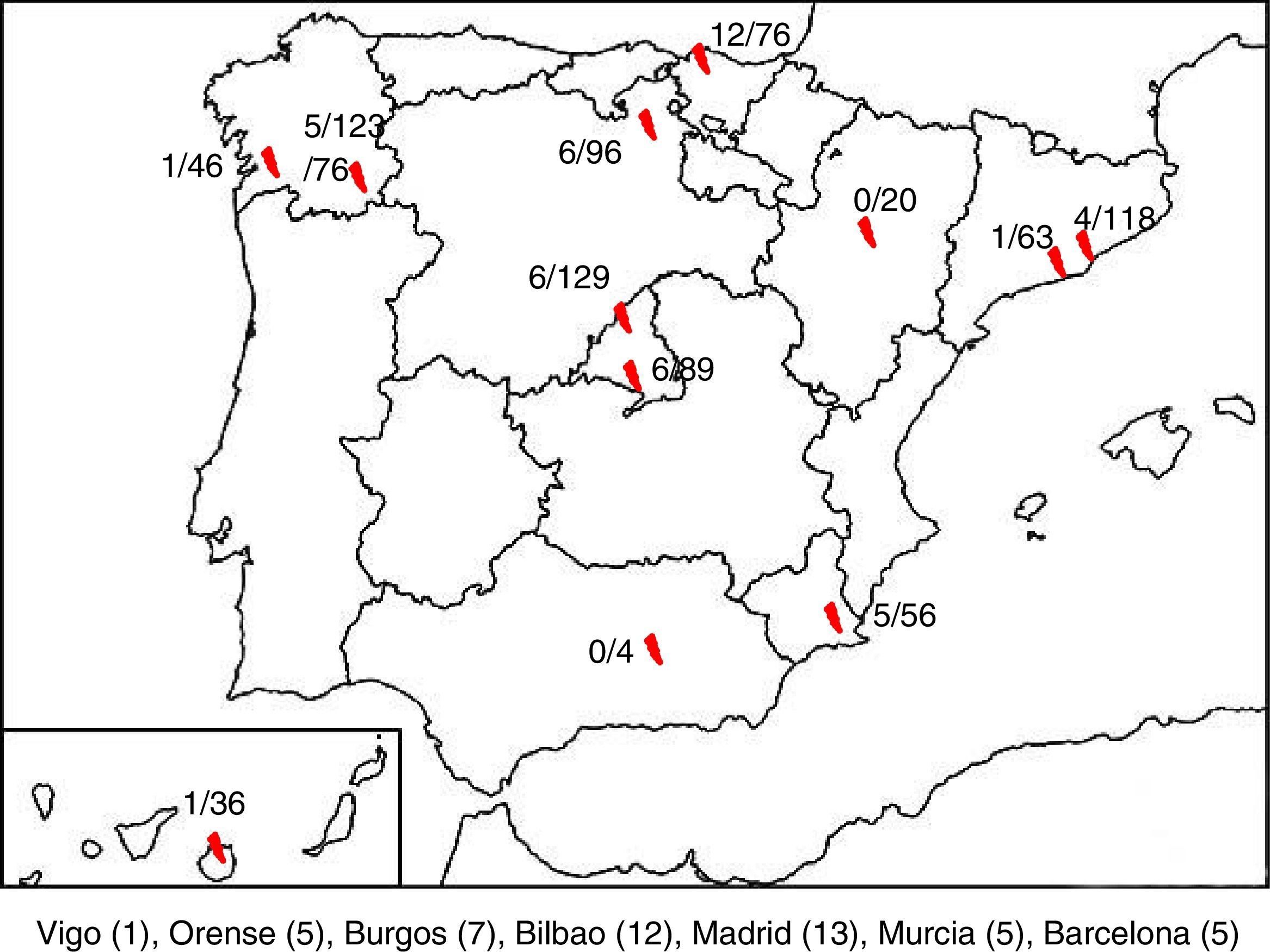
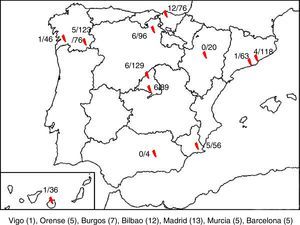
ResultadosSe recogieron en total 850 muestras correspondientes a 845 pacientes, de las cuales 47 fueron positivas para HPeV (5,52%). Se disponía de datos clínicos solo de 43 pacientes, por lo que 4 pacientes fueron excluidos del estudio. Se detectaron casos positivos en 10 de los 12 hospitales, cuya distribución aparece representada en la figura 1.
Se analizaron los datos epidemiológicos de los 43 pacientes con infección por HPeV, 24 varones y 19 mujeres. De todas las muestras positivas, 31 lo fueron en LCR (31/596 muestras de LCR en el estudio, 5,2%), 11 en suero (11/145, 7,58%) y una en EF (1/91, 1,09%). No se encontraron casos positivos en las muestras de heces (13 muestras), biopsia (4 muestras) ni lavado bronquial (1 muestra). La mediana de edad fue de 24 días (rango IC 12-42 días), con 26 de ellos neonatos (menores de 28 días) y solo 2 mayores de 3 meses. Dos de los niños eran prematuros. Todos los pacientes se encontraban en su domicilio cuando iniciaron la sintomatología. Ninguno de los pacientes acudía a guardería.
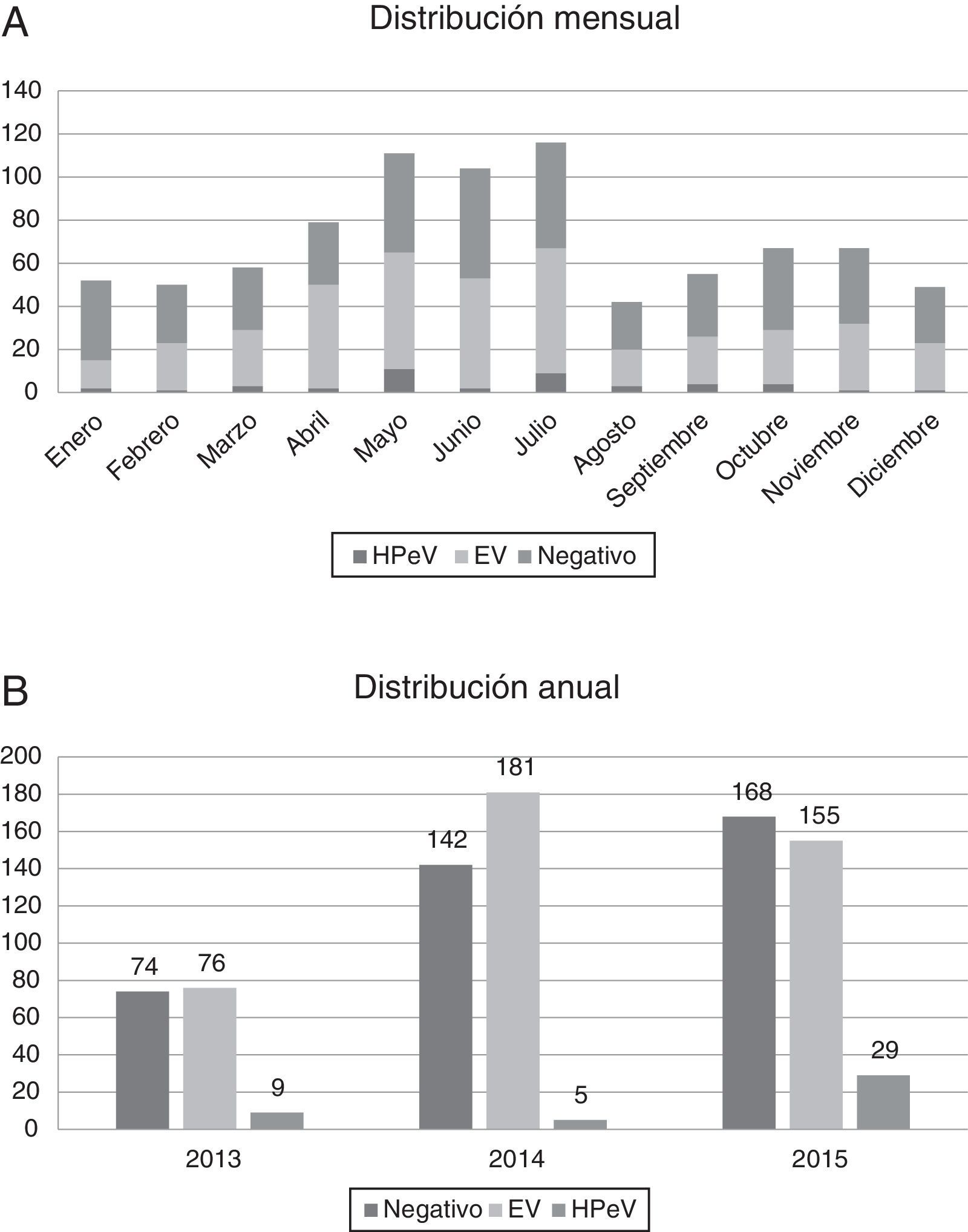
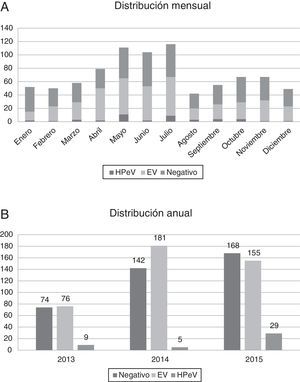
La mayoría de las infecciones por HPeV ocurrieron en primavera y verano, con predominio en el mes de mayo (11 pacientes) y julio (9 pacientes), pero se detectaron casos durante todo el año. La incidencia fue mayor en los años 2013 (9/159 muestras analizadas, 5,66%) y 2015 (29/352, 8,29%), frente al año 2014, en que solo hubo 5 casos detectados (5/328, 1,52%) (fig. 2).
Todos los pacientes en los que se recogieron los datos clínicos se presentaron con fiebre mayor de 38°C, con una media de 38,8° C, con una DE de 0,4 y un máximo de 40,2°C. La duración media de la fiebre fue 1,7 (DE 1,4) días, con un máximo de 6 días. El tiempo desde el inicio de la fiebre hasta la realización del estudio analítico variaba entre 1 y 24 h, con una media de 8,3 (DE 8,9) h.
Otros signos clínicos fueron irritabilidad (45% de los pacientes HPeV positivos), exantema (18,6%), diarrea (14%) y, en menor proporción, sibilancias, enantema y conjuntivitis.
Las pruebas bioquímicas mostraban valores de leucocitos, neutrófilos, proteína C reactiva y procalcitonina normales (tabla 1). El LCR tampoco mostraba alteraciones significativas, sin detectarse pleocitosis (salvo en un caso), a pesar de la detección de HPeV. Igualmente, las cifras de proteínas y glucosa en el LCR se encontraban dentro de límites normales.
Características clínicas y de laboratorio de los 43 niños con infección por parechovirus (HPeV)
| Síntomas | N.° pacientes (%) |
| Fiebre | 43/43 (100) |
| Irritabilidad | 13/29 (44,8) |
| Exantema | 8/43 (18,6) |
| Diarrea | 6/43 (14) |
| Encefalitis | 1/43 (2,3) |
| Bronquitis | 1/43 (2,3) |
| Complicaciones | |
| Alteración hepática | 5/43 (11,6) |
| Convulsiones | 2/43 (4,7) |
| Distrés respiratorio | 1/43 (2,3) |
| Datos virológicos | |
| HPeV-3 | 39/43 (90,7) |
| HPeV-1 | 1/43 (2,3) |
| HPeV-5 | 1/43 (2,3) |
| HPeV no tipificados | 2/43 (4,7) |
| Diagnóstico | |
| Fiebre sin foco | 26/43 (60,5) |
| Sepsis clínica | 13/43 (30,2) |
| Gastroenteritis | 4/43 (9,3)a |
| Meningoencefalitis | 1/43 (2,3) |
| Infección urinaria | 1/43 (2,3)b |
| Laboratorio. | |
| Datos bioquímicos | Media (DE) |
| Leucocitos en sangre cls/mm3 | 8.103 (5.005) |
| Neutrófilos totales cls/mm3 | 4.449 (4.541) |
| Leucocitos en LCR cls/mm3 | 4,33 (5,58) |
| Proteínas en LCR mg/dl | 60,11 (65,95) |
| Glucosa en LCR mg/dl | 54,73(6,89) |
| Proteína C reactiva mg/dl | 4,09 (4,86) |
| Procalcitonina ng/ml | 0,3 (0,54) |
DE: desviación estándar; LCR: líquido cefalorraquídeo.
En cuanto al tipo de HPeV identificado, mayoritariamente se detectó HPeV-3 (39/43, el 90,7% de los casos) (tabla 1). En 2 pacientes se detectó una coinfección. En un caso con Salmonella en el coprocultivo (HPeV-1) y en otro fue una infección urinaria por Escherichia coli (HPeV-3).
El diagnóstico clínico final más frecuente fue FSF (26 pacientes, 60,5%), seguido de sepsis clínica (13 pacientes, 30,2%), 3 gastroenteritis (6,9%) y una meningoencefalitis. Este último presentó posteriormente secuelas neurológicas, con persistencia de actividad epileptiforme en el electroencefalograma.
Al analizar de forma independiente en función del diagnóstico, se encontró que los pacientes con sepsis clínica tenían más frecuentemente alteración hepática de forma significativa (28,6% vs. 3,6%, p=0,018). Como era de esperar, presentaron más frecuentemente ingreso en la Unidad de Cuidados Intensivos (UCI) (50% vs. 19,2%, p=0,043).
El 90% de los pacientes recibieron tratamiento antibiótico, siendo mucho más frecuente entre los que eran neonatos (100% vs. 73%, p=0,01). Además, 12 pacientes (26%) precisaron ingreso en UCI, de los cuales 11 eran menores de un mes.
Como complicaciones graves, 2 pacientes presentaron convulsiones, uno distrés respiratorio y 6 alteración hepática con elevación de las transaminasas. Ningún paciente presentó coma, fallo hepático o cardiaco ni derrame pleural.
Analizando por separado a los menores y mayores de un mes, las únicas diferencias encontradas fueron la temperatura máxima (mayor en el grupo de los no neonatos, 39,1 vs. 38,6°C, p=0,01) y la cifra de hemoglobina (superior en los neonatos, 14,5 vs. 10,3mg/dl, p<0,01).
La evolución fue favorable en todos los pacientes, no existiendo ningún paciente fallecido, si bien un paciente precisó seguimiento en Neuropediatría por persistir actividad epileptiforme en el electroencefalograma.
DiscusiónEn este artículo se presentan los resultados de un estudio prospectivo multicéntrico realizado entre 2013 y 2015, en el que se han recogido muestras y datos clínicos de 845 pacientes con sepsis clínica, meningitis, encefalitis o FSF, entre los que se ha encontrado que un 5,56% de infecciones estaban asociadas a HPeV (47 casos). Es la primera vez que se realiza un estudio de ámbito nacional de estas características durante un periodo de 3 años y se demuestra que los HPeV circulan en nuestro país y que se asocian a infecciones neurológicas y sistémicas graves en lactantes pequeños. En la serie analizada hay 2 hospitales en los cuales no se han detectado casos de infección por HPeV, situados en las comunidades autónomas de Andalucía y Aragón. Sin embargo, posiblemente este hecho ha sido debido al escaso número de muestras de estos centros de que se dispuso y no a una falta de circulación del virus en dichas regiones.
En nuestra serie, la circulación de HPeV presenta estacionalidad, con un predominio de casos detectados en primavera y verano (fig. 2). Esta distribución difiere ligeramente de los estudios realizados en otros países, en los cuales encontraban un predominio en verano y otoño8,9. Además, parece que la circulación de HPeV-3 es bienal, con mayor número de casos en los años 2013 y 2015 que en el 2014. Estas observaciones ya estaban descritas previamente10, aunque son necesarios estudios con mayor número de muestras para confirmar la circulación bienal del HPeV tipo 3.
Los HPeV son agentes infecciosos frecuentes en la infancia precoz, ya que, según algunos estudios serológicos, hasta el 90% de los niños menores de 2 años han pasado una infección por algún tipo de HPeV, manifestándose habitualmente como cuadros leves con clínica gastrointestinal o respiratoria11,12. Sin embargo, en un porcentaje de casos la infección puede manifestarse como un cuadro más grave con importante afectación del estado general, llegando a precisar ingreso en la UCI, correspondiendo estos casos a las infecciones sistémicas y neurológicas (sepsis clínica y encefalitis, fundamentalmente). En estudios previos se describe el HPeV-1 como el tipo de HPeV más frecuente detectado, pero es el HPeV-3 el que se relaciona con cuadros de mayor gravedad, como meningitis o sepsis neonatal13,14. También en nuestra serie el HPeV-3 fue el HPeV identificado con más frecuencia (90,7% de los casos), aunque los criterios de inclusión del estudio favorecían la selección de pacientes con enfermedad grave. Solo en un paciente con gastroenteritis, y que además presentó una convulsión febril, se detectó un HPeV-1. Sin embargo, no podemos asegurar que toda la sintomatología clínica fuera debida a este virus, ya que también presentó un coprocultivo positivo para Salmonella. El único paciente con infección por HPeV-5 presentó un síndrome febril sin foco en el periodo neonatal. Estas manifestaciones son similares a las descritas por van der Sanden et al.10 en un estudio de 8 años desarrollado en Holanda, donde el HPeV-1 se relacionó con síntomas gastrointestinales, el HPeV-3 con sepsis y el HPeV-5 con síntomas gastrointestinales, fiebre y exantema. En este mismo estudio, el HPeV-3 fue también el más frecuente, por delante del HPeV-1 (57% vs. 35%). La diferencia en la distribución de los tipos entre nuestra serie y la de van der Sanden et al. probablemente esté en relación con los criterios de inclusión de ambos estudios, predominando el HPeV-3 cuando se incluye a pacientes ingresados o con infecciones graves, y el HPeV-1 cuando se realizan estudios poblacionales.
La edad de los pacientes con infección por HPeV es muy característica, presentándose en el 83,7% de los casos en niños menores de 2 meses y especialmente en neonatos (55,8%). Esto ha sido descrito también por otros autores, como Harvala et al., que en un estudio realizado en Escocia durante 8 años solo detectaron la presencia de HPeV en niños menores de 3 meses15. Resultados similares han sido descritos también en otro estudio realizado en Australia, donde el 75% de 118 niños con infección por HPeV eran menores de 2 meses16. Esta distribución según la edad diferencia a los HPeV de los EV, cuyas infecciones se pueden dar a cualquier edad, y no solo en niños pequeños17.
Las características clínicas de la infección por HPeV incluyen la presencia de fiebre en todos los casos, si bien ni la duración de la fiebre ni su intensidad son características de esta infección. Sí que resultó un dato frecuente la presencia de irritabilidad, en más de la mitad de los pacientes, como ya han descrito Vanagt et al., en una serie de 89 pacientes de Holanda18. En el 30,4% de los casos se observó una sepsis clínica, encontrando una asociación entre el diagnóstico de sepsis y la presencia de alteración hepática e ingreso en la UCI. En el 17,4% de los pacientes se observó exantema, una frecuencia similar a la descrita en otras series19.
Los hallazgos de bioquímica son poco específicos, con niveles de leucocitos, proteína C reactiva y procalcitonina bajos, como en otras infecciones virales. Sí es significativa la ausencia de pleocitosis en la práctica totalidad de los casos, como ha sido descrito en otras series, incluido un trabajo previo publicado por nuestro grupo sobre infecciones por HPeV y EV en neonatos20,21. En la mayoría de los casos el tiempo transcurrido entre el inicio de los síntomas y la realización de la punción lumbar podría contribuir a esta escasez de células en el LCR. Es relevante destacar la ausencia de pleocitosis ya que en estos casos sería importante no desechar el LCR y realizar el análisis de HPeV mediante PCR, para poder llegar al diagnóstico de la infección. Por tanto, clínicamente, la infección por HPeV se comporta como un cuadro de FSF, y sospecha de sepsis en la mayoría de los pacientes, sobre todo en los más pequeños, con afectación del estado general, que a menudo aconseja el ingreso en la UCI, si bien la evolución es buena en pocas horas, como ocurre en los casos aquí presentados. Solo un paciente fue diagnosticado de meningoencefalitis y presentó crisis convulsivas, precisando posteriormente un seguimiento por persistencia de actividad irritativa en el electroencefalograma. No obstante, hay algunos estudios que describen cuadros graves, fundamentalmente asociados a encefalitis, en algún caso mortal14,19,22.
No existen actualmente datos de seguimiento a largo plazo de niños con infección por HPeV, pero múltiples estudios hablan de la buena evolución a corto plazo. Sin embargo, Verboon-Maciolek et al.23 observaron la aparición de retraso psicomotor en una revisión retrospectiva en 3 de 11 neonatos con infección por HPeV. En nuestra serie también se observa un buen pronóstico general a corto plazo de la infección por HPeV, a pesar de que la mayoría de nuestros pacientes presentaron la infección por el tipo 3, que es el asociado a mayor gravedad. Un estudio reciente realizado en una pequeña serie de niños, en su mayoría prematuros, con encefalitis graves por HPeV, ha descrito a largo plazo, alteraciones neurológicas en el desarrollo de estos niños24.
Tampoco existe todavía ningún tratamiento para las infecciones por HPeV. En casos graves, se ha utilizado el tratamiento con inmunoglobulina intravenosa, como en el trabajo de Wildenbeest et al.25, en el que un paciente con una cardiomiopatía dilatada secundaria a infección por HPeV fue tratado con éxito. El diseño de anticuerpos monoclonales dirigidos contra HPeV-1 y 2 se encuentra en investigación26. Sin embargo, son precisos más estudios para poder utilizar los anticuerpos monoclonales en la práctica clínica. Además, sería interesante poder diseñar este tipo de tratamientos frente al HPeV-3, que es el que se ha relacionado con infecciones de mayor gravedad. En nuestra serie, el 90% de los niños recibieron tratamiento antibiótico, llegando al 100% en el subgrupo de los neonatos. Sin duda, el desarrollo de técnicas de diagnóstico precoz y el desarrollo de terapias dirigidas al virus podría optimizar el uso de estos tratamientos, permitiendo la retirada de los mismos, una vez se haya descartado una infección bacteriana. No debemos dejar de considerar que en un pequeño porcentaje de casos puede asociarse una coinfección entre virus y bacterias.
Podemos concluir que el HPeV-3 es una causa relevante y frecuente de FSF y sepsis clínica en lactantes pequeños. El cuadro clínico es característico en niños menores de 2 meses, con fiebre, irritabilidad, mal aspecto y a veces exantema. La evolución a corto plazo es buena, aunque en ocasiones requieren ingreso en la UCI.
Consideramos que el conocimiento de las características clínicas de las infecciones por HPeV y la implementación de las técnicas moleculares de diagnóstico en todos los hospitales pueden ayudar a mejorar el manejo de los pacientes con infecciones por estos virus.
FinanciaciónEstudio financiado por el Fondo de Investigaciones Sanitarias: AES (PI12-00904).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los miembros del Grupo de Estudio de las Infecciones por enterovirus y parechovirus en niños: Martinez-Almagro C, Trallero G, del Amo E, García-Costa J, Omeñaca M, Sanbonmatsu-Gámez S, Pérez-Ruiz M, Santos-Muñoz MJ, García-García ML, Rey Cao S.