Mycoplasma pneumoniae (MP) es uno de los agentes etiológicos más comunes de las neumonías adquiridas en la comunidad (NAC) en niños. Objetivo: describir las características clínicas y epidemiológicas, tratamiento y evolución de los pacientes con NAC por MP (NACM) en un hospital terciario de Valencia, España.
Material y métodosSe revisaron retrospectivamente las historias clínicas de los niños<14 años con NACM entre enero de 2010 y diciembre de 2015. Los pacientes con evidencia radiológica de neumonía y confirmación microbiológica de MP (PCR de exudado nasofaríngeo y/o anticuerpos IgM específicos frente a MP) se consideraron NACM.
ResultadosUn total de 162 pacientes se diagnosticaron de NACM; mediana de edad de 6 años (rango intercuartílico: 4-9 años). La proporción de pruebas positivas para MP en pacientes con NAC, así como el uso empírico de macrólidos, aumentó progresivamente con la edad. Hubo un pico de casos en 2011 y en 2015, con un máximo de casos en julio, agosto, noviembre y diciembre. El patrón radiológico más frecuente fue el infiltrado segmentario (62,3%), mientras que 22 (13,6%) presentaron derrame pleural. Los niños con NACM desarrollaron una clínica leve, con poca elevación de parámetros inflamatorios. Se inició tratamiento empírico con un macrólido en el 68,5% de los casos. La necesidad de ingreso hospitalario fue inversamente proporcional a la edad del paciente.
ConclusionesSegún este estudio, los niños con NAC de mayor edad tuvieron la mayor proporción de infección por MP, siendo poco sintomáticos y con escasa elevación de parámetros inflamatorios, pudiéndose beneficiar del tratamiento empírico con macrólidos. Por consiguiente, conocer la epidemiología de un área geográfica podría ser importante para el abordaje de las NAC en niños.
Mycoplasma pneumoniae (MP) is one of the most common etiological agents of community-acquired pneumonia (CAP) in children. We aimed to describe the clinical and epidemiological characteristics, treatment and outcome of children diagnosed with community-acquired MP pneumonia (CAMP) in a tertiary hospital in Valencia, Spain.
Material and methodsMedical records of children <14 years with CAMP were retrospectively reviewed from January 2010 to December 2015. Patients with radiological evidence of pneumonia and microbiological confirmation of MP (PCR from nasopharyngeal swab and/or serum specific IgM) were considered CAMP.
ResultsOne hundred and sixty two children were diagnosed with CAMP; median age 6 years (IQR: 4-9). The positive MP test rate among children with CAP progressively increased with age as did the empirical use of macrolides. There were two peaks of cases in 2011 and in 2015, being July, August, November and December the seasons with the higher number of cases. The most frequent radiological pattern was segmental infiltrate (62.3%) and 22 (13.6%) children had pleural effusion. It was noteworthy the mild symptomatology and low levels of inflammatory parameters that children with CAMP had. A macrolide was empirically initiated in 68.5% of cases. Hospital admission rate was inversely proportional to patient's age.
ConclusionsAccording to this study, older, less symptomatic patients and with lower inflammatory parameters had the greatest rate of MP infection among children with CAP and thus they could benefit of empiric macrolide therapy. Therefore, knowing the epidemiology of a geographical area may be important for the management of CAP in children.
La neumonía adquirida en la comunidad (NAC) en niños se asocia a una morbilidad importante en países desarrollados y a una alta mortalidad en países en vías de desarrollo, con una incidencia anual de 30-40 casos/1.000 niños menores de 5 años de edad y una tasa de hospitalización anual de 15,7 casos/10.000 niños menores de 18 años1.
La inclusión en los calendarios vacunales de la vacuna frente al Haemophilus influenzae tipo b, y posteriormente de la vacuna conjugada frente al neumococo, ha producido cambios en la epidemiología de la NAC pediátrica. La importancia del Mycoplasma pneumoniae (MP) como agente etiológico ha aumentado, especialmente en niños de 5 años o mayores2.
Aunque se han propuesto varias escalas clínicas, no hay síntomas o signos con un valor predictivo lo suficientemente bueno para establecer el diagnóstico etiológico de la neumonía3. La introducción de la reacción en cadena de la polimerasa (PCR) para el diagnóstico de MP ha sido revolucionaria en su manejo, pues proporciona resultados rápidamente con una elevada sensibilidad y especificidad que pueden orientar el tratamiento4.
El objetivo del estudio fue describir las características clínico-epidemiológicas y el tratamiento de la NAC por MP (NACM) en una población pediátrica en un período de 6 años.
Material y métodosLa población de estudio la formaron pacientes menores de 14 años, en los que se realizaron pruebas microbiológicas para la detección de MP (PCR para MP en frotis nasofaríngeo o serología de MP en la fase aguda) por sospecha de NACM, a criterio del pediatra, en un servicio de urgencias pediátricas en Valencia (España) entre el 1 de enero de 2010 y el 31 de diciembre de 2015. Se revisaron de manera retrospectiva las historias clínicas y los hallazgos de la radiografía de tórax de estos pacientes.
Para ser incluidos dentro de la población de estudio, los pacientes debían tener una radiografía de tórax realizada en el servicio de urgencias durante las 72 horas previas o en el momento del diagnóstico y extracción de muestra para la detección de MP. Se excluyeron los pacientes en los que los hallazgos radiográficos descartaron NAC a juicio de un pediatra/investigador sin conocimiento de los datos clínicos de los pacientes. Se realizaron estudios microbiológicos adicionales y otras pruebas diagnósticas a criterio del médico. Se recogió y analizó el recuento leucocitario y los niveles séricos de proteína C reactiva y procalcitonina en el momento del diagnóstico de NAC.
Se consideró caso de NACM a pacientes que presentaron los 2 criterios siguientes: 1) infección por MP confirmada por resultado positivo de PCR para MP en muestras de frotis nasofaríngeo (Progenie Molecular RealCycler®) o detección de anticuerpos IgM específicos frente a MP durante la fase aguda de la enfermedad (ELISA IgM, Vircell®); y 2) evidencia radiográfica de neumonía5. Los criterios radiográficos incluyeron la presencia de consolidación (opacidad en el pulmón con o sin broncograma aéreo), otros infiltrados (aumentos de densidad alveolar o intersticial) y derrame pleural. El engrosamiento peribronquial y las atelectasias no se consideraron criterios diagnósticos de neumonía.
Los criterios de exclusión fueron enfermedad crónica relevante (neoplasia, trasplante, enfermedad pulmonar exceptuando asma, inmunodeficiencia o cardiopatía grave), hospitalización reciente (en los 7 días previos), residencia en un centro sanitario de larga estancia e inclusión previa en el estudio en los últimos 28 días.
Se recogieron datos sobre el seguimiento posterior a la obtención de la muestra para detección de MP de las historias clínicas, que contienen información sobre todas las asistencias recibidas en el sistema de salud pública de la provincia de Valencia (atención de urgencias, hospitalaria, ambulatoria y primaria).
Análisis estadísticoLos estadísticos descriptivos fueron calculados y presentados como frecuencias absolutas y porcentajes para variables categóricas y la medianas y rangos intercuartílicos (RIC) para variables cuantitativas. Se estudió la asociación entre variables categóricas mediante la prueba Chi cuadrado o de Fisher, y entre variables cualitativas mediante análisis de varianza (ANOVA), la prueba «t» de Student o la prueba de Kruskal-Wallis, según correspondiese. El análisis estadístico se realizó con el paquete SPSS versión 22.0 para Windows (SPSS, Chicago, EE. UU.). Se consideró estadísticamente significativo un valor de p<0,05.
ResultadosPoblación de estudioSe realizaron pruebas microbiológicas para el diagnóstico de MP en 636 pacientes diagnosticados de NAC. De ellos 611 (96,1%) cumplieron los criterios radiográficos de NAC, y 25 (3,9%) fueron excluidos por no cumplir dichos criterios. Las pruebas empleadas para el diagnóstico de MP fueron la PCR exclusivamente en 558 (91,3%), la serología (IgM) exclusivamente en 40 (6,5%) y ambas técnicas en 13 pacientes (2,1%).
De los 611 casos con evidencia radiográfica de neumonía, 162 (26,5%) se diagnosticaron de NACM. La edad mediana al diagnóstico de NACM fue de 6 años (RIC: 4-9 años) y 84 de estos pacientes (51,9%) fueron niñas. El rango de edad estaba entre los 6 meses y los 13 años y 11 meses. De todos los pacientes con NACM, 148 (88,3%) tuvieron un resultado positivo por PCR, 19 (8,6%) anticuerpos IgM positivos y 5 (3,1%) resultados positivos en ambas pruebas. Todos los pacientes en los que se realizaron ambas pruebas tuvieron resultados positivos en las dos, excepto un niño que tuvo un resultado positivo en la serología y un resultado negativo en la PCR.
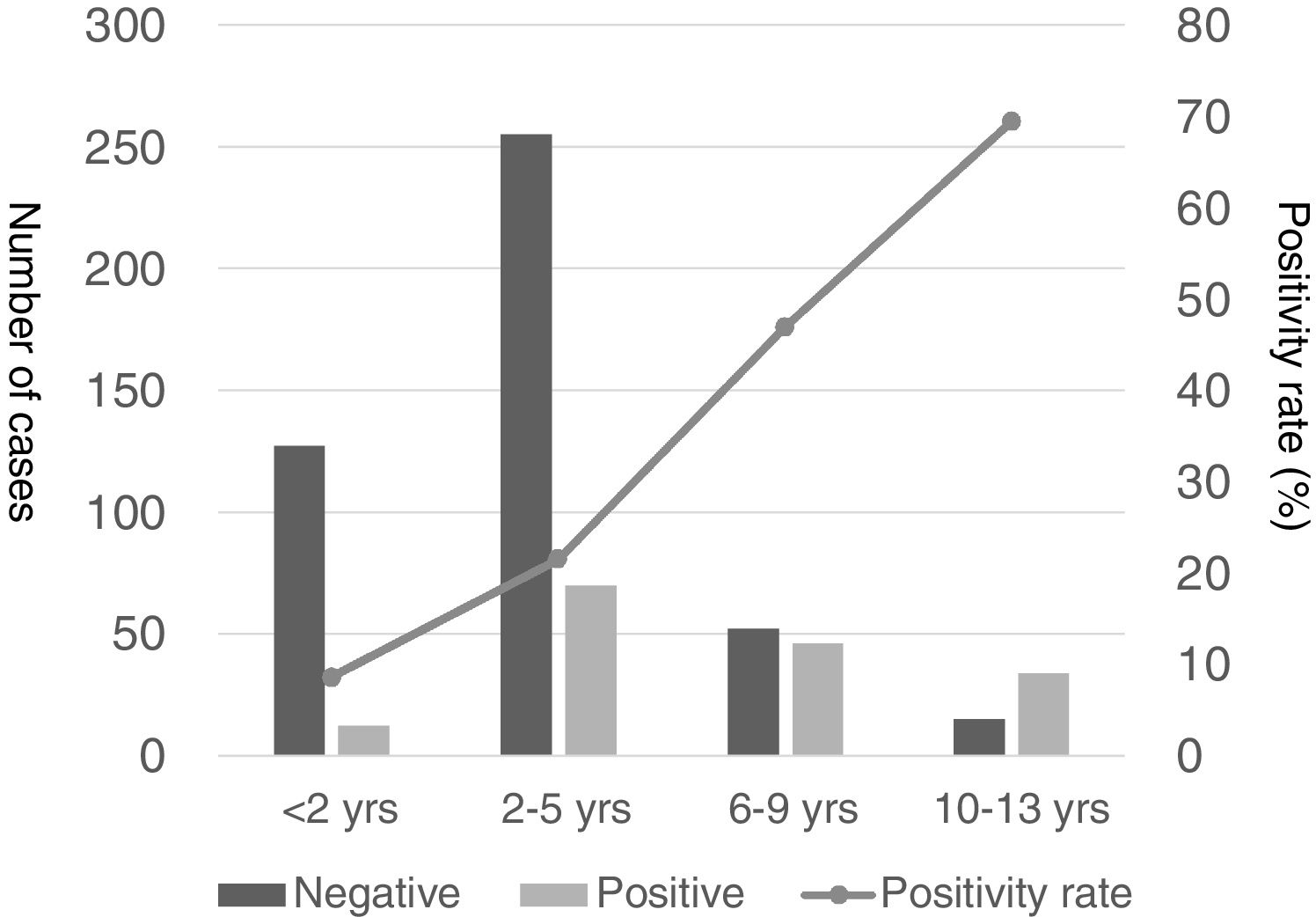
La tabla 1 muestra las características demográficas y clínicas, y los hallazgos de laboratorio en pacientes con NACM por grupo de edad. De los 162 pacientes, 32 (19,8%) reportaron antecedentes de asma o hiperreactividad bronquial.
Características demográficas, clínicas y de laboratorio en pacientes con NACM por grupos etarios
| <2a | 2-5a | 6-9a | 10-13a | Total | Valor de p | |
|---|---|---|---|---|---|---|
| n=12 (7,4%) | n=70 (43,2%) | n=46 (28,4%) | n=34 (21%) | n=162 (100%) | ||
| Datos demográficos | ||||||
| Tasa positividad | 8,6% | 21,5% | 46,9% | 69,4% | 26,5% | <0,001 |
| Sexo (mujer) | 3 (25,0%) | 35 (41,7%) | 27 (32,1%) | 19 (55,9) | 84 (51,9%) | NS |
| Sibilancias recurrentesa | 8 (66,7%) | 29 (41,4%) | 12 (26,1%) | 4 (14,8%) | 53 (32,7%) | 0,001 |
| Tratamiento | ||||||
| Empírico, macrólidob | 2 (16,7%) | 17 (24,3%) | 15 (32,6%) | 10 (29,4%) | 44 (28,2%) | NS |
| Empírico, β-lactámico | 8 (66,7%) | 22 (31,4%) | 12 (26,1%) | 7 (20,6%) | 49 (30,2%) | 0,024 |
| Empírico, β-lactámico+macrólido | 1 (8,3%) | 30 (42,9%) | 19 (41,3%) | 17 (50,0%) | 67 (41,4%) | NS |
| Corticoterapia sistémica | 4 (33,3%) | 12 (17,1%) | 1 (2,2%) | 1 (2,9%) | 18 (11,1%) | 0,002 |
| Oxigenoterapia | 3 (25,0%) | 17 (24,3%) | 2 (4,3%) | 1 (2,9%) | 23 (14,2%) | 0,003 |
| Ingreso | 9 (75,0%) | 35 (50,7%) | 13 (20,3%) | 7 (10,9%) | 64 (39,8%) | 0,001 |
| Estancia hospitalaria | 5 (3-6,7) | 3 (1,5-5,0) | 3 (2,0-3,5) | 2 (1,0-4,0) | 3 (2,0-5,0) | NS |
| Clínica | ||||||
| Derrame pleural | 1 (8,3%) | 11 (15,7%) | 7 (15,2%) | 3 (8,8%) | 22 (13,6%) | NS |
| Fiebre (°C) | 38,5(38,0-39,0) | 38,9(38,5-39,2) | 39(38,4-39,5) | 39,5(39-39,7) | 39(38,5-39,5) | 0,001 |
| Evolución fiebre (horas) | 84(33-120) | 96(39-144) | 96(48-144) | 144(96-168) | 96(48-144) | 0,01 |
| Analítica | ||||||
| Leucocitos (células/μl) | 11.550(9.500-16.775) | 11.200(9.525-13.950) | 9.450(7.650-12.250) | 8.300(7.000-9.600) | 10.200(8.000-12.900) | 0,005 |
| Neutrófilos (células/μl) | 6.200(2.600-10.150) | 7.900(5.225-11.725) | 6.150(4.500-9.700) | 5.600(4.600-7.000) | 6.400(4.850-9.950) | NS |
| Linfocitos (células/μl) | 4.800(3.625-5.125) | 2.300(1.625-3.200) | 1.850(1.500-2.100) | 1.500(1.100-1.900) | 2.000(1.450-2.950) | <0,001 |
| PCR (mg/dl) | 2,1 (1,3-3,9) | 3,4 (1,5-6,1) | 2,9 (1,6-6,1) | 3,2 (1,9-7) | 3 (1,5-6,0) | NS |
| PCT (ng/ml) | 0,7 (0,1-1,4) | 0,1 (0,1-0,1) | 0,1 (0,1-0,4) | 1,2 (0,0-2,4) | 0,1 (0,1-0,4) | NS |
Las diferencias estadísticamente significativas se presentan en negrita. Datos expresados como frecuencia absoluta y porcentaje o como mediana y rango intercuartílico.
a: años; PCR: proteína C reactiva; NS: no significativo; PCT: procalcitonina.
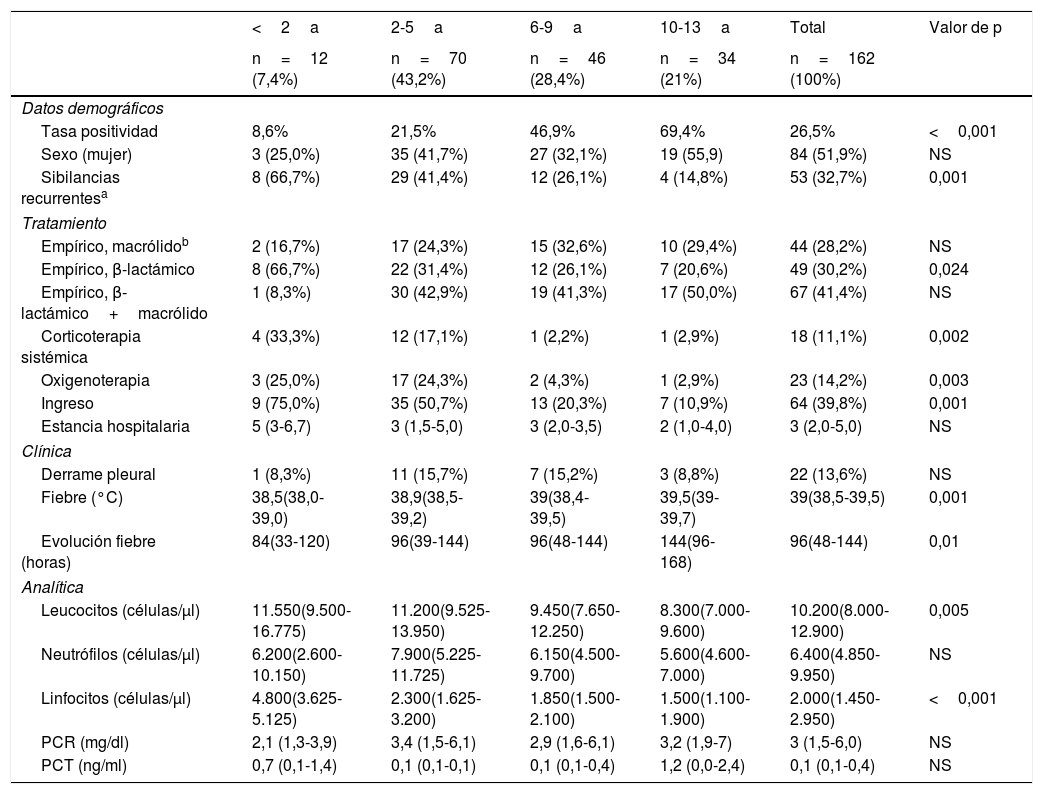
La proporción de resultados positivos para MP en pacientes con NAC aumentó progresivamente con la edad, con un resultado positivo en el 69,4% de los pacientes de edad superior a 9 años en comparación con el 8,6% de los niños menores de 2 años, el 21,5% de los de 2 a 5 años y el 46,9% de los de 6 a 9 años (fig. 1).
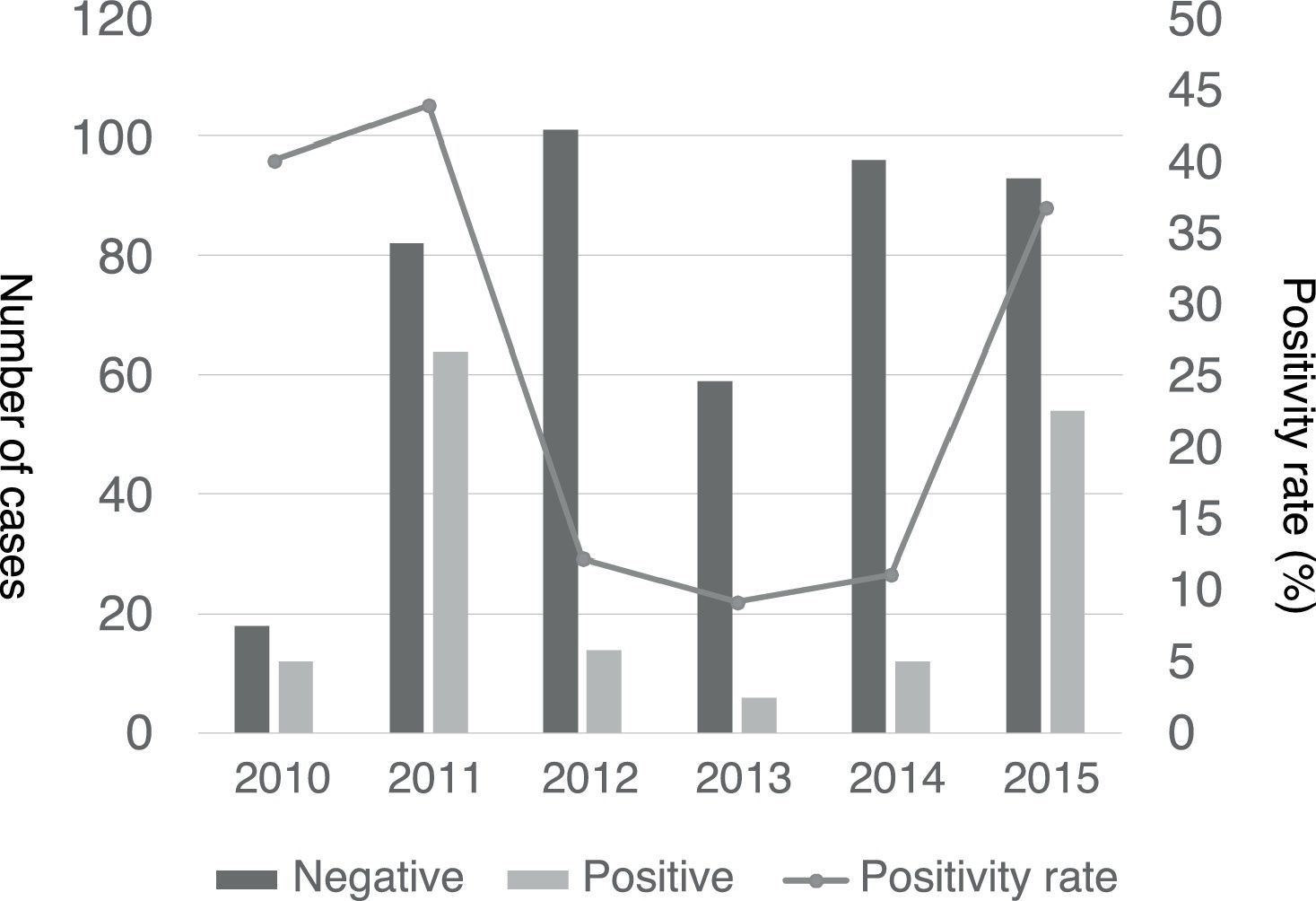
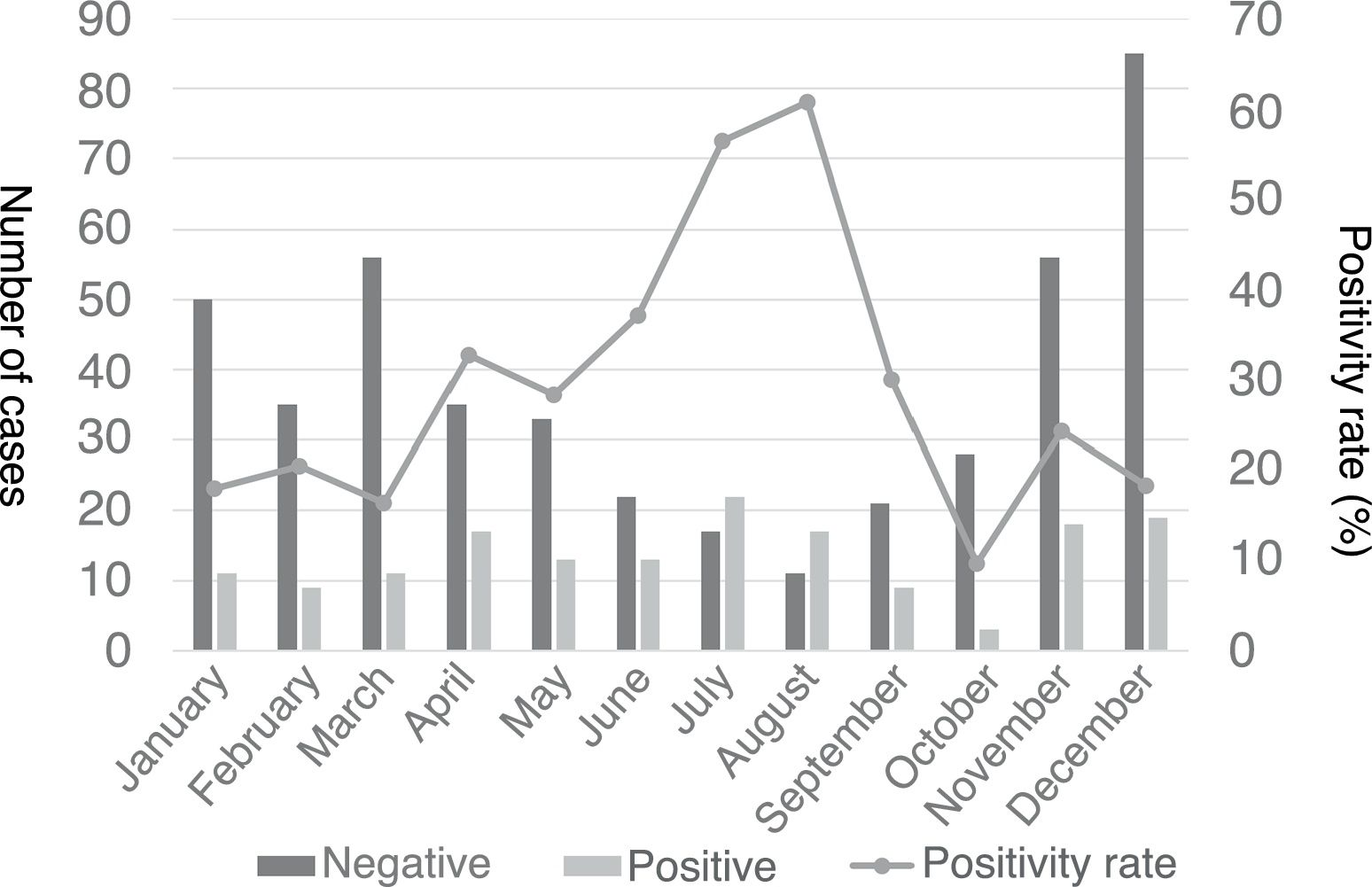
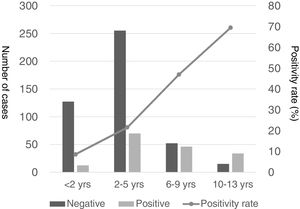
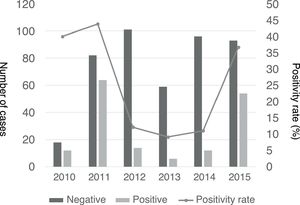
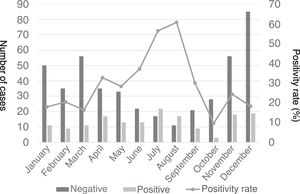
Se observó un pico de casos en 2011 y más adelante en 2015, con una incidencia 4 a 10 veces mayor en comparación con otros años (fig. 2). La distribución estacional de casos de NACM reveló mayor proporción de resultados positivos en verano en comparación con el resto de las estaciones (49,5% vs. 18% en invierno, 32,3% en primavera y 19,1% en otoño; p<0,05), con una asociación estadísticamente significativa con verano (OR=4,5; IC 95%: 26-7,8; p<0,001) y primavera (OR=2,2; IC 95%: 1,3-3,7; p=0,004) en comparación con el invierno. La figura 3 muestra la distribución de casos por meses del año.
Hubo un seguimiento en 154 de los 162 pacientes (95,1%): 120 (74,1%) por pediatría de atención primaria, 51 (31,5%) en las consultas externas del hospital y 96 (59,3%) durante el ingreso hospitalario. En varios pacientes el seguimiento tuvo lugar en más de un ámbito.
Otros patógenosSe realizaron pruebas para otros patógenos en 116 de los casos de NACM (71,6%). Se recogieron frotis nasofaríngeos para detección de virus respiratorios en 30/162 pacientes (18,5%) y para detección de Chlamydophila pneumoniae en 90/162 (55,6%), se obtuvieron muestras de sangre para cultivo en 21/162 (13,0%) y para serología frente a virus respiratorios durante la fase aguda de la infección en 10/162 (6,2%), y muestras de líquido pleural para cultivo en 4/162 (2,5%).
Hubo coinfección por MP y virus respiratorios en 7 de los 30 pacientes en los que se solicitó pruebas virológicas en frotis nasofaríngeo (23,3%) y coinfección por C. pneumoniae en uno de los 90 pacientes evaluados para esta bacteria (1,1%). En 2 niños se detectaron 3 virus diferentes y en otros 2 niños 2 virus diferentes. En el resto de los pacientes con coinfección viral se detectó un solo virus. El virus detectado con mayor frecuencia fue el virus respiratorio sincitial (4 casos), seguido de parainfluenza y virus influenza (en 2 pacientes cada uno). Además, se detectaron infecciones por adenovirus, rinovirus, metapneumovirus, bocavirus y coronavirus (cada uno en un paciente distinto). No hubo casos con aislamiento de patógenos en sangre o líquido pleural.
Presentación clínicaEl síntoma más frecuente en pacientes con NACM fue la tos (92,6%), seguido de fiebre (85,8%), rinorrea (45,1%), vómitos (26,5%), hiporexia (19,8%), exantema u otra manifestación cutánea (9,9%), dolor abdominal (5,6%), dolor de garganta (5,6%), diarrea (4,9%), cefalea (4,3%) y dolor torácico (2,5%). El exantema fue urticariforme en 9 pacientes, macular en 2, papular en uno y macular-petequial en otro. El resto de los pacientes con manifestaciones cutáneas fueron evaluados por un dermatólogo, diagnosticándose de eritema multiforme, reacción similar a la enfermedad del suero y pitiriasis liquenoide y varioliforme aguda, respectivamente.
Al compararse las manifestaciones por grupos etarios solo se observaron diferencias en la cefalea, que fue más frecuente en niños en edad escolar (10,9% vs. 5,9% en preadolescentes, sin casos en el resto de la cohorte; p=0,034), probablemente debido a la dificultad de su evaluación en niños más pequeños. La fiebre y su duración aumentaron con la edad (tabla 1).
Los ruidos respiratorios descritos con mayor frecuencia en la evaluación inicial en urgencias fueron los crepitantes, objetivados en 104/162 pacientes (64,2%), seguidos de hipoventilación en 82/162 (50,6%), sibilancias en 33/162 (20,4%) y roncus en 6/162 (3,7%), sin diferencias entre grupos de edad. La auscultación pulmonar fue normal en 22 pacientes (13,6%).
De los 162 pacientes con NACM, 53 (32,7%) presentaron sibilancias que requirieron tratamiento broncodilatador, con mayor frecuencia en niños pequeños (ver tabla 1) y en pacientes ingresados (48,4% en pacientes hospitalizados vs. 22,4% en los no ingresados; p=0,001). De los 53 pacientes con sibilancias, 18 (34%) requirieron corticoterapia sistémica, con la misma distribución por edad.
El hallazgo radiológico más común fue el infiltrado pulmonar segmentario (62,3%). Otros patrones menos frecuentes fueron el patrón intersticial (27,2%) y el lobar (13,0%). Se observó consolidación redonda en 7 casos (4,3%). Quince pacientes (9,3%) tuvieron afectación multilobar; 79 (48,8%) asociaron engrosamiento perihiliar y 5 (3,1%) atelectasia. Se evidenció derrame pleural en 22 pacientes (13,6%). El derrame fue pequeño en todos los casos (≤12mm), excepto en uno con tamaño de 28mm. Los pacientes con derrame pleural solo difirieron de aquellos sin derrame en el mayor porcentaje de hospitalización (44,4% vs. 67,6%; p=0,052) y una menor frecuencia de tratamiento empírico con macrólidos (48,6% vs. 18,2%; p=0,008). No se observaron diferencias significativas en los hallazgos radiológicos en función de la edad.
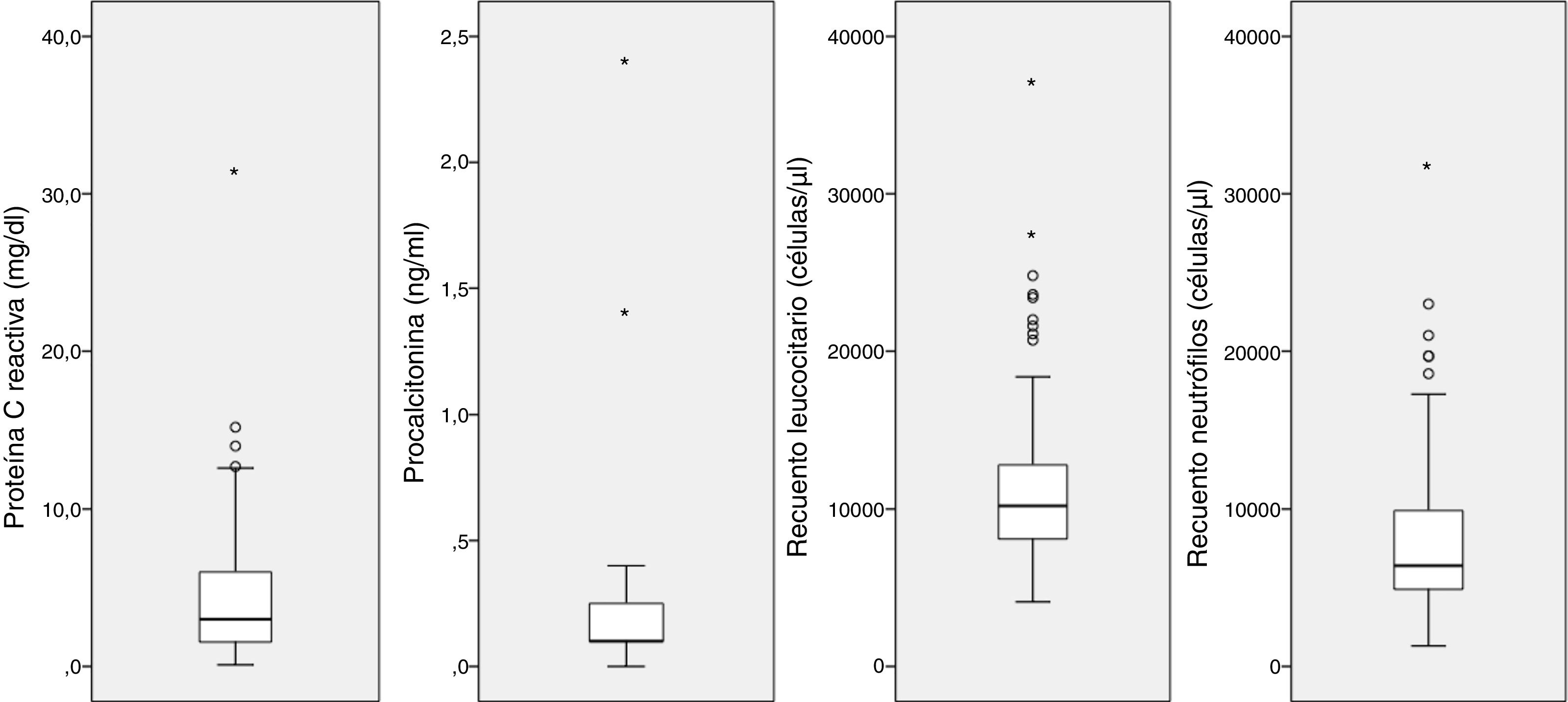
Hallazgos de laboratorioSe realizó recuento leucocitario en 105/162 pacientes con NACM (64,8%), determinación del nivel sérico de proteína C reactiva en 104 (64,2%) y de procalcitonina en 11 (0,7%). La figura 4 presenta una representación gráfica de los los reactantes de fase aguda en sangre. Cabe resaltar la escasa elevación de los parámetros inflamatorios, con las medianas de las siguientes determinaciones: leucocitos, 10.200 células/μl (RIC: 8000-12.900); neutrófilos 6.400células/μl (RIC: 4.850-9.950); proteína C reactiva 3mg/dl (RIC: 1,5-6); y procalcitonina 0,1 ng/ml (RIC: 0,1-0,4).
Los recuentos leucocitarios y linfocitarios fueron significativamente más altos en niños pequeños, lo que podría deberse al distinto rango de normalidad en este grupo etario, mientras que no hubo diferencias en el recuento de neutrófilos o en los niveles de proteína C reactiva o procalcitonina (tabla 1). No se encontraron diferencias significativas en las medianas de los parámetros inflamatorios en función de la presencia de derrame pleural o la necesidad de ingreso hospitalario.
TratamientoEl tratamiento empírico con macrólidos previo a la disponibilidad del resultado de la detección de MP fue más frecuente en pacientes de mayor edad (79,4% en el grupo de 10-13 años vs. 25% en niños<2 años; p=0,001), con un predominio de claritromicina (59,5%) frente a azitromicina en pacientes tratados con macrólidos. Dividiendo el seguimiento en 2 períodos, observamos que la azitromicina se empleó con más frecuencia en el segundo período (2013-2015) que en el primero (2010-2012): 91,5 de los macrólidos prescritos vs. 3,1% (p<0,001).
En 76 pacientes (46,9%) se había prescrito antibioterapia antes de la visita en la que se recogió la muestra para las pruebas de detección de MP: un betalactámico en 72 (44,4%), un macrólido en 3 (1,9%), y un betalactámico en combinación con un macrólido en un paciente (en todos los casos el macrólido fue claritromicina). Treinta y un pacientes (42,5%) habían sido diagnosticados de neumonía previamente durante el episodio. No se encontró una proporción mayor de prescripción de tratamiento empírico con macrólidos en el momento de la recogida de la muestra para detección de MP en pacientes que estaban siendo tratados con un betalactámico en monoterapia, ni en pacientes diagnosticados de neumonía los días previos.
El tratamiento empírico se modificó al obtenerse los resultados de las pruebas en 68 de los 162 pacientes (42%). El ajuste consistió en el cambio de un betalactámico a un macrólido en 21 de los 68 pacientes (30,9%), el paso de tratamiento combinado con un betalactámico y un macrólido a mantenimiento del macrólido en monoterapia en 26 (38,2%), y la adición de un macrólido a la antibioterapia con betalactámico en curso en 21 (31%). Siete pacientes (4,3%) fueron tratados con un betalactámico en monoterapia sin asociar un macrólido, con resolución de los síntomas.
Se ingresó a 64 pacientes (39,8%). La proporción de hospitalización fue superior en pacientes menores de 2 años. Veintitrés pacientes (14,2%) requirieron oxígeno suplementario, con una mayor proporción en niños pequeños. Tan solo hubo 3 niños que necesitaron ingresar en la unidad de cuidados intermedios, y ninguno requirió soporte ventilatorio. Ningún paciente requirió ingreso en la unidad de cuidados intensivos. Todos los pacientes presentaron resolución clínica y radiológica completa. De los pacientes con derrame pleural, solo uno (4,5%) requirió drenaje.
DiscusiónHasta la fecha, numerosos estudios han descrito las manifestaciones clínicas de la NACM en pacientes pediátricos hospitalizados6–13, pero, a nuestro conocer, el presente es uno de los estudios más amplios que describen las características de las NACM en la edad pediátrica, incluyendo pacientes ambulatorios. A pesar de su diseño retrospectivo, la gran proporción de pacientes de los que se obtuvieron datos de evolución nos permite establecer el curso clínico de esta enfermedad en una muestra representativa de la población general, y no solo de los pacientes que requieren ingreso.
Durante el periodo de estudio hubo 2 picos de incidencia: el primero en 2011 también descrito en otras poblaciones europeas14–16, y el segundo en 2015. Esto es consistente con el patrón epidémico cíclico de la NACM, por el que se sabe que existen brotes cada 4 a 7 años. Aún no se conoce bien la razón de este patrón. Es posible que el declive de la inmunidad de grupo y los cambios en los genotipos circulantes de MP en la población faciliten la aparición de brotes4.
La prevalencia estacional varía en función de la población bajo estudio. En países con climas templados los brotes de infección por MP suelen tener lugar en verano o a principios de otoño, cuando otros patógenos respiratorios son menos prevalentes9. En nuestra muestra la mayor proporción de casos positivos para MP correspondió al verano. No obstante, hubo picos de incidencia en julio, noviembre y diciembre. La mayor incidencia de infecciones respiratorias en noviembre y diciembre, combinada con una relativa menor de infecciones por MP, podría explicar el mayor número de casos de NAC con menor proporción relativa de casos positivos para MP en estos meses.
Aunque, teóricamente, MP es un patógeno que infecta preferentemente a niños en edad escolar, encontramos el mayor número de casos en el grupo de 2 a 5 años de edad. La mayoría de los estudios en la literatura médica han descrito picos en el grupo de 5 a 9 años de edad8,9,12,17. El porcentaje de positividad en niños con infecciones de vías bajas y su distribución por edad fue similar a lo reportado en un estudio unicéntrico reciente realizado en Dinamarca18. Un estudio poblacional multicéntrico de las NAC en niños, llevado a cabo en Estados Unidos, encontró una distribución relativamente homogénea de casos de MP por grupos de edad, aunque la proporción del total de casos de neumonía asociados a MP aumentó de manera sostenida con la edad2. Esto es similar a lo observado en nuestra muestra, con un porcentaje de positividad más alto en pacientes de mayor edad. En consecuencia, el tratamiento empírico de la NAC con un macrólido podría contemplarse en niños mayores y las pruebas de detección de MP reservarse para niños más pequeños, ya que la detección de MP podría conllevar cambios en el tratamiento.
Aunque las guías actuales recomiendan el uso de la PCR y la serología en una muestra única para el diagnóstico de infección por MP19,20, el gold standard diagnóstico continua siendo un aumento de al menos 4 veces en el título de anticuerpos determinado en muestras séricas pareadas21. Esta estrategia presenta inconvenientes en la práctica clínica, ya que dificulta la toma de decisiones con respecto a la instauración de tratamiento y puede que su utilidad se limite a la confirmación retrospectiva del diagnóstico. El desarrollo de la PCR ha sido revolucionario en este sentido. Los datos de nuestro estudio muestran un desplazamiento claro del uso de métodos serológicos por el uso de la PCR para el diagnóstico. No obstante, quedan cuestiones sin resolver, como, por ejemplo, la presencia de portadores asintomáticos, descrita en niños, que complica la interpretación de los resultados de la PCR22.
También observamos cambios en el uso de la claritromicina, que se vio desplazada por la azitromicina en el segundo período (91,5% vs. 3,1% porcentaje de prescripciones de azitromicina del total de prescripciones de macrólidos), un tratamiento que resulta más cómodo. De hecho, las guías norteamericanas de 2011 recomiendan la azitromicina como antibiótico de elección19.
Los hallazgos de laboratorio asociados a la NACM fueron remarcables. Cabe destacar la escasa elevación de la proteína C reactiva, con niveles similares a los reportados en otros estudios9,17,23. El principal motivo de preocupación al tratar a un niño con NACM con un macrólido en monoterapia es la posibilidad de coinfección por S. pneumoniae y la resistencia a antimicrobianos asociada a este patógeno. Un artículo publicado por Chiu et al. reportó niveles más altos de proteína C reactiva en los casos de MP con coinfección por S. pneumoniae en comparación con los casos de monoinfección por MP (66,5±24,0mg/l vs. 296,1±114,3mg/l; p<0,01)12. En nuestra población estudiada solo se detectó un caso de coinfección bacteriana (por C. pneumoniae). Otros autores han descrito proporciones de coinfección bacteriana de hasta el 2% en pacientes con NACM24. Esta diferencia puede deberse a varios motivos: la epidemiología local, influenciada por la cobertura vacunal, el ámbito de estudio de la muestra, el tipo de muestras analizadas o los criterios microbiológicos empleados en la definición de caso.
Nuestro estudio encontró diferencias en la presentación clínica entre grupos etarios. Las sibilancias asociadas a NACM fueron significativamente más frecuentes en niños más pequeños, aunque nuestros hallazgos están limitados por el escaso número de pacientes en los que se realizaron pruebas para detectar coinfecciones virales. En cualquier caso, el análisis estratificado de los pacientes en los que se realizaron pruebas de detección viral en muestras de frotis nasofaríngeo encontró una prevalencia mayor de sibilancias en pacientes con coinfección viral, aunque la diferencia no fue significativa (71,4% vs. 56,5%; p=0,481). La fiebre más elevada se observó en niños de mayor edad, en los que el diagnóstico se realizó tras un tiempo más prolongado de evolución de la misma. Entre los pacientes diagnosticados de NACM, el 14,2% se encontraba afebril en el momento del diagnóstico. Esto es similar a lo observado en un estudio de 257 neumonías neumocócicas en niños, de los que el 10% no presentó fiebre25.
Al contrario que otros estudios que encontraron que la diarrea, los vómitos y la afección de las vías aéreas superiores son más prevalentes en niños pequeños con NACM9,17, no encontramos diferencias en estas variables. Hasta el 25% de las infecciones por MP cursan con manifestaciones cutáneas4. En nuestro estudio, uno de cada 10 pacientes con NACM presentó exantema.
Algunos estudios han encontrado diferencias en la presentación clínica de los niños con NACM y coinfección viral12,13. En nuestra muestra, el análisis de los pacientes en los que se realizaron pruebas de detección de virus respiratorios en frotis nasofaríngeo mostró que, en comparación con los pacientes con resultados negativos, los pacientes con coinfección viral tienden a ser más jóvenes (mediana de edad 2,6 vs. 5,1 años; p=0,033) e ingresar en el hospital en una proporción mayor (100% vs. 60,9%; p=0,048).
Existen dudas sobre la necesidad de tratamiento en la NACM26,27. En nuestra muestra, casi todos los pacientes recibieron un macrólido antes o después de conocerse los resultados de las pruebas de detección de MP. Una revisión Cochrane previa21 concluyó que no hay suficiente evidencia sobre la eficacia de la antibioterapia en el tratamiento de infecciones de vías respiratorias bajas asociadas a MP en niños.
Nuestro estudio presenta algunas limitaciones. En primer lugar, un resultado positivo de la PCR o la serología no descarta la posibilidad de una infección pasada o la presencia de coinfección, limitación común en otros estudios similares7–12. No obstante, su evaluación nos permitió describir el manejo de estas infecciones en la práctica clínica habitual con las pruebas disponibles en la fase aguda de la enfermedad, y el seguimiento y tratamiento elegidos en función de sus resultados. Al mismo tiempo, la naturaleza retrospectiva del estudio impidió la recogida en todos los pacientes de muestras para evaluar coinfecciones por otros patógenos o describir en todos los casos la evolución de la enfermedad. Por último, al no realizarse rutinariamente un estudio de sensibilidad a los macrólidos, no fue posible establecer la tasa de resistencia a antimicrobianos en nuestra muestra. Dato interesante, ya que es bien conocido que la circulación de cepas resistentes a macrólidos ha aumentado en todo el mundo28–30.
Para concluir, basándonos en el presente estudio, los niños con NAC de mayor edad tienen la mayor proporción de infección por MP, siendo poco sintomáticos y con escasa elevación de parámetros inflamatorios, pudiéndose beneficiar del tratamiento empírico con macrólidos. Por consiguiente, conocer la epidemiología en un área geográfica podría ser importante para el abordaje de las NAC en niños.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Martin J. Smyth, por su ayuda en la revisión del manuscrito en inglés.
Presentaciones previas: 35.° Congreso Anual de la Sociedad Europea de Infectología Pediátrica, abril de 2017, Madrid, España; y viii Congreso de la Sociedad Española de Infectología Pediátrica, marzo de 2016, Valencia, España.