Tras la revisión de la mejor información científica disponible, el CAV-AEP publica las nuevas recomendaciones para proteger con vacunas a las embarazadas, los niños y los adolescentes residentes en España.
Se mantienen las mismas recomendaciones que el año anterior en cuanto a las vacunas hexavalentes y a la vacuna neumocócica conjugada de 13 serotipos, al refuerzo con tétanos, difteria, tosferina y poliomielitis inactivada (Tdpa-VPI) a los seis años y con tétanos, difteria y tosferina (Tdpa) a los 12-14 años y a las embarazadas a partir de la semana 27 (desde la semana 20 si hay alto riesgo de parto pretérmino).
Lo mismo sucede con las vacunas del rotavirus, del meningococo B tetraantigénica (2 + 1), de la vacuna meningocócica tetravalente (MenACWY), de la triple vírica, de la varicela y de la vacuna del virus del papiloma humano (VPH), en ambos géneros.
Como novedades este año el CAV-AEP recomienda:
La vacunación antigripal de seis a 59 meses de edad siempre que sea factible y no perjudique al programa vacunal dirigido a las personas de mayor riesgo.
En consonancia con las recomendaciones oficiales nacionales, el CAV-AEP recomienda el uso sistemático a partir de los 5 años de las vacunas para la COVID-19 de ARNm.
After reviewing the best available scientific information, CAV-AEP publishes their new recommendations to protect pregnant women, children and adolescents living in Spain through vaccination.
The same recommendations as the previous year regarding hexavalent vaccines, pneumococcal conjugate vaccine of 13 serotypes, booster with tetanus, diphtheria, pertussis and inactivated poliomyelitis (Tdpa-IPV) at 6 years and with tetanus, diphtheria and pertussis (Tdpa) at 12–14 years and pregnant women from week 27 (from week 20 if there is a high risk of preterm delivery).
Also with rotavirus, tetraantigenic meningococcal B (2+1), meningococcal quadrivalent (MenACWY), MMR, varicella and human papillomavirus (HPV) vaccines, for both genders.
As novelties this year the CAV-AEP recommends:.
Influenza vaccination from 6 to 59 months of age whenever feasible and does not harm the vaccination program aimed at people at higher risk.
According to official national recommendations, the CAV-AEP recommends the systematic use of COVID mRNA vaccines since 5 years old.
Tras un año en el que se ha comprobado el inmenso valor de las vacunas en términos de salud, el Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) renueva sus recomendaciones anuales de vacunación para el embarazo, infancia y adolescencia. Estas emanan del consenso y revisión de toda información relevante disponible (fig. 1). El fundamento puede consultarse en la web del CAV-AEP (www.vacunasaep.org), y más detalladamente en su manual de vacunas en línea (https://vacunasaep.org/documentos/manual/manual-de-vacunas). En la tabla 1 aparecen las vacunas comercializadas en España.
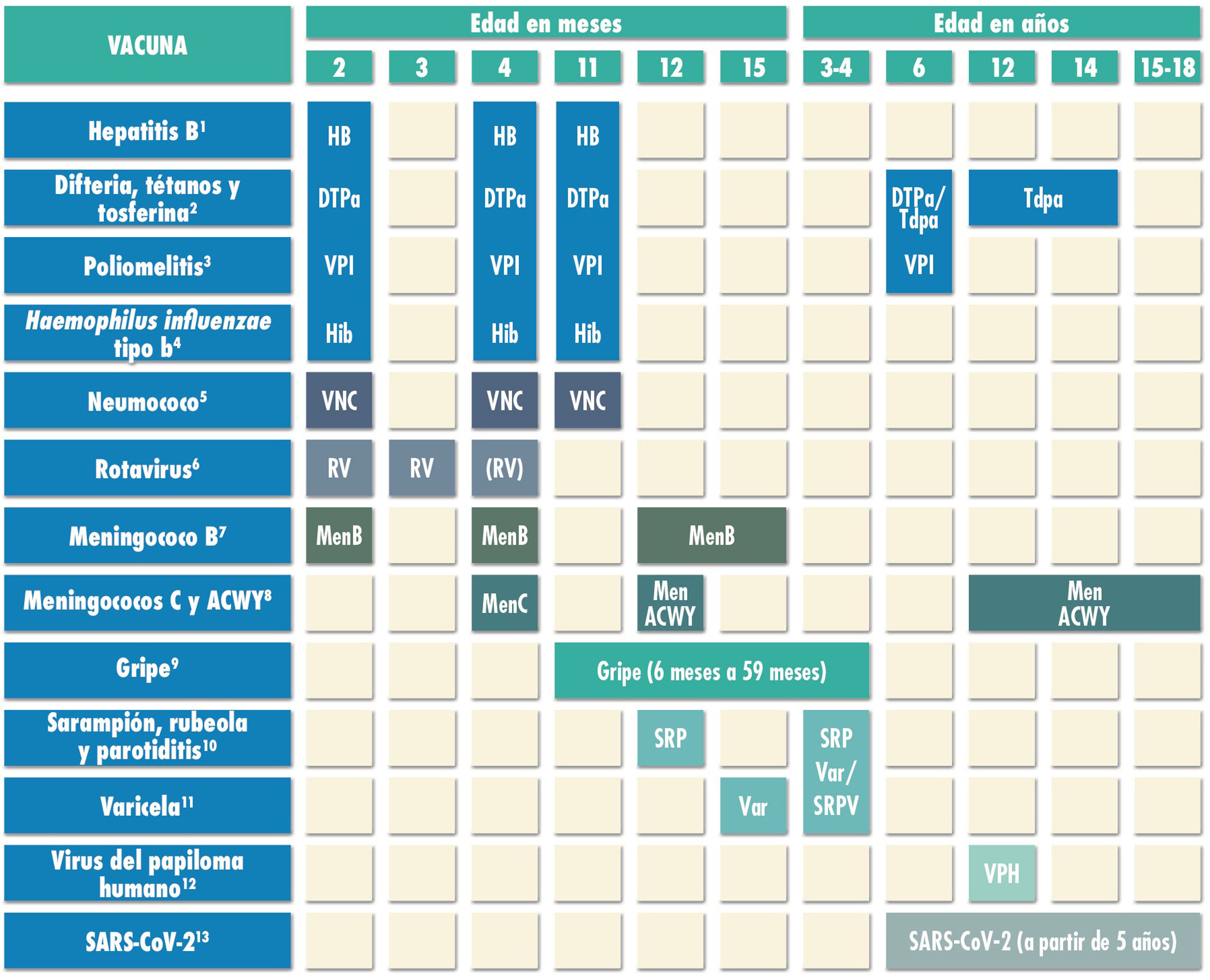
Calendario de vacunaciones sistemáticas de la Asociación Española de Pediatría 2022.
(1) Vacuna antihepatitis B (HB). Tres dosis, en forma de vacuna hexavalente, a los 2, 4 y 11 meses de edad. Los hijos de madres HBsAg positivas o con serología desconocida recibirán, además al nacimiento, una dosis de vacuna HB monocomponente junto con 0,5 mL de inmunoglobulina antihepatitis B (IGHB) si se confirma que el HBsAg materno es positivo. Los lactantes vacunados al nacimiento seguirán el calendario habitual del primer año, por lo que recibirán cuatro dosis de HB. A los niños y adolescentes no vacunados se les administrarán tres dosis de vacuna monocomponente según la pauta 0, 1 y 6 meses.
(2) Vacuna frente a la difteria, el tétanos y la tosferina (DTPa/Tdpa). Cinco dosis: primovacunación con dos dosis, a los 2 y 4 meses, de vacuna DTPa-VPI-Hib-HB (hexavalente); refuerzo a los 11 meses (3.ª dosis) con DTPa (hexavalente); a los seis años (4.ª dosis) con el preparado de carga estándar (DTPa-VPI), preferible al de baja carga antigénica de difteria y tosferina (Tdpa-VPI) y a los 12-14 años (5.ª dosis) con Tdpa. En los casos vacunados anteriormente con la pauta 3 + 1 (2, 4, 6 y 18 meses), en la dosis de los seis años se podrá utilizar Tdpa, ya que no precisan nuevas dosis de vacuna frente a la poliomielitis.
(3) Vacuna antipoliomielítica inactivada (VPI). Cuatro dosis: primovacunación con dos dosis, a los 2 y 4 meses, y refuerzos a los 11 meses (con hexavalentes) y a los seis años (con DTPa-VPI o Tdpa-VPI). En los casos vacunados anteriormente con la pauta 3 + 1 (2, 4, 6 y 18 meses), no se precisan más dosis de VPI.
(4) Vacuna conjugada frente al Haemophilus influenzae tipo b (Hib). Tres dosis: primovacunación a los 2 y 4 meses y refuerzo a los 11 meses con hexavalentes.
(5) Vacuna conjugada frente al neumococo (VNC). Tres dosis: las dos primeras a los 2 y 4 meses, con un refuerzo a partir de los 11 meses de edad. La vacuna recomendada en nuestro país, por el CAV-AEP, sigue siendo la VNC13.
(6) Vacuna frente al rotavirus (RV). Dos o tres dosis de vacuna frente al rotavirus: a los 2 y 3-4 meses con la vacuna monovalente o a los 2, 3 y 4 meses o 2, 3-4 y 5-6 meses con la pentavalente. La pauta ha de iniciarse entre las 6 y las 12 semanas de vida (es muy importante para minimizar riesgos) y debe completarse antes de las 24 semanas en la monovalente y de las 32 en la pentavalente. El intervalo mínimo entre dosis es de cuatro semanas. Ambas vacunas se pueden coadministrar con cualquier otra.
(7) Vacuna frente al meningococo B (MenB). 4CMenB. Tres dosis: se iniciará a los 2 meses de edad, con dos dosis separadas por 2 meses y un refuerzo a partir de los 12 meses, siempre que hayan pasado, al menos, 6 meses de la última dosis de primoinmunización. Se puede coadministrar con las otras vacunas del calendario, aunque podría producir fiebre con mayor frecuencia; por lo que, hasta los 12 meses, también se podría aplicar con una separación de 1 o 2 semanas con las otras vacunas inactivadas inyectables para minimizar su posible reactogenicidad. No es necesaria la separación de 1 o 2 semanas con las vacunas MenACWY, triple vírica, varicela y rotavirus. También se recomienda a cualquier edad en grupos de riesgo: asplenia anatómica o funcional, déficit de factores del complemento, tratamiento con eculizumab o ravulizumab, receptores de trasplante de progenitores hematopoyéticos, infección por VIH, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo B en el contexto de un brote epidémico.
(8) Vacuna conjugada frente al meningococo C (MenC) y vacuna frente a los meningococos ACWY (MenACWY). Una dosis de vacuna conjugada MenC-TT a los 4 meses de edad. A los 12 meses y a los 12-14 años se recomienda una dosis de la vacuna MenACWY, aconsejándose un rescate progresivo hasta los 18 años. En CC. AA. donde no está incluida la vacuna a los 12 meses en calendario sistemático, si los padres deciden no administrar MenACWY, deberá aplicarse la MenC-TT financiada por su comunidad. También se sigue recomendando especialmente MenACWY para niños y adolescentes que vayan a residir en países en los que la vacuna se indique a esa edad (Canadá, EE. UU., Argentina, Brasil, Australia, Arabia Saudí, Austria, Bélgica, Grecia, Holanda, Irlanda, Italia, Malta, Reino Unido, San Marino y Suiza) y para los que tengan factores de riesgo de EMI: asplenia anatómica o funcional, déficit de factores del complemento, tratamiento con eculizumab o ravulizumab, receptores de trasplante de progenitores hematopoyéticos, infección por VIH, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo A, C, W o Y en el contexto de un brote epidémico. Los viajeros a La Meca, por razones religiosas, y al llamado cinturón de la meningitis africano durante la estación seca deben recibir también MenACWY.
(9) Vacuna frente a la gripe. Se recomienda esta vacunación para todos los niños de 6 a 59 meses de edad con vacunas inactivadas parenterales y a partir de los 2 años, si está disponible, también se podría utilizar la vacuna atenuada intranasal. Si es la primera vez que la reciben se aplicarán dos dosis separadas por 4 semanas, como todos los niños menores de 9 años. Posteriormente precisarán una sola dosis para el resto de las campañas. La dosis es de 0,5 mL en las inactivadas y de 0,1 mL en cada fosa nasal para la atenuada. Para consultar los grupos de riesgo de esta vacuna se puede acceder al manual de vacunas en línea (https://vacunasaep.org/documentos/manual/manual-de-vacunas).
(10) Vacuna frente al sarampión, la rubeola y la parotiditis (SRP). Dos dosis de vacuna sarampión, rubeola, y parotiditis (triple vírica). La 1.ª a los 12 meses y la 2.ª a los 3-4 años de edad. La 2.ª dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, vacunación con dos dosis de SRP con un intervalo de, al menos, un mes.
(11) Vacuna frente a la varicela (Var). Dos dosis: la 1.ª a los 15 meses (también es aceptable a los 12 meses de edad) y la 2.ª a los 3-4 años de edad. La 2.ª dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, vacunación con dos dosis de vacuna monocomponente con un intervalo de, al menos, un mes.
(12) Vacuna frente al virus del papiloma humano (VPH). Vacunación sistemática universal frente al VPH, tanto de chicas como de chicos, a los 12 años, con dos dosis. Las vacunas disponibles en la actualidad son VPH2 y VPH9. Las dos están autorizadas en varones, aunque con VPH2 es aún escasa la experiencia en ellos. Pautas de vacunación según el preparado vacunal: la bivalente y la nonavalente con pauta de dos dosis (0 y 6 meses) entre 9 y 14 años y pauta de tres dosis [0,1-2 (según preparado vacunal) y 6 meses] para ≥ 15 años. Es posible su coadministración con las vacunas MenC, MenACWY, hepatitis A y B y Tdpa. No hay datos de coadministración con la vacuna de la varicela, aunque no debería plantear problemas.
(13) Vacuna frente al SARS-CoV-2. Actualmente están autorizadas dos vacunas en nuestro país a partir de los 12 años, Comirnaty-30 microgr (Pfizer) y Spikevax-100 microgr (Moderna) y otra entre 5 y 11 años con otra presentación con menor cantidad de antígeno (Comirnaty-10 microgr). Se aplicarán dos dosis separadas por tres semanas en la primera y en la tercera y por cuatro semanas en la segunda. La Comisión de Salud Pública de España ha decidido que la separación entre las 2 dosis de Comirnaty 10 mcgr sea de 8 semanas, pero si se administra a partir de los 21 días sería válida. Se pueden administrar con otras vacunas el mismo día o con la separación que se desee.
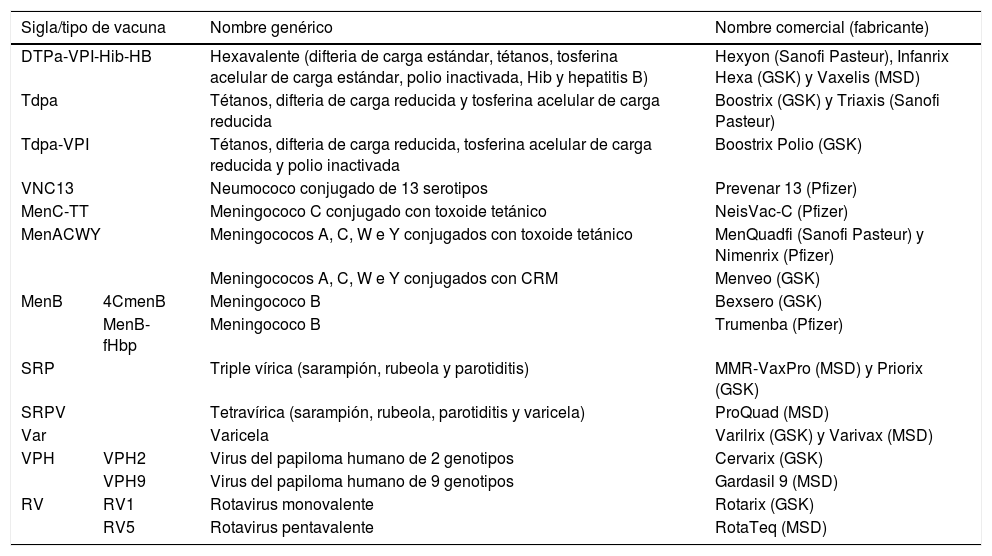
Siglas, nombres genéricos y comerciales de las vacunas sistemáticas recomendadas por el CAV-AEP disponibles actualmente en España
| Sigla/tipo de vacuna | Nombre genérico | Nombre comercial (fabricante) | |
|---|---|---|---|
| DTPa-VPI-Hib-HB | Hexavalente (difteria de carga estándar, tétanos, tosferina acelular de carga estándar, polio inactivada, Hib y hepatitis B) | Hexyon (Sanofi Pasteur), Infanrix Hexa (GSK) y Vaxelis (MSD) | |
| Tdpa | Tétanos, difteria de carga reducida y tosferina acelular de carga reducida | Boostrix (GSK) y Triaxis (Sanofi Pasteur) | |
| Tdpa-VPI | Tétanos, difteria de carga reducida, tosferina acelular de carga reducida y polio inactivada | Boostrix Polio (GSK) | |
| VNC13 | Neumococo conjugado de 13 serotipos | Prevenar 13 (Pfizer) | |
| MenC-TT | Meningococo C conjugado con toxoide tetánico | NeisVac-C (Pfizer) | |
| MenACWY | Meningococos A, C, W e Y conjugados con toxoide tetánico | MenQuadfi (Sanofi Pasteur) y Nimenrix (Pfizer) | |
| Meningococos A, C, W e Y conjugados con CRM | Menveo (GSK) | ||
| MenB | 4CmenB | Meningococo B | Bexsero (GSK) |
| MenB-fHbp | Meningococo B | Trumenba (Pfizer) | |
| SRP | Triple vírica (sarampión, rubeola y parotiditis) | MMR-VaxPro (MSD) y Priorix (GSK) | |
| SRPV | Tetravírica (sarampión, rubeola, parotiditis y varicela) | ProQuad (MSD) | |
| Var | Varicela | Varilrix (GSK) y Varivax (MSD) | |
| VPH | VPH2 | Virus del papiloma humano de 2 genotipos | Cervarix (GSK) |
| VPH9 | Virus del papiloma humano de 9 genotipos | Gardasil 9 (MSD) | |
| RV | RV1 | Rotavirus monovalente | Rotarix (GSK) |
| RV5 | Rotavirus pentavalente | RotaTeq (MSD) | |
El CAV-AEP, a través de sus documentos, busca informar de una manera práctica sobre las vacunas indicadas en infancia y juventud, basándose en la realidad epidemiológica de nuestro país y aboga por un cambio en el paradigma de las valoraciones farmacoeconómicas clásicamente aplicadas a vacunas infantiles. En la tabla 2 se muestran las fuentes de información y estrategias de búsqueda bibliográfica del documento.
Fuentes de información y estrategias de búsqueda bibliográfica del documento
| - TripDatabase: Búsqueda avanzada: (disease) (vaccine) (vaccination) |
| - Cochrane Library: Disease AND vaccine |
| - MEDLINE/PubMed: («disease/microorganism» [MeSH Terms]) AND («vaccine» [MeSH Terms] OR «vaccination» [MeSH Terms]). Filters activated: Child birth-18 years, Human (Sort by: Best Match) |
| - EMBASE: «disease»/exp AND «vaccine»/exp |
| - Webs oficiales del Ministerio de Sanidad y el Instituto de Salud Carlos III |
| - Páginas web de agencias reguladoras de medicamentos: Agencia Española de Medicamentos y Productos Sanitarios y European Medicines Agency |
| - CAV-AEP. Fichas técnicas |
| - Organismos gubernamentales o consultivos internacionales relacionados con la política vacunal: ACIP (EE. UU.), JCVI (RU), STIKO (Alemania), Public Health Agency of Canada, Australian Department of Health |
| - Comunicaciones y ponencias en congresos nacionales e internacionales |
| - Fuentes primarias (libros de texto, bibliografía de artículos seleccionados en la búsqueda) |
| - Datos cedidos directamente por los autores (no publicados) |
| - Publicaciones no indexadas en bases de datos |
| - Información procedente de la industria farmacéutica |
Un calendario de vacunaciones único en España redundaría en un beneficio igualitario para los niños, por lo que el CAV-AEP se posiciona ante la sociedad y la autoridad sanitaria para lograr este objetivo próximamente. Este comité hace hincapié en la necesidad urgente de reforzar la atención primaria como pieza clave para obtener coberturas vacunales óptimas (amenazadas por la pandemia COVID-19). Las desigualdades en el acceso a vacunas podrían salvarse con intervenciones específicas, dirigidas a poblaciones socialmente vulnerables, implementación de fórmulas de cofinanciación de preparados no incluidos en calendarios oficiales o utilización de canales de acceso global a información veraz sobre vacunas.
Como consecuencia de la pandemia y de la irrupción de vacunas contra la COVID-19, representantes del CAV-AEP han jugado un papel protagonista en los mensajes lanzados a la sociedad por el Ministerio de Sanidad y otras sociedades científicas, lo cual representa un avance en la participación de los pediatras en el diseño de la estrategia nacional de vacunación, tal y como recomienda la Organización Mundial de la Salud (OMS) y hacen otros países de nuestro entorno.
En este documento se exponen las recomendaciones de vacunación y se destacan las modificaciones realizadas.
Vacunación frente a hepatitis BRecomendación 2022:Tres dosis de vacuna hexavalente a los 2, 4 y 11 meses de edad.
La hepatitis B es una infección de distribución mundial. España es un país de baja endemicidad, con una prevalencia de HBsAg entre 0,2-0,5%, de anti-HBs de 4-6% y con infección neonatal e infección infantil infrecuentes1.
La pauta vacunal completa genera anticuerpos que confieren niveles protectores superiores al 95% en lactantes, niños y adultos jóvenes (https://www.who.int/es/news-room/fact-sheets/detail/hepatitis-b).
La vacunación de lactantes requiere de tres dosis en forma de vacuna hexavalente (2, 4 y 11 meses de edad). En el supuesto de riesgo de transmisión vertical del virus de hepatitis B (VHB) [hijos de madres HBsAg(+)], recibirán al nacimiento una dosis de vacuna HB monocomponente junto con 0,5 mL de inmunoglobulina específica antihepatitis B (IGHB) en las primeras 12 horas de vida. Se completará la vacunación, según calendario, hasta un total de cuatro dosis.
El intervalo mínimo recomendado entre primera y segunda dosis es de cuatro semanas, y entre segunda y tercera de ocho semanas. Retrasar la administración de la dosis final a los 11-12 meses asocia mayor inmunogenicidad2.
En niños y adolescentes no vacunados se administrará, a cualquier edad, tres dosis de vacuna monocomponente (o combinada con hepatitis A si existe indicación), con pauta 0, 1 y 6 meses.
Vacunación frente a difteria, tétanos, tosferina, poliomielitis y Haemophilus Influenzae tipo bRecomendación 2022: Esquema 2 + 1 con hexavalentes (DTPa-VPI-Hib-HB) a los 2, 4 y 11 meses; a los seis años con difteria, tétanos, tosferina de carga estándar + poliomielitis inactivada (DTPa-VPI), preferiblemente, o con tétanos, difteria y tosferina de carga reducida + VPI (Tdpa-VPI), y Tdpa a los 12-14 años. Es posible adelantar la primera dosis a las seis semanas de vida. Se recomienda Tdpa, en cada embarazo, preferentemente entre la 27 y 32 semana de gestación, lo más precozmente posible. Si la probabilidad de parto pretérmino es alta, se podría vacunar a partir de las 20 semanas.
El esquema 2 + 1 con vacunas hexavalentes es seguro y eficaz. Se implementó en España en 2016 y requiere una cuarta dosis de VPI a los seis años para completar la vacunación de poliomielitis; se recomienda aplicar DTPa-VPI, pero si no está disponible o el niño es mayor de siete años se utilizará Tdpa-VPI. En la adolescencia se aplica la quinta dosis de Tdpa, completando el esquema recomendado hasta los 60-65 años y se refuerza la protección frente a tosferina en adolescentes, que la padecen y transmiten, debido a que, ni la vacunación, ni la enfermedad natural, confieren inmunidad duradera.
La tosferina afecta a personas de todas las edades, pero el riesgo de enfermedad grave o muerte es mayor en lactantes pequeños. La vacunación en el embarazo es una estrategia eficaz para prevenir y disminuir la gravedad de enfermedad del lactante3. Kandeil en un estudio mundial comunica una efectividad del 69-93% para prevenir tosferina y del 90,5% para evitar la hospitalización en < 3 meses4.
El momento óptimo del embarazo para vacunar y el efecto del bloqueo (blunting) –existencia de los anticuerpos de transferencia materna que se relaciona con una menor respuesta a la primovacunación– en hijos de mujeres vacunadas son cuestiones en debate5. La efectividad vacunal no parece diferir si se vacuna en el segundo o tercer trimestre y aunque puede existir el bloqueo comentado, tras el refuerzo de tosferina de los 11 meses no se evidencian diferencias con hijos de mujeres no vacunadas. Aunque los beneficios de la vacunación maternal se prolongan más allá de los tres meses, no se justifica retrasar la primovacunación para evitar el bloqueo comentado, ya que la demora afecta a otros inmunógenos incluidos en la hexavalente.
Vacunación frente al neumococoRecomendación 2022:Vacunación antineumocócica con vacuna tridecavalente (VNC13) a todos los menores de cinco años y a cualquier edad en los grupos de riesgo. Para la vacunación sistemática del lactante sano, se recomienda el esquema 2 + 1 (2, 4 y 11 meses).
Las vacunas neumocócicas conjugadas (VNC) protegen tanto frente a enfermedad neumocócica invasora (ENI) como frente a no invasora (neumonía y otitis media aguda)6. Además, disminuyen las resistencias y el uso de antibióticos7. En España, la vacunación sistemática infantil ha reducido significativamente la carga de ENI, tanto en niños como en adultos8.
Tras el empleo de las VNC, se documentó un aumento de serotipos no vacunales (SNV)9. Esto ha ocasionado el desarrollo de vacunas incorporando un mayor número de serotipos10. La VNC13 es la vacuna que actualmente proporciona mejor cobertura frente a los serotipos circulantes en nuestro país11,12.
Vacunación frente al rotavirusRecomendación 2022:La vacuna antirrotavirus (RV) debería incluirse en el calendario sistemático para todos los lactantes.
La OMS (https://www.who.int/news/item/20-11-2015-statement-from-the-global-advisory-committee-on-vaccine-safety), la Academia Europea de Pediatría y la Sociedad Europea de Enfermedades Infecciosas Pediátricas apoyan esta recomendación13.
Más de 110 países incluyen RV en sus calendarios sistemáticos. Los beneficios sanitarios de esta medida son incuestionables y van más allá de los que pueden ofrecer las medidas higiénicas.
Los prematuros, cuya vacunación está financiada como grupo de riesgo, deben vacunarse sin retrasos, incluso hospitalizados, entre las seis y 12 semanas de vida14.
Un reciente metaanálisis valorando los efectos de la vacuna en > 100.000 menores reafirma los datos de efectividad y seguridad conocidos hasta ahora y valora en positivo su relación coste/beneficio15.
Vacunación frente a meningococosRecomendación 2022: Vacunación sistemática frente al meningococo B en lactantes a partir de dos meses de edad, con pauta 2 + 1. Para el resto de edades, incluida la adolescencia, recomendación de carácter individual. Se insta a utilizar vacuna meningococo C conjugada con toxoide tetánico (MenC-TT) a los cuatro meses e incorporación a los 12 meses de la vacuna tetravalente meningocócica (MenACWY) en sustitución de MenC-TT. Es primordial, si no se administra MenACWY, asegurar la dosis de MenC-TT. Se mantiene la recomendación de MenACWY en adolescentes a los 12 años con un rescate hasta los 18. Para el resto de edades pediátricas la recomendación es de tipo individual.
En España hay dos vacunas para la prevención de la enfermedad meningocócica invasora (EMI) por serogrupo B (MenB): 4CMenB (a partir de dos meses de edad) y MenB-fHbp (a partir de 10 años).
Los estudios de coste-efectividad de estas vacunas, desde la perspectiva coste/años de vida ajustados a la calidad (AVAC), resultan desfavorables al ser una enfermedad muy infrecuente. Además, las medidas frente a la pandemia por SARS-CoV-2 han propiciado un descenso notable en el número de casos por cualquier serogrupo. A pesar de ello, el CAV-AEP apuesta por la vacunación sistemática en lactantes, ya que MenB es el serogrupo más frecuente en España en menores de 12 meses, el grupo de edad con mayor tasa de esta devastadora enfermedad. Desde 2019, Canarias y Castilla y León la incluyen en sus calendarios y Andalucía la ha introducido en 2021.
4CMenB ha demostrado sobradamente su efectividad. En Reino Unido (RU), tras su introducción en calendario sistemático en 2015, se ha producido una reducción del 75% en el número de casos esperados, estimando que se evitaron 277 casos (IC 95: 236-323) en los tres primeros años del programa. La efectividad tras la pauta 2 + 1 fue del 71,2% frente a cepas potencialmente cubiertas por la vacuna16. Estos datos llevaron a modificar la ficha técnica en 2020, aceptándose iniciar esta pauta a los dos meses.
La efectividad también se comprobó en Italia tras su inclusión en programa de vacunación en lactantes en las regiones de Toscana (93,6% IC 95: 55,4-99,1%) y Veneto (91% IC 95: 59,9-97,9%), siendo mayor el impacto iniciando la pauta a los dos meses17.
En Portugal se ha incluido en 2020 la vacunación en calendario tras un estudio que estima una efectividad del 79% (IC 95: 45-92)18. Recientemente, la autoridad nacional de salud francesa recomendó esta vacunación en lactantes.
Por todo ello, reiteramos nuestra recomendación de incluir 4CMenB como sistemática, con pauta 2 + 1 e inició a los dos meses de edad. En otras edades, incluyendo adolescentes, es para protección individual, ya que estas vacunas no reducen la colonización nasofaríngea de MenB ni generan inmunidad de grupo19.
El notable aumento en la incidencia de EMI por serogrupos W e Y en el mundo20 indujo en algunos países la sustitución de la dosis de MenC por MenACWY en la adolescencia, e incluso en el segundo año de vida, buscando la protección directa del lactante por su mayor riesgo. En España, en la temporada 2014-2015, se detectó un aumento en la incidencia de EMI por W e Y, tendencia interrumpida por la pandemia COVID-19. Los datos más recientes del Centro Nacional de Epidemiología (https://www.isciii.es/QueHacemos/Servicios/VigilanciaSaludPublicaRENAVE/EnfermedadesTransmisibles/Boletines/Paginas/BoletinSemanalEnRed.aspx) muestran el descenso mantenido de EMI por cualquier serogrupo. Este descenso se observó también en muchos países como RU fundamentalmente por las medidas de contención aplicadas en la pandemia21. No obstante, dada la epidemiología impredecible de la enfermedad, el CAV-AEP recuerda la necesidad de seguir manteniendo elevadas coberturas vacunales.
El rescate entre 13 y 18 años se vio interrumpido en la mayoría de Comunidades Autónomas (CC.AA.) por la pandemia, dificultando alcanzar un impacto epidemiológico que proteja al lactante de forma indirecta. El CAV-AEP sigue apoyando la sustitución de MenC por MenACWY en la adolescencia e insta a introducir esta vacuna a los 12 meses para proteger directamente al lactante. Si no se administra MenACWY a los 12 meses, se debe asegurar la dosis de MenC para evitar un descenso en las coberturas.
Para el resto de edades pediátricas la recomendación es de tipo individual.
Vacunación frente a la gripeRecomendación 2022:La vacuna anual frente a gripe debería estar incluida en el calendario sistemático para todos los niños de 6 a 59 meses.
La gripe estacional tiene una elevada incidencia en niños sanos y cada año es causante de una significativa morbilidad en estos. Además, los niños pequeños son importantes vectores de propagación del virus a adultos y ancianos.
Aunque con frecuencia se cree que la gripe afecta principalmente a niños con afecciones subyacentes, múltiples estudios han demostrado el impacto de esta enfermedad en niños sanos22.
La vacuna antigripal es la forma más efectiva de prevención. Desde el año 2012, la OMS y el European Centre for Disease Prevention and Control (ECDC) recomiendan que los niños de seis a 59 meses sean considerados prioritarios para la vacunación antigripal23,24.
Disponemos de vacunas eficaces y seguras para uso pediátrico. La vacunación infantil es una de las medidas más efectivas para reducir la carga global de enfermedad, tanto en niños como en adultos, especialmente en aquellos de edad avanzada con peores respuestas a la vacunación. Varios estudios han demostrado la reducción de la morbimortalidad en personas mayores mediante vacunación antigripal infantil.
Vacunación frente a sarampión, rubeola y parotiditis (vacuna triple vírica: SRP)Recomendación 2022: La primera dosis de SRP se administrará a los 12 meses como triple vírica y la segunda a los tres a cuatro años en forma de vacuna tetravírica o SRP + varicela (SRPV).
España es un país libre de sarampión autóctono. Resulta esencial mantener coberturas de vacunación superiores al 95% para las dos dosis.
En 2020 (https://www.isciii.es/QueHacemos/Servicios/VigilanciaSaludPublicaRENAVE/EnfermedadesTransmisibles/Boletines/Paginas/BoletinSemanalEnRed.aspx), en España se notificaron 72 casos de sarampión, tres de rubeola (excluyendo rubeola congénita) y 6.220 de parotiditis.
El segundo estudio de seroprevalencia en España25 ha observado un descenso de población con títulos de anticuerpos protectores frente a sarampión a partir de los 10-15 años; la inmunidad frente a rubeola es superior al 95% en todas las edades y la protección frente a parotiditis es elevada entre los dos y 14 años, a partir de entonces decae.
Se recomienda administrar la primera dosis a los 12 meses con triple vírica y la segunda dosis a los tres a cuatro años con SRPV. La segunda dosis es imprescindible para corregir posibles fallos primarios y lograr una adecuada inmunidad de grupo.
Cuando por motivos epidemiológicos haya que vacunar a menores de 12 meses, se puede administrar la SRP entre seis y 11 meses de vida, pero esta dosis no se contabiliza por debajo de los 11 meses.
Se mantiene la recomendación de administrar por separado (SRP y V) en la primera dosis en menores de dos años por el mayor riesgo de convulsiones febriles26.
Vacunación frente a varicelaRecomendación 2022:Vacunación sistemática con dos dosis, a los 15 meses y a los tres a cuatro años (en la segunda se puede utilizar SRPV). En niños y adolescentes no vacunados y que no han padecido la enfermedad, se recomienda vacunación de rescate con dos dosis.
Se dispone de dos vacunas monocomponentes y dos SRPV, todas ellas de virus atenuados, que muestran elevada efectividad (92-97%)27.
La implementación de esta vacuna en los calendarios infantiles es una medida segura y coste/efectiva. Para evitar varicela en vacunados, así como la circulación del virus es necesario un esquema con dos dosis28. Desde 2016, todas las CC.AA. incluyen la vacunación antivaricela (15 meses y tres a cuatro años). La segunda dosis se administra con SRPV en nueve CC.AA.
Según diversos estudios, la incidencia de herpes zóster en niños vacunados de varicela es inferior a la incidencia tras la infección natural29.
Vacunación frente al papilomavirus humano (VPH)Recomendación 2022:Vacunación sistemática, preferentemente a los 12 años, con dos dosis, independientemente del género.
La edad recomendada son los 12 años, antes del inicio de relaciones sexuales, para alcanzar el mayor beneficio y optimizar coberturas. Se recomienda también la vacunación de rescate y de personas incluidas en grupos de riesgo.
Está demostrada la relación causal entre VPH y cáncer de cérvix y otros cánceres que afectan a ambos sexos, como el anal y el de cabeza y cuello30. La efectividad de las vacunas se traduce en una reducción del 85% de lesiones de alto grado31, del cáncer anogenital en varones32 y de las verrugas genitales en ambos sexos. También se ha sugerido un impacto sobre el cáncer orofaríngeo33; por otro lado, ya se dispone de datos de efectividad vacunal frente al cáncer de cérvix34.
Las vacunas frente al VPH son seguras, con balance beneficio/riesgo muy favorable. En España, las vacunas autorizadas en ambos sexos contienen dos (VPH2) o nueve (VPH9) genotipos. Aunque ambas protegen, VPH9 ofrece mayor cobertura directa frente al cáncer cervical (90%) y proporciona una prevención potencial del 85-95% de cánceres de vulva, vagina y ano relacionados con este virus; además, protege frente a verrugas genitales35.
El CAV-AEP recomienda la vacunación sistemática frente a VPH, tanto en varones como mujeres, con el preparado elegido en cada comunidad (VPH2 en cuatro CC.AA. y VPH9 en el resto).
Vacunación frente al SARS-CoV-2Recomendación 2022:Recomendación de vacunación frente al SARS-CoV-2 a partir de los 5 años.
Se recomienda la vacunación de todos los niños frente al SARS-CoV-2, siempre que exista una vacuna aprobada para su edad. Esta recomendación está basada en: 1) contemplar el derecho del niño a su protección individual frente a esta enfermedad; 2) conseguir y mantener espacios educativos seguros, que permitan la normalización de la escolarización y las relaciones interpersonales de los niños, con el consiguiente bienestar psicoemocional; 3) lograr la inmunidad de grupo; 4) disminuir la circulación del SARS-CoV-2 y prevenir la aparición de nuevas variantes y 5) no sería justo privar a la población infantil del beneficio que aporta la vacunación.
La carga global de la infección por SARS-CoV-2 en los niños es desconocida, ya que hasta en un 50% de ellos la infección puede ser asintomática. En la actualidad, en España, la incidencia de la COVID-19 es mayor en los niños menores de 11 años, que en cualquier otra edad36.
Aunque la enfermedad es leve en la mayoría de los niños, no está exenta de riesgos. En España, la tasa de hospitalizaciones en los niños es 4-6 por 1.000 infectados, la de ingresos en UCIP 3-4/10.000 y la letalidad 2-4/100.00037. Con todo, desde el inicio de la pandemia, se han producido, al menos, 6.000 hospitalizaciones, 300 ingresos en UCIP y 37 fallecimientos por COVID-19, la mitad de ellos en menores de 10 años38.
Los niños parecen infectarse y transmitir la enfermedad en menor grado que los adultos39,40. Sin embargo, es posible que estas diferencias se deban a las variaciones de las conductas sociales, según la edad, ya que en el ambiente domiciliarios el riesgo de contagio y de transmisión de la enfermedad es el mismo para todas las edades41.
Actualmente, hay tres vacunas de ARNm autorizadas para los niños y adolescentes: dos para los chicos mayores de 12 años, la vacuna BNT162b2 (Comirnaty-Pfizer) y la vacuna mRNA-1273 (Spikevax-Moderna), y un tercer preparado de Comirnaty, con menor carga de ARNm, para niños de 5-11 años. La eficacia frente a la infección sintomática en las dos primeras ha sido del 100% y en la tercera del 90,7%. Las tres son vacunas muy seguras, con efectos secundarios limitados, en la mayoría de los casos, a reacciones locales en el sitio de la inyección, cefalea, cansancio y fiebre poco intensa42-44.
Tras el uso clínico de Comirnaty y Spikevax, se han detectado algunos eventos de miocarditis asociados a esta vacuna, que se resuelve en 2-3 días en la gran mayoría de los casos45. Aun considerando esta complicación, el balance beneficio/riesgo es netamente favorable a estas vacunas, ya que es más frecuente tras la infección que tras la vacunación (https://vacunasaep.org/profesionales/noticias/comirnaty-y-miocarditis). Es muy probable que el balance sea todavía más favorable en los niños de 5-11 años, ya que la incidencia de miocarditis asociada a la vacuna disminuye por debajo de los 15 años.
FinanciaciónLa elaboración de estas recomendaciones (análisis de los datos publicados, debate, consenso y publicación) no ha contado con ninguna financiación externa a la logística facilitada por la AEP.
Conflictos de interesesConflictos de intereses potenciales de los autores (últimos cinco años):
FJAG ha colaborado en actividades docentes subvencionadas por Alter, Astra, GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur y como consultor en Advisory Board de GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur.
MJCO ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, MSD, Pfizer y Sanofi, como investigadora en ensayos clínicos de GlaxoSmithKline y Pfizer, y como consultora en Advisory Board de GlaxoSmithKline, Novartis, MSD, Pfizer y Sanofi Pasteur.
JAA ha colaborado en actividades docentes subvencionadas por AstraZeneca, GlaxoSmithKline, MSD, Pfizer, Sanofi Pasteur y Seqirus; como investigador en ensayos clínicos de GlaxoSmithKline y Sanofi Pasteur y como consultor en Advisory Board de AstraZeneca, GlaxoSmithKline, MSD, Pfizer, Sanofi Pasteur, Seqirus.
MGS ha colaborado en actividades docentes subvencionadas por Astra, GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur, como investigadora en ensayos clínicos de GlaxoSmithKline, Janssen, MSD y Sanofi Pasteur y como consultora en Advisory Board de GlaxoSmithKline y Novartis.
EGL ha recibido ayuda económica para asistir a actividades docentes nacionales y ha participado en actividades docentes subvencionadas por GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur, como investigadora en estudios de GlaxoSmithKline y MSD, y como consultora en Advisory Board de GlaxoSmithKline.
AIA ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur, ha recibido ayuda económica de Pfizer para asistir a actividades docentes nacionales, y ha asistido a actividades docentes subvencionadas por GlaxoSmithKline, MSD y Pfizer.
AMM ha recibido ayuda económica de Pfizer para asistir a actividades docentes nacionales e internacionales, aunque desde que es miembro del CAV-AEP no ha aceptado patrocinio directo alguno de ningún laboratorio farmacéutico para ninguna actividad (ni docente, ni discente). También ha colaborado como investigador sin recibir remuneración en un estudio promovido por MSD en 2019-20.
MLNG ha colaborado en actividades docentes subvencionadas por Gilead, GlaxoSmithKline, Janssen, MSD, Pfizer y ViiV, como consultor en Advisory Board para Abbott, AstraZeneca, Novartis y ViiV y en ensayos clínicos promovidos por GlaxoSmithKline, Pfizer, Roche y Sanofi Pasteur.
VPS ha recibido ayuda económica de MSD, Pfizer y Sanofi Pasteur para asistir a actividades docentes nacionales e internacionales, ha colaborado en actividades docentes subvencionadas por AstraZeneca, GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur y como consultor en Advisory Board de GlaxoSmithKline, Pfizer y Sanofi Pasteur.
IRC ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur, como investigadora en ensayos clínicos de vacunas de Ablynx, Abbot, Cubist, GlaxoSmithKline, Janssen, Medimmune, Merck, MSD, Novavax, Novartis, Pfizer, Roche, Regeneron, Sanofi Pasteur, Seqirus y Wyeth y como consultora en Advisory Board de MSD, Pfizer y Sanofi Pasteur.
JRC ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur y como investigador en ensayos clínicos de GlaxoSmithKline y Pfizer.
PSM ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline y MSD, como investigador en ensayos clínicos de Sanofi Pasteur y como consultor en Advisory Board para GlaxoSmithKline. Ha recibido ayuda económica de GlaxoSmithKline, MSD y Pfizer para asistir a actividades docentes nacionales e internacionales. Ha recibido becas bajo mecenazgo de GlaxoSmithKline.
A Javier Arístegui, José María Corretger, Nuria García Sánchez, Ángel Hernández Merino, Manuel Merino Moína y Luis Ortigosa, por su asesoría interna en la redacción y elaboración de estas recomendaciones.
Francisco José Álvarez García (FJAG), M.ª José Cilleruelo Ortega (MJCO), Javier Álvarez Aldeán (JAA), María Garcés-Sánchez (MGS), Elisa Garrote Llanos (EGL), Antonio Iofrío de Arce (AIA), Abián Montesdeoca Melián (AMM), Marisa Navarro Gómez (MLNG), Valentín Pineda Solas (VPS), Irene Rivero Calle (IRC), Jesús Ruiz-Contreras (JRC), Pepe Serrano Marchuet (PSM).



![Calendario de vacunaciones sistemáticas de la Asociación Española de Pediatría 2022. (1) Vacuna antihepatitis B (HB). Tres dosis, en forma de vacuna hexavalente, a los 2, 4 y 11 meses de edad. Los hijos de madres HBsAg positivas o con serología desconocida recibirán, además al nacimiento, una dosis de vacuna HB monocomponente junto con 0,5 mL de inmunoglobulina antihepatitis B (IGHB) si se confirma que el HBsAg materno es positivo. Los lactantes vacunados al nacimiento seguirán el calendario habitual del primer año, por lo que recibirán cuatro dosis de HB. A los niños y adolescentes no vacunados se les administrarán tres dosis de vacuna monocomponente según la pauta 0, 1 y 6 meses. (2) Vacuna frente a la difteria, el tétanos y la tosferina (DTPa/Tdpa). Cinco dosis: primovacunación con dos dosis, a los 2 y 4 meses, de vacuna DTPa-VPI-Hib-HB (hexavalente); refuerzo a los 11 meses (3.ª dosis) con DTPa (hexavalente); a los seis años (4.ª dosis) con el preparado de carga estándar (DTPa-VPI), preferible al de baja carga antigénica de difteria y tosferina (Tdpa-VPI) y a los 12-14 años (5.ª dosis) con Tdpa. En los casos vacunados anteriormente con la pauta 3 + 1 (2, 4, 6 y 18 meses), en la dosis de los seis años se podrá utilizar Tdpa, ya que no precisan nuevas dosis de vacuna frente a la poliomielitis. (3) Vacuna antipoliomielítica inactivada (VPI). Cuatro dosis: primovacunación con dos dosis, a los 2 y 4 meses, y refuerzos a los 11 meses (con hexavalentes) y a los seis años (con DTPa-VPI o Tdpa-VPI). En los casos vacunados anteriormente con la pauta 3 + 1 (2, 4, 6 y 18 meses), no se precisan más dosis de VPI. (4) Vacuna conjugada frente al Haemophilus influenzae tipo b (Hib). Tres dosis: primovacunación a los 2 y 4 meses y refuerzo a los 11 meses con hexavalentes. (5) Vacuna conjugada frente al neumococo (VNC). Tres dosis: las dos primeras a los 2 y 4 meses, con un refuerzo a partir de los 11 meses de edad. La vacuna recomendada en nuestro país, por el CAV-AEP, sigue siendo la VNC13. (6) Vacuna frente al rotavirus (RV). Dos o tres dosis de vacuna frente al rotavirus: a los 2 y 3-4 meses con la vacuna monovalente o a los 2, 3 y 4 meses o 2, 3-4 y 5-6 meses con la pentavalente. La pauta ha de iniciarse entre las 6 y las 12 semanas de vida (es muy importante para minimizar riesgos) y debe completarse antes de las 24 semanas en la monovalente y de las 32 en la pentavalente. El intervalo mínimo entre dosis es de cuatro semanas. Ambas vacunas se pueden coadministrar con cualquier otra. (7) Vacuna frente al meningococo B (MenB). 4CMenB. Tres dosis: se iniciará a los 2 meses de edad, con dos dosis separadas por 2 meses y un refuerzo a partir de los 12 meses, siempre que hayan pasado, al menos, 6 meses de la última dosis de primoinmunización. Se puede coadministrar con las otras vacunas del calendario, aunque podría producir fiebre con mayor frecuencia; por lo que, hasta los 12 meses, también se podría aplicar con una separación de 1 o 2 semanas con las otras vacunas inactivadas inyectables para minimizar su posible reactogenicidad. No es necesaria la separación de 1 o 2 semanas con las vacunas MenACWY, triple vírica, varicela y rotavirus. También se recomienda a cualquier edad en grupos de riesgo: asplenia anatómica o funcional, déficit de factores del complemento, tratamiento con eculizumab o ravulizumab, receptores de trasplante de progenitores hematopoyéticos, infección por VIH, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo B en el contexto de un brote epidémico. (8) Vacuna conjugada frente al meningococo C (MenC) y vacuna frente a los meningococos ACWY (MenACWY). Una dosis de vacuna conjugada MenC-TT a los 4 meses de edad. A los 12 meses y a los 12-14 años se recomienda una dosis de la vacuna MenACWY, aconsejándose un rescate progresivo hasta los 18 años. En CC. AA. donde no está incluida la vacuna a los 12 meses en calendario sistemático, si los padres deciden no administrar MenACWY, deberá aplicarse la MenC-TT financiada por su comunidad. También se sigue recomendando especialmente MenACWY para niños y adolescentes que vayan a residir en países en los que la vacuna se indique a esa edad (Canadá, EE. UU., Argentina, Brasil, Australia, Arabia Saudí, Austria, Bélgica, Grecia, Holanda, Irlanda, Italia, Malta, Reino Unido, San Marino y Suiza) y para los que tengan factores de riesgo de EMI: asplenia anatómica o funcional, déficit de factores del complemento, tratamiento con eculizumab o ravulizumab, receptores de trasplante de progenitores hematopoyéticos, infección por VIH, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo A, C, W o Y en el contexto de un brote epidémico. Los viajeros a La Meca, por razones religiosas, y al llamado cinturón de la meningitis africano durante la estación seca deben recibir también MenACWY. (9) Vacuna frente a la gripe. Se recomienda esta vacunación para todos los niños de 6 a 59 meses de edad con vacunas inactivadas parenterales y a partir de los 2 años, si está disponible, también se podría utilizar la vacuna atenuada intranasal. Si es la primera vez que la reciben se aplicarán dos dosis separadas por 4 semanas, como todos los niños menores de 9 años. Posteriormente precisarán una sola dosis para el resto de las campañas. La dosis es de 0,5 mL en las inactivadas y de 0,1 mL en cada fosa nasal para la atenuada. Para consultar los grupos de riesgo de esta vacuna se puede acceder al manual de vacunas en línea (https://vacunasaep.org/documentos/manual/manual-de-vacunas). (10) Vacuna frente al sarampión, la rubeola y la parotiditis (SRP). Dos dosis de vacuna sarampión, rubeola, y parotiditis (triple vírica). La 1.ª a los 12 meses y la 2.ª a los 3-4 años de edad. La 2.ª dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, vacunación con dos dosis de SRP con un intervalo de, al menos, un mes. (11) Vacuna frente a la varicela (Var). Dos dosis: la 1.ª a los 15 meses (también es aceptable a los 12 meses de edad) y la 2.ª a los 3-4 años de edad. La 2.ª dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, vacunación con dos dosis de vacuna monocomponente con un intervalo de, al menos, un mes. (12) Vacuna frente al virus del papiloma humano (VPH). Vacunación sistemática universal frente al VPH, tanto de chicas como de chicos, a los 12 años, con dos dosis. Las vacunas disponibles en la actualidad son VPH2 y VPH9. Las dos están autorizadas en varones, aunque con VPH2 es aún escasa la experiencia en ellos. Pautas de vacunación según el preparado vacunal: la bivalente y la nonavalente con pauta de dos dosis (0 y 6 meses) entre 9 y 14 años y pauta de tres dosis [0,1-2 (según preparado vacunal) y 6 meses] para ≥ 15 años. Es posible su coadministración con las vacunas MenC, MenACWY, hepatitis A y B y Tdpa. No hay datos de coadministración con la vacuna de la varicela, aunque no debería plantear problemas. (13) Vacuna frente al SARS-CoV-2. Actualmente están autorizadas dos vacunas en nuestro país a partir de los 12 años, Comirnaty-30 microgr (Pfizer) y Spikevax-100 microgr (Moderna) y otra entre 5 y 11 años con otra presentación con menor cantidad de antígeno (Comirnaty-10 microgr). Se aplicarán dos dosis separadas por tres semanas en la primera y en la tercera y por cuatro semanas en la segunda. La Comisión de Salud Pública de España ha decidido que la separación entre las 2 dosis de Comirnaty 10 mcgr sea de 8 semanas, pero si se administra a partir de los 21 días sería válida. Se pueden administrar con otras vacunas el mismo día o con la separación que se desee. Calendario de vacunaciones sistemáticas de la Asociación Española de Pediatría 2022. (1) Vacuna antihepatitis B (HB). Tres dosis, en forma de vacuna hexavalente, a los 2, 4 y 11 meses de edad. Los hijos de madres HBsAg positivas o con serología desconocida recibirán, además al nacimiento, una dosis de vacuna HB monocomponente junto con 0,5 mL de inmunoglobulina antihepatitis B (IGHB) si se confirma que el HBsAg materno es positivo. Los lactantes vacunados al nacimiento seguirán el calendario habitual del primer año, por lo que recibirán cuatro dosis de HB. A los niños y adolescentes no vacunados se les administrarán tres dosis de vacuna monocomponente según la pauta 0, 1 y 6 meses. (2) Vacuna frente a la difteria, el tétanos y la tosferina (DTPa/Tdpa). Cinco dosis: primovacunación con dos dosis, a los 2 y 4 meses, de vacuna DTPa-VPI-Hib-HB (hexavalente); refuerzo a los 11 meses (3.ª dosis) con DTPa (hexavalente); a los seis años (4.ª dosis) con el preparado de carga estándar (DTPa-VPI), preferible al de baja carga antigénica de difteria y tosferina (Tdpa-VPI) y a los 12-14 años (5.ª dosis) con Tdpa. En los casos vacunados anteriormente con la pauta 3 + 1 (2, 4, 6 y 18 meses), en la dosis de los seis años se podrá utilizar Tdpa, ya que no precisan nuevas dosis de vacuna frente a la poliomielitis. (3) Vacuna antipoliomielítica inactivada (VPI). Cuatro dosis: primovacunación con dos dosis, a los 2 y 4 meses, y refuerzos a los 11 meses (con hexavalentes) y a los seis años (con DTPa-VPI o Tdpa-VPI). En los casos vacunados anteriormente con la pauta 3 + 1 (2, 4, 6 y 18 meses), no se precisan más dosis de VPI. (4) Vacuna conjugada frente al Haemophilus influenzae tipo b (Hib). Tres dosis: primovacunación a los 2 y 4 meses y refuerzo a los 11 meses con hexavalentes. (5) Vacuna conjugada frente al neumococo (VNC). Tres dosis: las dos primeras a los 2 y 4 meses, con un refuerzo a partir de los 11 meses de edad. La vacuna recomendada en nuestro país, por el CAV-AEP, sigue siendo la VNC13. (6) Vacuna frente al rotavirus (RV). Dos o tres dosis de vacuna frente al rotavirus: a los 2 y 3-4 meses con la vacuna monovalente o a los 2, 3 y 4 meses o 2, 3-4 y 5-6 meses con la pentavalente. La pauta ha de iniciarse entre las 6 y las 12 semanas de vida (es muy importante para minimizar riesgos) y debe completarse antes de las 24 semanas en la monovalente y de las 32 en la pentavalente. El intervalo mínimo entre dosis es de cuatro semanas. Ambas vacunas se pueden coadministrar con cualquier otra. (7) Vacuna frente al meningococo B (MenB). 4CMenB. Tres dosis: se iniciará a los 2 meses de edad, con dos dosis separadas por 2 meses y un refuerzo a partir de los 12 meses, siempre que hayan pasado, al menos, 6 meses de la última dosis de primoinmunización. Se puede coadministrar con las otras vacunas del calendario, aunque podría producir fiebre con mayor frecuencia; por lo que, hasta los 12 meses, también se podría aplicar con una separación de 1 o 2 semanas con las otras vacunas inactivadas inyectables para minimizar su posible reactogenicidad. No es necesaria la separación de 1 o 2 semanas con las vacunas MenACWY, triple vírica, varicela y rotavirus. También se recomienda a cualquier edad en grupos de riesgo: asplenia anatómica o funcional, déficit de factores del complemento, tratamiento con eculizumab o ravulizumab, receptores de trasplante de progenitores hematopoyéticos, infección por VIH, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo B en el contexto de un brote epidémico. (8) Vacuna conjugada frente al meningococo C (MenC) y vacuna frente a los meningococos ACWY (MenACWY). Una dosis de vacuna conjugada MenC-TT a los 4 meses de edad. A los 12 meses y a los 12-14 años se recomienda una dosis de la vacuna MenACWY, aconsejándose un rescate progresivo hasta los 18 años. En CC. AA. donde no está incluida la vacuna a los 12 meses en calendario sistemático, si los padres deciden no administrar MenACWY, deberá aplicarse la MenC-TT financiada por su comunidad. También se sigue recomendando especialmente MenACWY para niños y adolescentes que vayan a residir en países en los que la vacuna se indique a esa edad (Canadá, EE. UU., Argentina, Brasil, Australia, Arabia Saudí, Austria, Bélgica, Grecia, Holanda, Irlanda, Italia, Malta, Reino Unido, San Marino y Suiza) y para los que tengan factores de riesgo de EMI: asplenia anatómica o funcional, déficit de factores del complemento, tratamiento con eculizumab o ravulizumab, receptores de trasplante de progenitores hematopoyéticos, infección por VIH, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo A, C, W o Y en el contexto de un brote epidémico. Los viajeros a La Meca, por razones religiosas, y al llamado cinturón de la meningitis africano durante la estación seca deben recibir también MenACWY. (9) Vacuna frente a la gripe. Se recomienda esta vacunación para todos los niños de 6 a 59 meses de edad con vacunas inactivadas parenterales y a partir de los 2 años, si está disponible, también se podría utilizar la vacuna atenuada intranasal. Si es la primera vez que la reciben se aplicarán dos dosis separadas por 4 semanas, como todos los niños menores de 9 años. Posteriormente precisarán una sola dosis para el resto de las campañas. La dosis es de 0,5 mL en las inactivadas y de 0,1 mL en cada fosa nasal para la atenuada. Para consultar los grupos de riesgo de esta vacuna se puede acceder al manual de vacunas en línea (https://vacunasaep.org/documentos/manual/manual-de-vacunas). (10) Vacuna frente al sarampión, la rubeola y la parotiditis (SRP). Dos dosis de vacuna sarampión, rubeola, y parotiditis (triple vírica). La 1.ª a los 12 meses y la 2.ª a los 3-4 años de edad. La 2.ª dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, vacunación con dos dosis de SRP con un intervalo de, al menos, un mes. (11) Vacuna frente a la varicela (Var). Dos dosis: la 1.ª a los 15 meses (también es aceptable a los 12 meses de edad) y la 2.ª a los 3-4 años de edad. La 2.ª dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, vacunación con dos dosis de vacuna monocomponente con un intervalo de, al menos, un mes. (12) Vacuna frente al virus del papiloma humano (VPH). Vacunación sistemática universal frente al VPH, tanto de chicas como de chicos, a los 12 años, con dos dosis. Las vacunas disponibles en la actualidad son VPH2 y VPH9. Las dos están autorizadas en varones, aunque con VPH2 es aún escasa la experiencia en ellos. Pautas de vacunación según el preparado vacunal: la bivalente y la nonavalente con pauta de dos dosis (0 y 6 meses) entre 9 y 14 años y pauta de tres dosis [0,1-2 (según preparado vacunal) y 6 meses] para ≥ 15 años. Es posible su coadministración con las vacunas MenC, MenACWY, hepatitis A y B y Tdpa. No hay datos de coadministración con la vacuna de la varicela, aunque no debería plantear problemas. (13) Vacuna frente al SARS-CoV-2. Actualmente están autorizadas dos vacunas en nuestro país a partir de los 12 años, Comirnaty-30 microgr (Pfizer) y Spikevax-100 microgr (Moderna) y otra entre 5 y 11 años con otra presentación con menor cantidad de antígeno (Comirnaty-10 microgr). Se aplicarán dos dosis separadas por tres semanas en la primera y en la tercera y por cuatro semanas en la segunda. La Comisión de Salud Pública de España ha decidido que la separación entre las 2 dosis de Comirnaty 10 mcgr sea de 8 semanas, pero si se administra a partir de los 21 días sería válida. Se pueden administrar con otras vacunas el mismo día o con la separación que se desee.](https://static.elsevier.es/multimedia/16954033/0000009600000001/v3_202201060630/S1695403321003829/v3_202201060630/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w95erwEulN6Tmh1xJpRhO+VE=)


