El CAV-AEP publica anualmente el calendario de vacunaciones que estima idóneo para los niños residentes en España, teniendo en cuenta la evidencia científica disponible.
Se mantiene el esquema 2+1 (2, 4 y 11 meses) con vacunas hexavalentes (DTPa-VPI-Hib-HB) y con antineumocócica conjugada 13-valente.
Se aconseja un refuerzo a los 6 años, preferentemente con DTPa (si está disponible), junto a una dosis de polio para aquellos que recibieron esquemas 2+1, así como vacunación con Tdpa en adolescentes y en cada embarazo, preferentemente entre las 27 y las 32 semanas.
La vacuna del rotavirus debería ser sistemática para todos los lactantes.
Se sigue proponiendo la incorporación en el calendario de la vacuna antimeningocócica B, con esquema 2+1 en lactantes.
Además de la inclusión de la vacuna antimeningocócica conjugada tetravalente (MenACWY) a los 12 años con rescate hasta los 18 años, inclusive, el CAV recomienda que esta vacuna sea introducida también a los 12 meses de edad, sustituyendo a MenC. Igualmente, se recomienda en los mayores de 6 semanas de edad con factores de riesgo o que viajen a países de elevada incidencia de estos serogrupos.
Se emplearán esquemas de 2dosis para triple vírica (12 meses y 3-4 años) y varicela (15 meses y 3-4 años). La segunda dosis se podría aplicar como vacuna tetravírica.
Se recomienda la vacunación sistemática universal frente al VPH, tanto a chicas como a chicos, preferentemente a los 12 años, debiendo realizar un mayor esfuerzo para mejorar las coberturas. La de 9 genotipos amplía la cobertura para ambos sexos.
The CAV-AEP annually publishes the immunisation schedule considered optimal for all children resident in Spain, taking into account the available evidence.
The 2+1 schedule is recommended (2, 4, and 11 months) with hexavalent vaccines (DTPa-VPI-Hib-HB) and with 13-valent pneumococcal conjugate.
A 6-year booster is recommended, preferably with DTPa (if available), with a dose of polio for those who received 2+1 schemes, as well as vaccination with Tdpa in adolescents and in each pregnancy, preferably between 27 and 32 weeks.
Rotavirus vaccine should be systematic for all infants.
Meningococcal B vaccine, with a 2+1 schedule, should be included in routine calendar.
In addition to the inclusion of the conjugated tetravalent meningococcal vaccine (MenACWY) at 12 years of age with catch up to 18 years, inclusive, the CAV recommends this vaccine to be also included at 12 months of age, replacing MenC. Likewise, it is recommended in those over 6 weeks of age with risk factors or who travel to countries with a high incidence of these serogroups.
Two-dose schedules for MMR (12 months and 3-4 years) and varicella (15 months and 3-4 years) will be used. The second dose could be applied as a tetraviral vaccine.
Universal systematic vaccination against HPV is recommended, both for girls and boys, preferably at 12 years, and greater effort should be made to improve coverage. The 9 genotype extends coverage for both genders.
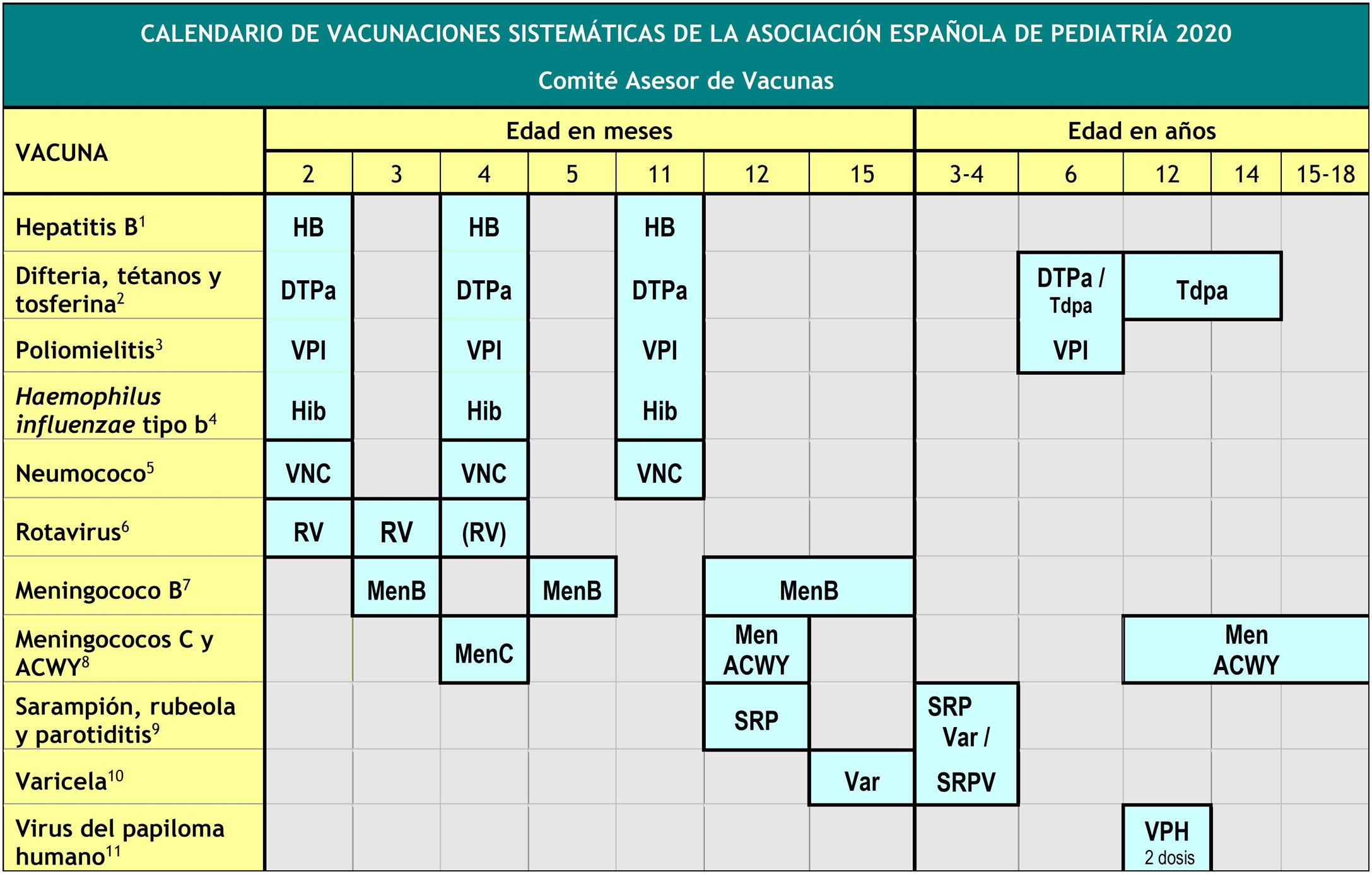
El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) actualiza sus recomendaciones de vacunación en la infancia y adolescencia con respecto al año pasado1 (fig. 1) considerando la evidencia científica disponible sobre la efectividad, eficiencia y seguridad de las vacunas, así como la epidemiología de las enfermedades inmunoprevenibles en nuestro país.
Calendario de vacunaciones sistemáticas de la Asociación Española de Pediatría 2020.
(1) Vacuna antihepatitis B (HB).– Tres dosis, en forma de vacuna hexavalente, a los 2, 4 y 11 meses de edad. Los hijos de madres HBsAg positivas o de serología desconocida recibirán además, al nacimiento, una dosis de vacuna HB monocomponente, junto con 0,5ml de inmunoglobulina antihepatitis B (IGHB) si se confirma que el HBsAg materno es positivo. Los lactantes vacunados al nacimiento seguirán el calendario habitual del primer año, por lo que recibirán 4 dosis de HB. A los niños y adolescentes no vacunados se les administrarán 3 dosis de vacuna monocomponente según la pauta 0, 1 y 6 meses.
(2) Vacuna frente a la difteria, el tétanos y la tosferina (DTPa/Tdpa).– Cinco dosis: primovacunación con 2 dosis, a los 2 y 4 meses, de vacuna DTPa (hexavalente); refuerzo a los 11 meses (3.a dosis) con DTPa (hexavalente); a los 6 años (4.a dosis) con el preparado de carga estándar (DTPa-VPI), preferible al de baja carga antigénica de difteria y tosferina (Tdpa-VPI), y a los 12-14 años (5.a dosis) con Tdpa.
(3) Vacuna antipoliomielítica inactivada (VPI).– Cuatro dosis: primovacunación con 2 dosis, a los 2 y 4 meses, y refuerzos a los 11 meses (con hexavalentes), y a los 6 años (con DTPa-VPI o Tdpa-VPI).
(4) Vacuna conjugada frente al Haemophilus influenzae tipo b (Hib).– Tres dosis: primovacunación a los 2 y 4 meses y refuerzo a los 11 meses con hexavalentes.
(5) Vacuna conjugada frente al neumococo (VNC).– Tres dosis: las 2 primeras a los 2 y 4 meses, con un refuerzo a partir de los 11 meses de edad. La vacuna recomendada por el CAV-AEP en nuestro país sigue siendo la VNC13.
(6) Vacuna frente al rotavirus (RV).– Dos o tres dosis de vacuna frente al rotavirus: a los 2 y 3-4 meses con la vacuna monovalente o a los 2, 3 y 4 meses o 2, 4 y 5-6 meses con la pentavalente. La pauta ha de iniciarse entre las 6 y las 12 semanas de vida (es muy importante para minimizar riesgos) y debe completarse antes de las 24 semanas en la monovalente y de las 32 en la pentavalente. El intervalo mínimo entre dosis es de 4 semanas. Ambas vacunas se pueden coadministrar con cualquier otra.
(7) Vacuna frente al meningococo B (MenB).– 4CMenB. Tres dosis: si se inicia a los 3 meses de edad, 2 dosis separadas por 2 meses y un refuerzo a partir de los 12 meses y con 6 meses de separación de la última de primoinmunización. Si se iniciara a los 2 meses serían precisas 4 dosis. Se recomienda una separación de 15 días con las otras vacunas inactivadas inyectables, hasta los 18 meses, para minimizar su posible reactogenicidad. No es necesaria la separación de 15 días con las vacunas de la varicela, triple vírica y del rotavirus.
(8) Vacuna conjugada frente al meningococo C (MenC) y vacuna frente a los meningococos ACWY (MenACWY).– Una dosis de vacuna conjugada MenC-TT a los 4 meses de edad. A los 12 meses y a los 12-14 años se recomienda una dosis de la vacuna MenACWY, aconsejándose un rescate progresivo hasta los 18 años de edad. En el caso de que los padres decidan no administrar MenACWY a los 12 meses, deberá aplicarse la MenC-TT financiada por la comunidad. También se sigue recomendando especialmente MenACWY para niños y adolescentes que vayan a residir en países en los que la vacuna se indique a esa edad (EE. UU., Canadá, Argentina, Austria, Grecia, Holanda, Italia, Reino Unido y Suiza) y para los que tengan factores de riesgo de EMI: asplenia anatómica o funcional, déficit de factores del complemento, tratamiento con eculizumab, receptores de trasplante de progenitores hematopoyéticos, infección por VIH, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo A, W o Y en el contexto de un brote epidémico.
(9) Vacuna frente al sarampión, la rubeola y la parotiditis (SRP).– Dos dosis de vacuna de sarampión, rubeola, y parotiditis (triple vírica). La 1.a a los 12 meses y la 2.a a los 3-4 años de edad. La 2.a dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, se recomienda vacunación con 2 dosis de SRP con un intervalo de, al menos, un mes.
(10) Vacuna frente a la varicela (Var).– Dos dosis: la 1.a a los 15 meses (también es aceptable a los 12 meses de edad) y la 2.a a los 3-4 años de edad. La 2.a dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, vacunar con 2 dosis de vacuna monocomponente con un intervalo de, al menos, un mes.
(11) Vacuna frente al virus del papiloma humano (VPH).– Vacunación sistemática universal frente al VPH, tanto de chicas como de chicos, a los 12 años, para prevenir los cánceres relacionados con este virus. Las 3 vacunas están autorizadas en varones, aunque con VPH2 es aún escasa la experiencia en ellos. Administrar 2 dosis a los 12 años. Pautas de vacunación según el preparado vacunal: para la vacuna tetravalente, pauta de 2 dosis (0 y 6 meses) entre 9 y 13 años, y pauta de 3 dosis (0, 2 y 6 meses) en ≥14 años; la bivalente y la nonavalente con pauta de 2 dosis (0 y 6 meses) entre 9 y 14 años y pauta de 3 dosis (0,1-2, según preparado vacunal, y 6 meses) para ≥15 años. Es posible su coadministración con las vacunas MenC, MenACWY, las de hepatitis A y B, y con Tdpa. No hay datos de coadministración con la vacuna de la varicela, aunque no debería plantear problemas.
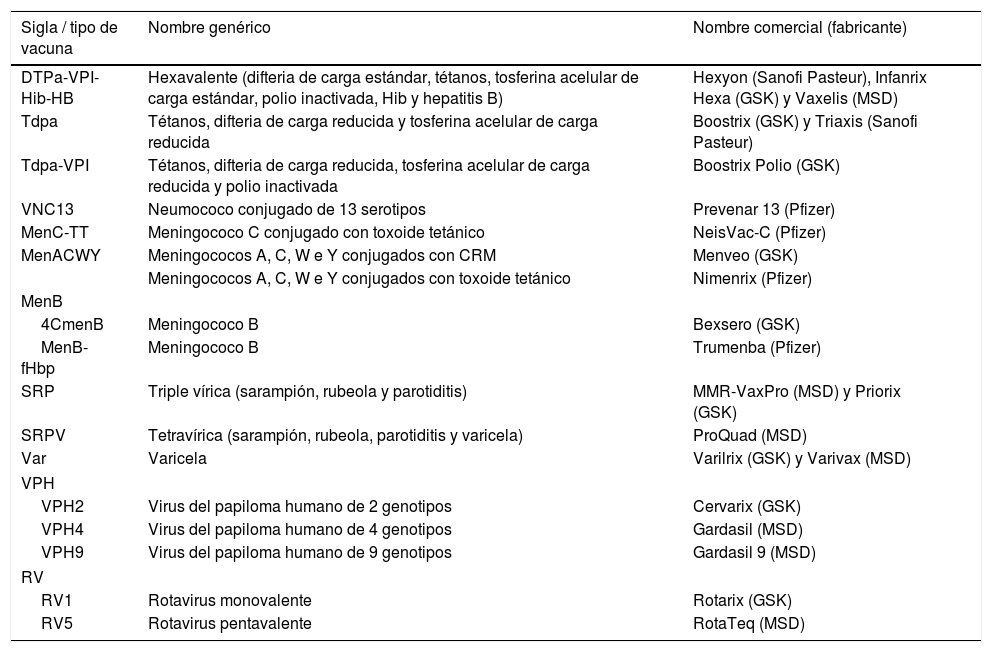
Se aconseja consultar el documento ampliado publicado en la web del CAV-AEP, donde se detallan los argumentos que sustentan estas recomendaciones. Además, las recomendaciones específicas para situaciones especiales y grupos de riesgo pueden consultarse en el Manual de vacunas en línea de la AEP. En la tabla 1 se expone un listado con las vacunas actuales.
Siglas, nombres genéricos y comerciales de las vacunas sistemáticas recomendadas por el CAV-AEP disponibles actualmente en España
| Sigla / tipo de vacuna | Nombre genérico | Nombre comercial (fabricante) |
|---|---|---|
| DTPa-VPI-Hib-HB | Hexavalente (difteria de carga estándar, tétanos, tosferina acelular de carga estándar, polio inactivada, Hib y hepatitis B) | Hexyon (Sanofi Pasteur), Infanrix Hexa (GSK) y Vaxelis (MSD) |
| Tdpa | Tétanos, difteria de carga reducida y tosferina acelular de carga reducida | Boostrix (GSK) y Triaxis (Sanofi Pasteur) |
| Tdpa-VPI | Tétanos, difteria de carga reducida, tosferina acelular de carga reducida y polio inactivada | Boostrix Polio (GSK) |
| VNC13 | Neumococo conjugado de 13 serotipos | Prevenar 13 (Pfizer) |
| MenC-TT | Meningococo C conjugado con toxoide tetánico | NeisVac-C (Pfizer) |
| MenACWY | Meningococos A, C, W e Y conjugados con CRM | Menveo (GSK) |
| Meningococos A, C, W e Y conjugados con toxoide tetánico | Nimenrix (Pfizer) | |
| MenB | ||
| 4CmenB | Meningococo B | Bexsero (GSK) |
| MenB-fHbp | Meningococo B | Trumenba (Pfizer) |
| SRP | Triple vírica (sarampión, rubeola y parotiditis) | MMR-VaxPro (MSD) y Priorix (GSK) |
| SRPV | Tetravírica (sarampión, rubeola, parotiditis y varicela) | ProQuad (MSD) |
| Var | Varicela | Varilrix (GSK) y Varivax (MSD) |
| VPH | ||
| VPH2 | Virus del papiloma humano de 2 genotipos | Cervarix (GSK) |
| VPH4 | Virus del papiloma humano de 4 genotipos | Gardasil (MSD) |
| VPH9 | Virus del papiloma humano de 9 genotipos | Gardasil 9 (MSD) |
| RV | ||
| RV1 | Rotavirus monovalente | Rotarix (GSK) |
| RV5 | Rotavirus pentavalente | RotaTeq (MSD) |
Las recomendaciones van dirigidas a pediatras, médicos de familia, profesionales de enfermería, matronas, familias y, en general, a todos aquellos interesados en una información actualizada sobre la vacunación pediátrica.
Los objetivos son promover el cumplimiento de los programas de vacunación oficiales y proponer a los profesionales sanitarios opciones para actualizar posibles vacunaciones demoradas y ampliar la protección individual con las vacunas no incluidas en calendarios oficiales.
Todo ello dentro del escenario epidemiológico propio y con la seguridad como pieza clave.
El CAV-AEP se reafirma en su objetivo de promover la consecución de un calendario de vacunaciones único, de forma que se mantenga el principio de igualdad en la prevención de enfermedad y en la oferta de salud a la población de todas las comunidades autónomas (CC. AA.).
Es necesario articular sistemas de debate para avanzar en otros importantes aspectos como los siguientes: mejorar la Atención Primaria como base del SNS y en la que se llevan a cabo las vacunaciones, abordar brechas de las coberturas de vacunación en algunas edades, poblaciones y lugares, contemplar fórmulas de cofinanciación de vacunas no incluidas en calendarios oficiales, instaurar un sistema de compensación de posibles, aunque raros e imprevisibles, daños ocasionados por vacunas y desarrollar una plataforma de información global sobre vacunaciones.
Al igual que en otros países, es necesario promover una nueva estructura técnica y científica de estudio y decisión de recomendaciones vacunales de ámbito nacional, siguiendo las recomendaciones de la OMS, lo que permitiría la sincronización de los diversos enfoques científicos, sociales y de gestión sanitaria implicados.
La AEP está abierta y dispuesta a participar y colaborar con el MSCBS, las CC. AA. y demás partes involucradas en las tareas y procesos de mejora de las vacunaciones.
Vacunación frente a hepatitis BRecomendación 2020:se recomienda vacunar a los lactantes con 3 dosis de vacuna hexavalente: 2, 4 y 11 meses de edad. En niños mayores y adolescentes no vacunados se aplicarán 3 dosis de vacuna monocomponente, con pauta 0, 1 y 6 meses.
En España, la tasa de incidencia anual de hepatitis B se mantiene por debajo de 2 casos/100.000 habitantes. En 2016 se notificaron 530 casos, lo que supuso una incidencia de 1,14 casos/100.0002.
Desde 2018, todas las comunidades autónomas inician a los 2 meses de edad, con preparado hexavalente, la serie vacunal de hepatitis B.
La vacunación precoz del recién nacido es preceptiva en hijos de madres HBsAg positivas o con serología desconocida, independientemente del peso al nacimiento, y siempre con vacuna monocomponente. Deberán recibir, además, inmunoglobulina antihepatitis B en las primeras 12 h de vida si el HBsAg materno es positivo. Los lactantes vacunados al nacimiento seguirán el calendario habitual del primer año, por lo que recibirán 4 dosis de HB.
Vacunación frente a difteria, tétanos, tosferina, poliomielitis y Haemophilus influenzae tipo BRecomendación 2020: se recomienda el esquema 2+1 con hexavalentes a los 2, 4 y 11 meses. Los niños vacunados con pauta 2+1 deben recibir DTPa-VPI, preferiblemente, o Tdpa-VPI a los 6 años y Tdpa a los 12-14 años. Se recomienda vacunar con Tdpa a las embarazadas, en cada embarazo, preferentemente entre las 27 y las 32 semanas de gestación, lo más precozmente posible. Si se sospecha posible prematuridad, se podría vacunar a partir de las 16 semanas.
La pauta 2+1 es suficientemente inmunógena y permite optimizar las dosis disponibles. Es posible adelantar la 1.a dosis a las 6 semanas de vida.
Los objetivos de la vacunación gestacional son evitar la tosferina en menores de 3 meses y disminuir la transmisión. La prioridad es la vacunación con Tdpa en la embarazada, sin olvidar las series primarias, los refuerzos y la vacunación del personal sanitario de las áreas de obstetricia y pediatría.
La vacunación gestacional es efectiva evitando la enfermedad (90-93%) y la muerte (95%) en menores de 2 meses3. La inmunogenicidad es elevada y, en algunos estudios, superior cuando se vacuna precozmente, a las 13-25 semanas frente a después de las 264, pero es necesario comprobar que no aumenten los casos de tosferina en menores de 2 meses con esta pauta. Si se vacuna en el tercer trimestre, el nivel de anticuerpos es mayor cuando se recibe entre las 27 y las 30 semanas5.
Algunos autores recomiendan que los prematuros sigan el esquema 3+1, ya que los estudios en este grupo se realizaron con dicha pauta, aunque se desconoce si es necesario. Muchos países europeos mantienen la pauta 2+16, lo cual facilita el cumplimiento del calendario, algunas veces retrasado o incompleto en ellos.
Los lactantes que sigan esquema 2+1 con hexavalentes deberán recibir el refuerzo de 6 años preferiblemente con preparados DTPa junto con componente antipolio (DTPa-VPI).
El aumento de casos de poliomielitis por virus salvaje en Pakistán y Afganistán obliga a estar atentos en caso de viajes internacionales.
Vacunación frente al neumococoRecomendación 2020:se recomienda vacunar frente al neumococo a todos los menores de 5 años, así como a todos los niños con enfermedades de riesgo de cualquier edad. Para la vacunación sistemática del lactante se recomienda el esquema 2+1 (2, 4 y 11 meses). El CAV-AEP recomienda seguir utilizando la vacuna neumocócica conjugada tridecavalente (VNC13), considerando la epidemiología de las infecciones neumocócicas en España antes de la introducción de esta vacuna y la experiencia de uso.
El impacto de las vacunas neumocócicas conjugadas, decavalente (VNC10) y VNC13, sobre las infecciones neumocócicas, invasoras (ENI) y no invasoras, producidas por los serotipos vacunales, ha condicionado que solo algunos casos de ENI estén causados por dichos serotipos vacunales. Se prevé que la vacunación infantil conseguirá la casi eliminación (90% de reducción) de la ENI por los serotipos vacunales en 10 años, si se mantienen coberturas vacunales altas. Por tanto, el impacto futuro de las VNC dependerá del reemplazo por SNV y de la capacidad de mantener tasas altas de vacunación.
El aumento de la ENI causada por SNV refleja los cambios en la colonización nasofaríngea, en los que, además de la vacuna, intervienen otros factores complejos difíciles de controlar, entre otros, el potencial invasor de los propios serotipos7. Esto explica la diversidad del fenómeno del reemplazo en diferentes países, incluso entre aquellos que utilizan la misma vacuna.
El incremento de ENI por los SNV, más acusado en>65 años, reduce, pero no anula, el beneficio neto de la vacunación7,8. Otro hecho es que el fenómeno de reemplazo puede llegar a cambiar la distribución de las diferentes formas de ENI.
Los EE. UU. representan una excepción al fenómeno de reemplazo, ya que no se ha detectado incremento de ENI por los SNV en ninguna edad7,9. Tampoco en Madrid se produjo incremento en ENI por SNV en menores de 15 años, pero sí en otras edades por los serotipos 8, 3, 12F, 22F, 12B y 24F.
A pesar de que en los países en los que se ha utilizado VNC10 se ha constatado un fuerte incremento de ENI por 19A, en un estudio realizado en Kenia, la incidencia de ENI por este serotipo no cambió ni se detectó reemplazo por otros SNV10.
Recientemente, se ha confirmado que el nivel de anticuerpos específicos necesario para evitar la colonización nasofaríngea (clave en la inmunidad de grupo) es superior al que se precisa para evitar ENI y diferente para los distintos serotipos.
Vacunación frente al rotavirusRecomendación 2020:la vacuna frente al rotavirus (RV) debería estar en el calendario sistemático para todos los lactantes.
Ahora mismo, más de 100 países han introducido en sus calendarios la vacunación frente al rotavirus. Los beneficios sanitarios de esta medida han sido enormes y en Europa los programas de vacunación han dado lugar a reducciones de carga de enfermedad del 60-90%, tanto en visitas de atención primaria como en hospitalizaciones11.
En España, los estudios revisados en los últimos 10 años muestran una alta efectividad, que oscila entre el 83 y el 96% frente a hospitalizaciones por rotavirus12.
La vacunación afecta también de forma indirecta y positiva al entorno no vacunado, lo que aumenta notablemente el impacto y la eficiencia. Se debe prestar especial atención, por su mayor vulnerabilidad, a los recién nacidos prematuros, que deben recibir la vacunación sin retrasos, incluso si estuvieran hospitalizados, antes de alcanzar las 12 semanas de vida13.
Los beneficios de la vacunación son muy superiores a los riesgos de invaginación intestinal, único efecto adverso grave relacionado, que es muy infrecuente (entre 1 y 5 casos/100.000 niños vacunados)14.
Vacunación frente a meningococosRecomendación 2020: la vacuna frente al meningococo B se recomienda de forma sistemática a lactantes a partir de los 3 meses de edad, con una pauta 2+1. Para el resto de las edades pediátricas, incluyendo la adolescencia, la recomendación es de tipo individual.
También se aboga por el uso de la vacuna MenC-TT a los 4 meses y por sustituir la dosis de MenC de los 12 meses por MenACWY. Es primordial que, en caso de no recibir esa vacuna, se asegure la dosis de MenC. Se mantiene la indicación de MenACWY en adolescentes, y se aconseja un rescate hasta los 18 años.
Existen en España 2vacunas para la prevención de enfermedad meningocócica invasora (EMI) por MenB: 4CMenB (desde los 2 meses de vida) y MenB-fHbp (autorizada en Europa a partir de 10 años), compuestas por antígenos proteicos subcapsulares.
Al ser la EMI por MenB una enfermedad muy poco frecuente, los estudios convencionales de coste/beneficio que se realizan con esta vacuna resultan desfavorables. Sin embargo, el CAV-AEP considera que debería ser incluida en el calendario sistemático por 2razones:
- 1)
La EMI es una enfermedad devastadora y el serogrupo más frecuentemente aislado en menores de 12 meses en España es el B15.
- 2)
Es una vacuna efectiva, como lo demuestra el impacto tras su introducción en el calendario del Reino Unido en 2015, siguiendo un esquema 2+1 en lactantes.
Los resultados de los primeros 10 meses del programa mostraron una efectividad del 83% frente a cualquier cepa de MenB, con una reducción del 50% de casos en población diana16. Tras 3 años de programa, se ha constatado una efectividad ajustada global del 58,9% (IC 95%: −31,5%-87,1%), con un 70,5% para cepas teóricamente cubiertas por la vacuna. Desde 2015 se han evitado 277 casos de EMI por MenB, y se ha observado, en las 3cohortes vacunadas, tasas de incidencia anual por debajo de las esperadas17, sin problemas de seguridad. Es posible que la 4CMenB pueda proporcionar protección cruzada frente a otros serogrupos.
Asumiendo ciertas incertidumbres esperables en cualquier vacuna de reciente desarrollo, el CAV-AEP considera que existen suficientes datos de impacto y seguridad para considerar a 4CMenB como una vacuna recomendable para todos los lactantes, el grupo de edad con mayor tasa de EMI, siguiendo una pauta 2+1 con inicio a los 3 meses. Ya son 2las comunidades españolas (Castilla y León y Canarias) que han incluido 4CMenB en el calendario oficial infantil.
El CAV-AEP recomienda la vacunación frente al meningococo B en los adolescentes para mejorar la protección individual, pero no de forma sistemática, toda vez que estas vacunas no reducen la colonización nasofaríngea ni generan inmunidad de grupo18.
La efectividad de la vacuna monovalente frente al MenC ha sido ampliamente demostrada. La tasa de EMI por serogrupo C en España se ha mantenido muy baja durante la temporada 2017-2018 (0,08 casos/100.000 habitantes)15.
A partir del año 2000, se ha producido un aumento notable en la incidencia de EMI por serogrupos W e Y en Europa19, por lo que, muchos países han modificado su política vacunal contra la EMI, sustituyendo la dosis de MenC por MenACWY en el segundo año de vida o en la adolescencia. Algunos países americanos como EE. UU., Canadá, Chile y Argentina han incluido también MenACWY en sus calendarios20.
En España, desde la temporada 2014-2015, se detecta un aumento en la incidencia anual de EMI, tendencia que se ha mantenido año tras año, debido al incremento en la incidencia de EMI por W e Y. Los últimos datos del Centro Nacional de Epidemiología (semana 32 de 2019) reflejan un claro incremento: 77 casos de EMI por W (tasa 0,16/100.000) y 48 por Y (tasa 0,10/100.000)15.
Con estos datos, la Comisión de Salud Pública publicó en 2019 un documento con las recomendaciones de vacunación frente a EMI. Con relación a MenACWY, considera prioritaria la vacunación de adolescentes y adultos jóvenes, sustituyendo la MenC de los 12 años por MenACWY y planeando una vacunación de rescate a adolescentes de 13 a 18 años en un plazo de 2-3 años, con lo que busca alcanzar impacto epidemiológico lo antes posible21. Por otra parte, Castilla y León ha incluido MenACWY en su calendario oficial a los 12 meses y a los 12 años. Andalucía lo hará durante 2020.
El CAV-AEP apoya la sustitución de MenC por MenACWY en la adolescencia, pero también a los 12 meses, a la vista de la tendencia creciente en la incidencia de EMI por W e Y en menores de 5 años. En caso de no administrarse MenACWY a los 12 meses, se debe asegurar la dosis de MenC para evitar una caída en las coberturas.
Vacunación frente a sarampión, rubeola y parotiditis (vacuna triple vírica: SRP)Recomendación 2020: se recomienda que la 1.adosis de SRP se administre a los 12 meses de edad y la 2.aa los 3-4 años. Esta última se puede aplicar como vacuna tetravírica (SRPV).
Debido a una cobertura subóptima en algunos países, la prevalencia del sarampión presenta un incremento continuado en los últimos años en las 6 regiones de la OMS. En la Región Europea, durante el primer semestre de 2019, la cifra se ha duplicado respecto al mismo periodo de 201822 y 4países han perdido la categoría de libres de sarampión (no así España). Persisten brotes de parotiditis, mientras que la rubeola permanece estable23. Mantener coberturas vacunales por encima del 95% para las 2 dosis y una vigilancia epidemiológica estrecha son esenciales para la eliminación de estas enfermedades.
Algunos estudios han detectado un mayor riesgo de sufrir convulsiones febriles cuando se administra SRPV como primera dosis en menores de 2 años de edad, por lo que se recomienda, por el momento, administrar los 2preparados por separado (SRP y V), por debajo de esa edad24.
Vacunación frente a varicelaRecomendación 2020:se recomienda la vacunación frente a varicela en todos los niños con 2 dosis, a los 15 meses y a los 3-4 años de edad (en la segunda dosis se puede utilizar la tetravírica). Se recomienda, además, vacunación de rescate, con 2dosis (o completar la pauta de 2 dosis) a todos los niños y adolescentes que no hayan padecido la enfermedad.
Desde 2016, todas las CC. AA. incluyen la vacunación de varicela con una pauta de 2 dosis (a los 15 meses y a los 3-4 años)25. Se dispone de 2vacunas monocomponentes y 2tetravíricas, que muestran una elevada efectividad (92-97,3%)26.
En 2019, 9CC. AA. introdujeron la SRPV como segunda dosis, lo que facilita el cumplimiento del calendario vacunal.
La estrategia de vacunación universal frente a varicela ha demostrado ser coste-efectiva27. Tras más de 20 años de vacunación en países como EE. UU., la incidencia de enfermedad ha disminuido globalmente28, al igual que la del herpes zóster en población infantil29. No se ha documentado desplazamiento de varicela a edades posteriores, ni tampoco incremento en la incidencia poblacional de herpes zóster30.
Vacunación frente al papilomavirus humano (VPH)Recomendación 2020:vacunación sistemática universal frente al VPH, tanto de chicas como de chicos, preferentemente a los 12 años, para prevenir la enfermedad oncológica relacionada con este virus.
La edad óptima de vacunación son los 12 años, con 2 dosis, para alcanzar máxima inmunogenicidad y mayor beneficio potencial, al administrarse antes de las primeras relaciones sexuales, y aspirar a la mayor cobertura vacunal posible. La recomendación de vacunación es aplicable a edades posteriores, en caso de retraso en su administración, y a grupos de especial riesgo, dados los beneficios que aporta.
Esta vacunación, en chicas, sigue demostrando gran eficacia y efectividad para la prevención de infección persistente por VPH, de verrugas genitales y de lesiones cervicales preneoplásicas, con hasta un 85% de prevención de lesiones de alto grado, incluso pasados 10 años31,32.
En varones, la eficacia vacunal es más elevada en la prevención del cáncer relacionado con VPH en los sujetos que no han iniciado actividad sexual33.
Estas vacunas son extremadamente seguras y su balance beneficio/riesgo es muy favorable31. Los únicos eventos adversos descritos son la anafilaxia, común a todas las vacunas, y el síncope34. Aun así, la cobertura en España continúa siendo muy inferior a la del resto de vacunas sistemáticas35.
La vacunación en varones ya está en el calendario de 29 países, a los que recientemente se han sumado Alemania y Reino Unido34,36. Hay datos relevantes sobre el papel etiopatogénico del VPH en ciertos tipos de cáncer que afectan a ambos sexos, pero más en varones, como el cáncer anal y el de cabeza y cuello37. La inmunogenicidad es comparable a la obtenida en chicas38. Por todo ello, el CAV-AEP recomienda vacunar también a varones adolescentes.
En nuestro país, hay 3vacunas disponibles: la de 9 tipos (VPH9), la de 4 y la de 239,40. Las 3proporcionan protección frente al cáncer de cérvix y lesiones precancerosas, aunque las 2primeras protegen también de verrugas genitales. La VPH9 ofrece la mayor cobertura directa frente a enfermedad oncológica cervical (90%) y una prevención potencial de cánceres vulvar, vaginal y anal relacionados con VPH (85-95%)41. Todas están autorizadas para su uso en ambos sexos. En el caso de la vacunación VPH financiada, este comité recomienda aceptar el preparado seleccionado por cada comunidad autónoma.
FinanciaciónLa elaboración de estas recomendaciones (análisis de los datos publicados, debate, consenso y publicación) no ha contado con ninguna financiación externa a la logística facilitada por la AEP.
Conflicto de interesesRespecto a los últimos 5 años:
FJAG ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer, Sanofi Pasteur y MSD y ha actuado como consultor en Advisory Board de GlaxoSmithKline, Novartis, Pfizer, Sanofi Pasteur y MSD.
MJCO ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer, Sanofi Pasteur y MSD, como investigadora en ensayos clínicos de GlaxoSmithKline y Pfizer, y como consultora en Advisory Board de GlaxoSmithKline, Novartis, Pfizer, Sanofi Pasteur y MSD.
JAA ha colaborado en actividades docentes subvencionadas por Astra, GlaxoSmithKline, Pfizer, Sanofi Pasteur y MSD, como investigador en ensayos clínicos de GlaxoSmithKline y Sanofi Pasteur y como consultor en Advisory Board de GlaxoSmithKline, MSD, Sanofi Pasteur y Pfizer.
MGS ha colaborado en actividades docentes subvencionadas por Astra, GlaxoSmithKline, Pfizer, Sanofi Pasteur y MSD, como investigadora en ensayos clínicos de GlaxoSmithKline, Janssen, Sanofi Pasteur y MSD y como consultora en Advisory Board de GlaxoSmithKline y Novartis.
NGS ha colaborado en actividades docentes subvencionadas por Sanofi Pasteur y MSD y ha asistido a actividades docentes subvencionadas por Novartis y Pfizer.
EGL ha recibido ayuda económica para asistir a actividades docentes nacionales y ha participado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer, Sanofi Pasteur y MSD como investigadora en ensayos clínicos de GlaxoSmithKline y como consultora en Advisory Board de GlaxoSmithKline.
AHM ha recibido ayuda económica para asistir a actividades docentes nacionales y ha participado en actividades docentes subvencionadas por Pfizer.
AIA ha colaborado en actividades docentes subvencionadas por GSK, Pfizer, Sanofi Pasteur y MSD, ha recibido ayuda económica de Pfizer para asistir a actividades docentes nacionales y ha asistido a actividades docentes subvencionadas por GSK, MSD y Pfizer.
MMM ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer, Sanofi Pasteur y MSD, como investigador en ensayos clínicos de GlaxoSmithKline, Pfizer, Sanofi Pasteur y MSD y como consultor en Advisory Board de Novartis.
AMM ha recibido ayuda económica de Pfizer para asistir a actividades docentes nacionales e internacionales, aunque desde que es miembro del CAV-AEP no ha aceptado patrocinio directo alguno de ningún laboratorio farmacéutico para ninguna actividad (ni docente, ni discente).
MLNG ha colaborado en actividades docentes subvencionadas por Gilead, GlaxoSmithKline, Janssen, Pfizer, MSD y ViiV, como consultor en Advisory Board para Abbott, Astra Zeneca, Novartis y ViiV y en ensayos clínicos promovidos por GlaxoSmithKline, Pfizer, Roche y Sanofi Pasteur.
JRC ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer, Sanofi Pasteur y MSD y como investigador en ensayos clínicos de GlaxoSmithKline y Pfizer.
A Javier Arístegui, José María Corretger y Luis Ortigosa, por su asesoría interna en la redacción y elaboración de estas recomendaciones.
Francisco José Álvarez García. Pediatra. Centro de Salud de Llanera. Asturias. Profesor Asociado en Ciencias de la Salud. Departamento de Medicina. Universidad de Oviedo.
María José Cilleruelo Ortega. Servicio de Pediatría. Hospital Universitario Puerta de Hierro-Majadahonda, Madrid. Departamento de Pediatría. Facultad de Medicina. Universidad Autónoma de Madrid.
Javier Álvarez Aldeán. Pediatra. Jefe de Servicio de Pediatría. Hospital Costa del Sol. Marbella. Málaga.
María Garcés-Sánchez. Pediatra. Centro de Salud Nazaret. Valencia. Investigadora adscrita al Área de Vacunas. FISABIO. Valencia.
Nuria García Sánchez. Pediatra. Centro de Salud Delicias Sur. Zaragoza. Profesora Asociada en Ciencias de la Salud. Departamento de Pediatría. Facultad de Medicina. Universidad de Zaragoza.
Elisa Garrote Llanos. Pediatra. Sección de Infectología del Hospital Universitario Basurto. Bilbao. Profesora Asociada. Facultad de Medicina. Universidad del País Vasco. UPV-EHU.
Ángel Hernández Merino. Pediatra. Centro de Salud La Rivota. Alcorcón. Madrid.
Antonio Iofrío de Arce. Pediatra. Centro de Salud El Ranero. Murcia.
Manuel Merino Moína. Pediatra. Centro de Salud El Greco. Getafe. Madrid.
Abián Montesdeoca Melián. Pediatra. Centro de Salud de Guanarteme. Las Palmas de Gran Canaria.
María Luisa Navarro Gómez. Servicio de Pediatría. Hospital Universitario Gregorio Marañón. Madrid. Profesora asociada. Departamento de Pediatría. Facultad de Medicina. Universidad Complutense de Madrid.
Jesús Ruiz-Contreras. Servicio de Pediatría. Hospital Universitario 12 de octubre. Madrid. Catedrático de Pediatría. Facultad de Medicina. Universidad Complutense de Madrid.