El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) actualiza anualmente el calendario de vacunaciones teniendo en cuenta tanto aspectos epidemiológicos, como de seguridad, efectividad y eficiencia de las vacunas.
El presente calendario incluye grados de recomendación. Se han considerado como vacunas sistemáticas aquellas que el CAV-AEP estima que todos los niños deberían recibir; como recomendadas las que presentan un perfil de vacuna sistemática en la edad pediátrica y que es deseable que los niños reciban, pero que pueden ser priorizadas en función de los recursos para su financiación pública; y dirigidas a grupos de riesgo aquellas con indicación preferente para personas en situaciones de riesgo. Los calendarios de vacunaciones tienen que ser dinámicos y adaptarse a los cambios epidemiológicos que vayan surgiendo. El CAV-AEP considera como objetivo prioritario la consecución de un calendario de vacunación único para toda España.
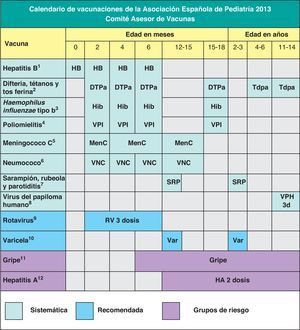
Teniendo en cuenta los últimos cambios en la epidemiología de las enfermedades, el CAV-AEP mantiene las novedades propuestas la temporada anterior, como la administración de las primeras dosis de las vacunas triple vírica y varicela a los 12 meses y las segundas dosis a los 2-3 años, así como la administración de la vacuna Tdpa a los 4-6 años, siempre acompañada de otra dosis a los 11-14 años, con preferencia a los 11-12 años.
El CAV-AEP estima que deben incrementarse las coberturas de vacunación frente al papilomavirus humano en las niñas de 11 a 14 años, con preferencia a los 11-12 años. Se reafirma en la recomendación de incluir la vacunación frente al neumococo en el calendario de vacunación sistemático. La vacunación universal frente a la varicela en el segundo año de vida es una estrategia efectiva y, por tanto, un objetivo deseable. La vacunación frente al rotavirus, dadas la morbilidad y la elevada carga sanitaria, es recomendable en todos los lactantes. Se insiste en la necesidad de vacunar frente a la gripe y a la hepatitis A a todos los que presenten factores de riesgo para dichas enfermedades.
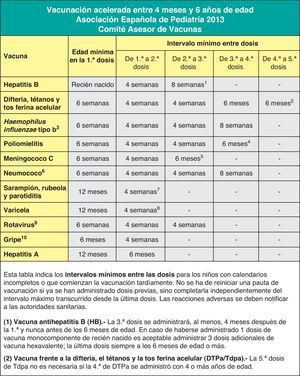
Finalmente, se insiste en la necesidad de actualizar las vacunaciones incompletas con las pautas de vacunación acelerada.
The Advisory Committee on Vaccines of the Spanish Association of Paediatrics (CAV-AEP) updates the immunisation schedule every year, taking into account epidemiological data as well as evidence on the safety, effectiveness and efficiency of vaccines.
The present schedule includes levels of recommendation. We have graded as routine vaccinations those that the CAV-AEP consider all children should receive; as recommended those that fit the profile for universal childhood immunisation and would ideally be given to all children, but that can be prioritised according to the resources available for their public funding; and as risk group vaccinations those that specifically target individuals in situations of risk. Immunisation schedules tend to be dynamic and adaptable to ongoing epidemiological changes. Nevertheless, the achievement of a unified immunisation schedule in all regions of Spain is a top priority for the CAV-AEP.
Based on the latest epidemiological trends, CAV-AEP follows the innovations proposed in the last year's schedule, such as the administration of the first dose of the MMR and the varicella vaccines at age 12 months and the second dose at age 2-3 years, as well as the administration of the Tdap vaccine at age 4-6 years, always followed by another dose at 11-14 years of age, preferably at 11-12 years.
The CAV-AEP believes that the coverage of vaccination against human papillomavirus in girls aged 11-14 years, preferably at 11-12 years, must increase. It reasserts its recommendation to include vaccination against pneumococcal disease in the routine immunisation schedule. Universal vaccination against varicella in the second year of life is an effective strategy and therefore a desirable objective.
Vaccination against rotavirus is recommended in all infants due to the morbidity and elevated healthcare burden of the virus. The Committee stresses the need to vaccinate population groups considered at risk against influenza and hepatitis A.
Finally, it emphasizes the need to bring incomplete vaccinations up to date following the catch-up immunisation schedule.
Como en años anteriores, el Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) actualiza el calendario de vacunaciones teniendo en cuenta la evidencia disponible sobre la seguridad, la efectividad y la eficiencia de las vacunas infantiles, así como la epidemiología de las enfermedades inmunoprevenibles en nuestro medio.
Estas recomendaciones van dirigidas a pediatras, médicos de familia, personal de enfermería, familiares de los niños y, en general, a todas aquellas personas interesadas en disponer de una información actualizada sobre la vacunación en la edad pediátrica.
Teniendo en cuenta que en España los calendarios oficiales de vacunación son sufragados en su totalidad por los servicios públicos de salud, desde 2010 el calendario de este comité incluye grados de recomendación para las diferentes vacunas, con el objeto de establecer niveles de prioridad en la financiación pública de las mismas, considerando no solo su efectividad y seguridad, sino también la carga de enfermedad en nuestro medio y, cuando es posible, también criterios de eficiencia. Este mismo criterio pretende orientar al pediatra sobre las recomendaciones dirigidas a los padres acerca de las vacunas contempladas en este calendario, pero no incluidas en los calendarios oficiales. En la figura 1 se muestra el calendario de vacunaciones recomendado por el CAV-AEP para 2013, clasificando las vacunas en sistemáticas, recomendadas y las dirigidas a grupos de riesgo. Se han considerado como vacunas sistemáticas aquellas que el CAV-AEP estima que todos los niños en España deberían recibir de forma universal; como recomendadas las que presentan un perfil de vacuna sistemática en la edad pediátrica y que el CAV-AEP considera deseable que todos los niños reciban, pero que, por razones de coste-efectividad, su prioridad se establece en función de las posibilidades económicas de su financiación pública, y dirigidas a grupos de riesgo aquellas que se consideran indicadas para personas en situaciones ambientales o personales que incrementen el riesgo de presentar las enfermedades para las que van dirigidas o de presentar formas más graves si las padeciesen o bien porque tengan una enfermedad de base que pueda agravarse o desestabilizarse si contraen la enfermedad infecciosa.
Se sigue haciendo hincapié en la necesidad de que las inmunizaciones sistemáticas alcancen a todos los niños, eliminando las disparidades étnicas, territoriales, sociales y económicas. Se considera un objetivo primordial poner al día el calendario de vacunación en los niños inmigrantes y en aquellos cuyo calendario de vacunación esté incompleto, no solo para lograr su protección individual ante las enfermedades inmunoprevenibles, sino también para evitar la formación de grupos de población susceptible que puedan dar lugar a la aparición de brotes epidémicos, como los de sarampión que han sucedido muy recientemente en España. Los contactos esporádicos que algunos niños tienen con los servicios de salud (urgencias, ingreso hospitalario, pediatra, médico de cabecera o enfermera) deben ser aprovechados para la actualización de su calendario de vacunación.
Este año se han incluido al inicio de cada apartado los puntos clave de actuación con cada una de las vacunas. Dentro de los mismos, se insiste en los cambios propuestos desde el año pasado1, destacando:
- –
Las primeras dosis de las vacunas triple vírica (TV) y de la varicela se recomiendan a los 12 meses.
- –
Las segundas dosis de las vacunas TV y de la varicela se recomiendan entre los 2 y 3 años, con preferencia por los 2 años.
- –
Si las circunstancias epidemiológicas lo requieren, se recomienda una dosis de refuerzo frente al meningococo C a aquellos niños que hayan recibido solamente la serie primaria en el primer año de vida sin refuerzo a partir de los 12 meses de edad.
- –
Se recomienda la vacuna combinada de baja carga antigénica frente al tétanos, la difteria y la tos ferina (Tdpa) a los 4-6 años, pero obligatoriamente seguida de otra dosis de Tdpa a los 11-14 años, con preferencia a los 11-12 años.
Los calendarios de vacunaciones tienen que ser dinámicos y adaptarse a los cambios epidemiológicos que vayan surgiendo, así como a la incorporación de nuevas vacunas o novedades relacionadas con las vacunas ya existentes. Algunas modificaciones propuestas en este nuevo calendario ya están siendo aplicadas en algunas comunidades españolas. El CAV-AEP sigue considerando un objetivo primordial la consecución de un calendario único de vacunación, de forma que se mantenga el principio de igualdad en la prevención de la salud y el principio de racionalidad que facilite el cumplimento de las inmunizaciones en los niños que cambien de comunidad autónoma como lugar de residencia. En la actualidad, no hay diferencias epidemiológicas en las enfermedades inmunoprevenibles entre las diferentes comunidades autónomas (CC. AA.), con la posible excepción de la hepatitis A en Ceuta y Melilla, que justifiquen la existencia de calendarios de vacunaciones distintos2. El CAV-AEP estima que es necesario un esfuerzo colectivo de todos los agentes sanitarios y políticos implicados en la toma de decisiones sobre el diseño del calendario de vacunaciones para los niños residentes en España y sigue ofreciendo su colaboración para la consecución de este sensato objetivo.
Vacunación frente a la hepatitis BRecomendación CAV-AEP 2013: el CAV-AEP recomienda que la vacunación frente a la hepatitis B se realice en el primer año de vida con 3 o 4 dosis en forma de vacuna monocomponente, pentavalente o hexavalente. En niños mayores, se aplicarán 3 dosis de vacuna monocomponente con la pauta 0, 1 y 6 meses.
La vacunación frente a la hepatitis B requiere 3 dosis que pueden administrarse según las siguientes pautas equivalentes: 0, 1 y 6 meses; 0, 2 y 6 meses; 2, 4 y 6 meses. Los 3 esquemas son adecuados para hijos de madres seronegativas (HBsAg [del inglés Hepatitis B surface antigen] negativo). Las 2 primeras pautas son también correctas para hijos de madres portadoras del virus de la hepatitis B (HBsAg positivo). Estos últimos deben recibir, además, 0,5ml de inmunoglobulina específica antihepatitis B, por vía intramuscular, preferiblemente en las primeras 12 horas de vida y en un lugar anatómico diferente de la zona de la vacuna.
La vacunación en el primer año con 4 dosis es aceptable si se utiliza la vacuna combinada hexavalente (DTPa-VPI-Hib-HB [difteria, tétanos, tos ferina-vacuna antipoliomielítica inactivada-Haemophilus influenzae tipo b-hepatitis B]) a los 2, 4 y 6 meses de vida en aquellas CC. AA. donde se vacuna frente a la hepatitis B al nacimiento con preparado monocomponente2. Otra opción, en caso de vacunación sistemática neonatal, es la administración alternante de vacuna hexavalente a los 2 y 6 meses y pentavalente (DTPa-VPI-Hib) a los 4 meses3,4.
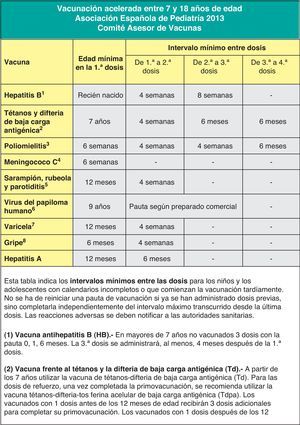
El intervalo mínimo recomendado entre la 1.a y la 2.a dosis es de 4 semanas, y entre la 2.a y la 3.a, de 8 semanas. La dosis final de la serie debe administrarse no antes de las 24 semanas de edad (aproximadamente 6 meses) y, al menos, 16 semanas (aproximadamente 4 meses) después de la 1.ª dosis. Las dosis administradas antes de estos intervalos recomendados deben considerarse no válidas.
En los prematuros de menos de 2.000g de peso al nacimiento, que sean hijos de madres HBsAg negativas y que vivan en CC. AA. donde esté establecida la vacunación universal neonatal frente a la hepatitis B, se recomienda posponer la 1.ª dosis de la vacuna hasta que hayan alcanzado un mes de edad cronológica o al alta hospitalaria. En el caso de prematuros de menos de 2.000g de peso al nacimiento, que sean hijos de madres HBsAg positivas o de serología desconocida, se recomienda vacunarlos y administrarles la inmunoglobulina específica en las primeras 12 horas de vida, si bien debe considerarse esta vacunación como dosis no contabilizable y repetirse al mes de edad, por lo que han de recibir un total de 4 dosis5.
La vacunación de rescate frente a la hepatitis B en niños mayores y adolescentes no vacunados con anterioridad se realizará siguiendo la pauta 0, 1 y 6 meses4.
En sujetos no incluidos en grupos de riesgo no es preciso realizar controles serológicos posvacunación (anticuerpos anti-HBs) tras completar la serie frente a la hepatitis B6.
Por otro lado, en las personas de riesgo, que es en quienes está indicada esta determinación analítica, solo se considerará fiable el resultado si se efectúa 1-2 meses después de la dosis final de la pauta (pero no antes de los 9 meses de edad y junto con la determinación de HBsAg, en hijos de madres HBsAg positivas). Si la determinación de anti-HBs se realiza posteriormente a estos 2 meses y el resultado es negativo, no implica necesariamente falta de respuesta a la vacunación porque entre el 15 y el 50% de las personas vacunadas negativizan los anti-HBs y siguen protegidos por la memoria inmunológica de esta vacuna4. Si el resultado fuera negativo, y dentro del plazo de 1-2 meses, se recomienda una nueva serie completa de 3 dosis con la pauta habitual (0, 1 y 6 meses) y si la determinación posterior de anti-HBs, 1-2 meses después, persistiese negativa (< 10 mUI/ml) deberán ser considerados finalmente como no respondedores a la vacunación frente a la hepatitis B y no deben aplicárseles más dosis. Estos pacientes, en caso de exponerse a un riesgo de infección, deberán recibir inmunoglobulina específica antihepatitis B.
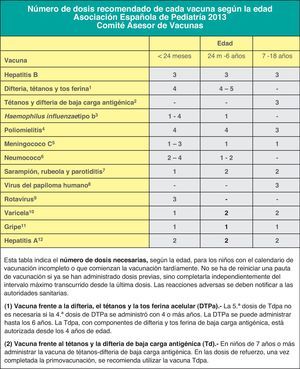
Vacunación frente a la difteria, el tétanos, la tos ferina, la poliomielitis y el Haemophilus influenzae tipo bRecomendación CAV-AEP 2013: el CAV-AEP recomienda la primovacunación de DTPa-VPI-Hib-HB a los 2, 4 y 6 meses, siendo aceptable el empleo de la vacuna hexavalente o de la pentavalente más vacuna monocomponente de hepatitis B. Se puede valorar adelantar la 1.ª dosis a las 6 semanas de vida. El refuerzo con DTPa-VPI-Hib debe realizarse a los 15-18 meses, con un refuerzo posterior con Tdpa a los 4-6 años y a los 11-14 años, con preferencia a los 11-12 años.
Se recomienda la vacunación con Tdpa del entorno familiar de los recién nacidos (especialmente de la madre no previamente vacunada en el embarazo), así como la vacunación de la embarazada a partir de la semana 20 de gestación o en el puerperio inmediato.
Como en ediciones precedentes, el CAV-AEP continúa recomendando el uso de vacunas combinadas porque facilita la administración conjunta de varias vacunas en el mismo momento y lugar anatómico, al tiempo que reduce el número de inyecciones y las molestias al niño, evita errores, acorta los tiempos de administración, mejora las coberturas y simplifica el calendario de vacunación. Por todas estas razones, el CAV-AEP recomienda el uso de la vacuna hexavalente (DTPa-VPI-Hib-HB) durante la primovacunación a los 2, 4 y 6 meses1.
Por cuestiones económicas o por problemas de abastecimiento de la vacuna hexavalente, se puede recurrir al preparado pentavalente (DTPa-VPI-Hib), completándose el calendario sistemático con una o varias dosis frente a la hepatitis B (monocomponente), según el esquema recomendado para esta vacunación. La evidencia científica adquirida a través de amplios ensayos clínicos apoya el uso de estas vacunas combinadas, sin que exista incompatibilidad con otras inmunizaciones, ni interferencias antigénicas reseñables7-9. Es importante señalar que la vacuna pentavalente es la idónea para inmunizar como dosis de refuerzo a los 15-18 meses (4.ª dosis de DTPa, VPI y Hib).
En nuestro país, la administración de la 5.ª dosis de DTPa (refuerzo) correspondiente a los 4-6 años se ha llevado a cabo hasta el año 2010 con DTPa (Infanrix®). Sin embargo, la tendencia ha sido a sustituirla por la vacuna Tdpa (de baja carga antigénica frente a la difteria y la tos ferina) y así se ha realizado ya en 14 CC. AA., Ceuta y Melilla, basándose en las recomendaciones de algunas publicaciones científicas y especialmente en la recomendación de la Ponencia del Programa y Registro de Vacunaciones que propuso a la Comisión de Salud Pública la sustitución de la DTPa administrada como 5.ª dosis en el calendario del Consejo Interterritorial del Sistema Nacional de Salud (CISNS) por una vacuna Tdpa10. La justificación de este cambio se consensuó por el menor coste y por la menor frecuencia de reacciones adversas que las observadas con DTPa. Igualmente, la respuesta inmunitaria frente a la tos ferina, el tétanos y la difteria fue similar a la observada por el uso de las vacunas de alta carga antigénica o de las vacunas Td y similar a la respuesta que se obtuvo en estudios de eficacia en contactos en el ámbito familiar11.
El CAV-AEP comparte la recomendación de aplicar Tdpa en la 5.ª dosis, pero además considera que esta 5.ª dosis debería ser complementada forzosamente con una 6.ª dosis con esta misma vacuna en la adolescencia, estrategia que actualmente realizan 21 países en el mundo (entre ellos, Estados Unidos, Canadá, Australia, Argentina, México, y varios países europeos como Alemania, Francia, Italia y Finlandia)12,13. En España, la Comunidad de Madrid y las ciudades autónomas de Ceuta y Melilla también han implantado esta pauta2, dada la disminución de la inmunidad frente a la tos ferina que se produce con el paso de los años14. El CAV-AEP estima que la edad óptima para esta dosis es de los 11 a los 14 años, con preferencia entre los 11 y los 12 años. En otros países, se recomienda posteriormente una dosis de refuerzo cada 10 años (Td o preferible Tdpa)13. En España, las recomendaciones oficiales del Ministerio consideran que los niños que completan su calendario de vacunación en la adolescencia no precisarán otra dosis hasta los 60-65 años de edad y que un adulto está bien vacunado con 5 dosis de tétanos recibidas a lo largo de su vida15. Actualmente, en España existen 2 preparados comerciales disponibles de Tdpa de características similares, Boostrix® (GlaxoSmithKline) y Triaxis® (Sanofi Pasteur MSD), autorizadas para su uso en niños a partir de los 4 años de edad, y ambos prácticamente sin reactogenicidad y con buena inmunogenicidad, lo que los hace idóneos para las estrategias recomendadas.
En los últimos años, se ha venido observado un resurgimiento de la infección por Bordetella pertussis en países desarrollados, incluidos aquellos que tienen coberturas de vacunación elevadas, sobre todo en adolescentes y adultos, y en segundo lugar, en lactantes menores de 3-4 meses16,17. Este incremento se ha justificado por una disminución de la inmunidad vacunal y natural, debida al paso del tiempo, y por el descenso de la incidencia de la enfermedad a consecuencia de las campañas de vacunación, lo que ha conducido a una disminución del efecto de refuerzo (booster) inducido por la infección natural. Consecuentemente, dada la circulación de la bacteria en la comunidad, se ha producido un aumento de casos de tos ferina en lactantes de corta edad, habitualmente menores de 3-4 meses, aún no vacunados o con solo una dosis de DTPa a los 2 meses. Precisamente, este grupo de edad es el que presenta mayor morbimortalidad de los pacientes afectados.
Por estas razones, se están desarrollando estrategias complementarias para controlar este resurgimiento de la enfermedad y que se exponen a continuación18.
La primovacunación con DTPa se ha venido recomendando rutinariamente desde los 2 meses de edad. Sin embargo, organismos como la American Academy of Pediatrics (AAP) y el Advisory Committee on Immunization Practices (ACIP) consideran que la edad mínima se puede adelantar a las 6 semanas19-21, estrategia que podría reducir aproximadamente el 9% de los casos de tos ferina, el 6% de las muertes y el 9% de las hospitalizaciones20,21. La vacunación del recién nacido es controvertida22-25 y aún no se recomienda por ningún organismo oficial.
La estrategia del nido (cocooning)23,24,26 está diseñada para proteger al recién nacido y al lactante aún no inmunizados mediante la vacunación de los padres (especialmente de la madre) y convivientes que vayan a tener contacto con el niño. La madre debe ser inmunizada antes del alta hospitalaria, en el puerperio inmediato.
Desde 2011, en EE. UU.27 y en Argentina se recomienda la estrategia de vacunación de la madre durante la gestación a partir de las 20 semanas. Recientemente, Reino Unido ha recomendado la vacunación contra la tos ferina en todas las embarazadas entre las semanas 28 y 38 de gestación28. Esta estrategia permite el paso transplacentario de anticuerpos protectores al recién nacido y se considera el modo más efectivo para protegerlos, sin evidencia de riesgo para la madre ni el niño.
La evidencia científica acumulada en varios ensayos clínicos ha demostrado que las vacunas Tdpa confieren protección mantenida por el incremento elevado de anticuerpos tras la dosis de refuerzo con respuestas similares a la dosis previa y con una tolerancia excelente en adultos y adolescentes29. Esto ha sido avalado por ensayos clínicos diseñados en voluntarios para recibir un recuerdo de Tdpa, 10 años después de haber sido previamente vacunados, demostrándose que un 92% presentó niveles de anticuerpos adecuados de protección frente a los antígenos vacunales de la difteria, el tétanos y la tos ferina (toxoide pertúsico, hemaglutinina filamentosa y pertactina)30. Aun así, se han venido observando fallos vacunales a pesar de la excelente efectividad/eficiencia de las vacunas.
Otras medidas adicionales que deben valorarse son: la vacunación obligatoria de todos los profesionales de la salud, es decir, cualquier sanitario cuya actividad implique contacto con pacientes o con fluidos orgánicos de enfermos, en un servicio sanitario o en un laboratorio, especialmente aquellos en contacto directo con los niños (Ginecología, Pediatría, Neonatología y Unidades de Cuidados Intensivos Pediátricos), para reducir la morbilidad asociada a la transmisión de la tos ferina en los centros sanitarios31,32; la administración de un refuerzo sistemático para todos los adultos incluidos los mayores de 65 años17,19, y el refuerzo rutinario de Tdpa en todos los adultos en caso de heridas en vez de la administración de Td33.
En cuanto a la vacunación frente al Hib, en España se dispone de una presentación conjugada en forma monocomponente frente al mismo, en la que el polisacárido capsular se conjuga con la proteína del toxoide tetánico (PRP-T) que le sirve como transportador, como así sucede en los preparados combinados pentavalentes (DTPa-VPI-Hib) y hexavalente (DTPa-VPI-Hib-HB). La pauta de vacunación sistemática recomendada por el CAV-AEP no difiere de la propuesta en años anteriores, pudiéndose iniciar la primovacunación desde las 6 semanas de edad.
Se recomiendan 3 dosis en el primer año de vida, con intervalos de 4-8 semanas entre ellas (2, 4 y 6 meses de edad); en las vacunas Hib monocomponentes, para niños entre 6 y 12 meses son suficientes 2 dosis con el mismo intervalo. A los 15-18 meses de edad es obligada la dosis de refuerzo, quedando el sujeto inmunizado con niveles de eficacia próximos al 100%34. En los niños de entre 12 y 14 meses, no inmunizados previamente, se recomiendan 2 dosis y a partir de los 15 meses una dosis, no siendo necesaria la vacunación en niños mayores inmunocompetentes de 59 meses3.
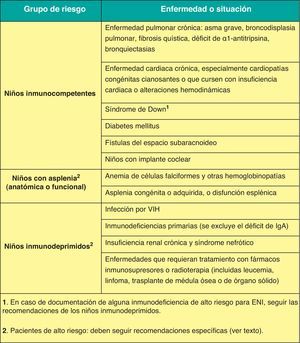
Por encima de esta edad, la indicación de una dosis de vacuna se llevaría a cabo en individuos sin antecedentes de vacunación con factores de riesgo de infección invasora por Hib: asplenia anatómica o funcional (en los casos de esplenectomía programada, 2 meses antes de la intervención y en caso de urgencia, 2 semanas después de la intervención), leucemia, anemia de células falciformes, inmunodeficiencias adquiridas y trasplante de células madre hematopoyéticas3.
Para aquellos niños que hayan presentado la enfermedad invasora antes de los 24 meses edad y no estuviesen vacunados, se recomienda que reciban las dosis de vacuna de acuerdo con la edad, como si no estuvieran vacunados, iniciando la vacunación un mes después de haber pasado la enfermedad invasora.
La vacuna de la poliomielitis inyectable (VPI) forma parte de la vacuna hexavalente y de las pentavalentes. La pauta de administración, en la primovacunación durante la primera infancia, es de 3 dosis en los meses 2, 4 y 6, y una cuarta de refuerzo a los 15-18 meses de edad, que debe administrarse con un intervalo mínimo de 6 meses respecto a la dosis previa. Esta última dosis no es necesaria en el caso de que la 3.ª de VPI haya sido administrada después de que el niño haya cumplido los 4 años3. Por otro lado, existe un preparado monocomponente, con una formulación frente a la poliomielitis de virus inactivados de potencia aumentada (VPIa, tipo Salk), pero actualmente solo es accesible como «medicación extranjera», por lo que se reserva especialmente para personas no inmunizadas que vayan a viajar a zonas endémicas de poliomielitis (Nigeria, Afganistán y Pakistán). En estos casos, es necesario haber recibido, al menos, 3 o más dosis de vacuna VPI y es conveniente ofrecer otra dosis antes de iniciar el viaje. Las personas que viajan frecuentemente, por periodos cortos, a zonas de polio endémica normalmente necesitan una sola dosis de vacuna después de recibir la serie primaria35.
Vacunación frente al meningococo CRecomendación CAV-AEP 2013: el CAV-AEP recomienda que la vacunación frente al meningococo C se realice con vacunas conjugadas monovalentes con la siguiente pauta: primovacunación con 2 dosis en el primer año (a los 2 y a los 4-6 meses de edad) y una dosis de refuerzo en el segundo año de vida, preferentemente entre los 12 y los 15 meses.
La incidencia de la enfermedad meningocócica en España se mantiene baja. En la temporada 2009-2010 se notificaron 563 casos de enfermedad meningocócica (438 confirmados) a la red nacional RENAVE, lo que supone la tasa más baja registrada en los últimos 11 años: 0,96 casos/100.000 habitantes, de los que 0,12/100.000 corresponden al serogrupo C36. En la temporada 2011-2012 (semana 41/2011-semana 35/2012, datos provisionales), se registraron 54 casos de enfermedad meningocócica C, con una tasa de 0,12/100.000 y una letalidad del 16,67%. La introducción en España de la vacuna conjugada en el calendario infantil en 1999-2000 resultó determinante en el control de la enfermedad meningocócica del grupo C, que ha experimentado un descenso respecto a la época prevacunal de hasta el 88%.
El CAV-AEP mantiene la recomendación de vacunar frente al meningococo C con vacunas conjugadas monovalentes con la siguiente pauta: primovacunación con 2 dosis en el primer año (a los 2 y a los 4-6 meses de edad) y una dosis de refuerzo en el segundo año de vida, preferentemente entre los 12 y los 15 meses.
A pesar del éxito que ha supuesto la vacunación antimeningocócica C, los niños vacunados el primer año de vida con la vacuna antimeningocócica C conjugada con la proteína CRM197 pierden progresivamente los anticuerpos y su capacidad bactericida a partir del año de la vacunación, si no se administra una dosis de refuerzo el segundo año de vida. Este hecho se acompaña de una pérdida de la efectividad de la vacuna y de la aparición de la enfermedad en los niños vacunados, hecho constatado no solo en España37-39, sino también en otros países como el Reino Unido40,41.
El CAV-AEP considera que algunos niños que recibieron aquella pauta de vacunación, sin dosis de refuerzo en el segundo año de vida y que cumplen ahora 12 años de edad, pueden ser susceptibles a las infecciones por el meningococo C. Teniendo en cuenta que la mayor carga de enfermedad por el meningococo C ocurre en la actualidad en adolescentes y adultos jóvenes y la elevada letalidad de esta infección (en 2011 fue del 37,7% y en 2012 del 16,67%), el CAV-AEP estima que en aquellas cohortes de niños primovacunados y que no han recibido una dosis de refuerzo de vacuna antimeningocócica C a partir de los 12 meses de vida estaría recomendada una dosis de refuerzo adicional si las condiciones epidemiológicas así lo justifican. Actualmente, Murcia y Asturias tienen contemplada en su calendario, a los 11 y a los 14 años, respectivamente, la administración de una dosis de vacuna antimeningocócica C a aquellos niños que no tengan una dosis aplicada después de los 12 meses de edad2.
En los niños que recibieron dosis de refuerzo a partir de los 12 meses de edad, algunos estudios clínicos y modelos matemáticos han constatado que, a pesar del descenso del título de anticuerpos a lo largo de los primeros 4-6 años de edad, pueden estar protegidos, durante algunos años, por la inmunidad de grupo42. Aún no se conoce con exactitud si será necesaria la administración de una dosis extra en algún momento de la infancia o adolescencia en estos niños. En el momento actual, existe una polémica abierta en diversos países, sobre cuál debería ser la estrategia más efectiva y eficiente de vacunación frente al meningococo C y con qué tipo de vacunas43,44. Estudios preliminares encuentran mayor respuesta y más duradera en los niños más mayores y, dado que durante la adolescencia se produce el segundo pico de incidencia de la enfermedad meningocócica, una de las estrategias ideadas para optimizar la efectividad y la eficiencia consiste en una pauta de 3 dosis (1+1+1), administradas a los 3 y 12 meses y en la adolescencia, como se está realizando en el Reino Unido desde principios del año 201245.
La colonización nasofaríngea por el meningococo C es más alta en los adolescentes que en cualquier otra época de la vida46. Por ello, la administración de una dosis de vacuna a los adolescentes podría tener un gran impacto en la incidencia de la enfermedad al reducir la tasa de portadores.
El CAV-AEP es consciente de la necesidad de conseguir que los niños vacunados mantengan una inmunidad individual y de grupo protectora en la preadolescencia y adolescencia, edades de riesgo para la enfermedad por el meningococo C, para lo que podría ser necesaria la aplicación de una nueva dosis de refuerzo en niños mayores, modificando las pautas actualmente recomendadas. Es necesario tener más información epidemiológica y acuerdo entre las CC. AA. para nuevas recomendaciones sobre la vacunación frente al meningococo C.
Las vacunas contra el meningococo C pueden coadministrarse con el resto de las vacunas del calendario infantil, al no haberse demostrado interferencias clínicamente significativas en la respuesta inmunitaria frente a los diferentes antígenos vacunales47. No se ha comprobado la intercambiabilidad entre los 3 preparados disponibles, por lo que es recomendable, en primovacunación, utilizar el mismo preparado vacunal.
Desde el año 2010 hay disponible en España una vacuna conjugada tetravalente frente a los meningococos de los serogrupos A, C, W135 e Y. Es de uso hospitalario y actualmente está autorizada a partir de los 2 años de edad, en caso de viaje a zonas endémicas de meningitis: el conocido como «cinturón africano de la meningitis»48.
Vacunación frente al neumococoRecomendación CAV-AEP 2013: el CAV-AEP recomienda la vacunación frente al neumococo de forma sistemática en todos los niños menores de 5 años, como la mejor medida para la prevención de la enfermedad neumocócica en la infancia. El CAV-AEP estima que la vacuna neumocócica conjugada tridecavalente (VNC13) es la que mejor cobertura proporciona actualmente frente a los serotipos circulantes y la que mayor impacto puede tener en el control de la enfermedad neumocócica en España.
Los datos epidemiológicos a favor de la introducción de la vacunación antineumocócica dentro de los calendarios sistemáticos oficiales se siguen acumulando y sumando a los que se disponían de años anteriores1.
En Alemania, 2 años después de la introducción de las vacunas neumocócica conjugada decavalente (VNC10) (abril del 2009) y VNC13 (diciembre del 2009), se ha producido una reducción del 78% de los casos de enfermedad neumocócica invasora (ENI) por los 6 serotipos propios de la VNC13 en los niños menores de 2 años49. En el caso del 19A, la reducción en este grupo de edad ha sido del 98%49.
Un estudio realizado en el Reino Unido ha demostrado que una dosis de VNC13 en niños mayores de 12 meses proporciona una efectividad del 73%, hecho que, a su vez, demuestra que una sola dosis de rescate puede tener un impacto significativo en la carga global de la ENI. La administración de una o más dosis en el primer año de vida, más una 2.ª dosis después de los 12 meses, tiene una efectividad del 77%. La efectividad por serotipos con una o más dosis fue del 76% frente al 7F y del 70% frente al 19A. Para el serotipo 1, la efectividad fue del 62%, aunque no se alcanzó la significación estadística, debido al escaso número de casos50.
En la Comunidad de Madrid, tras la introducción de la VNC13, en junio de 2010, se ha producido una reducción del 54% de enfermedad invasora comparando el periodo mayo 2009-abril 2010 con el periodo mayo 2011-abril 2012. Durante este lapso, el serotipo 19A ha disminuido más de un 90%51. El serotipo 1 también ha disminuido casi un 30%, hecho relevante, teniendo en cuenta que los estudios llevados a cabo en Sudáfrica y Gambia plantearon dudas sobre la efectividad de las vacunas conjugadas frente a este serotipo52,53.
La VNC13 también disminuye la colonización nasofaríngea. Así, en los niños vacunados con la VNC13 se reduce alrededor del 50% para los serotipos 19A, 7F y 6C, en comparación con los niños vacunados con VNC754,55. Cuantitativamente, la disminución de colonización más significativa se ha producido con el serotipo 19A, disminuyendo desde un 15,4% a un 8,2% en el primer estudio54 y desde un 22,9% hasta un 12,6% en el segundo55. La reducción de la colonización nasofaríngea por el 19A no solo puede contribuir a disminuir algunas formas de ENI, como la meningitis, la bacteriemia oculta y el empiema pleural, en las que este serotipo está fuertemente implicado56,57, sino también a disminuir las resistencias bacterianas, ya que el 19A es el responsable de la mayoría de las multirresistencias (resistencias a 2 o más antibióticos) y de la práctica totalidad de las resistencias de alto nivel a cefotaxima (estas últimas solo encontradas en aislamientos del LCR en meningitis)57-59. Tras la introducción de la VNC7, se ha constatado un aumento del serotipo 6C, tanto en ENI como en colonización nasofaríngea60. El serotipo 6C es el más frecuente dentro de la enfermedad invasora causada por el serogrupo 6 en EE. UU. Este incremento también se ha constatado en España desde la inexistencia en la era anterior a la VNC7 hasta un 5,4% en la era posterior a la VNC761. La falta de efectividad de la VNC7 frente al serotipo 6C se corresponde con la carencia de actividad opsonofagocítica frente a este serotipo en más del 70% de los sujetos que reciben esta vacuna60.
El CAV destaca que en situaciones de vacunación no sistemática debe seguir utilizándose el esquema de inmunización de 3 dosis de primovacunación en el primer año de vida (2, 4 y 6 meses), seguidas de una dosis de refuerzo en el segundo año a los 12-15 meses (esquema 3+1). La primovacunación con 2 dosis, en ausencia de suficiente inmunidad de grupo, puede dejar al niño en situación de riesgo frente a algunos serotipos neumocócicos menos inmunógenos, como el 6B y el 23F62,63, hasta que no se administre la dosis de refuerzo. Por tanto, en la práctica individual, en un escenario sin vacunación universal, la pauta 2+1 no es aceptable por las razones expuestas.
Los niños que han comenzado una pauta con una de las 2 vacunas deberían finalizarla con la misma. Ambos preparados contienen distinta proteína de conjugación y, además, no existen datos de intercambiabilidad durante el esquema de vacunación.
Dado que alrededor del 60% de los casos de ENI en España se producen en niños mayores de 24 meses56, y que en este grupo de edad la cobertura de la VNC13 para los serotipos circulantes es superior al 85%56, el CAV-AEP recomienda la administración de una dosis de VNC13 en niños de hasta 59 meses sin antecedentes de vacunación con VNC13, aunque hayan sido previamente vacunados correctamente con VNC7 o VNC10.
Los niños prematuros (particularmente los < 32 semanas) tienen más probabilidad de presentar una enfermedad invasora por Streptococcus pneumoniae que los recién nacidos a término, por lo que se debe recomendar especialmente en estos niños la VNC13.
En cuanto a los pacientes con alto riesgo de presentar una ENI (fig. 2), como inmunodeprimidos o niños con asplenia orgánica o funcional, se establecen las siguientes recomendaciones: a) debe utilizarse siempre una pauta 3+1; b) es preceptivo que reciban 2 dosis de VNC13 en el segundo año de vida si no han recibido, al menos, 2 dosis en el primer año, y c) los niños de 2 a 5 años sin ninguna dosis previa de VNC13 deben recibir 2 dosis separadas por un intervalo mínimo de 2 meses. Además, en estos niños debe completarse la inmunización frente a esta bacteria con la administración, a partir de los 2 años de edad, de la vacuna antineumocócica polisacarídica de 23 serotipos (VNP23), con un intervalo mínimo de 2 meses tras la última dosis recibida de VNC1364. Al cabo de 5 años recibirán la segunda y última dosis de la VNP23. En otros niños no inmunodeprimidos (fig. 2), pero con riesgo alto de presentar enfermedad neumocócica grave o frecuente, puede optarse por seguir o bien las mismas recomendaciones dirigidas a los pacientes de alto riesgo, o bien las recomendadas a los niños sanos de su propia comunidad autónoma, y se recomienda que reciban una única dosis de VNP23 a partir de los 2 años de edad, con un intervalo mínimo de 2 meses tras la última dosis recibida de VNC1364.
Finalmente, este comité desea expresar que la suspensión de la financiación de la vacunación antineumocócica universal en la Comunidad de Madrid a los niños nacidos desde el 10 de mayo del 2012 supone un retroceso en el control de las infecciones neumocócicas de los niños y de los adultos, y se prevé que se revierta el descenso de la enfermedad neumocócica, así como la inmunidad de grupo conseguidas tras el inicio de la vacunación sistemática en el año 2006 en esta comunidad autónoma65. Actualmente, en España, solamente Galicia mantiene la vacunación universal antineumocócica en el calendario.
Vacunación frente al sarampión, la rubeola y la parotiditis (vacuna triple vírica)Recomendación CAV-AEP 2013: el CAV-AEP mantiene la norma general de vacunación que comprende la administración de 2 dosis de la vacuna triple vírica (TV), recomendando la primera a los 12 meses y la segunda a los 2-3 años de edad, preferentemente a los 2 años. En caso necesario, un intervalo mínimo de 4 semanas entre ellas asegura una correcta inmunización. Se reafirma asimismo en la necesidad de alcanzar y mantener altas coberturas vacunales, para conseguir inmunidad de grupo y propiciar la eliminación de las enfermedades que previene.
En los últimos años se están produciendo amplios brotes de sarampión autóctono en toda la Región Europea66,67. En España, se manifestaron, a partir de octubre de 2010, extensos brotes epidémicos en Andalucía (Sevilla, más de 1.000 casos; Granada, en torno a 250 casos) y durante el primer semestre del 2012 en la Comunidad Valenciana (Alicante, más de 600 casos). Ello condujo a que en 2011 se notificaran en el país tasas de 4,1 casos de la enfermedad por 100.000 habitantes, que descendieron a 3,01/100.000 en los meses precedentes a agosto del 2012, cifra aun significativamente superior a la declarada en 2010 (0,5/100.000)68,69. Estos brotes epidémicos y otros más limitados inciden sobre todo en adultos jóvenes de colectivos con bajas coberturas de vacunación y en niños que aún no han recibido la 1.a dosis de la vacuna TV. Datos recientes muestran que los lactantes menores de 12-15 meses, y que por tanto no han alcanzado la edad de la primovacunación, constituyen un grupo creciente de riesgo para contraer el sarampión, debido a que los niveles de anticuerpos protectores transferidos por sus madres son cada vez menores en cantidad y duración, sobre todo en las que fueron vacunadas y no sufrieron la infección natural. En este escenario, puede afirmarse que la gran mayoría de los niños de 6 a 9 meses de edad de los países occidentales carece actualmente de inmunidad frente al sarampión70,71. Algo similar se está reconociendo para la parotiditis: el tiempo medio global específico de la pérdida de anticuerpos frente a la enfermedad se ha calculado en 3,8 meses en los hijos de madres con inmunidad natural y de 2,4 meses en hijos de mujeres vacunadas, una diferencia significativa (p=0,025)72. Esta situación explica, en gran medida, la reciente detección de brotes de parotiditis en varias regiones europeas y españolas. Por otra parte, siguen notificándose en Europa casos de rubeola. En general, sus incidencias son bajas (0,12/100.000 habitantes en España), pero alcanzando en algunos de los países europeos cifras muy preocupantes, de hasta 80/100.000, lo que puede posibilitar el resurgimiento de la temida rubeola congénita73.
Teniendo en cuenta estos cambios epidemiológicos, el CAV-AEP considera que la 1.ª dosis de TV debería administrarse a los 12 meses de vida, recomendando el abandono de la alternativa de los 15 meses, como han hecho ya la práctica totalidad de las CC. AA.2. Se reducirá así la ventana de desprotección frente a estas infecciones en lactantes y niños de corta edad. Se abre incluso la posibilidad de adelantarla a los 9-11 meses de modo sistemático en un próximo futuro, como ya se realiza en algunos países centroeuropeos73.
La vacuna TV es un preparado muy inmunógeno de virus hiperatenuados frente a sarampión, rubeola y parotiditis. Tras la administración de una dosis se alcanzan tasas de seroconversión del 90-95% para el sarampión, del 82-85% para parotiditis y superiores al 95% para la rubeola; después de la administración de la 2.ª dosis, se aproximan al 100%. Esta 2.ª dosis es imprescindible para lograr una adecuada inmunidad de grupo74,75 y corregir posibles fallos primarios de la primera. Por ello, el CAV-AEP considera que la 2.ª dosis de la vacuna TV debería administrarse entre los 2 y los 3 años, preferentemente a los 2 años. Adelantando esta 2.ª dosis se disminuye la posibilidad de contraer las enfermedades que previene en las edades de riesgo, se reduce la circulación de los virus implicados en la comunidad y es muy probable que se mejore el cumplimiento de la inmunización.
En España no se dispone de la vacuna monocomponente frente al sarampión, por lo que, en todos los casos (incluida la vacunación selectiva en menores de 12 meses), deberá administrarse como vacuna TV. La población infantil inmigrante no vacunada frente a la rubeola y la parotiditis debe vacunarse con la vacuna TV.
El CAV-AEP se reafirma asimismo en la necesidad de alcanzar y mantener altas coberturas con esta vacuna, para conseguir inmunidad de grupo y propiciar la eliminación de las enfermedades que previene.
El sarampión es la enfermedad prevenible por la vacuna TV de mayor impacto individual y colectivo, y ante su potencial presentación han sido consensuadas actuaciones bien definidas. Las acciones a cumplir en caso de alerta epidemiológica por brote de sarampión o tras contactos accidentales con enfermos, son las siguientes74-76:
- –
En los niños menores de 6 meses se administrarán 0,25ml/kg de inmunoglobulina polivalente en dosis única, por vía intramuscular, en los primeros 6 días postexposición. No está indicada la administración de la vacuna TV.
- –
A los niños de entre 6 y 11 meses se les administrará una dosis de la vacuna TV (dosis no computable) y se les volverá a vacunar a partir de los 12 meses cumplidos con, al menos, un mes de intervalo, considerándose esta última como la 1.ª dosis. Si hubiesen transcurrido más de 72 horas y menos de 6 días desde la posible exposición, a los menores de 12 meses se les administrará inmunoglobulina polivalente en lugar de la vacuna. Posteriormente, 5 o 6 meses más tarde, deben recibir la vacuna TV.
- –
A los mayores de un año potencialmente susceptibles que hayan permanecido en contacto con enfermos durante las 72 horas previas, se les administrará la vacuna TV. Se consideran personas susceptibles a las nacidas después de 1966 que no acrediten antecedentes de la enfermedad o la recepción de 2 dosis de la vacuna a partir de los 12 meses de vida. Se asume que las personas nacidas antes de 1966 no corren el riesgo de presentar el sarampión, al presuponérseles inmunizadas frente al mismo, tras haberlo padecido de forma natural.
- –
A los niños mayores de un año, adolescentes y adultos sanos con una exposición a la enfermedad entre las 72 horas y los 6 días previos, y que no acrediten antecedentes clínicos de sarampión o que no hayan recibido, al menos, una dosis de vacuna después de los 12 meses de edad, se les debe administrar una dosis de inmunoglobulina polivalente intramuscular, con la posología de 0,25mg/kg, con una dosis total máxima de 15ml.
- –
A los niños, adolescentes y adultos susceptibles en los que la vacunación esté contraindicada, como los inmunocomprometidos o las embarazadas, se les administrará inmunoglobulina polivalente intramuscular antes de los 6 días posteriores a la exposición. La dosis para pacientes inmunocomprometidos es de 0,5mg/kg, con un máximo de 15ml.
- –
Debe aprovecharse la coyuntura epidemiológica para revisar la situación vacunal de los niños mayores de 3 años, actualizándola en caso necesario.
Recomendación CAV-AEP: el CAV-AEP mantiene la recomendación de la vacunación sistemática frente al virus del papiloma humano (VPH) de todas las niñas de 11 a 14 años, con preferencia a los 11-12 años, como forma de prevención del cáncer cervical y de lesiones precancerosas del tracto genital en la mujer. Es preciso un gran esfuerzo de todos los profesionales sanitarios para incrementar las coberturas vacunales actuales.
El CAV-AEP se adhiere a las recomendaciones del CISNS en referencia a la vacunación sistemática frente al VPH de todas las niñas de 11 a 14 años, con preferencia a los 11-12 años, como forma de prevención del cáncer cervical y de lesiones precancerosas del tracto genital en la mujer77. Además, el CAV-AEP recomienda la vacunación de todas las adolescentes que no hubiesen recibido la vacuna por superar la edad fijada por cada comunidad autónoma para la vacunación sistemática. Recientemente, 10 sociedades científicas españolas, incluida la AEP, han elaborado un documento de consenso sobre la vacunación frente al VPH, en el que se ofrece información ampliada sobre inmunogenicidad, eficacia, efectividad y seguridad, así como unas recomendaciones finales, empleando el sistema GRADE, que pueden ser consultadas en la web del CAV-AEP78.
Actualmente, la cobertura global de vacunación frente al VPH en niñas adolescentes en España no es la deseable, con una media del 65% en 201179. De hecho, hay algunas CC. AA. con un índice realmente alarmante (inferior al 50-60%)79. El esfuerzo y el convencimiento a la hora de recomendar la vacunación por parte de los profesionales sanitarios son muy importantes80, así como la puesta en marcha de programas escolares de vacunación para obtener coberturas elevadas, como se ha demostrado, por ejemplo, en Cataluña, La Rioja, Extremadura o Navarra.
Otro punto que se debe discutir sería la edad idónea para la vacunación. Dados los últimos datos obtenidos en España publicados recientemente (estudio CLEOPATRA), en los que se aprecia un aumento de la prevalencia de infección cervical por VPH en mujeres jóvenes (24% en mujeres de 18 años) y un adelanto progresivo de las relaciones sexuales completas en las adolescentes (21% a los 15 años)81, sería más razonable iniciar la vacunación en torno a los 11-12 años que a los 13-14, para conseguir el máximo beneficio de la vacunación en la población diana.
Existen 2 vacunas disponibles en España frente al VPH: la vacuna tetravalente (VPH 6, 11, 16 y 18) Gardasil® (Sanofi Pasteur MSD)82 y la bivalente (VPH 16 y 18) Cervarix® (GlaxoSmithKline)83.
Gardasil®, con actualización de su ficha técnica en mayo del 2012, es una vacuna indicada en mujeres a partir de los 9 años de edad para la prevención de las lesiones genitales precancerosas (cervicales, vulvares y vaginales) y del cáncer cervical relacionadas causalmente con ciertos tipos oncogénicos del VPH, además de las verrugas genitales relacionadas causalmente con tipos específicos del VPH82. Además, está autorizada para su empleo en varones de 9 a 26 años para la prevención de verrugas genitales externas82. Estas indicaciones están basadas en la demostración, tras la administración de Gardasil®, de una adecuada inmunogenicidad en personas de ambos sexos de 9 a 26 años de edad, y de eficacia en mujeres de 16 a 45 años de edad y en varones de 16 a 26 años82. Por otro lado, aunque la ficha técnica aprobada por la Food and Drug Administration (FDA) estadounidense contempla la indicación de Gardasil® para la prevención de cáncer anal causado por VPH 16 y 18 y la prevención de neoplasia anal intraepitelial de cualquier grado causada por VPH 6, 11, 16 y 18 en ambos sexos de 9 a 26 años de edad84, la European Medicines Agency (EMA) está evaluando por el momento esta ampliación de la indicación.
Cervarix®, con última actualización en enero del 2012, es una vacuna indicada en mujeres a partir de los 9 años de edad para la prevención de lesiones premalignas y del cáncer del cuello uterino relacionadas causalmente con ciertos tipos oncogénicos del VPH83. La indicación está basada en la demostración, después de la administración de Cervarix®, de una adecuada inmunogenicidad en niñas y mujeres de 9 a 55 años de edad, y de eficacia en mujeres de 15 a 25 años de edad83.
En los ensayos clínicos con un seguimiento de hasta 4 años, se corrobora para ambas vacunas una eficacia superior al 98% para la prevención de las lesiones preneoplásicas de alto grado (CIN2+ [del inglés cervical intraepitelial neoplasm] y adenocarcinoma in situ) debidas a los VPH oncogénicos 16 y 18, en mujeres en los rangos de edad indicados anterioremente82,83.
Se ha confirmado, para ambas vacunas, la presencia de distintos grados de protección cruzada para otros tipos de VPH oncogénicos no incluidos en ambos preparados85,86. Concretamente, frente a lesiones preneoplásicas (CIN2+ y adenocarcinoma in situ) por VPH 31 se ha constatado una eficacia del 55% (IC del 95%, 26-74) con la vacuna tetravalente86 y del 87% (IC del 95%, 68-96) con la bivalente85. La vacuna bivalente, además, ha demostrado una eficacia protectora para CIN2+ del 68% (IC del 95%, 39-84) para VPH 33, y del 82% (IC del 95%, 17-98) para VPH 4585. Gracias a estos hallazgos, en la ficha técnica de Cervarix® se ha ampliado la indicación frente a los serotipos 31, 33 y 4583. Estos datos son de gran relevancia, ya que permiten obtener una eficacia protectora global frente a lesiones preneoplásicas por VPH superior a la esperada.
La posología de las vacunas frente al VPH es de 3 dosis (fig. 1), a los 0, 2 y 6 meses con la tetravalente82 y a los 0, 1 y 6 meses con la bivalente83, para garantizar la máxima eficacia esperable. En caso de variaciones de estas pautas deben respetarse los intervalos mínimos entre dosis. En cuanto a Gardasil®, la 2.ª dosis debe ser administrada, al menos, un mes después de la 1.ª dosis, y la 3.ª dosis, al menos, 3 meses después de la segunda82. Las 3 dosis deben ser administradas dentro de un periodo de un año. Con relación a la vacuna Cervarix®, la 2.ª dosis puede administrarse entre 1 y 2,5 meses después de la primera, y la 3.ª dosis entre 5 y 12 meses tras la primera83.
No hay datos que documenten la intercambiabilidad entre ambas vacunas frente al VPH, por lo que se recomienda utilizar el mismo preparado comercial para toda la pauta de vacunación82,83.
Se ha comprobado la ausencia de interferencia inmunológica o variaciones significativas de la reactogenicidad cuando se administran simultáneamente con otras vacunas aplicables durante la adolescencia, como la Tdpa y la antimeningocócica tetravalente87,88, así como la vacuna combinada frente a los virus de las hepatitis A y B89.
Tanto los ensayos clínicos realizados90 como el seguimiento poscomercialización91, con más de 100 millones de dosis administradas entre ambas vacunas, permiten confirmar la seguridad de estas vacunas y su adecuado balance beneficio/riesgo. En junio de 2009, la Organización Mundial de la Salud (OMS) reafirmó su adecuado perfil de seguridad, tras revisar todos los datos existentes92. Constataron que los efectos adversos más frecuentes son la reactogenicidad local y el dolor muscular generalizado. Se han comunicado algunas reacciones alérgicas en pacientes sensibilizados a alguno de los componentes y se evidencia un incremento de declaraciones de síncopes tras la administración de vacunas en adolescentes y jóvenes, que se consideran debidos a reacciones vagales que son más frecuentes en este grupo de edad91,92. En un estudio de EE. UU., en el que se siguió de forma prospectiva durante 6 meses a más de 189.000 mujeres de entre 9 y 26 años vacunadas con la vacuna tetravalente, no se observó ningún tipo de asociación con la aparición de las 18 principales enfermedades autoinmunitarias, incluyendo las de tipo neurológico y reumatoide93.
Dada la reciente aprobación de la vacuna tetravalente para su uso en varones de 9 a 26 años84, este tema debe ser analizado y comentado. Se ha documentado el papel de los varones en la transmisión del VPH, constatándose tasas de infección superiores a las de las mujeres y más mantenidas a lo largo de la vida, aunque la carga de enfermedad neoplásica en el varón es mucho menor94. No obstante, la prevalencia de las verrugas genitales en el varón es similar o algo superior a la observada en la mujer, y es también debida a los VPH 6 y 11 en más del 90% de los casos94. Con la vacuna tetravalente se ha confirmado una eficacia del 90% en la prevención de las verrugas genitales en el varón; sin embargo, se dispone de datos limitados acerca de la prevención de lesiones precancerosas y de cáncer de ano y del área oro-faringo-laríngea, aunque parece existir una tendencia hacia la prevención84.
Dados los datos disponibles de la carga global de enfermedad94 y de la eficacia de la vacuna tetravalente en varones82, algunos organismos oficiales ya han incluido a los varones en los programas de vacunación sistemática. Así, en EE. UU., los Centers for Disease Control and Prevention (CDC) y la AAP la recomiendan para todos los varones de 11 a 21 años, además de una recomendación individualizada de 22 a 26 años3,95,96. En Australia97 y Canadá98 también se ha comenzado la vacunación sistemática en varones de 12 a 15 años y de 9 a 26 años, respectivamente.
Actualmente, existe un debate abierto sobre la estrategia de vacunación en varones, alimentado por todos los datos que se van publicando, que deberán seguir siendo analizados junto a los modelos de eficiencia. Los primeros análisis demuestran que la vacunación en varones podría ser coste-efectiva en situaciones de baja cobertura vacunal en niñas adolescentes, pero parece ser más beneficiosa aún la estrategia basada en incrementar la cobertura de estas99, así como la vacunación selectiva de varones homosexuales100.
Vacunación frente al rotavirusRecomendación CAV-AEP 2013: el CAV-AEP considera que la vacunación frente al rotavirus, con el preparado pentavalente actualmente disponible en España, es una medida de salud recomendable y segura para todos los lactantes. Se recomienda la administración de 3 dosis. La primera se administra entre las 6 y las 12 semanas de edad. El intervalo mínimo entre dosis es de 4 semanas. Las 3 dosis deben ser administradas antes de las 32 semanas de edad. Puede administrarse al mismo tiempo que las otras vacunas del calendario.
La carga global de las gastroenteritis agudas por rotavirus (GEA-RV) está bien caracterizada a escala mundial, habiéndose demostrado la eficacia y la efectividad de estas vacunas desde su comercialización en 2006, tanto en países industrializados como en países en vías de desarrollo101,102.
Durante los últimos 6 años, más de 30 países las han ido introduciendo en sus calendarios de vacunaciones, habiéndose publicado, a lo largo de los últimos 12 meses, datos que señalan una disminución significativa del número de hospitalizaciones debidas a GEA-RV, así como un descenso en la mortalidad debida a esta infección en muchos de esos países y una disminución en las tasas de infección nosocomial por rotavirus103.
Además de estos efectos directos sobre la salud de los niños vacunados, se están percibiendo efectos indirectos debidos a la disminución del riesgo de GEA-RV en grupos de niños mayores y adultos no vacunados, probablemente por efecto de la inmunidad de grupo104-106.
Revisando los datos referidos a España, también se confirma esta tendencia a una reducción significativa de las hospitalizaciones debidas a GEA-RV en nuestro país, con una relación directa entre el grado de cobertura y la reducción de los ingresos hospitalarios107,108.
En relación con las recomendaciones 2012 de este comité, para la vacunación frente al rotavirus, se han producido muy pocas novedades:
De las 2 vacunas frente al rotavirus registradas en España, la vacuna pentavalente (RotaTeq®) sigue siendo la única disponible actualmente en los canales de distribución de farmacias, tras la decisión tomada en noviembre del 2010 por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)109.
Se han introducido algunos cambios en la ficha técnica de RotaTeq®, incluyendo la posibilidad de administrar la última dosis antes de las 32 semanas de vida, en lugar de las 26 semanas que se recomendaba con anterioridad110. RotaTeq® se aplica en 3 dosis. La 1.ª dosis se administra entre las 6 y las 12 semanas de edad. El intervalo mínimo entre dosis es de 4 semanas. Las 3 dosis deben ser administradas antes de las 32 semanas de edad. RotaTeq® puede administrarse al mismo tiempo que las otras vacunas del calendario.
En los estudios de vigilancia poscomercialización de las vacunas frente al rotavirus, en 2011 se publicaron algunos estudios en los que se ponía de manifiesto que, en la primera semana tras la vacunación, podría presentarse algún caso más de invaginación intestinal de lo esperado, en función de las tasas basales de incidencia, aunque sin diferencias entre niños vacunados y no vacunados111,112. Sin embargo, los beneficios que se obtienen con la vacunación frente al rotavirus, tanto en descenso de morbilidad como de mortalidad, siguen siendo muy superiores a los hipotéticos riesgos comentados y así lo refrendó la OMS, manteniendo la recomendación de la vacunación universal frente al rotavirus113.
Durante el año 2012 se ha continuado manteniendo una estrecha vigilancia de la seguridad de las vacunas frente al rotavirus, no existiendo evidencias de riesgos incrementados de invaginación en los niños vacunados114-116, ni de otros problemas de seguridad117. En trabajos recientes se insiste en que el balance riesgo de posible invaginación versus beneficios de la vacunación frente al rotavirus continúa siendo favorable a esta última118.
Su utilización en niños prematuros sigue siendo segura, recomendándose la administración en niños pretérminos de más de 25 semanas de gestación, que se encuentren clínicamente estables y no ingresados119.
Teniendo en cuenta la morbilidad y la elevada carga sanitaria que representa la enfermedad, este comité continúa considerando la vacunación de todos los lactantes frente al rotavirus como una oferta de salud de gran interés.
Vacunación frente a la varicelaRecomendación CAV-AEP 2013: el CAV-AEP recomienda la administración de la vacuna frente a la varicela a todos los niños con 2 dosis: una 1.ª dosis a los 12 meses, y una 2.ª dosis a los 2-3 años, a ser posible a los 2 años.
El CAV-AEP mantiene la recomendación de vacunar frente a la varicela a todos los niños con la misma pauta emitida en el año 2012: una 1.ª dosis a los 12 meses (es aceptable entre 12 y 15 meses) y una 2.ª dosis a los 2-3 años, a ser posible a los 2 años1. El CAV-AEP sigue estimando que la estrategia de vacunación sistemática solo a los niños susceptibles entre los 10-14 años y solo a los niños en riesgo de varicela grave y a sus contactos próximos sanos en la primera infancia, propuesta por el CISNS en el año 2006 y vigente en la actualidad77, no previene la mayoría de los casos de varicela ni la mayoría de las complicaciones y hospitalizaciones, que son más frecuentes en números absolutos, en la primera infancia.
La efectividad de la vacunación se ha ido constatando de forma progresiva en todas aquellas regiones o países en los que se ha ido introduciendo. En EE. UU., donde la vacunación universal comenzó en 1995, se ha demostrado una disminución sostenida del número de casos de varicela en todos los grupos de edad, así como de las complicaciones y de las hospitalizaciones debidas a la enfermedad, no solo en los vacunados sino también en los no vacunados, como consecuencia de la inmunidad de grupo. Así, en el trabajo de Shah et al., en el que se comparan los casos atendidos ambulatoriamente y las hospitalizaciones producidas entre los años 1993 y 1995, antes de comercializarse la vacuna, con los registrados entre 1996 y 2004, se demuestra que la tasa de la enfermedad descendió un 66%, desde 106,6/100.000 antes de la vacunación a 36,4/100.000 después de instaurada la misma. La mayor reducción se observó en los menores de 4 años, en los que la incidencia de la enfermedad descendió un 98%, reducción que se produjo también en individuos no vacunados120. De una forma paralela descendieron las hospitalizaciones hasta un 53%, sobre todo en los menores de 14 años, así como las complicaciones de la enfermedad120. En EE. UU. se ha documentado igualmente un descenso franco de la mortalidad; en los 12 años siguientes al comienzo de la vacunación (1995-2007) disminuyó un 88%, pasando de una tasa de 0,41 por millón de personas en el periodo entre 1990 y 1994 a 0,05 por millón entre 2005 y 2007, y aunque la reducción se produjo en todos los grupos de edad, la más acentuada tuvo lugar en los menores de 20 años121.
En otros países, como Alemania122, Canadá123 e Italia124, los datos de efectividad son parecidos a los de EE. UU. y se mantienen hasta la actualidad. Así, en la región del Véneto (Italia), donde la vacunación universal se introdujo en 2005, se ha constatado que la tasa de incidencia de varicela entre los 0 y 14 años ha pasado de 6.136/100.000 personas/año en el 2000 a 4.004/100.000 en 2008, y la tasa de hospitalización ha descendido de 18,7 a 8,4, respectivamente, siendo más acentuado en el grupo de edad de 1 a 4 años124.
En España, 4 comunidades y ciudades autónomas (Madrid, Navarra, Ceuta y Melilla) vacunan universalmente a los niños en el 2.° año de la vida. Los datos de eficacia más concluyentes son los ofrecidos por las comunidades de Madrid y Navarra, donde está implantada la vacunación universal desde los años 2006 y 2007, respectivamente. En Madrid, entre los años 2006 y 2009, la reducción del número de casos fue del 66% y el de las hospitalizaciones del 50%. Fue también muy evidente la inmunidad de grupo, que alcanzó no solo a niños de distintas edades no vacunados, sino incluso hasta el 56% de los adultos jóvenes con edad comprendida entre los 20 y los 24 años125. En Navarra, la incidencia de la varicela disminuyó un 93% entre 2006 y 2010, y la tasa de hospitalización descendió un 73%; también se observó inmunidad de grupo, incluso en mayores de 20 años (84,6%)126.
En la actualidad, parece que la necesidad de 2 dosis de vacuna para obtener la máxima eficacia protectora de la misma no deja lugar a dudas, pues con una sola dosis se comunican brotes o un número de casos de varicela más o menos elevado, incluso en grupos con coberturas de vacunación superiores al 90%, conforme aumenta el número de años desde que la vacunación tuvo lugar. A este respecto, es muy ilustrativo el trabajo publicado en EE. UU. en el año 2007 en el que se demuestra, durante un periodo de seguimiento de 10 años (1995-2004), que la posibilidad de presentar varicela después de una dosis de vacuna, se incrementa significativamente con el paso del tiempo tras la vacunación: desde 1,6 casos por 1.000 personas/año en el primer año a 9 por 1.000 personas/año a los 5 años y a 58,2 por 1.000 personas/año a los 9 años de la vacunación127, observándose además que, a medida que aumenta el tiempo desde la vacunación, no solo crece el número de casos de la enfermedad en niños vacunados (la llamada varicela breakthrough), sino que además aumenta la gravedad de los mismos128.
En este mismo sentido, es de interés el trabajo publicado en el año 2012 referido a un brote de varicela en Pekín, donde entre 916 escolares que habían recibido una dosis se produjeron 87 casos, sin relación con la edad de vacunación ni con el tiempo transcurrido desde la misma, concluyéndose que la dosis única es efectiva en la prevención de la enfermedad, pero no es suficiente para prevenir brotes129. Debe señalarse también que la posibilidad de que un niño vacunado con una sola dosis presente la varicela no solo parece debida a la pérdida de inmunidad inducida por la vacuna con el paso del tiempo, sino también a fallos primarios de vacunación, posibilidad esta que se recoge con una frecuencia variable que llega hasta el 24% de los casos con una sola dosis130.
Algunos modelos matemáticos estiman que con una sola dosis de vacuna y coberturas de vacunación del 90% se obtendría una disminución aproximada de la incidencia de la enfermedad del 65% en los años siguientes a la introducción de la vacuna y que la adición de una 2.ª dosis aumentaría en un 22% la efectividad vacunal131. Confirman estas consideraciones trabajos como el de Shapiro et al., que valora la efectividad de 2 dosis de vacuna frente a la varicela en un estudio de casos y controles en niños mayores de 4 años, entre 2006 y 2010132. Los autores concluyen que la efectividad de 2 dosis fue del 98,3% mientras que la de una fue solo del 86% y que la posibilidad de contraer la enfermedad fue un 95% más baja con 2 dosis que con una. Igualmente, los CDC comunicaron en agosto de 2012 que en EE. UU., entre los años 2006 y 2010, a partir de la recomendación de la pauta de 2 dosis, la incidencia de la varicela ha disminuido un 71,6% adicional al descenso que se había producido entre 2000 y 2005 con la dosis única133.
En EE. UU., ya desde el año 2006, a través del ACIP y de la AAP, se recomienda una pauta de vacunación frente a la varicela con 2 dosis, la primera entre los 12 y 15 meses de edad y la segunda entre los 4 y 6 años, considerándose que, después de 2 dosis, la respuesta inmunológica se eleva de forma considerable, por lo que el 99% de los niños alcanzan niveles de anticuerpos 15 veces superiores a los obtenidos con una dosis única. Se estima que, con 2 dosis, la prevención de cualquier tipo de varicela alcanza el 98% de los casos, comparado con el 94% con una sola dosis, y que la eficacia contra la enfermedad grave alcanza el 100%. Asimismo, se considera que los receptores de 2 dosis de vacuna tienen 3,3 veces menos probabilidades de contraer varicela, comparados con los que solo reciben una, durante los 10 años siguientes a la inmunización134. De esta forma, por tanto, se obtiene una respuesta inmunológica más parecida a la de la infección natural, se hace mucho más infrecuente la varicela en niños vacunados por pérdida de la inmunidad, se consigue mayor inmunidad de grupo y se corrigen los posibles fallos primarios de vacunación que se producen con la dosis única. A este respecto es importante resaltar la importancia de obtener una cobertura de vacunación, con las 2 dosis, superior al 90% en los primeros años, pues de lo contrario se corre el riesgo de que se origine una bolsa de sujetos susceptibles, que aumentará considerablemente la carga de la enfermedad en la edad adulta. Es decir, a nivel individual, la protección con 2 dosis es excelente, pero si no se alcanzan las coberturas indicadas, la circulación del virus continuará y como medida de salud pública, el control de la enfermedad será difícil de conseguir. Es indudable que para conseguir coberturas superiores al 90% con las 2 dosis, sería deseable que la vacuna estuviera financiada por la sanidad pública, como lo está en la actualidad en Madrid, Navarra, Ceuta y Melilla.
Con relación al coste-efectividad de la estrategia con 2 dosis, los estudios realizados en EE. UU. se muestran favorables134,135. Sin embargo, dado que este tipo de estudios no es totalmente extrapolable de un país a otro, sería deseable la realización en nuestro medio de estudios con relación a este parámetro para confirmar si los beneficios superan al gasto sanitario.
Otro tema controvertido es el posible aumento en los próximos años de la incidencia del herpes zóster en los individuos que pasaron varicela, al suprimirse el refuerzo exógeno que supone la circulación del virus salvaje, así como la conveniencia de la vacunación contra el mismo a partir de los 50 años136.
En cualquier caso, en la actualidad, analizando todos estos hechos y a la luz de los datos epidemiológicos de las CC. AA. españolas y de los países en los que se ha introducido la vacunación universal, el CAV-AEP sigue considerando que la estrategia de vacunación universal contra la varicela con una 1.ª dosis a los 12 meses (es aceptable entre 12 y 15 meses) y una 2.ª dosis a los 2-3 años, a ser posible a los 2 años, es la más adecuada y que en ambos momentos es recomendable que se administre a la vez la vacuna triple vírica. Debe recordarse que al ser las vacunas de la varicela y de la triple vírica ambas de virus atenuados, pueden administrarse el mismo día en lugares anatómicos diferentes, pero si esto no es posible deberá separarse su administración, al menos, un mes.
En niños con riesgo de varicela grave y en sus contactos próximos sanos, las 2 dosis de vacuna deben administrarse con un intervalo más corto del propuesto de forma general, con objeto de proporcionarles una protección rápida y corregir, también a corto plazo, un posible fallo primario de vacunación. A este respecto, se considera que en los menores de 13 años en estas circunstancias la 2.ª dosis, si bien puede administrarse al mes de la primera, convendría administrarla a los 3 meses de esta y en los mayores de esta edad la 2.ª dosis se debería administrar al mes de la primera.
Actualmente, en España hay disponibles 2 vacunas contra la varicela: Varivax® (Sanofi Pasteur MSD) y Varilrix® (GlaxoSmithKline). Esta última, desde septiembre del 2009, está autorizada por la AEMPS solo como medicamento de uso hospitalario y, por tanto, no está disponible en el canal farmacéutico extrahospitalario, con lo que su administración queda restringida a los servicios de farmacia de los hospitales. Este cambio de las condiciones de dispensación no fue consecuencia de ninguna variación de la eficacia, la inmunogenicidad o la seguridad de esta vacuna. De ahí que, aunque lo deseable es que las 2 dosis de la vacunación sean del mismo preparado comercial, en el hospital o fuera de él, por las razones expuestas, si un niño recibió una 1.ª dosis de Varilrix® en el medio extrahospitalario, dado que no es posible administrar la 2.ª dosis con el mismo preparado, puede completar la pauta con Varivax®.
Vacunación frente a la gripe estacionalRecomendación CAV-AEP 2013: el CAV-AEP recomienda la vacunación antigripal en la infancia y la adolescencia en: a) grupos de riesgo: niños a partir de los 6 meses de edad y adolescentes en determinadas situaciones o enfermedades de base; b) niños sanos a partir de los 6 meses de edad y adolescentes sanos que convivan con pacientes de riesgo, y c) adultos en contacto con niños y adolescentes incluidos en grupos de riesgo. Es especialmente importante la recomendación de la vacunación antigripal de todos los profesionales sanitarios.
El CAV-AEP considera que la vacunación antigripal es una estrategia especialmente beneficiosa cuando va dirigida a personas, niños y adultos, que se incluyen en los grupos de población considerados de riesgo. Pertenecen a estos grupos de riesgo aquellas personas que, debido a la enfermedad de base que presentan, o por el tratamiento que reciben, en el caso de sufrir una infección por el virus de la gripe, pueden padecer formas complicadas y más graves de la enfermedad, aumentando el riesgo de mortalidad o la desestabilización de su enfermedad de base. Sin embargo, muchos niños y adolescentes pertenecientes a estos grupos de riesgo continúan sin recibir, por distintas razones, dicha vacunación anual. Es necesaria una mayor implicación de los profesionales de la salud, las autoridades sanitarias y todos los agentes sociales para transmitir a la población, y de forma especial a los padres de niños y adolescentes pertenecientes a los grupos de riesgo, las recomendaciones de vacunación frente a la gripe estacional.
Este comité, al igual que otras sociedades científicas de España, desea hacer un especial énfasis en la vacunación antigripal de todos los profesionales sanitarios en contacto con pacientes137.
La información ampliada para esta vacunación puede ser consultada en el documento que este comité elabora de forma anual, antes del inicio de la temporada epidémica138.
Anualmente, la OMS decide las cepas del virus de la gripe que deben contener las vacunas estacionales. Para esta temporada 2012-2013, la cepa A/H1N1 elegida procede de la cepa H1N1-2009, que fue también empleada en las campañas 2010-2011 y 2011-2012. En cambio, la cepa A/H3N2 y la cepa B son diferentes de las empleadas en las 2 campañas anteriores139.
Con relación a la infancia y a la adolescencia, el CAV-AEP recomienda la vacunación antigripal en:
- 1.
Grupos de riesgo. Niños mayores de 6 meses y adolescentes en las siguientes situaciones o enfermedades de base:
- –
Enfermedad respiratoria crónica (p. ej., fibrosis quística, displasia broncopulmonar, asma e hiperreactividad bronquial, etc.).
- –
Enfermedad cardiovascular grave (congénita o adquirida).
- –
Enfermedad metabólica crónica (p. ej., diabetes, errores congénitos del metabolismo, etc.).
- –
Enfermedad crónica renal (p. ej., insuficiencia renal, síndrome nefrótico, etc.) o hepática.
- –
Enfermedad inflamatoria intestinal crónica.
- –
Inmunodeficiencia congénita o adquirida.
- –
Asplenia funcional o anatómica.
- –
Enfermedad oncológica.
- –
Enfermedad hematológica moderada o grave (p. ej., hemoglobinopatía, leucemia, etc.).
- –
Enfermedad neuromuscular crónica y encefalopatía moderada-grave.
- –
Malnutrición moderada o grave.
- –
Obesidad mórbida (índice de masa corporal igual o mayor de 3 desviaciones estándar por encima de la media para su edad).
- –
Síndrome de Down y otras cromosomopatías graves.
- –
Tratamiento continuado con ácido acetilsalicílico (por riesgo de síndrome de Reye en caso de infección por virus gripal salvaje).
- –
Embarazo en adolescentes.
- –
- 2.
Niños sanos mayores de 6 meses y adolescentes sanos que convivan con pacientes de riesgo. Se recomienda la vacunación de aquellos niños sanos mayores de 6 meses y adolescentes sanos, sin patología de base, pero que sean contactos domiciliarios (convivientes) de pacientes (niños o adultos) pertenecientes a los grupos de riesgo de complicaciones.
- 3.
Adultos en contacto con niños y adolescentes pertenecientes a grupos de riesgo. Debe insistirse en la vacunación frente a la gripe estacional de todos los adultos que sean contactos domiciliarios (convivientes o cuidadores) de niños y adolescentes que pertenezcan a los grupos de riesgo. Se enfatiza la recomendación de la vacunación antigripal en el personal sanitario que trabaja con niños.
Dado que los niños son la fuente principal de propagación del virus de la gripe en la comunidad (familia, escuela…)140, ya que eliminan una mayor carga viral y durante más tiempo que los adultos141, que las mayores tasas de incidencia se registran en la población menor de 15 años142 y que la tasa media de hospitalización en menores de 5 años sanos es de alrededor de 1 por 1.000143, el CAV-AEP considera que los niños mayores de 6 meses sanos y no incluidos en los grupos de riesgo anteriormente mencionados, pueden vacunarse frente a la gripe estacional si sus padres lo solicitan o su pediatra lo considera conveniente. Esta actitud preventiva constituye, sin duda, una oferta de salud que proporciona al niño o adolescente vacunado una protección individual directa, además de favorecer una protección familiar y comunitaria indirectas.
La vacunación antigripal universal de todos los niños, en el momento actual en nuestro medio y con las vacunas disponibles, plantea diversas dudas y algunos inconvenientes: a) necesidad de añadir anualmente una inyección intramuscular al calendario de vacunaciones, con los problemas inherentes de implementación y aceptabilidad; b) la efectividad de las vacunas antigripales trivalentes inactivadas en niños menores de 2 años es muy baja144-146, y c) el coste sería elevado y no existen suficientes datos de eficiencia en la edad pediátrica.
En los niños menores de 9 años, para la obtención de una protección óptima frente a la gripe son necesarias 2 dosis de la vacuna, separadas por, al menos, 4 semanas147,148. La 1.ª dosis debe administrarse tan pronto como la vacuna esté disponible, para asegurar así que ambas dosis puedan ser recibidas antes del inicio de la actividad gripal, ya que la protección es mayor cuando ambas dosis se administran durante la misma temporada de gripe147. Solo en los siguientes supuestos, en niños menores de 9 años, sería suficiente con una sola dosis147:
- –
Haber recibido 2 o más dosis de vacuna de la gripe estacional desde el 1 de octubre del 2010.
- –
Haber recibido 2 o más dosis de vacuna de la gripe estacional antes del 1 de octubre del 2010 y, al menos, una dosis de vacuna de la gripe pandémica monovalente 2009 (H1N1).
- –
Haber recibido, al menos, una dosis de vacuna de la gripe estacional antes del 1 de octubre del 2010 y, al menos, una dosis de la gripe estacional después del 1 de octubre del 2010.
El motivo para esta recomendación está basado en la importancia del antecedente de haber recibido una vacuna antigripal que contuviera la cepa pandémica 2009 (H1N1), ya que es muy probable su circulación predominante durante esta temporada. En niños de 9 años o más es suficiente con una dosis de vacuna antigripal cada temporada, si existe indicación para ello147.
Las únicas vacunas disponibles autorizadas para menores de 18 años en nuestro medio, en el momento actual, son los preparados trivalentes inactivados148, procedentes de cultivos en huevos de gallina embrionados, para su administración por vía intramuscular.
La vacuna antigripal atenuada de administración intranasal, indicada de 2 a 18 años, ha llegado por primera vez a España para esta temporada, pero en dosis limitadas. Es esperable que en las próximas temporadas, con mayor disponibilidad de este preparado, pueda ser tenida como una alternativa atractiva para mejorar la aceptabilidad de la vacunación antigripal en la población general, así como en los profesionales sanitarios, dada su mayor eficacia y comodidad de administración.
Vacunación frente a la hepatitis ARecomendación CAV-AEP 2013: el CAV-AEP recomienda la vacuna frente a la hepatitis A en ciertas situaciones de riesgo con 2 dosis, con un intervalo de, al menos, 6 meses entre dosis. Debe valorarse su administración en niños mayores de 12 meses que acuden a guardería.
Actualmente, en España en todas las CC. AA., excepto Cataluña, Ceuta y Melilla, la estrategia de vacunación contra la hepatitis A se basa en la vacunación selectiva a grupos con riesgo incrementado, siguiendo las recomendaciones expresadas por la circular 15/98 de la Dirección General de Farmacia149, que se puede resumir de la siguiente manera.
La vacunación está indicada en:
- –
Personas que viajan a zonas de alta o media endemicidad de hepatitis A, especialmente si han nacido con posterioridad a 1966 y si se desplazan a zonas rurales o con condiciones higiénico-sanitarias deficientes.
- –
Personas con procesos hepáticos crónicos, o en tratamiento mantenido con fármacos hepatotóxicos, o con hepatitis B o C, que a pesar de no tener un mayor riesgo de infección, sí lo tienen de sufrir una hepatitis A fulminante.
- –
Pacientes hemofílicos que reciben hemoderivados y los pacientes candidatos a trasplantes de órganos.
- –
Cuidadores o familiares en contacto directo con enfermos de hepatitis A.
- –
Personas con infección por el virus de la inmunodeficiencia humana (VIH).
- –
Personas que presentan estilos de vida que suponen un mayor riesgo de infección: por ejemplo, hombres que practican sexo con hombres o bien usuarios de drogas por vía parenteral.
- –
Personas con un mayor riesgo ocupacional.
- –
Recomendaciones en determinadas situaciones: manipuladores de alimentos, personal que trabaja en guarderías infantiles y personal sanitario de instituciones asistenciales.
Se incluye la recomendación de vacunar al personal de guarderías infantiles (educadores, personal de limpieza y cocina, etc.) debido a la existencia de casos asintomáticos en los niños que acuden a las mismas y a la facilidad de transmisión y contagio que presentan estos niños que no controlan esfínteres; sin embargo. el uso de la vacuna no debería limitarse solo a estos trabajadores, sino que podría ampliarse a los niños para su propia protección y la de sus familiares y contactos domésticos.
El CAV-AEP recomienda, además, la vacunación frente a la hepatitis A, como profilaxis preexposición, a los niños mayores de 12 meses con elevado riesgo de infección pertenecientes a estos otros grupos:
- –
Niños inmigrantes que visitan sus países de origen que tienen una endemicidad intermedia o alta para la infección por el virus de la hepatitis A.
- –
Residentes en instituciones cerradas y sus cuidadores.
- –
Síndrome de Down y sus cuidadores.
Las indicaciones como profilaxis postexposición, en los 14 días siguientes a la misma, incluyen:
- –
Contacto domiciliario con un caso agudo de infección por virus de la hepatitis A.
- –
De forma preferente, ante la presencia de brotes en guarderías.
En España, el papel de las guarderías en la difusión del virus de la hepatitis A está subestimado. Las guarderías que atienden a niños con pañales tienen más probabilidad de experimentar brotes de esta enfermedad. Por esta razón, los niños mayores de 12 meses que acuden a guardería deberían beneficiarse de la administración de la vacuna contra la hepatitis A150. Idealmente, la vacunación se realizará antes del acceso a las guarderías. Los niños que acuden a estas a edades más tempranas no serán vacunados hasta que tengan 12 meses de edad, edad mínima recomendada para la administración de la vacuna.
La pauta de vacunación en ambos tipos de profilaxis consiste en 2 dosis, a partir de los 12 meses de edad, con un intervalo de, al menos, 6 meses entre dosis151,152. Para los viajeros se recomienda que la 1.ª dosis se administre, al menos, un mes antes del viaje a la zona endémica.
Las excepciones a una estrategia de vacunación selectiva son la comunidad de Cataluña y las ciudades autónomas de Ceuta y Melilla, que incorporaron la vacunación universal a sus calendarios de vacunación pediátricos2. Cataluña instauró en 1998 la vacunación universal frente a la hepatitis A en los preadolescentes de 12 años, aplicándola en las escuelas en forma de vacuna combinada frente a las hepatitis A y B. Con esta medida, la efectividad frente a la hepatitis A ha sido muy importante, con una reducción del 97% en la incidencia de casos en las cohortes vacunadas y con disminuciones importantes en las no vacunadas, probablemente como consecuencia de la inmunidad de grupo, por lo que han decidido mantener el programa hasta el curso 2013-2014, año en el que las cohortes de niños vacunados frente a la hepatitis B en el primer año de vida llegarán al curso en el que se administra la vacuna combinada frente a ambos virus153-156. Ceuta y Melilla incluyeron en el año 2000 la vacunación universal frente a la hepatitis A en niños en el segundo año de vida2.
De la misma manera que ocurrió con la estrategia selectiva de la vacunación frente a la hepatitis B, la vacunación frente a la hepatitis A de la población de mayor riesgo tendrá muy poco impacto en la incidencia de la enfermedad, ya que solo se puede prevenir un pequeño porcentaje del total de casos. Únicamente la vacunación universal puede reducir de forma significativa la enfermedad. Además, al no existir un reservorio no humano, ni infecciones crónicas por el virus de la hepatitis A, la vacunación universal tiene el potencial de la eliminación de la enfermedad de una comunidad o país.
En resumen, el CAV-AEP mantiene la recomendación de vacunar frente a la hepatitis A a las personas con un riesgo incrementado de infección, a la vez que considera que, idealmente, la vacunación universal de todos los niños podría ser la estrategia óptima para la eventual eliminación y control de esta enfermedad.
Próximas vacunas: meningococo BDesde hace años se está intentando obtener una vacuna eficaz frente al meningococo B. Las primeras líneas de investigación se dirigieron al desarrollo de vacunas de polisacáridos capsulares, pero se comprobó que eran poco inmunógenas y podían generar fenómenos de autoinmunidad. El siguiente paso se dirigió a conseguir vacunas frente a vesículas de membrana externa (OMV) del germen; sin embargo, estas vacunas mostraron una pobre respuesta inmunológica, una baja eficacia, especialmente en niños menores de 4 años, y escasa protección cruzada frente a cepas heterólogas, por lo que solo se han empleado de forma esporádica, especialmente para intentar controlar brotes epidémicos157.
Las últimas líneas de investigación se basan en técnicas recombinantes y de «vacunología inversa»158. Basándose en estas nuevas tecnologías, existen en la actualidad 2 vacunas en diferentes fases de desarrollo:
- 1.
Vacuna antimeningocócica multicomponente del serogrupo B (4CMenB), del laboratorio Novartis.
Tras la finalización de los ensayos clínicos, esta vacuna fue presentada en diciembre de 2010 para su autorización en la EMA y está pendiente de su próxima comercialización. Contiene varios antígenos relacionados con la patogenicidad (fHbp, NadA y NHBA), combinados con vesículas de membrana externa de la vacuna utilizada en Nueva Zelanda (cepa 98/254), como inmunomodulador.
Los datos presentados se basan en diversos ensayos clínicos efectuados en más de 8.000 lactantes, niños pequeños, adolescentes y adultos. La pauta de primovacunación empleada consta de 3 dosis (2, 4 y 6 meses). Los resultados de los ensayos muestran que la vacuna induce una buena respuesta inmunológica en lactantes, cuando se administra sola o en combinación con otras vacunas de calendario, con una tolerabilidad aceptable159. Es igualmente inmunógena cuando se administra como refuerzo en el segundo año de vida a niños previamente vacunados o después de 2 dosis administradas entre los 12 y 15 meses, con un intervalo de 2 meses entre ambas, en niños que no han recibido ninguna dosis previa. También genera una potente respuesta inmunológica en adolescentes y adultos. Un estudio reciente en adolescentes concluye que la administración de 2 dosis de vacuna, separadas por un intervalo de 1 a 6 meses, confiere protección adecuada en el 99-100% de los sujetos160. Datos indirectos recientes indican que esta vacuna puede proporcionar protección frente al 75-80% de las cepas del meningococo B causantes de enfermedad invasora en Europa161.
- 2.
La otra vacuna en desarrollo, del laboratorio Pfizer, es un preparado bivalente compuesto por 2 variantes (A05 y B01) del grupo de lipoproteínas de la membrana externa, designadas como LP2086. Los ensayos clínicos realizados en adolescentes muestran una buena respuesta inmunológica tras la administración de 2 dosis162. Existen datos recientes de un estudio realizado en niños entre 18 y 36 meses que muestran una buena respuesta inmunológica tras la administración de 3 dosis de vacuna163.
En resumen, parece que puede estar próxima la aparición y comercialización de vacunas eficaces frente al meningococo B. Se trata de preparados con perfil de vacuna sistemática, aunque será preciso confirmar la cobertura de las cepas circulantes en nuestro medio.
Calendarios acelerados de vacunación para niños y adolescentes con vacunación incompletaEn muchas ocasiones, es necesario vacunar a niños que no han recibido vacunas previamente o que no han seguido un calendario de vacunaciones de forma regular, lo han iniciado tardíamente, lo han interrumpido o han sido vacunados en sus países de origen con una pauta diferente a la indicada en España. En todos estos niños se debe realizar una adaptación al calendario de vacunación de nuestro país. Se han elaborado unas tablas para orientar en la realización de pautas de vacunación acelerada en niños y adolescentes con inmunización incompleta (figs. 3-5).
El objetivo de estos calendarios acelerados es que sean un instrumento de ayuda para los pediatras en su práctica diaria. Se basan en recomendaciones de diversas sociedades científicas y de expertos, y para interpretarlos deben tenerse en cuenta las siguientes premisas164,165:
- –
Edad del niño y, en función de ella, el número de dosis necesarias para estar correctamente vacunado (fig. 3). Las dosis administradas previamente, si las hubiese, deben considerarse válidas siempre que respeten la edad mínima y el intervalo mínimo entre las dosis. No se reiniciará una pauta de vacunación si el niño ha recibido dosis previas válidas. Para actualizar el calendario se establecerán las dosis necesarias en función de la edad y se restarán las que ya hubiese recibido; el resultado serán las dosis necesarias para poner al día el calendario de vacunas.
- –
Se considerarán válidas las dosis que estén correctamente registradas o identificadas. En los casos en los que no hubiese ninguna prueba documentada de las vacunas administradas, y por interrogatorio no se pudiese establecer fehacientemente qué vacunas ha recibido un individuo, debe recomendarse la administración de todas las vacunas adecuadas para la edad, como si se tratase de un paciente no vacunado.
- –
Debe respetarse el intervalo mínimo entre dosis para obtener una adecuada respuesta inmunológica y considerar la vacunación como válida. La aplicación de estos intervalos permite completar cuanto antes el calendario de vacunación (pauta acelerada) y alcanzar rápidamente un estado de inmunización adecuado. A partir de ese momento, será preferible no utilizar los intervalos mínimos para continuar la vacunación, respetando los intervalos habituales recomendados.
- –
Se administrarán de forma simultánea todas las vacunas posibles en lugares anatómicos distintos. Se utilizarán preferentemente vacunas combinadas (para disminuir el número de inyecciones). En caso de que, por distintos motivos, no se pudieran administrar todas las vacunas simultáneamente (reticencia del niño, sus padres o tutores, número elevado de dosis pendientes o no disponibilidad de algún preparado) y se considere que el niño volverá a la consulta por tener un domicilio estable, se administrarán primero las vacunas que inmunicen frente a la patología de mayor riesgo con relación a la edad del niño y a la epidemiología de su entorno y las que lo inmunicen frente a enfermedades para las que no hubiese recibido ninguna dosis previa de vacuna.
En las figuras 4 y 5 se muestran los intervalos mínimos y el número de dosis necesarias de las vacunas recomendadas por el CAV-AEP para niños entre 4 meses y 6 años, y para niños y adolescentes entre los 7 y los 18 años de edad, respectivamente. Es necesario, para una correcta comprensión de la figura, leer el pie de la misma, ya que la información allí expresada aclara algunos aspectos que hacen referencia a situaciones específicas.
Conflicto de interesesDMP ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD, como investigador en ensayos clínicos de GlaxoSmithKline y como consultor en Advisory Board de Pfizer y Astra-Zeneca.
FJAG ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD.
JAF ha colaborado en actividades docentes y como investigador en ensayos clínicos subvencionados por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD.
FBC ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline y Baxter.
MJCO ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigadora en ensayos clínicos de Pfizer.
JMCR ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Sanofi Pasteur MSD y Novartis.
JGH ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD.
THS ha colaborado en actividades docentes subvencionadas por Pfizer, Sanofi Pasteur MSD y como investigadora en ensayos clínicos de Pfizer.
MMM ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD.
LOC ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline.
JRC ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline y Pfizer.
David Moreno-Pérez (DMP), Francisco José Álvarez García (FJAG), Javier Arístegui Fernández (JAF), Francisco Barrio Corrales (FBC), M. José Cilleruelo Ortega (MJCO), José María Corretger Rauet (JMCR), José González-Hachero (JGH), Teresa Hernández-Sampelayo Matos (THSM), Manuel Merino Moína (MMM), Luis Ortigosa del Castillo (LOC), Jesús Ruiz-Contreras (JRC).
Los miembros del Comité Asesor de Vacunas de la Asociación Española de Pediatría se presentan en el anexo 1.