La enfermedad de Kawasaki (EK) es una vasculitis aguda de causa desconocida, predominante en el sexo masculino. Los efectos de la enfermedad a largo plazo dependen de la existencia de lesiones coronarias —aneurismas—, siendo el pronóstico de los pacientes con aneurismas gigantes sombrío, ya que en su evolución natural pueden presentar trombosis coronaria o lesiones obstructivas severas.
ObjetivosDescribimos las características de una serie de 8 pacientes lactantes con EK y severa afectación coronaria. Se describen la epidemiología y los métodos diagnósticos, y se revisa el tratamiento de la fase aguda, así como las secuelas cardiovasculares a largo plazo.
MétodosSe realizó un análisis descriptivo de pacientes ingresados en el Servicio de Cardiología Pediátrica del Hospital Universitario La Fe (Valencia) por EK con afectación coronaria.
ResultadosEn todos los casos se objetivó la afectación de más de una arteria. El diagnóstico se instauró precozmente en solo 2 casos, a pesar de ello, ningún paciente presentó deterioro grave de la función ventricular durante la fase aguda. El tratamiento incluyó gammaglobulina por vía intravenosa y ácido acetilsalicílico en dosis antiinflamatorias durante la fase aguda. En los casos de trombosis coronaria se asociaron doble antiagregación y corticoides. Las lesiones aneurismáticas silentes persisten hasta el momento actual.
ConclusionesLa EK es la causa más común de enfermedad cardiaca adquirida en niños. El retraso en el diagnóstico se asocia a mayor frecuencia de lesiones coronarias, que podrían incrementar el riesgo de eventos cardiovasculares en la edad adulta, precisando este subgrupo un seguimiento clínico estrecho con control de los factores de riesgo cardiovascular a largo plazo.
Kawasaki disease (KD) is an acute vasculitis of unknown origin and predominant in males. The long-term effects of the disease depend on whether there are coronary lesions, particularly aneurysms. The prognosis of patients with giant aneurysms is very poor due to their natural progression to coronary thrombosis or severe obstructive lesions.
ObjectivesA series of 8 cases is presented where the epidemiology and diagnostic methods are described. The treatment of the acute and long-term cardiovascular sequelae is also reviewed.
MethodsA descriptive analysis was conducted on patients admitted to the Paediatric Cardiology Unit of La Fe University Hospital (Valencia) with KD and a coronary lesion.
ResultsMore than one artery was involved in all patients. Although early diagnosis was established in only two cases, none of the patients had severe impairment of ventricular function during the acute phase. Treatment included intravenous gammaglobulin and acetylsalicylic acid at anti-inflammatory doses during the acute phase. A combination of dual antiplatelet therapy and corticosteroids was given in cases of coronary thrombosis. The silent aneurysms continue to persist.
ConclusionsKD is the most common cause of acquired heart disease in children. The delay in diagnosis is associated with a greater likelihood of coronary lesions that could increase the risk of cardiovascular events in adulthood. Thus, this subgroup requires close clinical monitoring for a better control of cardiovascular risk factors over time.
La enfermedad de Kawasaki (EK) es una de las vasculitis más frecuentes de la infancia cuyo origen sigue siendo desconocido. Es más frecuente en niños de origen asiático y con edades comprendidas entre los 2 y los 5 años1,2. Todas las estructuras cardiacas pueden verse implicadas, pero la afectación coronaria es la complicación más temida, dado que la formación de aneurismas coronarios (AC) puede dar lugar a trombosis, cardiopatía isquémica, así como ateroesclerosis precoz y muerte súbita en su evolución, con mención especial en aquellos aneurismas de gran tamaño, con mayor frecuencia de complicaciones (estenosis/trombosis). El tratamiento en la fase aguda está dirigido a controlar el estado inflamatorio sistémico, mientras que a largo plazo está enfocado a la prevención de la cardiopatía isquémica en aquellos pacientes que desarrollaron lesiones coronarias3 (figs. 1–4).
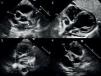
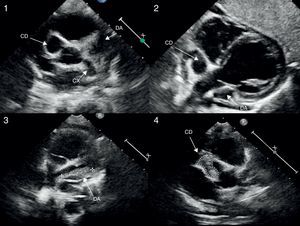
Imagen ecocardiográfica (plano paraesternal corto alto modificado a nivel de grandes arterias para valoración de raíz aórtica y arterias coronarias) en el que se objetiva la presencia de aneurismas gigantes en los segmentos proximales de las tres arterias coronarias principales (imágenes 1 y 2). Ecocardiografía de control en la que se evidencian trombos intraluminal en ADA y CD, manteniéndose la función cardiaca sistólica conservada (imágenes 3 y 4).
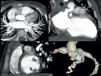
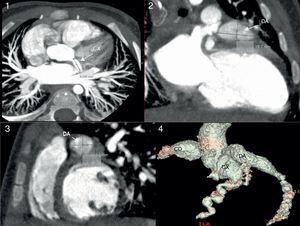
Imagen de cardio-TC. Se visualiza en las 3 proyecciones de la reconstrucción multiplanar (axial —imagen 1—, coronal —imagen 2— y sagital —imagen 3—) la dilatación proximal aneurismática en grado gigante de ADA y CD; en la reconstrucción volumétrica-3D (imagen 4) se puede observar de forma precisa la localización, la extensión y el tamaño de los mismos.
Se realizó un análisis descriptivo de forma retrospectiva entre octubre del 2004 y mayo del 2015. Se incluyó a 8 pacientes menores de 2 años con criterios de EK completo o incompleto (tabla 1) y AC gigantes.
Criterios de enfermedad de Kawasaki
| Presentación completa | Presentación incompleta |
|---|---|
| Fiebre ≥ 5 días evolución+4 de los siguientes criterios clínicos: | Fiebre ≥ 5 días evolución+2 o 3 criterios clínicos+PCR>30mg/l o VSG>40mm/h+al menos 3 de los siguientes criterios de laboratorio: |
| a. Inyección conjuntival bilateral no exudativa | a. Albúmina ≤ 3g/dl |
| b. Alteraciones de la mucosa bucal: lengua aframbuesada, enantema, labios fisurados | b. Anemia microcítica y normocrómica para la edad |
| c. Exantema polimorfo | c. Elevación de GPT |
| d. Lesión palmo-plantar, descamación | d. Plaquetas > 450.000/mm3 después de 7 días |
| e. Adenopatía cervical > 1,5cm | e. Leucocitos>15.000/mm3 |
| f. 10 células/campo en el sedimento orina |
Adaptada de “The Japanese Ministry of Health research committee” y “American Heart Academy of Pediatrics”.
La EK según la definición de Kawasaki1 en 1967 se define como presencia de fiebre elevada>5 días de evolución y 4 de los siguientes criterios: inyección conjuntival bilateral no exudativa, alteraciones bucales (lengua aframbuesada), eritema y descamación palmoplantar, exantema polimorfo no petequial y adenopatías (tabla 1)4. Se consideró EK incompleta si únicamente se presentaban 2-3 de los 5 criterios. En cuanto a las alteraciones analíticas, la EK se asocia invariablemente con un proceso inflamatorio, con elevación de la VSG (> 20mmHg), la PCR (> 30mg/l) y los leucocitos (> 12.000/mm3). La trombocitosis (plaquetas>450.000/mm3) se produce hacia el final de la segunda semana de la enfermedad y, por tanto, no tiene utilidad diagnóstica en la fase aguda, en la que el recuento de plaquetas puede ser bajo o normal (peor pronóstico). Otras alteraciones analíticas son: hiperbilirrubinemia, hipertransaminasemia, hipoalbuminemia (< 3,5g/dl), piuria estéril y pleocitosis en el líquido cefalorraquídeo.
Al ingreso en nuestro centro los pacientes con sospecha de EK fueron valorados cardiológicamente con un examen físico completo, electrocardiograma y ecocardiograma. Las alteraciones coronarias, se clasificaron en: ectasias, aneurismas pequeños<5mm, medianos (5-6mm) y gigantes>6-8mm y/o Z-score (≥ 10)5,6; y estenosis/trombosis coronaria. Cuando hay afectación coronaria extensa, hoy día, se preconiza la realización de una TC de coronarias (TCC) para caracterizar la afectación anatómica o detectar complicaciones. Así mismo la aparición de la resonancia magnética y su aplicación en la cuantificación de la perfusión miocárdica mediante la administración de dipiridamol IV (RMDPIV) permite una mejor caracterización del daño miocárdico y de la viabilidad del tejido afectado.
Las variables recogidas incluyeron: sexo, edad, estacionalidad, días de fiebre, criterios clínicos y analíticos —incluyendo péptido natriurético cerebral (pro-BNP) o biomarcadores de daño miocárdico (troponinaT)— y datos de técnicas de imagen como la ecocardiografía, la TCC y otras técnicas con valoración funcional, como la gammagrafía de perfusión miocárdica o la RMDPIV y tratamiento recibido.
En cuanto a los tratamientos y las dosis empleadas, las gammaglobulinas (IGIV) se utilizaron en perfusión continua IV (PCIV) en 12 h a 2 g/kg/dosis, el ácido acetilsalicílico (AAS) se usó durante la fase aguda a dosis antiinflamatorias (80-100mg/kg/día), reduciéndose a dosis antiagregante (3-5mg/kg/día) cuando la fiebre hubiera desaparecido. Se definió no respuesta al tratamiento como persistencia de fiebre más de 36 h tras la administración de IGIV. Los corticoides se usaron en 2 pautas (los pacientes no son correlativos en el tiempo); a los más antiguos se les administró prednisona IV 1-2mg/kg/día (5-7 días) y a los más recientes, metilprednisolona IV 30mg/kg/día (3 días). Como tratamiento antiinflamatorio de rescate, se utilizó infliximab (5mg/kg en dosis única IV), un anticuerpo monoclonal con una potente acción antiinflamatoria, en pacientes con afectación coronaria que no se lograba una adecuada anticoagulación y con persistencia clínico-analítica de estado inflamatorio basal no controlado.
Los tratamientos anticoagulantes empleados fueron inicialmente heparina de bajo peso molecular (enoxaparina) a dosis de 1mg/kg/día vía subcutánea y en los casos con trombosis coronaria se prefirió el uso de heparina sódica en PCIV (28 U/kg/h). El abciximab (anticuerpo monoclonal, que bloquea el desencadenamiento de la generación de trombina que sigue a la activación plaquetaria) fue empleado en los pacientes con trombosis coronaria de forma concomitante al AAS y la heparina sódica, en PCIV a dosis de 1,5 U/kg/h (0,25 μg/kg/min) durante 12h. El activador tisular del plasminógeno (r-TPA) es una enzima implicada en la disolución de coágulos de sangre (cataliza la conversión de plasminógeno a plasmina, que es la enzima principal para la disolución de coágulos de sangre); se empleó a baja dosis debido a la edad de los pacientes en PCIV de 12 h (0,1mg/kg/h). La pauta profiláctica antitrombótica al alta fue de AAS y acenocumarol para mantener INR entre 2 y 2,5.
ResultadosEn nuestra serie de 8 pacientes el rango de edad fue de 5 a 24 meses, en su mayoría lactantes (mediana de edad=8,3 meses) y varones (62,5%). El 90% de los casos comenzaron en meses fríos (invierno, otoño). En cuanto al diagnóstico, basado en criterios clínicos establecidos clásicamente desde 1974 y revisados por Jane et al. en 20042, consultaron por fiebre persistente en el 100% de los casos, superior a 39°C en el 90% de los casos. El exantema polimorfo estuvo presente en todos ellos; la inflamación de las mucosas y la conjuntivitis bilateral no exudativa en el 50% y solo presentó adenitis cervical uno de estos, lo que indica que en su mayoría (6 casos, 75%) fueron identificados inicialmente como formas incompletas de la EK (tabla 1). Del total de la serie, 3 pacientes tuvieron un diagnóstico inicial diferente (uno de ellos como viriasis, otro como bacteriemia y un tercero como fallo hepático y encefalitis en contexto de sepsis) y solo 2 pacientes (casos 6 y 8) cumplían criterios de EK completa.
En cuanto a las alteraciones analíticas en el momento del diagnóstico (tomado como el momento de pautar tratamiento específico con gammaglobulinas), la presencia de leucocitosis fue un denominador común en todos los casos; por otro lado, en 6 de los 8 pacientes (75%) hubo una marcada trombocitosis (los otros 2 casos fueron los de diagnóstico más precoz). Todos los pacientes presentaban alteraciones en los reactantes de fase aguda, con una PCR elevada en los 8 pacientes y con una VSG elevada en 7 de los 8 pacientes de nuestra serie. Todos los pacientes presentaban hipoalbuminemia en nuestra serie al diagnóstico. El aumento de biomarcadores de daño miocárdico y pro-BNP fue significativo en todos los pacientes, con valores de troponinas T y pro-BNP ligeramente elevados y en los 2 casos de trombosis coronaria (25%) los valores fueron muy elevados (troponina T>2ng/ml y pro-BNP>15.000pg/ml), sin presentar fallo ventricular severo en ningún caso.
La detección inicial de las anomalías coronarias se realizó mediante ecocardiograma Doppler en su mayoría (fig. 1), excepto en un caso (paciente 4) en el cual en relación con un enfoque inicial atribuido a proceso viral, el diagnóstico inicial se realizó a través de TC torácica solicitada por infiltrados en ambos lóbulos superiores, identificándose alteraciones coronarias confirmadas en ecocardiografía. En todos los casos, en el estudio de imagen inicial se objetivó la afectación de más de una arteria.
En cuanto al tratamiento, en los 2 pacientes que cumplían criterios diagnósticos clásicos (tabla 2) cuando llegaron a su hospital de referencia el tratamiento se instauró rápidamente (pacientes 6 y 8); en el resto de los casos, el tratamiento dirigido no fue tan precoz, debido a la falta de sospecha inicial. Todos recibieron tratamiento inicial con IGIV y AAS; este último a dosis antiinflamatorias durante la fase aguda-subaguda hasta comprobar descenso de marcadores analíticos inflamatorios y quedar apiréticos de forma mantenida, para continuar con dosis antiagregante al alta. La mediana de días de fiebre en que se administraron gammaglobulinas fue de 12,25 días (mínimo 9 días y máximo 23 días). Precisaron dosis repetidas de IGIV 5 de los pacientes, debido a la falta de respuesta clínica. En estos 5 casos se pautaron además corticoides (en 3 de ellos con la pauta inicial de prednisona y en 2 de ellos, más recientes, con la pauta de metilprednisolona) y en 2 de ellos (casos con trombosis intracoronaria), además se asoció infliximab en dosis única.
Características de la muestra
| Caso | Edad | Género | Estación | Afectación cardiaca al diagnóstico | Síntomas/signos | Tratamiento agudo | Tratamiento crónico |
|---|---|---|---|---|---|---|---|
| 1 | 11 meses | Varón | Invierno | ACG múltiples (ADA y circunfleja). FEVI 58%. Trombo intraluminal en circunfleja | Fiebre (18 días), exantema morbiliforme, inyección conjuntival, vesículas | IGIV (3 dosis), AAS, corticoides, abciximab, infliximab, r-TPA, HBPM y heparina sódica IV | AAS y acenocumarol Captopril |
| 2 | 6 meses | Mujer | Primavera | ACG (CD), FEVI normal. Dilatación ectásica multiterritorial (ADA y circunfleja) | Fiebre (13 días), exantema generalizado, afectación palmo-plantar. Hiperemia conjuntival | IGIV (3 dosis), AAS, corticoides, HBPM | AAS y acenocumarol |
| 3 | 5 meses | Varón | Invierno | ACG múltiples (CD, ADA y circunfleja). FEVI 53%. Trombos intraluminales en CD y ADA | Fiebre (2 semanas), exantema polimorfo Descamación palmo-plantar tardía | IGIV (3 dosis), AAS, corticoides, abciximab, infliximab, r-TPA, HBPM y heparina sódica IV | AAS, clopidogrel y acenocumarol Carvedilol, captopril Estatinas |
| 4 | 4 meses | Varón | Invierno | ACG (CD y ADA) sin trombosis. FEVI normal | Fiebre (3 semanas), exantema y descamación palmo-plantar | IGIV (2 dosis), AAS | AAS y acenocumarol Estatinas |
| 5 | 11 meses | Varón | Otoño | ACG (ADA y circunfleja) sin trombosis intracoronarias | Fiebre (3 semanas), síntomas catarrales, exantema y descamación | IGIV (1 dosis), AAS | AAS y acenocumarol |
| 6 | 2 años | Mujer | Invierno | ACG (CD y ADA) sin trombosis. FEVI conservada | Febrícula intermitente (10 días), síntomas catarrales. Exantema. Descamación | IGIV (1 dosis), AAS | AAS y acenocumarol |
| 7 | 14 meses | Mujer | Otoño | ACG (CD y ADA) sin trombosis. FEVI en límite alto | Fiebre (2 semanas), exantema tronco y descamación plantar | IGIV (3 dosis), AAS, corticoides | AAS y acenocumarol |
| 8 | 7 meses | Varón | Invierno | ACG (ADA y circunfleja) sin trombosis. FEVI normal | Fiebre (9 días), vesículas, adenopatía cervical. Exantema. Descamación | IGIV (3 dosis), AAS, corticoides. HBPM | AAS y acenocumarol. Estatinas |
AAS: ácido acetilsalicílico; ACG: aneurismas coronarios gigantes; ADA: arteria descendente anterior; CD: coronaria derecha; FEVI: fracción de eyección del ventrículo izquierdo; HBPM: heparina de bajo peso molecular; IGIV: inmunoglobulina por vía intravenosa; r-TPA: activador tisular del plasminógeno.
En los 2 casos de trombosis coronaria (casos 1 y 3) se asoció anticoagulación con heparina de bajo peso subcutánea o sódica IV, además de antiagregación con AAS. En estos casos, además, dado que estos pacientes continuaban con marcadores inflamatorios elevados y marcado escenario procoagulante basal sin poder lograr una anticoagulación apropiada, se asociaron corticoides y otros antiinflamatorios, como el infliximab; en los 2 se pautó tratamiento con activador tisular del plasminógeno (r-TPA), que se mantuvo durante 12h, con escaso efecto, por lo que se decidió continuar con heparina sódica IV, que fue efectiva.
En uno de los casos (paciente 3), inicialmente por ecocardiografía y posteriormente mediante TCC, trombosis asintomática intraaneurisma (fig. 2) en origen de coronaria derecha (CD), con diámetro máximo de 13mm, y en la arteria descendente anterior (ADA) ostial, respectivamente, tratadas con trombólisis sistémica con r-TPA, infliximab, abciximab y heparina sódica IV, presentando disfunción sistólica ligera. La RMDPIV confirmó la antigüedad del trombo, debido a la presencia de área de necrosis circunscrita a la zona septal y posterior con zonas revascularizadas por colaterales. Al alta se mantuvo tratamiento con AAS, acenocumarol, inhibidores de la enzima conversora de angiotensina, carvedilol y espironolactona.
El otro caso (paciente 1) fue diagnosticado de trombosis intraaneurisma en CD, pautándose tratamiento con heparina sódica IV y r-TPA, asociando disfunción sistólica ligera de la fracción de eyección del ventrículo izquierdo (FEVI) y con desaparición del trombo y normalización de la FEVI en los controles ecocardiográficos posteriores; la TCC de control confirmó la ausencia de lesiones trombóticas intraauneurismáticas y la RMDPIV descartó la presencia de lesiones isquémicas o necróticas, con normalización de la FEVI. Al alta, se pautó tratamiento de profilaxis antitrombótica, precisando únicamente captopril para la función miocárdica.
En promedio, la lesión coronaria se identificó más allá del décimo día de fiebre, teniendo en cuenta que la mayoría fueron remitidos desde otros centros. A pesar de ello, ningún paciente presentó deterioro grave de la FEVI, valvulopatías graves ni complicaciones mecánicas durante la fase aguda. Durante el seguimiento, las lesiones coronarias se han mantenido estables, sin desarrollo de nuevas complicaciones (estenosis o aneurismas).
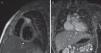
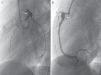
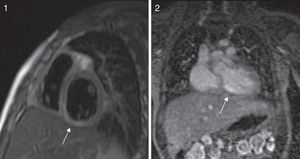
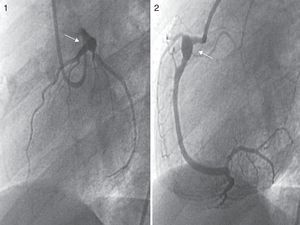
Los controles ambulatorios periódicos incluyeron electrocardiograma, ecocardiografía cada 3-6 meses y TCC cada 12 meses, así como al menos una gammagrafía de perfusión miocárdica (casos más antiguos) o RMDPIV (fig. 3), como prueba de imagen funcional en valoración pronóstica, que se repitió de forma periódica en los 2 casos con trombosis coronaria. Se realizaron coronariografías en los 3 casos más antiguos y en los 2 casos recientes con trombosis intracoronaria, tras pasar la fase inicial de la enfermedad (fig. 4). Se realizó ergometría funcional a los 3 pacientes más antiguos, que fue bien tolerada sin hallazgos patológicos.
En el total de los casos, las lesiones aneurismáticas persisten hasta el momento actual, manteniendo tratamiento crónico con AAS a dosis antiagregante, acenocumarol para INR entre 2 y 2,5, y en 3 de estos tratamientos hipolipidemiante con estatinas (casos 3, 4 y 8) en algún momento del curso evolutivo (edad media de 8,25 años al inicio del tratamiento).
DiscusiónSospechar la EK en fases iniciales sigue siendo fundamental para el pronóstico a largo plazo de estos pacientes, dado que el tratamiento precoz con IGIV y AAS a dosis antiinflamatorias es el factor más importante para evitar el desarrollo de AC, que generalmente aparecen entre el séptimo y décimo día de fiebre, siendo la principal causa de la morbimortalidad cardiovascular en la EK, disminuyendo así su incidencia del 25 al 2-12%, y la incidencia de aneurismas gigantes del 4 a < 1%4,7,8. La mediana del inicio del tratamiento en esta serie es al 12.° día de fiebre, lo cual es un factor pronóstico negativo notable en cuanto al desarrollo de alteraciones coronarias, así como de la respuesta a la dosis inicial de gammaglobulinas. Si tras 36h de la primera dosis IGIV los pacientes no muestran una respuesta completa, está indicada la administración de una segunda dosis de IGIV al mismo tiempo que se inicia el tratamiento con esteroides9,10. Un reciente estudio muestra buenos resultados en pacientes con EK con alto riesgo de lesión coronaria cuando se combina la IGIV con prednisona mantenida hasta que la PCR se normalice11-13. A pesar de esto, aún está por determinar la eficacia y las pautas de tratamiento con corticoides (actualmente se prefieren los pulsos de metilprednisolona) y también las indicaciones de los inhibidores del receptor GP IIB/IIIA, como abciximab, y antiinflamatorios de última generación, como el infliximab14, siendo estos últimos utilizados actualmente en casos resistentes al uso de dosis repetidas de IGIV en pacientes graves con AC gigantes y/o disfunción ventricular con complicaciones trombóticas15,16. Los pacientes que presentamos han precisado al menos 2 dosis de gammaglobulinas para quedar afebriles, en 5 casos han precisado asociar corticoides y en los casos más graves se han añadido nuevas terapias, como el abciximab o el infliximab. Los 2 casos que presentaron trombosis intracoronaria fueron pacientes de alto riesgo, de diagnóstico tardío y en los que la persistencia de la fiebre y un estado inflamatorio basal procoagulante favorecieron la aparición de estas complicaciones. Es importantísimo no solo la prevención, sino también el control de la inflamación, ya que supone un sustrato básico para la producción de trombos sobre una zona de elevado riesgo.
El ecocardiograma es la técnica fundamental para el diagnóstico y el seguimiento de las lesiones cardiacas, acompañado del electrocardiograma. De forma rutinaria hoy día, se utiliza la estandarización mediante las tablas de Z-score para clasificar el tamaño de los AC, pues evalúa las dimensiones de las arterias coronarias, ajustada por superficie corporal. Todos nuestros pacientes fueron diagnosticados y seguidos por ecocardiografía; así mismo, las complicaciones fueron valoradas precozmente con esta técnica de imagen. La TCC es una prueba de gran valor en el diagnóstico y el seguimiento de estos pacientes, si bien la exposición a radiaciones ionizantes, la necesidad de anestesia y la regulación de la frecuencia cardiaca son puntos a tener en cuenta: la disponibilidad, la rapidez y la elevada información que proporciona han hecho que se trate de la prueba ideal en sustitución de la coronariografía, que presenta mayores riesgos debido a la fragilidad coronaria de estos pacientes9. Solo se realizó coronariografía en los pacientes más antiguos de la serie, siendo los más recientes estudiados por TCC tanto al diagnóstico como durante el seguimiento. Realizamos TCC de control al año del diagnóstico, salvo que las exploraciones complementarias no invasivas sugieran realización de estudio previo. En cuanto a las pruebas funcionales, la RMDPIV aporta valiosa información sobre la viabilidad miocárdica, además de valorar los aneurismas, en pacientes pequeños precisa sedación y/o anestesia, siendo su punto fuerte la ausencia de irradiación12. La coronariografía define con exactitud aneurismas, estenosis, trombosis con oclusión de la circulación y presencia de circulación colateral. Actualmente, su uso queda limitado a un escaso grupo de pacientes en los que el resto de técnicas de imagen no ha sido contributoria, o bien en aquellos que presentan lesiones crónicas sintomáticas, como terapia de revascularización y en aquellas con obstrucción subclínica y test de isquemia positivos16,17. Solo tienen RMDPIV los pacientes más recientes de la serie, para completar estudio de extensión tras la TCC. Durante el seguimiento, si había lesiones iniciales, se ha realizado un control a los 6 meses y otro al año del primero, y si no hay ningún hallazgo, realizamos la prueba según evolución. En el seguimiento de los pacientes con AC, se recomienda la realización de un ecocardiograma y un ECG cada 2-4 meses; así como un test de detección de isquemia mediante prueba de esfuerzo o RMDPIV cada 6-12 meses o si existe clínica indicativa de isquemia18,19.
La duración de la fiebre, que posiblemente refleje el inicio del daño inflamatorio vascular, se ha asociado a mayor riesgo de lesiones coronarias significativas. Se han descrito mayores complicaciones coronarias, cuando la fiebre sobrepasa los 7 días. Harada et al.20 establecieron unos criterios para determinar el riesgo de lesión coronaria en pacientes con EK, para así poder detectar a aquellos con mayor riesgo de afectación coronaria y que se beneficiarían de tratamiento con IGIV; dichos criterios se basan en la presencia de leucocitosis>12.000/mm3, plaquetas menor de 350.000/mm3, PCR>30mg/l, hematocrito menor del 35%, albumina<3,5g/dl, edad menor de 12 meses y sexo masculino.
Una vez pasada la fase aguda, el objetivo es reducir el riesgo de trombosis coronaria. Los cambios tardíos en las lesiones coronarias incluyen curación y fibrosis de las arterias afectadas, lo que puede provocar formación de estenosis particularmente en el segmento postaneurismático, asociando mayor riesgo de trombosis, infarto agudo de miocardio y muerte súbita. Se ha observado hiperplasia intimal progresiva años después del episodio inicial de EK. En pacientes con lesiones coronarias persistentes leves (ectasias o aneurismas de pequeño calibre) se mantendrá al menos antiagregación. Durante el seguimiento de los pacientes con AC gigantes, se recomienda mantener de forma indefinida antiagregación simple con AAS, así como anticoagulación con acenocumarol para mantener INR entre 2 y 2,5 de forma indefinida21. Es importante recordar que las lesiones coronarias de la EK son distintas de la ateroesclerosis del adulto22. El tratamiento de las complicaciones se ha realizado tradicionalmente mediante cirugía de revascularización miocárdica, debido al elevado riesgo de la terapia percutánea en lesiones agudas en estos pacientes. Ninguno de nuestros pacientes ha requerido terapia de revascularización hasta la fecha.
Los pacientes con EK presentan anormalidades subclínicas de la función endotelial y del flujo de reserva fraccional23, por lo que parecen tener un perfil de mayor riesgo cardiovascular si se compara con niños sanos, asociando cifras más elevadas de presión arterial y mayor adiposidad que se mantiene en la edad adulta, por lo que el seguimiento y la implementación de medidas de prevención secundaria de cardiopatía isquémica es esencial en estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.