La anemia hemolítica se caracteriza por la reducción en la vida media de los hematíes. La destrucción prematura de los eritrocitos puede producirse por alteraciones corpusculares (anomalías de membrana, enzimáticas o hemoglobinopatías) y extracorpusculares (mecanismos inmunitarios/no inmunitarios)1.
Presentamos el caso de un lactante de 3 meses con letargia, hiporexia, retraso ponderoestatural e involución psicomotriz (hipotonía, irritabilidad y pérdida de sonrisa social) de un mes de evolución. Como antecedentes personales destacaban un crecimiento intrauterino retardado disarmónico, una serología materna positiva para lúes durante la gestación y anemia perniciosa mal controlada. No había consanguinidad. La alimentación era con lactancia materna exclusiva.
En la exploración física presentaba un estado general regular, hipoperfusión periférica, palidez e ictericia mucocutáneas, un soplo sistólico eyectivo, taquicardia (que mejoró tras la expansión de volumen), papilitis lingual, aftas palatinas, muguet, queilitis angular y hepatoesplenomegalia de 2 cm. En la exploración neurológica destacaban hiporreactividad e hipotonía axial.
En la analítica inicial se observó anemia (hematocrito 14,6%), normocítica, normocrómica e hiporregenerativa (reticulocitos absolutos 26.900/μl, índice reticulocitario corregido 0,9%), trombocitopenia (76.000/μl) y leucopenia (3.600/μl) con neutropenia grave (200/μl). La extensión de sangre periférica mostró esquistocitos y macroovalocitos. En la bioquímica sanguínea destacaban hiperbilirrubinemia (6,9 mg/dl) de predominio indirecto y elevación de LDH (2.087 U/l). Se amplió el estudio etiológico de anemia hemolítica, previamente a conocer el antecedente materno, siendo negativos el test de Coombs, las crioaglutininas, el test de Donath-Landsteiner, la cupremia, la ceruloplasmina, la hemoglobinuria, las hormonas tiroideas y la determinación de glucosa-6-fosfatodeshidrogenasa y piruvato quinasa. Se descartó sífilis congénita y se realizaron serologías para virus, obteniendo una PCR de citomegalovirus positiva (160 copias/ml), con PCR negativa en sangre de talón (probable primoinfección posnatal). Los niveles de vitamina B12 fueron de 8 ng/l (normal: 200-980) y el folato de 21,3 μg/l (2,5-15). Los anticuerpos anti-factor intrínseco, la anti-peroxidasa y la anti-tiroglobulina fueron positivos.
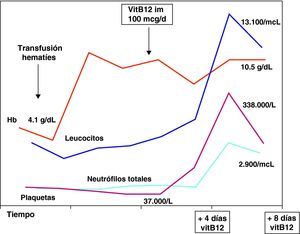
Tras el diagnóstico de déficit de cobalamina el cuarto día de ingreso, se instauró tratamiento parenteral con vitamina B12 (100 μg/día im los 10 primeros días, con una dosis acumulada de 1 mg; 100 μg/48 h durante 2 semanas y luego de forma mensual). Recibió ácido fólico como tratamiento coadyuvante. La recuperación hematológica se observó a partir del cuarto día de tratamiento, según se aprecia en la figura 1.
Posteriormente, se mantuvo tratamiento mensual, con controles hematológicos normales. Tras la negativización de los autoanticuerpos maternos a los 6 meses de vida (tabla 1), se suspendió el tratamiento. No se observaron otras manifestaciones autoinmunitarias. La evolución neurológica sigue un curso favorable.
Comparación entre los hallazgos analíticos de madre e hijo y evolución tras el tratamiento con vitamina B12 parenteral
| Madre | Niño (3 meses) | Niño (6 meses) | |
| Hemoglobina (g/dl) | 13,5 | 5,0 | 11,4 |
| VCM (fL) | 102,5 | 88,5 | 80,5 |
| Recuento de leucocitos (n/μl) | 5.000 | 3.700 | 9.000 |
| Neutrófilos totales (n/μl) | 2.600 | 200 | 1.400 |
| Plaquetas (n/μl) | 178.000 | 78.000 | 307.000 |
| Niveles de vitamina B12 (200-980 ng/l) | 62 | 8 | 967 |
| Niveles de ácido fólico (2,5-15 μg/l) | 6,4 | 21,3 | > 24,0 |
| Ac. anticélulas parietales gástricas (U/l) | Negativos | Negativos | Negativos |
| Ac. antifactor intrínseco (U/l) | 300 | 15,5 | Negativos |
| Ac. anti-tiroglobulina (U/l) | > 3.000 | 702 | Negativos |
| Ac. anti-peroxidasa (U/l) | 910 | 64,4 | Negativos |
| TSH (mU/l)/T4 libre (ng/dl) | Nomales | 4,58/1,4 | 5,01/0,6 |
| Esofagogastroscopia | Gastritis atrófica | No realizada | No realizada |
VCM: volumen corpuscular medio.
El déficit de cobalamina es una causa infrecuente de anemia hemolítica y pancitopenia1. En la práctica, se describe principalmente en lactantes con lactancia materna exclusiva cuyas madres son vegetarianas estrictas1,2 y más infrecuentemente en hijos de madres con anemia perniciosa3-7. En la literatura se describe una disminución de la transferencia placentaria de vitamina B12 y una carencia nutricional posnatal. El mecanismo de destrucción eritrocitaria tiene un origen intramedular (eritropoyesis ineficaz por defecto madurativo) y extramedular (intravascular) de etiología incierta3.
La sintomatología se inicia habitualmente a los 3-6 meses de vida. Las alteraciones más frecuentes son hematológicas (anemia macro/normocítica, pancitopenia) y neurológicas (hipotonía, regresión psicomotriz, temblores, nistagmo, ataxia, convulsiones o coma)3,5,7,8. Con menor frecuencia, se observan alteraciones estomatológicas (glositis, queilitis, aftas, muguet o mucositis), digestivas (vómitos, hepatoesplenomegalia) e hiperpigmentación (rara en niños)6,7.
El diagnóstico se basa en el antecedente materno junto al hallazgo de anemia megaloblástica, hemolítica y/o pancitopenia en el lactante, con disminución de los niveles plasmáticos de cobalamina y elevación de ácido metilmalónico y homocisteína. Se observa anemia normo/macrocítica hiporregenerativa. La extensión de sangre periférica puede presentar neutrófilos hipersegmentados y macroovalocitos. El estudio de médula ósea no es imprescindible. El diagnóstico diferencial debe realizarse con déficits congénitos de transcobalamina-II, el síndrome de Immerslund-Gräsbeck (déficit del receptor ileal de transcobalamina-factor intrínseco) y el déficit congénito de factor intrínseco, que son de herencia autosómica recesiva8-10.
El tratamiento no está estandarizado en lactantes, basándose en recomendaciones para adultos3-5,10. Inicialmente se administra una pauta más intensiva que asegure la repleción de los depósitos de vitamina B12 y posteriormente una dosis de mantenimiento hasta la negativización de los anticuerpos maternos.
Las secuelas son principalmente neurológicas, siendo factores predictivos de mala evolución la severidad de la clínica neurológica al comienzo y los valores maternos de vitamina B123,10. Una mejoría neurológica inicial no implica buenos resultados a largo plazo3. Las secuelas persistentes podrían prevenirse con un buen control materno durante la gestación y la lactancia materna, y un seguimiento estrecho de los recién nacidos hijos de madre con anemia perniciosa para realizar un diagnóstico y tratamiento precoz del déficit de cobalamina.