Existen pocos datos referentes a la práctica de sedación paliativa en población pediátrica. El objetivo de este estudio es crear una definición estandarizada de sedación paliativa para población pediátrica y aplicarlo en una Unidad de Cuidados Paliativos Pediátricos.
Material y métodosSe realizó una revisión no sistemática de la literatura en búsqueda de la evidencia y recomendaciones existentes para la práctica de sedación en población pediátrica, tras lo cual se creó una definición de sedación paliativa basada en tres ítems: 1. Indicación 2. Consentimiento 3. Aplicación. Posteriormente se realizó una revisión retrospectiva de registros clínicos para analizar la práctica de sedación paliativa atendidos por la Unidad de Atención Integral Paliativa Pediátrica de Madrid (UAIPPM) en un periodo de cinco años (enero 2013-diciembre 2017).
ResultadosDe 163 pacientes analizados, la sedación se aplicó en 20, 17 pacientes de la propia Unidad (70% varones; mediana de edad: 11,9 años); 12 pacientes padecían cáncer, siete enfermedades neurológicas y uno un síndrome polimalformativo; 52,9% pacientes sufrían más de un síntoma en el momento de indicar la sedación paliativa, siendo el dolor (64,7%) y la disnea (58,8%) los más frecuentes. En cuanto a la definición, sólo tres pacientes consiguieron una cumplimentación global de la misma, siendo el registro del consentimiento informado el área con mayor potencial de mejora.
ConclusionesLa evaluación basada en una definición estandarizada permitió definir la práctica de sedación paliativa en nuestra Unidad y encontrar áreas potenciales de mejora.
Data surrounding palliative sedation in pediatric patients is scarce. Our objective is to assess the utility of creating a quality standard for pediatric palliative sedation.
Material and methodsA non-systematic review of the literature was used to find recommendations for pediatric palliative sedation, after which a definition was established based on three items: (1) indication, (2) consent, and (3) application. Afterwards, a retrospective analysis of palliative sedations applied by our unit over 5 years was performed.
ResultsOut of 163 patients, palliative sedation was applied in 20, in 17 of them by our unit (14/20 males; median: 11.9 years). Twelve patients had oncological diseases, seven had neurological conditions, and one had a polymalformative syndrome. Nine patients had more than one symptom at the time of PS initiation with pain (11/17) and dyspnoea (10/17) being the most frequent. As for the definition, only three patients achieved a global completion, with the registration of the consent, specification of refractoriness and the establishment of an adequate initial sedative dose being the areas with more possible improvement.
ConclusionsThe application of the definition allowed us to analyze and find areas of improvement for our clinical practice of palliative sedation in pediatric patients.
La sedación paliativa se define como el uso de uno o más fármacos para reducir el nivel de consciencia de un paciente para aliviar el sufrimiento debido a uno o más síntomas refractarios1,2. Si bien las definiciones han variado3, la mayoría de las guías coinciden en señalar puntos compartidos. Sin embargo, los datos existentes, especialmente en población pediátrica son escasos4–6, donde apenas se han publicado algunas series de casos5,7–10. Incluso cuando la población pediátrica con necesidades paliativas se considera diferente a la de los adultos11–13, no existen guías específicas, dificultando la práctica de sedación paliativa para los equipos de Cuidados Paliativos Pediátricos contando solo con escasos estudios que analicen esta práctica.
En este trabajo, analizamos la práctica de sedación paliativa en la Unidad de Atención Integral Paliativa Pediátrica de la Comunidad de Madrid (UAIPPM) en un periodo de cinco años a través de la creación y aplicación de una definición estandarizada.
Materiales y métodosEste estudio se llevó a cabo en dos fases:
Fase 1: establecimiento de la definiciónRevisión no sistemática de la literatura sobre sedación paliativa. Su objetivo era buscar puntos en común en la literatura existente que se pudieran transformar en ítems de evaluación de la definición.
Como resultado obtuvimos un total de 11 guías nacionales e internacionales, así como un capítulo de libro en un tratado de referencia. Como la literatura específica pediátrica se correspondía en su mayoría con series de casos4,5,7–10,14 y ante la inexistencia de guías específicas más allá de algunas referencias en tratados sobre cuidados paliativos pediátricos6,15,16, elegimos guías generales de cuidados paliativos de adulto como marco de la definición, adaptando aquellos puntos con especificidades pediátricas (dosis de fármacos, consentimiento informado…). Específicamente, tomamos como referencia las guías de la Sociedad Europea de Cuidados Paliativos (EAPC)2 y de la Sociedad Europea de Oncología Médica (ESMO)1 como referencia internacional y la guía de la Sociedad Española de Cuidados Paliativos (SECPAL) y del Consejo General de Colegios Oficiales de Médicos (CGCOM)17 y del Ministerio de Sanidad18 a nivel nacional.
En estos documentos encontramos cinco puntos en común: 1) Presencia de un sufrimiento intratable causado por un síntoma. 2) Presencia de una enfermedad «terminal». 3) Necesidad de discusión con el paciente y proceso de consentimiento informado. 4) Necesidad de consultar con un equipo experto en manejo de síntomas. 5) Aplicación de fármaco/s sedante/s para disminuir el nivel de consciencia y evitar el sufrimiento del paciente monitorizando su respuesta. Teniendo en cuenta estos puntos creamos la definición. Para el análisis posterior, excluimos los ítems 2 y 4 dado que todos los pacientes atendidos por la UAIPPM presentan enfermedades limitantes o amenazantes para la vida y que esta Unidad se considera el referente regional de cuidados paliativos pediátricos, incluyendo el manejo de síntomas difíciles.
Por lo tanto, se incluyeron tres ítems principalmente: 1. Indicación 2. Consentimiento 3. Aplicación (tabla 1). Para el ítem 1a se emplearon la Guías del instituto NICE de Reino Unido de atención a niños al final de la vida19. Se han elegido estas guías por su metodología, si bien otros textos pueden aportar mayor profundidad en el manejo de síntomas20,21. Para el ítem 2a se adaptó lo señalado por la Ley de Autonomía del paciente22 que considera a toda persona mayor de 16 años sin impedimento cognitiva o judicial, emancipada legalmente o considerada como tal por su médico responsable competente para tomar decisiones. En la tabla 2 se incluyen los fármacos y dosis de los ítems 3a y 3b6,23.
Ítems de la definición de sedación paliativa
| 1. Indicación | |
| a) Tratamiento sintomático previo | El síntoma/s para el que se aplica la sedación contaba con tratamiento sintomático adecuado. |
| b) Especificación de refractariedad | Uno o más síntomas se identifican como «refractario»/«sin posibilidad de tratamiento» o términos similares indicando que la sedación paliativa es el último recurso posible. |
| 2. Consentimiento | |
| a) Evaluación de la competencia del paciente | Se consideraba al paciente competente si era mayor de 16 años, emancipado legalmente o considerado como tal por su médico sino existía alteración cognitiva descrita. Si no, su padre/tutor se consideraron responsables para participar en la toma de decisiones ítem 2b. |
| b) Participación en el proceso | Discusión y aceptación con el responsable (punto 2a) registrado en la historia. |
| 3. Aplicación | |
| a) Fármaco adecuado | En tabla 2 |
| b) Dosis inicial adecuada | En tabla 2 |
| c) Monitorización | Registro de medidas de monitorización (sintomático o de sedación) con escalas o de manera subjetiva. |
Fármacos incluidos en el estándar y sus dosis
| Fármaco | Dosis inicial |
|---|---|
| Midazolam | 0,05 mg/kg que pueden repetirse hasta un máximo de 2 mg total.Después dejar 1/4-1/3 de la dosis acumulada por hora. |
| Lorazepam | 0,05 mg/kg cada 2-4 horas. |
| Levomepromazina | 0,5-1 mg/kg/día dividida en 4 dosis hasta un máximo de 75 mg/día. |
| Clorpromazina | 1-2 mg/kg/día dividido en 4 dosis hasta un máximo de 40 mg/día |
| Haloperidol | 0,1 mg/kg/h |
| Propofol | 1 mg/kg/h |
| Tiopental | Dosis de 2-5 mg/kg seguidos de una infusión a 1-5 mg/kg/h |
| Pentobarbital | Dosis de 2-3 mg/kg en 30 min (ritmo máximo de 0,8 mg/h) seguido de una infusión a 1-2 mg/kg/h |
| Dexmedetomidina | 1 mcg/kg administrado en 10 minutos seguidos de una infusión 0,1-1 mcg/kg/h |
| Fenobarbital | IV: Bolo 1-6 mg/kg (máximo 20 mg/kg) en 20 min seguido de una infusión a 1 mg/kg/hSC: 2,5-5 mg/kg en 24 horas repartida en una o dos dosis (máximo 300 mg/dosis) |
IV: Intravenosa; SC: Subcutánea
Para que uno de los tres ítems se considerase como cumplido, debía contar con todos su subitems (a, b y c) como cumplidos.
Fase 2: descripción de la población y evaluación de la definiciónEstudio retrospectivo de registros clínicos de los pacientes fallecidos atendidos por la UAIPPM en un periodo de cinco años (enero 2013-diciembre 2017) para localizar a todos los pacientes que recibieron sedación paliativa y analizar aquellas realizadas por la UAIPPM.
Los datos de los pacientes fallecidos se obtuvieron de los registros internos de la UAIPPM. Se excluyeron a aquellos pacientes sin informe de exitus (informe en el que se recogen los datos de toda la atención clínica prestada por la UAIPPM al paciente). Para seleccionar a los pacientes que recibieron sedación paliativa se establecieron los siguientes criterios:
- •
Se menciona el término «sedación paliativa».
- •
La disminución del nivel consciencia se usa en el manejo de un síntoma.
- •
Se emplea un fármaco sedante para controlar un síntoma referido como «refractario» o de «control difícil».
- •
Se emplea un fármaco sedante en perfusión a dosis adecuadas.
La sedación paliativa se excluye cuando un fármaco sedante se empleaba de manera primaria para manejar un síntoma (benzodiacepinas para ansiedad, crisis epilépticas o disnea) y el síntoma no se consideraba «refractario» ni se empleaba el término sedación paliativa.
Para analizar la necesidad de sedación paliativa en nuestra población también se clasificaron a aquellos pacientes en los que no se empleó en los siguientes grupos:
- a)
Pacientes sin necesidad de sedación: la historia clínica establece una situación de control sintomático adecuado.
- b)
Pacientes en los que no se puede descartar la posible necesidad de una sedación paliativa: no se establece claramente la situación de control sintomático.
Los datos siguientes se recogieron para todos los pacientes: género, edad al fallecimiento, clasificación por enfermedad oncológica vs. no oncológica, diagnóstico principal, tiempo de seguimiento por la UAIPPM y lugar de fallecimiento, analizándose comparativamente estas características entre la población que recibió sedación y aquella que no la recibió.
En los pacientes en los que la sedación se administró por la UAIPPM, además se recogieron los ítems de la definición y las siguientes variables: síntoma/s que indicaron la sedación, sedación continua o intermitente y superficial o profunda. Si se aplicó monitorización se registró si se basaba en la sedación y/o en los síntomas y si se emplearon escalas. También se registraron los fármacos empleados, dosis máxima, presencia de efectos adversos, razón para finalizar la sedación y si el paciente alcanzó una situación de confort.
Análisis estadísticoSe utilizó STATA ® v16.1. Para la comparación de variables entre pacientes con y sin sedación se emplearon pruebas paramétricas (X2 y prueba t de Student para la comparación de medias) o no paramétricas (test de rangos de Wilcoxon y test de Mann-Whitney, respectivamente). Para la descripción se utilizó la mediana y el rango intercuartílico. El nivel de significación se estableció en p < 0,05.
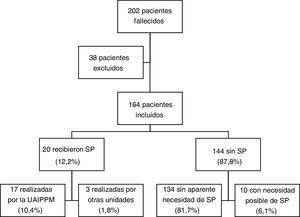
ResultadosCaracterísticas de la población; comparación con el grupo controlEn el periodo de estudio fallecieron 202 pacientes en seguimiento por la UAIPPM (fig. 1), excluyéndose 38 por ausencia de informe de exitus; 20 pacientes (12,2%) recibieron sedación paliativa, de las cuales 17 fueron realizados a cargo de la UAIPPM y tres por otras unidades (una por un servicio de hematología, una por un servicio de oncología y otra por un servicio de pediatría). De entre los 144 pacientes que no recibieron sedación paliativa, el 93,1% presentaba aparente buen control sintomático, no pudiendo descartarse la necesidad de sedación en un 6,9%.
Las características comparadas de los pacientes con y sin sedación se muestran en la tabla 3. De los 20 pacientes que la recibieron el 70% eran varones, con una mediana de edad de 11,9 años (IQ: 8,0-16,8); 12 pacientes (60%) padecían cáncer (ocho tumores sólidos extracraneales, dos tumores del sistema nervioso central y dos neoplasias hematológicas) y siete (35%) enfermedades neurológicas (seis pacientes con encefalopatías estáticas y un paciente con atrofia muscular espinal) y un paciente padecía un síndrome polimalformativo con aplasia medular como principal problema. La mediana de tiempo de seguimiento fue de 2,7 meses (IQ:0,4-14,5). Los pacientes que recibieron sedación presentaron una edad significativamente mayor y fallecieron más frecuentemente en casa que aquellos que no la recibieron. Los pacientes con diagnóstico de cáncer no recibieron sedación paliativa con mayor frecuencia frente a otros diagnósticos.
Características de los pacientes que reciben sedación paliativa frente a los que no la recibieron. Los porcentajes se refieren a los subgrupos en función de haber recibido o no sedación paliativa. En Género, Enfermedad y Lugar de fallecimiento se utilizó la X2 de Pearson. En Edad al fallecimiento y Lugar de fallecimiento se empleó la prueba de suma de rangos de Wilcoxon por ser la n de los pacientes con SP < 30
| Pacientes con sedación paliativa (n = 20) | Pacientes sin sedación paliativa (n = 144) | p | |
|---|---|---|---|
| Género | 0,58 | ||
| Varón | 14 (70%) | 91(63,2%) | |
| Mujer | 6 | 52 | |
| Edad al fallecimiento (años) | 11,9 (IQ:8,0-16,7) | 8,5 (IQ: 2,5-13,4) | 0,02 |
| Enfermedad | 0,84 | ||
| Oncológica | 12 (60%) | 83 (57,6%) | |
| No-oncológica | 8 | 61 | |
| Seguimiento UAIPPM (meses) | 2,7 (IQ:0,4-14,5) | 3,2 (IQ:1,1-13,6) | 0,4 |
| Lugar de fallecimiento | 0,029 | ||
| Hospital | 12 (60%) | 50 (34,7%) | |
| Domicilio | 8 | 94 |
SP: Sedación paliativa; UAIPPM: Unidad de Atención Integral Paliativa Pediátrica de Madrid.
De entre los 17 pacientes sedados a cargo de la UAIPPM, 9 presentaron más de un síntoma sin control en el momento de iniciar la sedación (tabla 4). Los síntomas más frecuentes fueron dolor (64,7%) y disnea (58,8%). Cuatro pacientes presentaban agitación, siempre acompañando a algún otro síntoma (tres dolor, uno disnea). Un paciente presentó convulsiones y disnea. La sedación se aplicó en un 52,9% de los pacientes en el hospital y en un 47,1% en domicilio.
Características de la aplicación de las sedaciones paliativas
| Género | Edad al fallecimiento | Enfermedad | Tiempo seg. | Lugar de aplicación | Síntomas | Tipo | Nivel | Monitorización | Fco. | Dosis máxima(mg/kg/h) | Duración(días) | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | M | 9 a 5 m | Hemangioendoteliomametastásico | 4 m | Hosp. | Disnea | Síntomat. | MDZ | < 1 | |||
| 2 | V | 5 m | AME I | 4 d | Dom. | Disnea | Síntomat. | MDZ | 1 | |||
| 3 | V | 19 a | Epilepsia | 3 a 9 m | Dom. | Dolor | Cont. | Síntomat. | MDZ | 0,2 | 3 | |
| Disnea | HLP (+2) | 0,8 | ||||||||||
| 4 | V | 15 a 1 m | Parálisis cerebral infantil | 5 d | Hosp. | Disnea, | Cont. | Síntomat. | MDZ | 0,3 | 2 | |
| Convulsiones | ||||||||||||
| 5 | V | 19 a 3 m | Glioma de bajo grado | 9 d | Hosp. | Dolor | Cont. | Síntomat. | MDZ | 0,2 | 1 | |
| Agitación | ||||||||||||
| 6 | V | 18 a 2 m | Parálisis cerebral infantil | 1 a 8 m | Hosp. | Disnea | Cont. | Superf. | Síntomat. | MDZ | 0,3 | 4 |
| Agitación | Sedación | |||||||||||
| 7 | V | 7 a 6 m | Meduloblastoma | 9 d | Hosp. | Dolor | Cont. | Prof. | Síntomat. | MDZ | 0,17 | 1 |
| Disnea | Sedación | |||||||||||
| 8 | V | 19 a 10 m | Ataxia espinocerebelosatipo VII | 4 m | Hosp. | Disnea | Cont. | Síntomat. | MDZ | 0,3 | 5 | |
| Sedación | ||||||||||||
| 9 | V | 17 a 1 m | Osteosarcoma | 1 d | Dom. | Dolor | Cont. | Síntomat. | 1 | |||
| Disnea | Sedación | |||||||||||
| 10 | V | 10 a 10 m | Neuroblastoma | 6 m | Dom. | Dolor | Cont. | Síntomat. | MDZ | 0,01 | 1 | |
| Agitación | HLP | 0,001 | ||||||||||
| 11 | M | 4 a 6 m | Retinoblastoma | 1 m 10 d | Dom. | Dolor | Int. | Superf. | Síntomat. | MDZ | 21 | |
| 12 | V | 9 a 7 m | Osteosarcoma | 1 m 18 d | Dom. | Dolor | Cont. | Prof. | Síntomat. | MDZ | 0,05 | < 1 |
| Sedación | HLP | 0,05 | ||||||||||
| 13 | V | 4 a 11 m | Rabdomyosarcoma | 1 m 18 d | Hosp. | Dolor | Cont. | Prof | Síntomat. | MDZ | 0,2 | 1 |
| Disnea | ||||||||||||
| 14 | M | 16 a 3 m | LLA | 17 d | Dom. | Dolor | Cont. | Prof | Síntomat. | MDZ | 0,25 | 3 |
| 15 | M | 11 a 9 m | Parálisis cerebral infantil | 2 a | Dom. | Dolor | Int. | Prof | Síntomat. | PPF | 1 | |
| 16 | V | 5 a 7 m | Daño cerebral adquirido | 8 m | Hosp. | Dolor | Cont. | Prof | Síntomat. | MDZ | 0,35 | 42 |
| Agitación | PPF (+40) | 7,3 | ||||||||||
| 17 | M | 14 a 11 m | Osteosarcoma | 1 d | Hosp. | Disnea | Cont. | Prof | Síntomat. | MDZ | 0,1 | 1 |
a: años; AME: atrofia muscular espinal; Cont.: continua; d: días; Fco.: fármacos; HLP: haloperidol; Hosp.: hospital; Int.: intermitente; M: mujer; m: meses; MDZ: midazolam; PPF: propofol; Prof.: profunda; Sintomat.: sintomático; Superf.: superficial; Tiempo seg.: tiempo seguimiento; V: varón.
En la variable «Fco.», el número entre paréntesis indica el número de días tras el inicio de la sedación en la que se añade el segundo fármaco.
Se aplicó sedación continua en 76,4% pacientes e intermitente en 11,8% (datos ausentes en dos casos). El nivel de sedación alcanzando se registró en 10 pacientes: profunda en ocho y superficial en dos. El fármaco más empleado fue el midazolam (88,2%) ya fuese solo (64,7%) o en combinación con haloperidol (17,6%) o propofol (5,9%). En un paciente se empleó solo propofol. La dosis máxima para cada fármaco fue de 0,35 mg/kg/h de midazolam, 0,8 mg/kg/h de haloperidol y 7,3 mg/kg/h de propofol.
En 16 pacientes la razón para finalizar la sedación fue el fallecimiento; el paciente restante, desarrolló un shock séptico que desembocó en un estado de coma en el que la sedación no era necesaria. Solo un paciente desarrolló efectos secundarios (broncorrea leve que no requirió tratamiento). La mediana de duración de la sedación fue 1,5 días (IQ: 1,5-3,5).
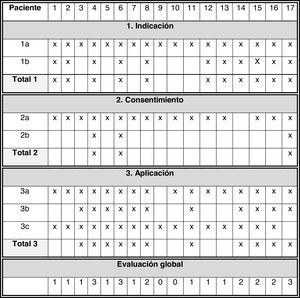
Evaluación de la definiciónLos principales resultados de este apartado se muestran en la figura 2:
- 1.
Indicación: todos los pacientes presentaban tratamientos previos adecuados (1a = 100%). En 11 pacientes se identificó al síntoma como refractario. Cumplimiento del ítem 1: 64,7%.
- 2.
Consentimiento informado: En 16 pacientes no se consideraron competentes para consentir por edad (< 16 años) o por presentar deterioro cognitivo, recayendo el consentimiento en sus tutores. El paciente 17 (14 años) fue considerado como competente por su médico y participó en el proceso. El paciente 14 tenía más de 16 años y no presentaba datos de deterioro cognitivo, pero no se registró participación en el proceso de consentimiento. Por ello, el ítem 2a se cumplió en 94,1% pacientes. El registro del proceso de consentimiento informado (ítem 2b) se registró en 17,6% pacientes. Cumplimiento del ítem 2: 17,6%.
- 3.
Aplicación de sedación: En 16 pacientes el fármaco elegido fue apropiado, sin registrarse en el restante (ítem 3a = 94,1%). En 11 pacientes la dosis inicial fue adecuada, en dos inferior a lo establecido y en cuatro no se registró (ítem 3b = 11/17). En todos los pacientes se realizó monitorización del control sintomático (17/17) o de la sedación (5/17; ítem 3c = 17/17), pero en ningún caso se usaron escalas, basándose siempre en valoraciones subjetivas. Cumplimiento del ítem 3: 64,7%.
En la valoración global del estándar en 17,6% pacientes se completaron los tres ítems, en 23,5% dos, en 47,1% uno y 11,8% ninguno de los ítems.
DiscusiónDesde nuestro conocimiento, este es uno de los primeros estudios que describe el proceso de análisis de sedación paliativa en nuestro medio. Como principales hallazgos, la sedación se aplicó en un 12% de los pacientes que padecían fundamentalmente cáncer y enfermedades neurológicas graves. Los síntomas más frecuentes en su indicación fueron dolor, disnea y agitación. Su aplicación fue mayoritariamente continua y aplicada hasta el periodo de final de vida. El fármaco empleado más frecuentemente fue el midazolam. El establecimiento de la definición, aunque basada en la escasa literatura existente, permitió encontrar áreas de mejora para la unidad, fundamentalmente el proceso de consentimiento. Las principales limitaciones de este estudio se deben a su naturaleza retrospectiva basada en registros clínicos y en la ausencia de un consenso sobre la definición y aplicación de sedación paliativa pediátrica.
Sobre la frecuencia de aplicación de sedación paliativa en pacientes fallecidos con atención paliativa, los datos en la literatura varían de un grupo a otro, desde datos similares a los nuestros17 a cifras superiores al 50%9,24, pero pocos de estos estudios se centran en población pediátrica. En nuestro estudio, hay una necesidad aparentemente baja de sedación, aunque este dato puede estar sesgado dado que el clínico que registra el informe de exitus puede sobrevalorar el grado de confort alcanzado por el paciente. Atendiendo a la alta proporción de pacientes con enfermedades neurológicas en nuestro estudio y en cuidados paliativos pediátricos25, la necesidad real de aplicar sedación paliativa en este grupo puede ser particularmente difícil de estimar al existir problemas inherentes de comunicación en los pacientes. Además, en nuestro estudio, los pacientes con cáncer no recibieron sedación con mayor frecuencia que aquellos que padecían otras enfermedades. Esto contrasta con el hecho de que la mayoría de los artículos sobre sedación paliativa en población pediátrica se corresponde con pacientes con cáncer5,7–9. Si bien los estándares internacionales señalan esta heterogeneidad13, existe la necesidad de contar con estudios regionales que determinan la epidemiología regional de las distintas enfermedades que atiende un equipo de cuidados paliativos pediátricos. Además, el acceso local a equipos expertos en manejo de síntomas puede determinar también la necesidad de sedación paliativa en el ámbito regional.
Aunque se presentaron diferencias significativas en edad y lugar de aplicación/fallecimiento a la hora de recibir o no sedación paliativa, estos resultados deben analizarse con cautela, al no haberse ajustado por posibles variables de confusión. Con respecto al lugar de fallecimiento, parece razonable que los pacientes con síntomas más difíciles de controlar sean hospitalizados para un control más riguroso, como han indicado estudios previos4. En cambio, resulta más difícil explicar la relación de la edad con la indicación de sedación paliativa. Al no ser este el objetivo primario del estudio, no se ha analizado. Nuestra postulación es que una mayor edad se correlaciona con una mayor capacidad para expresar sufrimiento, lo que podría explicar parcialmente esta asociación, pero son necesarios estudios más rigurosos.
Los síntomas identificados en este estudio son algunos de los registrados con más frecuencia en población pediátrica al final de la vida26,27. En este sentido, las sedaciones aplicadas se corresponden con las características de sedaciones en agonía (continuas y profundas)1,17. Estudios previos ya han descrito la aplicación de sedación paliativa para el control de más de un síntoma4, la alta coexistencia de agitación como segundo síntoma puede deberse a que ésta fuera provocada por el síntoma «primario» aunque no pudimos aclarar esto en nuestro estudio. El empleo de las guías NICE19 puede plantear limitaciones para evaluar el manejo de síntomas difíciles, sin embargo, más allá de recomendaciones de expertos no existe un consenso para el manejo de la mayoría de los síntomas considerados difíciles en cuidados paliativos pediátricos4. El midazolam fue el fármaco utilizado con más frecuencia, como recomiendan la literatura existente en población pediátrica y de adultos1,2,6.
Es necesario comentar el caso de dos pacientes en particular. El paciente 15 dejó de recibir sedación paliativa con propofol para dolor tras sufrir un shock séptico que secundariamente disminuyó el nivel de consciencia de la paciente, sin observarse un aumento del dolor tras finalizar la sedación. El paciente 16 sufría espasticidad refractaria en tratamiento con tizanidina, baclofeno intratecal y varios medicamentos adyuvantes para dolor en el que se inició una perfusión intravenosa de midazolam para la espasticidad que se tuvo que aumentar hasta dosis sedativas sin existir otra posibilidad de tratamiento. El paciente permaneció estable durante 40 días, donde un patrón mixto de espasticidad e irritabilidad neurológica reapareció sin respuesta a nuevos aumentos de midazolam, requiriendo adición de propofol como segundo fármaco sedante. Estos dos casos ilustran dos de los principios subyacentes a la sedación paliativa: se deben aplicar solo cuando sea necesario disminuir farmacológicamente el nivel de consciencia, sin buscar adelantar o retrasar el momento del fallecimiento del paciente1,2,28. Además es necesario señalar aquellos pacientes en los que un fármaco potencialmente sedante se emplea a dosis con fines sintomáticos y no sedantes, los cuales se han distinguido en este caso con los criterios de inclusión y el punto 3b de la definición.
La definición establecida puede ser controvertido, al no emplearse una metodología específica y al haber decidido que todos los subitems de cada ítem deberían estar correctamente realizados. Esta decisión se tomó con base en dos consideraciones. En primer lugar, el objetivo del estándar era buscar áreas de mejoras. Requerir el adecuado cumplimiento de cada subitem, nos permitió localizar las áreas con mayor margen de mejora más fácilmente, como fue el caso del proceso de consentimiento informado. En segundo lugar, la literatura existente en pacientes pediátricos es muy escasa, lo que dificulta el establecimiento de un estándar no solo de lo que es la «mejor» práctica clínica, sino también de la práctica clínica «habitual». Hasta alguna de las dosis recogidas en la tabla 2 se basan en recomendaciones de expertos de datos extrapolados de población adulta al no haber literatura pediátrica disponible6. En este sentido, creímos que un análisis basado en el mayor número de ítems posible serviría para describir nuestra práctica.
Las principales limitaciones de nuestro estudio son debidas a basarse en registros clínicos retrospectivos. Especialmente, en determinados elementos (como el proceso de consentimiento informado) se debe considerar que una inadecuada cumplimentación del estándar puede reflejar no una práctica clínica inadecuada sino simplemente un inadecuado registro clínico de esta práctica. Esto es especialmente importante en el punto del consentimiento informado, donde hemos sido conservadores cuando este proceso debería basarse en la toma de decisiones compartidas, especialmente en pacientes con enfermedades graves29,30. Para caracterizar la necesidad real y práctica de la sedación paliativa, sería necesario realizar un estudio prospectivo. Sin embargo, el registro de discusiones clínicas con los pacientes y sus familias no deja de ser un parte esencial de la práctica médica. Un estudio en población adulta con necesidades paliativas demostró un registro de discusión en el 70% de los pacientes31.
En conclusión, nuestro estudio refleja una baja necesidad de sedación paliativa en una población de cuidados paliativos pediátricos al final de la vida. La creación de este estándar permitió detectar que el proceso de consentimiento y/o su registro eran las principales áreas de posible mejora en nuestra unidad. Los cambios que esta detección han podido producir en nuestra práctica están pendientes de determinarse una vez pase otro periodo de cinco años. La validez externa de esta definición requiere de más evaluaciones futuras.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue presentado como Comunicación Oral en el III Congreso de la Sociedad Española de Cuidados Paliativos Pediátricos (Toledo, 21 de Marzo de 2019) y como póster en el 16th World Congress de la European Association for Palliativa Care (Berlín, 23 al 25 de Mayo de 2019).