El consenso internacional recomienda el cribado de las alteraciones hidrocarbonadas (AH) en fibrosis quística (FQ) mediante sobrecarga oral de glucosa (SOG) anual desde los 10 años de edad y/o iniciada la pubertad.
ObjetivosEvaluar la presencia de AH y su posible repercusión clínica (cambios nutricionales y de función pulmonar) en pacientes impúberes con FQ.
Pacientes y métodosEstudio retrospectivo en 19 pacientes impúberes con FQ (68% varones). Según la SOG, clasificamos (Consenso 2010): tolerancia normal glucosa (TNG) o AH (alteración tolerancia glucosa [ATG], alteración indeterminada glucosa (AIG), diabetes [DRFQ]). Analizamos: SOG (glucemia e insulinemia), estado nutricional (IMC), función pulmonar (espirometría forzada) y función pancreática exocrina. Estudio estadístico con programa SPSS, versión-15.0 mediante pruebas no paramétricas.
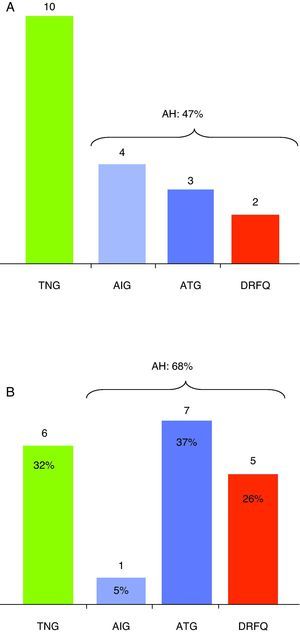
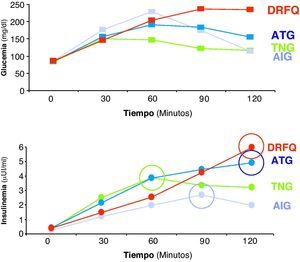
ResultadosEdad media primera SOG: 8,5 años (5,8-9,8); seguimiento medio: 2 años (2-3). Al inicio: el 53% TNG y el 47% AH; evolutivamente: 4/10 pacientes con TNG desarrollan AH (3ATG, 1DRFQ), 3/4 AIG desarrollan 2ATG y 1DRFQ. Edad media aparición AH: 8,6 años (6,4-11,1). El 69% tuvo deterioro nutricional y/o de la función pulmonar el año previo al diagnóstico de AH. Dos pacientes con AH eran suficientes pancreáticos exocrinos. La insulinemia basal y el área bajo la curva de la SOG fueron comparables entre TNG y AH. El índice insulinogénico fue inferior en AH (p=0,006). Todos los pacientes tuvieron un pico de secreción de insulina retrasado.
ConclusionesLa frecuente detección de AH en pacientes impúberes con FQ y su repercusión clínica plantean la necesidad de adelantar su cribado. La suficiencia pancreática exocrina no excluye el desarrollo de AH.
Annual screening for abnormal glucose tolerance (AGT) with oral glucose test should begin by age 10 years in cystic fibrosis (CF) patients (Consensus-2010).
AimsTo examine the frequency of AGT and its outcome in prepubertal CF patients and the changes in glycemic and nutritional status and lung function over the preceding year.
Patients and methodsRetrospective study of 19 prepubertal CF patients (68% males). All subjects underwent an oral glucose tolerance test (OGTT). Results were classified as: normal glucose tolerance (NGT) or AGT (impaired glucose tolerance [IGT], CF related diabetes [CFRD] or indeterminate glucose tolerance [INDET]). We analyzed: OGTT (glucose and insulin levels), nutritional status (BMI-SD) and lung function (forced spirometry). Statistical analysis was performed with SPSS program-version-15.0, non parametric tests.
ResultsMean age at first OGGT: 8.5 years (5.8-9.8). Mean follow-up: 2 years (2-3). Initially, 47% patients had AGT and 53% NGT. In follow-up: 4/10 NGT patients developed AGT (3 IGT, 1 CFRD). Among initial AGT patients, of 4 INDET: 2 developed IGT, 1 CFRD. Mean age of AGT onset: 8.6 years (6.4-11.1). In 69% AGT patients a declining BMI-DS and/or lung function was found in the preceding year. In OGTTs performed, fasting and 2h AUC insulin levels were comparable between NGT and AGT; however, insulinogenic index was lower in AGT patients (p=.006). Insulin secretion was delayed in all patients.
ConclusionsThe high frequency of AGT in prepubertal CF patients and their negative clinical impact supports the usefulness of an earlier glycemic screening.
La alteración hidrocarbonada (AH) es la complicación más frecuente en fibrosis quística (FQ), asociando gran morbimortalidad1,2. El fallo de la célula ß pancreática es progresivo, con aparición de AH precoces previas al desarrollo de diabetes relacionada con la FQ (DRFQ). La DRFQ suele aparecer a partir del final de la segunda década de la vida y su prevalencia aumenta con la edad3. En las fases iniciales de la AH los pacientes suelen estar asintomáticos o con síntomas insidiosos, como deterioro de la función pulmonar y/o empeoramiento del estado nutricional no explicables o retraso del crecimiento y/o pubertad en la edad pediátrica4,5. La mayoría de las AH precoces únicamente son detectables si se realiza su cribado. En la actualidad, los consensos nacionales6 e internacionales7 recomiendan iniciar el cribado a partir de los 10 años de edad, iniciada la pubertad, mediante sobrecarga oral de glucosa (SOG) anual. Es importante corroborar si las AH están ya presentes en el estadio prepuberal, como han apuntado estudios recientes8–9, y si dichas alteraciones tienen repercusión clínica.
El objetivo de nuestro estudio es analizar la presencia de AH precoz en pacientes impúberes con FQ y su posible relación con la situación clínico-metabólica.
Pacientes y métodosEstudio retrospectivo en 123 pacientes seguidos en nuestra unidad de FQ, analizando los 19 que eran impúberes al realizar la primera SOG (68% varones). Realizamos el cribado de AH anualmente desde los 6 años de edad, o antes si existe evolución clínica tórpida, siempre que el paciente colabore. Todas las SOG se realizaron estando el paciente en fase estable de su enfermedad, sin procesos intercurrentes ni corticoterapia sistémica las 6-8 semanas previas. En la SOG (1,75g/kg de glucosa, máximo 75g) determinamos glucemia (mg/dl, método glucosa oxidasa, analizador AEROSET-c8000 Abbott) e insulinemia (μU/ml, inmunoensayo, analizador Immulite-2000 Siemens) cada 30min durante 2h. Analizamos la fase precoz de secreción de insulina mediante el índice insulinogénico (II), definido como el cociente entre los incrementos de insulina y glucosa entre los tiempos 0 y 30min de la SOG. Según los resultados de la SOG, dividimos a los pacientes en: tolerancia normal a glucosa (TNG), alteración de tolerancia a glucosa (ATG), alteración indeterminada a glucosa (AIG) o DRFQ, según el Consenso Americano 2010 (tabla 1).
Clasificación según los resultados de la sobrecarga oral de glucosa
| Diagnóstico | Glucemia basal | Glucemia a los 120 min | Glucemias 30, 60 y 90 min |
| Tolerancia normal glucosa | < 100 | < 140 | – |
| Alteración glucemia ayunas | 100-125 | – | – |
| Alteración tolerancia glucosa | < 100 | 140-199 | – |
| Alteración indeterminada glucosa | < 100 | < 140 | ≥ 200 |
| Diabetes | ≥ 126 | ≥ 200 | – |
Los valores de glucemia se presentan en mg/dl.
Fuente: Moran et al.7
Analizamos evolutivamente: edad (años), sexo, estadio puberal (estadios Tanner), glucemia e insulinemia en la SOG, estado nutricional (índice masa corporal [IMC] en desviaciones estándar (kg/m2, DE), según Hernández et al., función pulmonar (espirometría forzada: capacidad vital forzada [CVF] y volumen espiratorio forzado en el primer segundo [VEF1], expresados en porcentaje del valor predictivo para el sexo y la talla, equipo MasterLab-Erich Jaeger) y presencia de insuficiencia pancreática exocrina (necesidad de enzimas pancreáticas). Consideramos empeoramiento del estado nutritivo y/o la función pulmonar la caída de valores de IMC, CVF y/o VEF1 en cualquier cuantía al comparar el momento del diagnóstico de AH con el año previo.
Análisis estadístico de datos con programa SPSS, versión-15.0. Asumiendo la no normalidad de la muestra, comparamos los datos utilizando pruebas no paramétricas; nivel de significación estadística p < 0,05. Datos expresados en porcentaje, mediana y rango intercuartílico.
Estudio aprobado por el comité ético del hospital. Los padres/tutores legales de los pacientes, tras ser informados, firmaron el consentimiento para participar.
ResultadosEdad media primera SOG 8,5 años (5,8-9,8): 10 pacientes (53%) tenían TNG y 9 (47%) alguna AH (4 AIG, 3 ATG y 2 DRFQ) (fig. 1A). Seguimiento medio 2 años (2-3). Durante la evolución: de los 10 pacientes con TNG inicial, 4 desarrollaron AH (3 ATG, 1 DRFQ); de los 4 pacientes con AIG, 2 desarrollan ATG y 1 DRFQ (fig. 1B). Evolutivamente desarrollaron diabetes 2/7 pacientes (29%) con AH en la primera SOG frente a 1/10 (10%) con normalidad inicial. Edad media de aparición de cualquier AH 8,6 años (6,4-11,1), AIG 7,2 años (5-10), ATG 10,4 años (7,3-12) y DRFQ 8,6 años (7,7-10,9). Ningún paciente tenía AGA.
Alteraciones hidrocarbonadas detectadas en la sobrecarga oral de glucosa. A. Sobrecarga oral de glucosa inicial. B. Sucesivas sobrecargas orales de glucosa. TNG: tolerancia normal a la glucosa; AIG: alteración indeterminada a la glucosa; ATG: alteración de la tolerancia a la glucosa; DRFQ: diabetes relacionada con la fibrosis quística.
Ningún paciente presentaba sintomatología cardinal de diabetes. Se detectó deterioro del estado nutricional y/o función pulmonar en 9/13 pacientes (69%) durante el año previo al diagnóstico de AH (tabla 2). Del total, 4/19 pacientes (21%) eran suficientes pancreáticos exocrinos y 2/13 entre aquellos con AH.
Diferencias entre pacientes con fibrosis quísticas con y sin alteracion hidrocarbonada en relación con el estado nutricional y la función pulmonar durante el año previo al diagnóstico
| IMC en DE diferencia | CVF, % diferencia | VEF1, % diferencia | |
| TNG | 0,07 (0 - 0,1) | –6 (–9 - +1) | –1 (–16 - +7) |
| AH | –0,1 (–0,3 - 0,1) | –3,5 (–8 - –1) | –5,5 (–12 - 0) |
| p | ns | ns | ns |
AH: alteración hidrocarbonada; CVF %: capacidad vital forzada expresada en porcentaje sobre el valor predictivo; IMC en DE: índice de masa corporal expresado en desviaciones estándar; ns: diferencia no significativa; p: nivel de significación estadística; TNG: tolerancia normal a la glucosa; VEF1, %: volumen espiratorio forzado en el primer segundo expresado en porcentaje sobre el valor predictivo.
El II fue significativamente menor en los pacientes con AH vs. TNG (2,8 vs. 4,5; p = 0,006). No hubo diferencias en los niveles de insulina en ayunas ni en el área bajo la curva en la SOG entre los pacientes con y sin AH. Se detectó retraso del pico de insulinemia en todos los pacientes con FQ: pico a los 60 min en TNG (34,2μU/ml [24,4-58,3]), a los 90min en AIG (25,1μU/m [18,7-35,7]) y a los 120min en ATG (49,4μU/m [31,9-60,1]) y DRFQ (51,9μU/m [46,3-80,9]) (fig. 2).
DiscusiónInicialmente, la existencia de AH en FQ se evidenció en adolescentes y adultos jóvenes; por ello, los consensos actuales recomiendan realizar su cribado anualmente a partir de los 10 años6,7. En realidad, la prevalencia de AH en FQ depende del tipo de cribado, la edad de estudio y de lo estricto de su búsqueda. En nuestra experiencia4, en 50 pacientes con FQ (edad media 20,7 años) el 62% tenían TNG, el 20% ATG y el 18% DRFQ. Elder et al.8, en pacientes entre 3-20 años, evidencian una prevalencia de AH del 38% (43% ATG, 29% AGA, 14% ATG/AGA y 14% DRFQ). Moran et al.3 en 527 pacientes encuentran DRFQ en el 2% de los niños y el 19% de adolescentes. Recientemente, Ode et al.9 estudian 94 niños con FQ entre 6-9 años y detectan AH en el 41%. Estos resultados son semejantes a los nuestros, con AH inicial en un 47% (edad más precoz 3,75 años) presentando ya DRFQ 2 pacientes (8,5 y 8,6 años) sin ninguna sintomatología.
El diagnóstico de AH en FQ se asocia a un empeoramiento clínico iniciado años antes4–6,10,11. En nuestra serie, la mayoría de los pacientes que desarrollan algún tipo de AH tienen deterioro del estado nutricional y/o función pulmonar durante el año previo al diagnóstico, aunque sin diferencias significativas en relación con aquellos con TNG. Analizando la glucemia a los 60min de la SOG y relacionándola con la función pulmonar, no encontramos la asociación negativa de glucemia entre 141-199mg/dl con los valores de VEF1 recientemente comunicada por Brodsky et al.12, ni con la FVC; tampoco una mayor tendencia en estos pacientes a desarrollar DRFQ. El pequeño tamaño de nuestra muestra limita el análisis.
Ode et al.9 apuntan que los niños entre 6-9 años con AH precoz son un grupo de riesgo para el desarrollo precoz de diabetes y recomiendan iniciar el cribado de AH a partir de los 6 años. Es importante señalar la edad media de diagnóstico de DRFQ en nuestra población, 8,6 años (7,7-10,9), teniendo el paciente más joven 6,8 años, que indica que la diabetes en FQ puede aparecer en la primera década de la vida. Por todo ello, pensamos que sería beneficioso adelantar la edad actualmente recomendada de inicio del cribado de AH en FQ, más teniendo en cuenta la mayor morbimortalidad en pacientes pediátricos con FQ y AH1,10,13,14. Por otro lado, en FQ se ha comprobado el efecto beneficioso de la insulinoterapia tanto para controlar la AH como para contrarrestar el estado catabólico secundario a la insulinopenia que precede al diagnóstico de cualquier AH3,12,15–17. Así, plantear un diagnóstico precoz implica también adelantar su tratamiento.
Es conocida la insuficiencia pancreática exocrina como factor de riesgo del desarrollo de AH en FQ. En nuestra serie, 2/13 pacientes con AH son suficientes pancreáticos exocrinos, por lo que la suficiencia pancreática exocrina no descarta el desarrollo de AH y estos pacientes no deben ser excluidos del cribado.
El II permite conocer la intensidad del pico precoz de liberación de insulina. Entre nuestros pacientes, este índice fue menor en aquellos con AH vs. con TNG, lo que demuestra la alteración de la función de la célula βpancreática18. En sujetos sanos el pico de liberación de insulina se obtiene a los 30min de la SOG19. Todos nuestros pacientes con FQ tuvieron retraso del pico de liberación de insulina, tanto si tenían AH como TNG, en concordancia con lo detectado por Ode et al.10. El retraso de esta liberación fue progresivamente más acusado a mayor AH. Todo ello pone de manifiesto un fallo precoz y progresivo de la célula β pancreática en FQ desde la edad prepuberal.
En conclusión, la frecuente detección de AH en pacientes impúberes con FQ y su repercusión clínica plantean la necesidad de modificar las recomendaciones del cribado y apoyan adelantar su inicio. La HbA1c ha sido descartada para el cribado de AH en FQ, no así la monitorización continua de glucosa, que podría ser un método precoz y útil de diagnóstico como ha sido sugerido, entre otros, por nuestro grupo20. El presente estudio encuentra un retraso en la secreción de insulina tras la SOG en todos nuestros pacientes con FQ, indicando una alteración sutil de la célula β pancreática incluso en aquellos con normalidad hidrocarbonada. La suficiencia pancreática exocrina no excluye el desarrollo de AH. Se necesitan estudios prospectivos con mayor número de pacientes para determinar la edad de inicio el cribado de AH en FQ.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.