Clostridium difficile es la principal causa de diarrea nosocomial en adultos, y su incidencia está aumentado en los últimos años. Es difícil determinar su impacto en niños debido a las altas tasas de colonización.
Material y métodosEstudio retrospectivo en menores de 15 años ingresados con diarrea a lo largo de un año. Se estudiaron las características epidemiológicas, clínicas, analíticas y la evolución de los niños con infección por Clostridium difficile (ICD) en comparación con otros aislamientos. Los factores predictores de ICD fueron determinados mediante análisis multivariante.
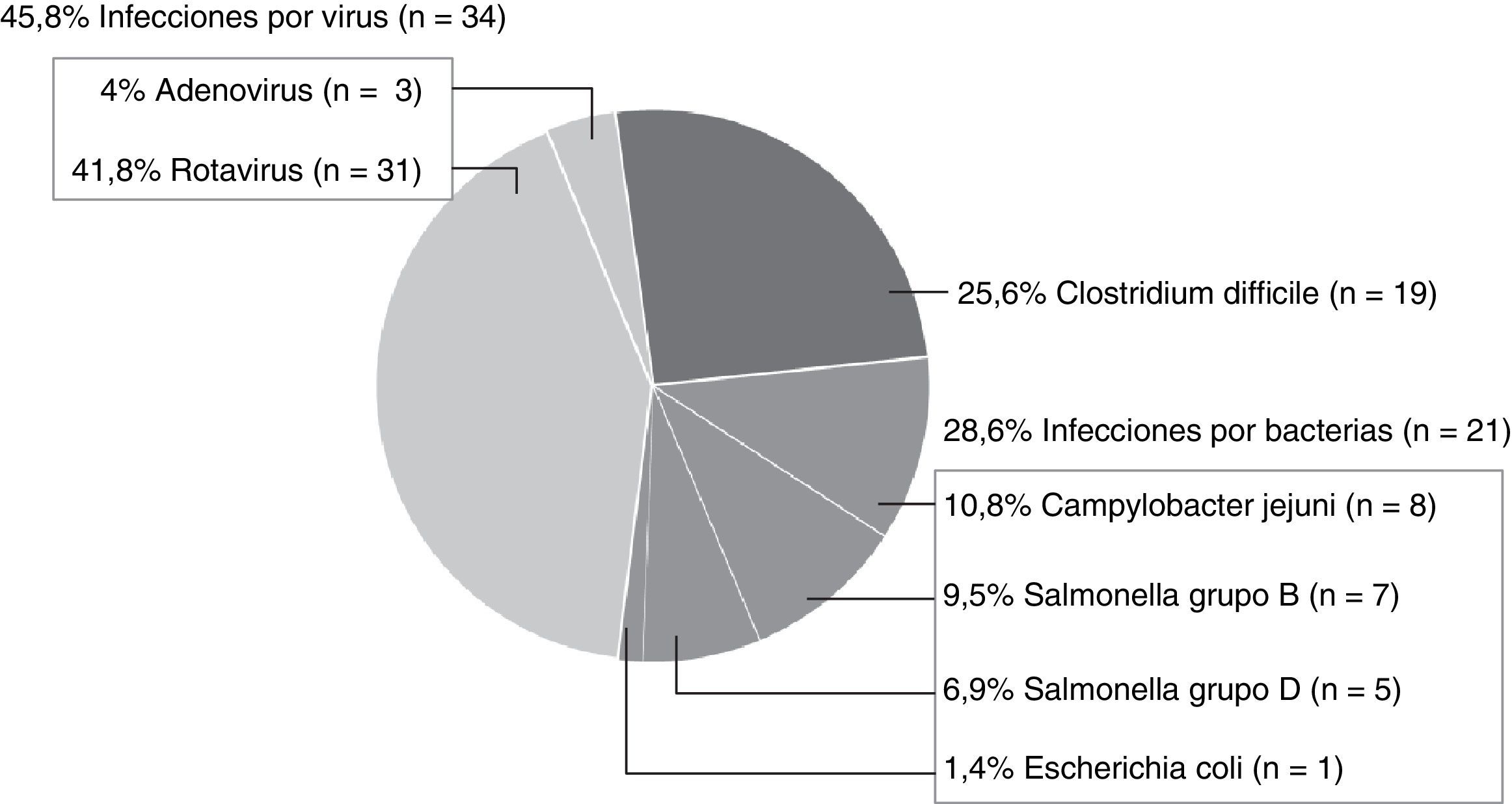
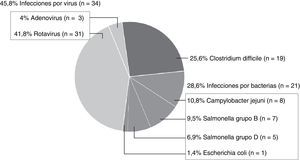
ResultadosSe identificaron 250 niños con diarrea, realizándose estudio microbiológico completo en 174. En 79 (45,4%) se llegó al diagnóstico: 25,6% ICD (n=19; 13 enterotoxigénicos); 28,6% otras bacterias (n=21) y 45,8% virus (n=34; rotavirus n=31; adenovirus n=3). Un 68,4% fueron menores de 2 años, y un 15,8% fueron adquiridos en la comunidad. En comparación con otras causas de diarrea, la ICD se asoció a comorbilidad (p<0,0001), contacto reciente con el sistema sanitario (p<0,0001), estancia en UCI (p=0,003) y exposición reciente a antibióticos (p<0,0001). Los pacientes con ICD cursaron de forma oligosintomática. No hubo diferencias clínicas entre las ICD productoras o no de toxina, siendo la comorbilidad el principal asociado con la ICD (OR 40,02; IC 95% 6,84-232,32; p<0,0001).
ConclusionesEl aislamiento de Clostridium difficile es frecuente en niños hospitalizados con diarrea en nuestro medio. La ICD resultó más frecuente en niños pequeños con comorbilidad y contacto reciente con el sistema sanitario, presentado, en su mayoría, un curso clínico oligosintomático. Se necesitan más estudios para conocer la epidemiología de esta infección en niños.
Clostridium difficile is the leading cause of nosocomial and antibiotic-associated diarrhea in adults, and its incidence has substantially risen over the last few years. The prevalence of this infection in children is difficult to assess due to the high rates of colonization in this setting.
Material and methodsA one-year retrospective study was conducted on children under 15 years admitted to hospital with acute diarrhea. Epidemiological, clinical, laboratory findings and outcome of children with Clostridium difficile infection (CDI) were compared to other causes of diarrhea. Risk factors for CDI were identified by multivariate analysis.
ResultsTwo hundred and fifty children with acute diarrhea were identified. A microbiological pathogen was identified in 79 (45.4%) of 174 patients who underwent complete testing: 19 CDI (25.6%, 13 of which were enterotoxin-producing), 21 other bacteria (28.6%), and 34 viruses (45.8%; rotavirus n=31; adenovirus n=3). The estimated incidence of CDI was 3 cases/1,000 admissions, with 68.4% of them occurring in children younger than 2 years. Overall, 15.8% were community-acquired. Compared to other causes of diarrhea, CDI was associated with comorbidity (P<.0001), recent contact with the health-care system (P<.0001) or intensive care unit stay (P=.003) and exposure to antibiotics in the previous month (P<.0001). The clinical course of children with CDI was less symptomatic. There were no clinical differences between Clostridium difficile toxin-producers and non-toxin producers. Comorbidity was identified as the main risk factor associated with CDI (OR 40.02, 95% CI 6.84-232.32; P<.0001).
ConclusionsThe isolation of Clostridium difficile is common in hospitalized children with diarrhea in our setting. CDI is more frequent in children with comorbidity and recent contact with the health-care system, presenting a mostly oligosymptomatic clinical course. Further studies are needed to understand the epidemiology of this infection in pediatrics, especially the percentage of asymptomatic carriers.
Clostridium difficile (CD) es la principal causa de diarrea nosocomial en adultos, acompañándose de una morbimortalidad significativa y un incremento de los costes sanitarios. Su significado en niños no está bien establecido debido a las altas tasas de colonización asintomática en neonatos y menores de 2 años, que puede alcanzar el 70%1,2. Aunque la infección sintomática en niños cursa, habitualmente, con un cuadro de diarrea leve y autolimitada, algunos grupos de riesgo, como los pacientes oncológicos o con determinadas afecciones gastrointestinales, pueden desarrollar formas graves de colitis seudomembranosa3,4.
En los últimos años ha tenido lugar un incremento global de la prevalencia y morbimortalidad de la infección por CD (ICD) debido, en parte, a la emergencia de la cepa hipervirulenta BI/NAP1/0275, cuyo primer caso en población autóctona en nuestro país ha sido descrito recientemente6,7. En población infantil, la epidemiología también ha cambiado en la última década, detectándose un aumento de los casos, tanto de origen nosocomial como de la comunidad8. Sin embargo, no existen estudios que evalúen su prevalencia y factores determinantes en niños españoles. Por ello, se diseñó un estudio retrospectivo en pacientes hospitalizados con el fin de describir la epidemiología, las características clínicas y la evolución de los niños en los que se aísla CD, comparándolos con las de los niños ingresados por otras causas infecciosas de diarrea.
Material y métodosEstudio retrospectivo de una cohorte de niños ingresados en el Hospital General Universitario Gregorio Marañón con un cuadro de diarrea entre septiembre de 2010 y octubre de 2011. La identificación de pacientes se realizó mediante los códigos de la CIE-10 «diarrea», «gastroenteritis», «colitis» y «Clostridium difficile». Se realizó un estudio descriptivo y, posteriormente, la cohorte se dividió en 2 grupos: 1) niños en los que se aisló CD, y 2) niños en los que el aislamiento fue una bacteria o virus distinto de CD. Ambos grupos se analizaron descriptivamente y se compararon sus características epidemiológicas, clínicas, analíticas y su evolución.
Criterios de inclusiónSe incluyó en el análisis a los menores de 15 años hospitalizados con diarrea con estudio microbiológico completo en heces: coprocultivo, antígenos de rotavirus y adenovirus, y cultivo (en nuestro hospital se realiza sistemáticamente cultivo de CD en todas las muestras procesadas para coprocultivo) o detección de toxinas de CD9.
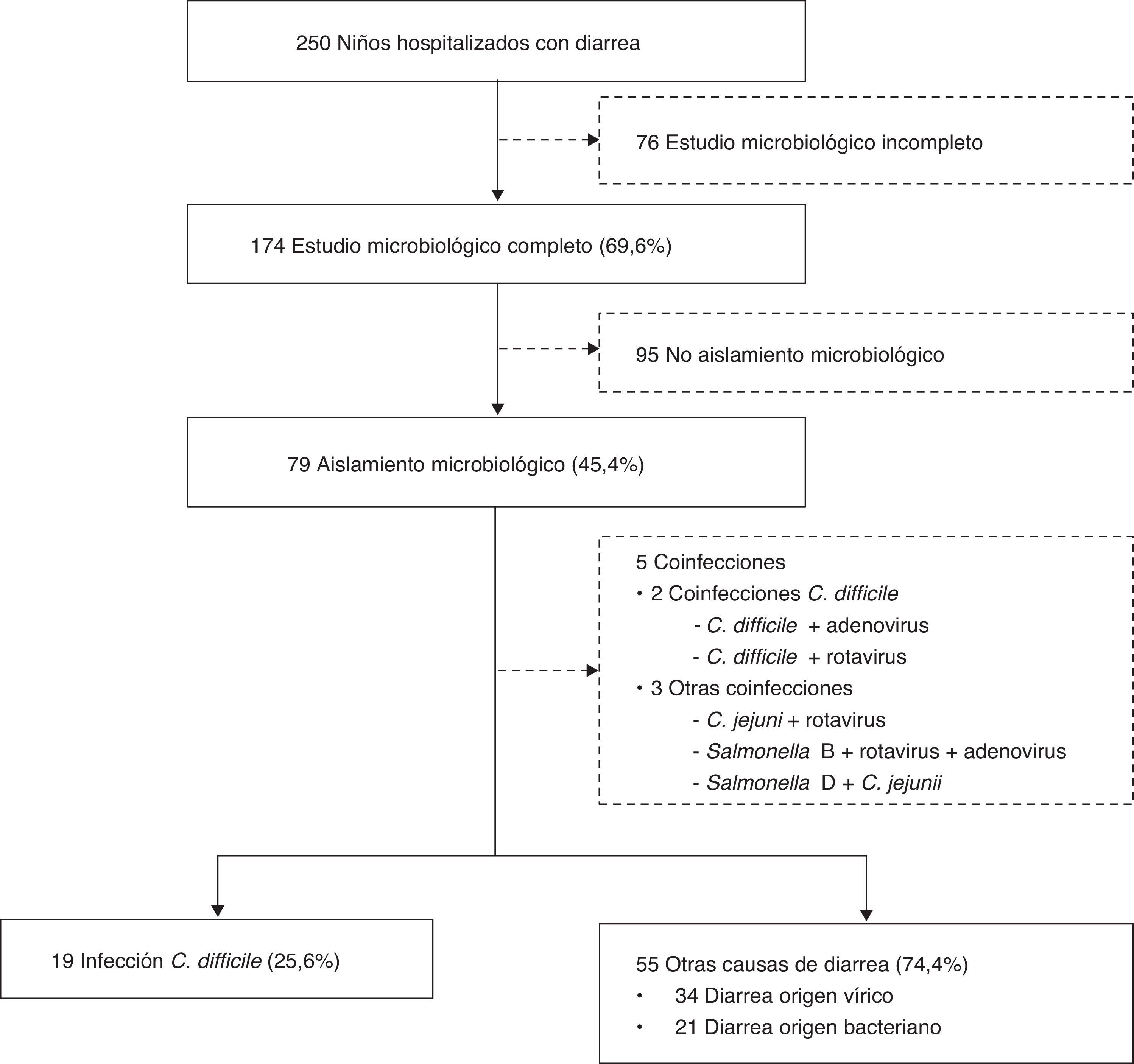
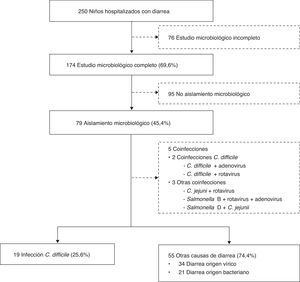
Criterios de exclusiónLos niños sin estudio microbiológico completo y aquellos sin aislamiento microbiológico fueron excluidos del análisis (fig. 1).
DefinicionesDefinimos como diarrea el episodio agudo de>3 deposiciones líquidas de, al menos, 24h de evolución. Se consideró ICD el cuadro de diarrea no atribuible a otra causa en cuyas heces se aisló CD o se detectó producción de citotoxina. Los casos de ICD adquiridos en la comunidad fueron aquellos en los que el paciente no había presentado contacto con el sistema sanitario el mes previo.
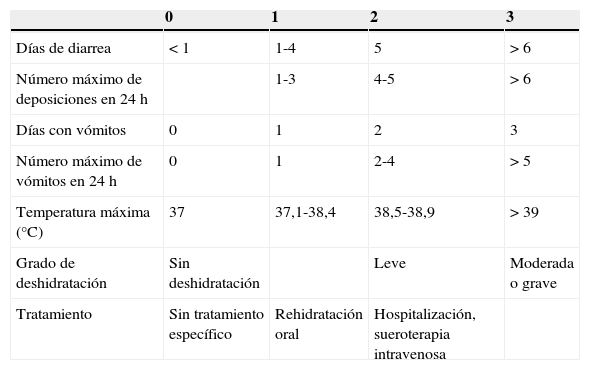
Las características clínicas se determinaron mediante una escala de valoración que clasifica el cuadro en leve, moderado o grave (Ruuska y Vesikari, tabla 1)10.
Escala para la valoración de la gravedad de la diarrea en niños
| 0 | 1 | 2 | 3 | |
|---|---|---|---|---|
| Días de diarrea | <1 | 1-4 | 5 | >6 |
| Número máximo de deposiciones en 24h | 1-3 | 4-5 | >6 | |
| Días con vómitos | 0 | 1 | 2 | 3 |
| Número máximo de vómitos en 24h | 0 | 1 | 2-4 | >5 |
| Temperatura máxima (°C) | 37 | 37,1-38,4 | 38,5-38,9 | >39 |
| Grado de deshidratación | Sin deshidratación | Leve | Moderada o grave | |
| Tratamiento | Sin tratamiento específico | Rehidratación oral | Hospitalización, sueroterapia intravenosa |
Leve: 0-8 puntos; moderada: 9-14 puntos; grave:>15 puntos.
Adaptado de: Ruuska y Vesikari10.
Además, se consideró ICD grave aquellos síndromes clínicos acompañados de alguno de los siguientes criterios11:
- 1.
Colitis seudomembranosa diagnosticada mediante endoscopia o anatomía patológica.
- 2.
Intervención quirúrgica secundaria a ICD.
- 3.
Perforación gastrointestinal.
- 4.
Megacolon tóxico.
- 5.
Neumatosis intestinal.
- 6.
Ingreso en una unidad de cuidados intensivos (UCI) los 2 días posteriores al diagnóstico.
- 7.
Shock asociado al cuadro de diarrea.
Se estudiaron las siguientes variables: a) características demográficas: sexo, edad, nacionalidad; b) factores de riesgo: comorbilidad, cirugía gastrointestinal, hospitalización el último mes, ingreso en UCI el último mes, contacto con el sistema sanitario el mes previo, antibioterapia previa, tipo de antibiótico; c) clínica: temperatura máxima, número de deposiciones/día, número de vómitos/día, sangre en heces, grado de deshidratación; d) laboratorio: leucocitosis máxima, neutrofilia máxima, PCR máxima, pH<7,3; e) evolución: días de ingreso, diarrea y vómitos, y f) tratamiento: sueroterapia oral o intravenosa, antibioterapia. Por último, se estudiaron los resultados microbiológicos: coprocultivo, cultivo o toxina de CD en heces, antígeno de rotavirus y adenovirus.
Análisis estadísticoSe analizaron las características demográficas, clínicas y analíticas, los factores de riesgo y la evolución de las distintas causas de diarrea. Los resultados de las variables categóricas se presentan como frecuencias o tasas, y los de las variables continuas, como medias (DE) o medianas (RIC). La comparación entre los agentes infecciosos se realizó mediante los test Chi cuadrado o exacto de Fisher (variables categóricas), o mediante el test t de Student, Wilcoxon, U de Mann-Whitney, o ANOVA (variables continuas).
Para la identificación de los factores asociados con la presencia de CD se construyó un modelo de regresión logística incluyendo las variables identificadas en el análisis bivariado como posiblemente relacionadas. Dicha asociación se reporta mediante odds ratios (OR) con intervalos de confianza del 95%. Para el análisis estadístico se utilizó SPSS® Statistical software, versión 20.0 (SPSS Inc., Chicago, IL, EE. UU.).
ResultadosDoscientos cincuenta niños hospitalizados fueron diagnosticados de diarrea en el período de estudio, siendo un 56% varones. La mediana de edad fue de 1,2 años (RIC 0,5-3,3).
Se realizó estudio microbiológico completo de heces en 174 niños (69,6%), llegándose al diagnóstico etiológico en 79 (45,4%). Cinco pacientes presentaron varios aislamientos: 2 coinfecciones por CD asociadas a otros microorganismos (CD+rotavirus y CD+adenovirus), y 3 coinfecciones con otros patógenos (C. jejuni+rotavirus; Salmonella D +C. jejuni; Salmonella B+rotavirus+adenovirus). Los niños con coinfecciones fueron excluidos del análisis (fig. 1).
Entre los 74 niños con un único aislamiento, en 19 se aisló CD (25,6%), detectándose citotoxina en 13 (68,4%). Además, se encontraron 21 aislamientos bacterianos (28,6%) y 34 virales (45,8%) (fig. 2).
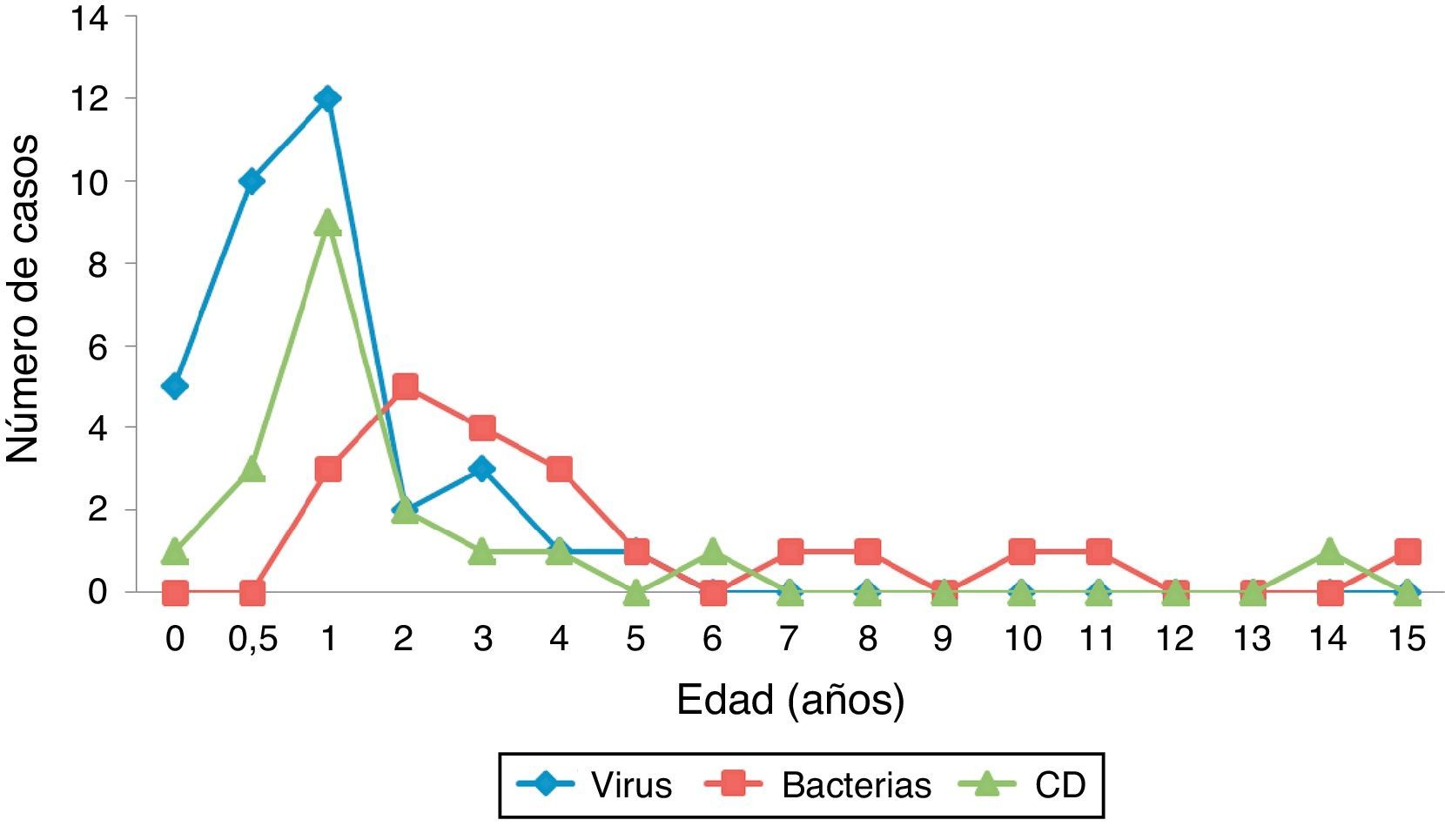
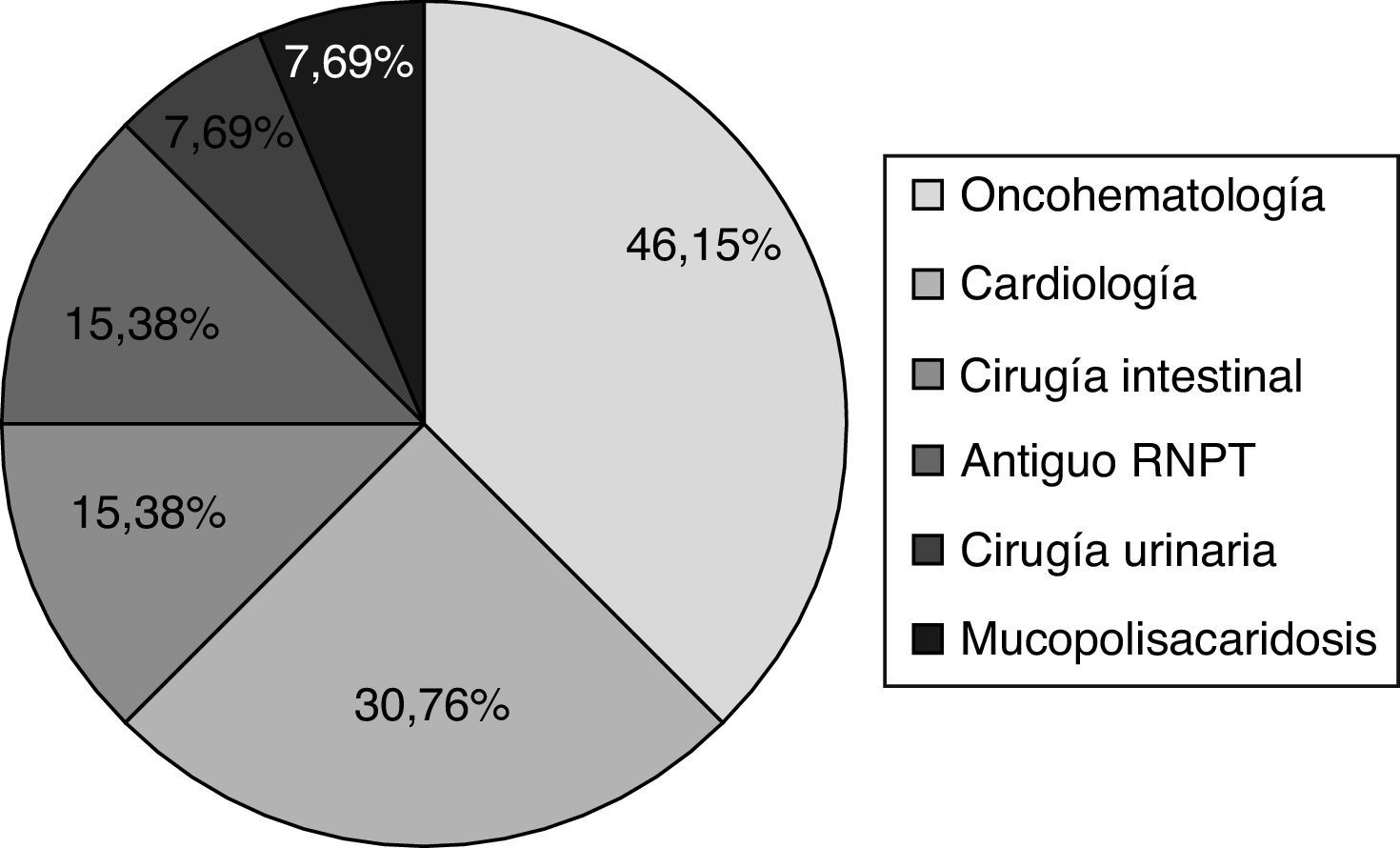
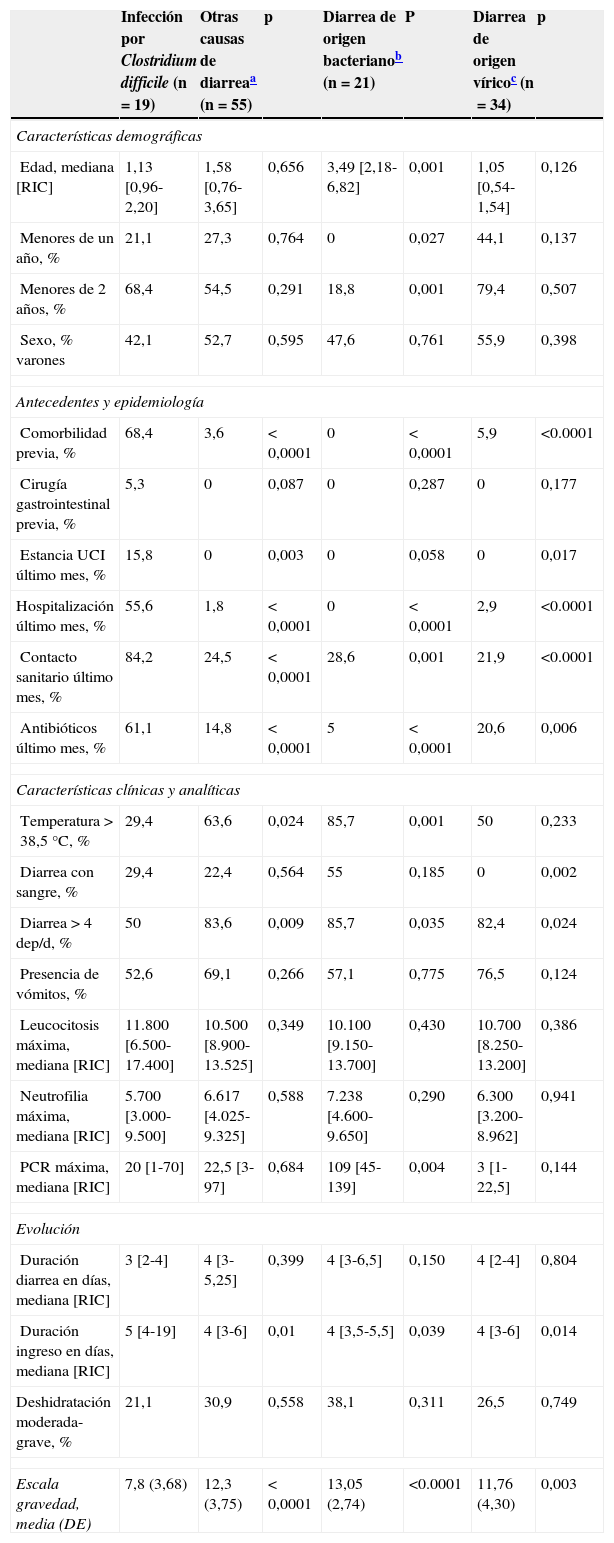
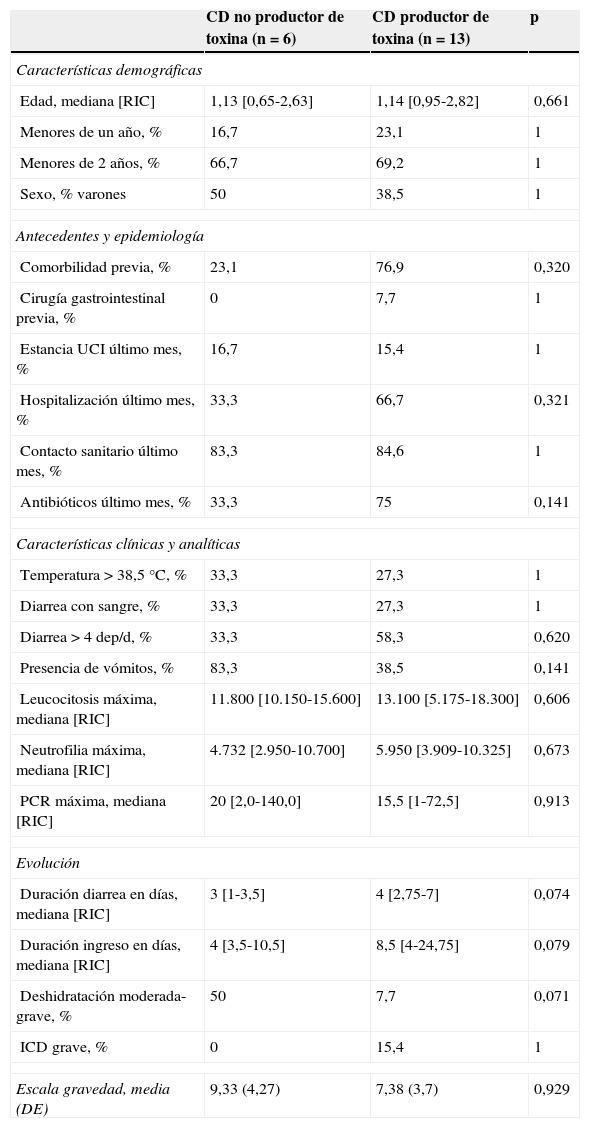
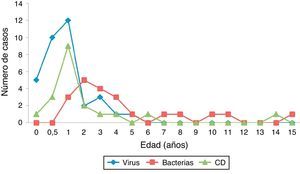
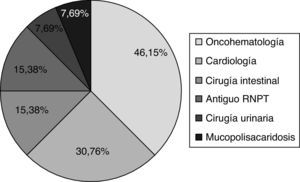
Características de los niños con infección por Clostridium difficileUn 42,1% de los niños con ICD fueron varones (edad 1,1 años [RIC 0,9-2,2]). Las principales características de los niños con ICD y su comparación con otras causas infecciosas de diarrea se exponen en la tabla 2. El 68,4% fueron<2 años (fig. 3). La mayoría presentaban antecedentes patológicos (68,4%), tratándose, sobre todo, de enfermedad oncohematológica, cardiológica, cirugía intestinal o antiguos prematuros (fig. 4). Un 15,8% fueron adquiridas en la comunidad. De esta manera, el mes anterior al ingreso, el 84,2% de los niños había tenido contacto con el sistema sanitario, y el 55,6% había estado hospitalizado. El 61,1% había recibido algún antibiótico (sulfametoxazol/trimetoprima 4, cefotaxima 3, amoxicilina/clavulánico 1; penicilina; otros 3). Dos presentaron ICD grave (10,52%). En 13 pacientes (68,4%) se confirmó producción de enterotoxina (n=13). No hubo diferencias clínicas ni analíticas entre los casos productores o no de enterotoxina (tabla 3).
Características de los niños con infección por Clostridium difficile en comparación con otras causas de diarrea
| Infección por Clostridium difficile (n=19) | Otras causas de diarreaa (n=55) | p | Diarrea de origen bacterianob (n=21) | P | Diarrea de origen víricoc (n=34) | p | |
|---|---|---|---|---|---|---|---|
| Características demográficas | |||||||
| Edad, mediana [RIC] | 1,13 [0,96-2,20] | 1,58 [0,76-3,65] | 0,656 | 3,49 [2,18-6,82] | 0,001 | 1,05 [0,54-1,54] | 0,126 |
| Menores de un año, % | 21,1 | 27,3 | 0,764 | 0 | 0,027 | 44,1 | 0,137 |
| Menores de 2 años, % | 68,4 | 54,5 | 0,291 | 18,8 | 0,001 | 79,4 | 0,507 |
| Sexo, % varones | 42,1 | 52,7 | 0,595 | 47,6 | 0,761 | 55,9 | 0,398 |
| Antecedentes y epidemiología | |||||||
| Comorbilidad previa, % | 68,4 | 3,6 | <0,0001 | 0 | <0,0001 | 5,9 | <0.0001 |
| Cirugía gastrointestinal previa, % | 5,3 | 0 | 0,087 | 0 | 0,287 | 0 | 0,177 |
| Estancia UCI último mes, % | 15,8 | 0 | 0,003 | 0 | 0,058 | 0 | 0,017 |
| Hospitalización último mes, % | 55,6 | 1,8 | <0,0001 | 0 | <0,0001 | 2,9 | <0.0001 |
| Contacto sanitario último mes, % | 84,2 | 24,5 | <0,0001 | 28,6 | 0,001 | 21,9 | <0.0001 |
| Antibióticos último mes, % | 61,1 | 14,8 | <0,0001 | 5 | <0,0001 | 20,6 | 0,006 |
| Características clínicas y analíticas | |||||||
| Temperatura>38,5°C, % | 29,4 | 63,6 | 0,024 | 85,7 | 0,001 | 50 | 0,233 |
| Diarrea con sangre, % | 29,4 | 22,4 | 0,564 | 55 | 0,185 | 0 | 0,002 |
| Diarrea>4 dep/d, % | 50 | 83,6 | 0,009 | 85,7 | 0,035 | 82,4 | 0,024 |
| Presencia de vómitos, % | 52,6 | 69,1 | 0,266 | 57,1 | 0,775 | 76,5 | 0,124 |
| Leucocitosis máxima, mediana [RIC] | 11.800 [6.500-17.400] | 10.500 [8.900-13.525] | 0,349 | 10.100 [9.150-13.700] | 0,430 | 10.700 [8.250-13.200] | 0,386 |
| Neutrofilia máxima, mediana [RIC] | 5.700 [3.000-9.500] | 6.617 [4.025-9.325] | 0,588 | 7.238 [4.600-9.650] | 0,290 | 6.300 [3.200-8.962] | 0,941 |
| PCR máxima, mediana [RIC] | 20 [1-70] | 22,5 [3-97] | 0,684 | 109 [45-139] | 0,004 | 3 [1-22,5] | 0,144 |
| Evolución | |||||||
| Duración diarrea en días, mediana [RIC] | 3 [2-4] | 4 [3-5,25] | 0,399 | 4 [3-6,5] | 0,150 | 4 [2-4] | 0,804 |
| Duración ingreso en días, mediana [RIC] | 5 [4-19] | 4 [3-6] | 0,01 | 4 [3,5-5,5] | 0,039 | 4 [3-6] | 0,014 |
| Deshidratación moderada-grave, % | 21,1 | 30,9 | 0,558 | 38,1 | 0,311 | 26,5 | 0,749 |
| Escala gravedad, media (DE) | 7,8 (3,68) | 12,3 (3,75) | <0,0001 | 13,05 (2,74) | <0.0001 | 11,76 (4,30) | 0,003 |
DE: desviación estándar; ICD: infección por Clostridium difficile; PCR: proteína C reactiva; RIC: rango intercuartílico; UCI: unidad de cuidados intensivos.
Características de los niños con infección por Clostridium difficile en función de la producción de toxina
| CD no productor de toxina (n=6) | CD productor de toxina (n=13) | p | |
|---|---|---|---|
| Características demográficas | |||
| Edad, mediana [RIC] | 1,13 [0,65-2,63] | 1,14 [0,95-2,82] | 0,661 |
| Menores de un año, % | 16,7 | 23,1 | 1 |
| Menores de 2 años, % | 66,7 | 69,2 | 1 |
| Sexo, % varones | 50 | 38,5 | 1 |
| Antecedentes y epidemiología | |||
| Comorbilidad previa, % | 23,1 | 76,9 | 0,320 |
| Cirugía gastrointestinal previa, % | 0 | 7,7 | 1 |
| Estancia UCI último mes, % | 16,7 | 15,4 | 1 |
| Hospitalización último mes, % | 33,3 | 66,7 | 0,321 |
| Contacto sanitario último mes, % | 83,3 | 84,6 | 1 |
| Antibióticos último mes, % | 33,3 | 75 | 0,141 |
| Características clínicas y analíticas | |||
| Temperatura>38,5°C, % | 33,3 | 27,3 | 1 |
| Diarrea con sangre, % | 33,3 | 27,3 | 1 |
| Diarrea>4 dep/d, % | 33,3 | 58,3 | 0,620 |
| Presencia de vómitos, % | 83,3 | 38,5 | 0,141 |
| Leucocitosis máxima, mediana [RIC] | 11.800 [10.150-15.600] | 13.100 [5.175-18.300] | 0,606 |
| Neutrofilia máxima, mediana [RIC] | 4.732 [2.950-10.700] | 5.950 [3.909-10.325] | 0,673 |
| PCR máxima, mediana [RIC] | 20 [2,0-140,0] | 15,5 [1-72,5] | 0,913 |
| Evolución | |||
| Duración diarrea en días, mediana [RIC] | 3 [1-3,5] | 4 [2,75-7] | 0,074 |
| Duración ingreso en días, mediana [RIC] | 4 [3,5-10,5] | 8,5 [4-24,75] | 0,079 |
| Deshidratación moderada-grave, % | 50 | 7,7 | 0,071 |
| ICD grave, % | 0 | 15,4 | 1 |
| Escala gravedad, media (DE) | 9,33 (4,27) | 7,38 (3,7) | 0,929 |
CD: Clostridium difficile; DE: desviación estándar; ICD: infección por Clostridium difficile; PCR: proteína C reactiva; RIC: rango intercuartílico; UCI: unidad de cuidados intensivos.
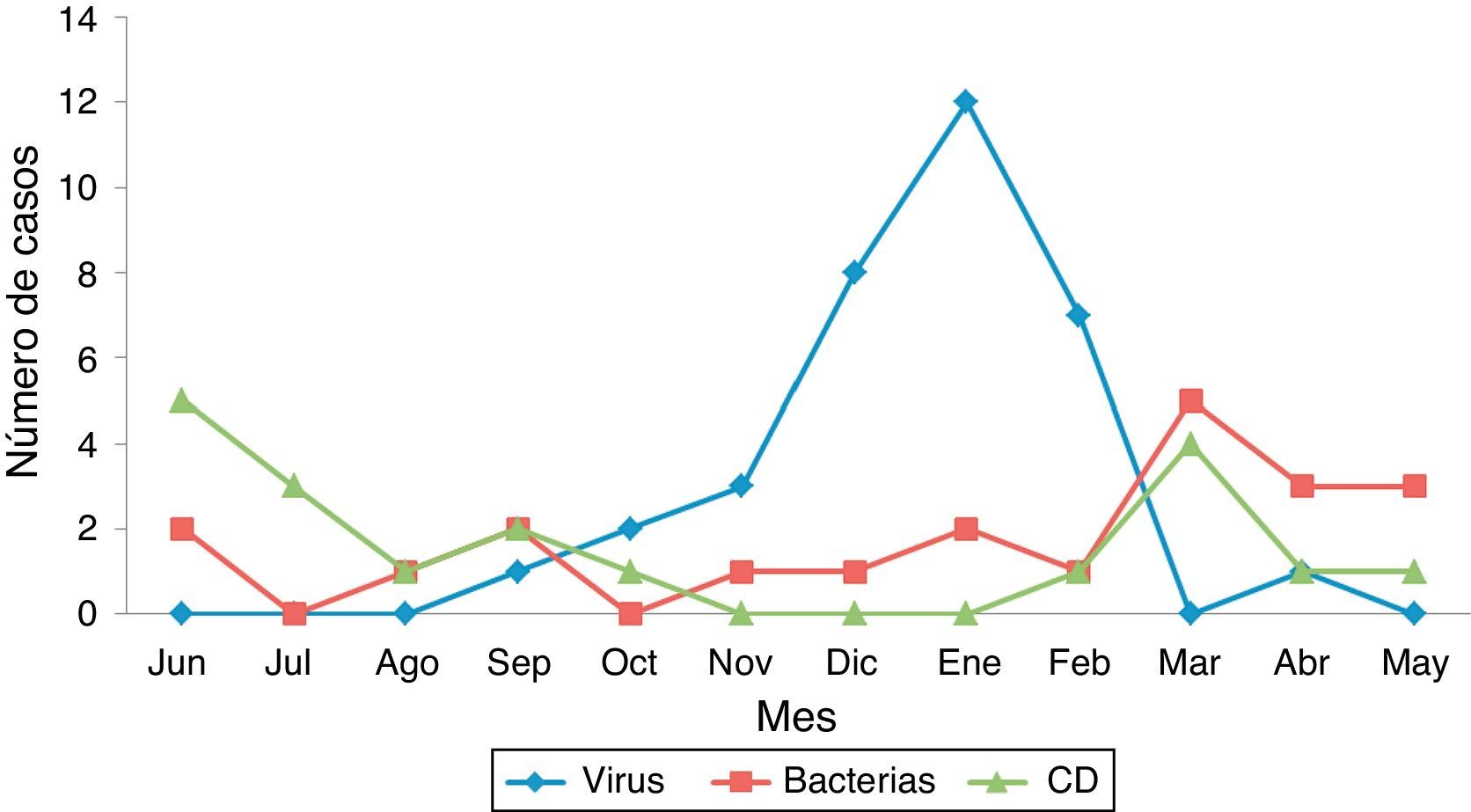
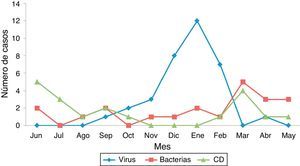
En comparación con otros aislamientos, los niños con CD presentaron con mayor frecuencia enfermedad crónica (68,4 vs. 3,6%; p<0,0001) y estancias hospitalarias más prolongadas (mediana 5 vs. 4 días; p=0,01). Desde un punto de vista epidemiológico, el aislamiento de CD no mostró un patrón estacional, a diferencia de otras causas de diarrea, especialmente las virales, que fueron más frecuentes en otoño e invierno (fig. 5). Los niños con ICD tuvieron con mayor frecuencia contacto con el sistema sanitario el último mes (84,2 vs. 24,5%; p<0,0001), ingresos hospitalarios (55,6 vs. 1,8%; p<0,0001) y estancia reciente en UCI (15,8 vs. 0%; p<0,003). El consumo reciente de antibióticos también resultó más habitual en niños con ICD (61,1 vs. 14,8%; p<0,0001). Clínicamente, las ICD fueron menos sintomáticas, con menor frecuencia de fiebre (29,4 vs. 63,6%; p=0,024), menos deposiciones (50 vs. 83,6% con más de 4dep/d; p=0,009) y puntuaciones más bajas en la escala de gravedad empleada (mediana 7,8 vs. 12,3; p<0,0001). Por el contrario, no se encontraron diferencias en los parámetros analíticos.
Al comparar los cuadros de origen bacteriano frente a las ICD, los primeros ocurrieron en niños más mayores (mediana 3,4 vs. 1,1 años; p=0,001), siendo un 81,2% mayores de 2 años. No se encontró asociación con antecedentes epidemiológicos ni con comorbilidad en las diarreas bacterianas. Estos cuadros fueron más sintomáticos, con mayor frecuencia de fiebre (85,7 vs. 29,4%; p=0,001), menos de 4 dep/d (85,7 vs. 50%, p=0,035) y cifras más altas de proteína C reactiva (mediana 109 vs. 20mg/L; p=0,004). La puntuación en la escala de gravedad fue mayor en aquellas de origen bacteriano en comparación con las ICD (mediana 13,1 vs. 7,8; p<0,0001).
Los cuadros producidos por virus, al igual que las ICD, fueron más frecuentes en niños pequeños (mediana 1,05 vs. 1,1 años; p=0,12), siendo el 79,4%<2 años. En estos pacientes, la comorbilidad asociada y el contacto reciente con el sistema sanitario fueron inusuales. Clínicamente, estos niños presentaron más deposiciones que aquellos con ICD (82,4 vs. 50% más de 4dep/d; p=0,024) y una mayor puntuación en la escala clínica (mediana 11,76 vs. 8; p=0,003), aunque no existieron diferencias analíticas en comparación con los niños con ICD.
Factores asociados con el aislamiento de Clostridium difficileEn el análisis multivariante, el aislamiento de CD se asoció significativamente con la comorbilidad del paciente (OR 40; IC 95% 6,8-232,3; p<0,0001). Además, los niños con ICD presentaron menores puntuaciones en la escala de valoración clínica (OR 0,8; IC 95% 0,7-0,9; p=0,049).
DiscusiónEste es el primer estudio en nuestro país que determina el impacto de la ICD en niños hospitalizados con diarrea. En él encontramos que el aislamiento de CD en estos niños es frecuente, en su mayoría productores de toxina. En este estudio, CD se aísla de forma característica en menores de 2 años con enfermedad subyacente, y se asocia a estancias hospitalarias prolongadas, uso reciente de antibióticos y contacto habitual con el sistema sanitario. La mayoría de los cuadros cursaron de forma benigna y oligosintomática.
En las últimas décadas, CD se ha convertido en la principal causa de infección intestinal relacionada con el medio sanitario en adultos, favorecido por la diseminación de la cepa hipervirulenta CD027, responsable de brotes en EE. UU., Canadá y Europa5,12,13. La epidemiología en niños refleja los cambios en adultos, aumentando su incidencia en el ámbito hospitalario y en la comunidad14–16. En nuestro país también ha habido un incremento en relación con el uso de antibióticos, el envejecimiento y el aumento de comorbilidad de la población hospitalizada17. Recientemente se ha notificado el primer caso autóctono de la cepa CD0277. La tasa de ICD en pacientes hospitalizados en España es de 2,4 casos/1.000 ingresos18, no existiendo datos en población infantil. En nuestro estudio la incidencia de ICD en niños hospitalizados con diarrea fue de 3 casos/1.000 ingresos, siendo CD la bacteria aislada con más frecuencia, superada únicamente por rotavirus. Un 15,8% fueron casos adquiridos en la comunidad, frente al 25% descrito en otras series pediátricas19.
Sin embargo, a partir de nuestros hallazgos no es posible determinar si el aislamiento de CD en niños representa la verdadera enfermedad o el estado de portador asintomático. La colonización asintomática en adultos de la comunidad sucede en un 1,6-4% de la población20, ascendiendo al 5-26% en el ámbito hospitalario, y sobrepasando el 50% en brotes epidémicos20,21. Un estudio pediátrico en el medio hospitalario puso de manifiesto que la situación en niños mayores es similar, describiéndose un 25% de sujetos colonizados19. Sin embargo, la colonización en menores de 2 años, incluyendo cepas productoras de enterotoxina, sobrepasa el 70%2. Así, se ha visto que la colonización por CD ocurre poco tiempo después del nacimiento, y aumenta progresivamente durante el primer año de vida4, descendiendo posteriormente con la edad. A partir de los 3 años las tasas igualan a las de los adultos3, siendo los factores de riesgo asociados la enfermedad de base, la hospitalización previa y la exposición a más de 2 antibióticos22. Estas tasas de colonización en niños tienen importantes implicaciones. En primer lugar, los niños se comportan como reservorios de CD, transmitiendo la infección a la población adulta23,24 o a niños susceptibles. Por otra parte, el hallazgo incidental de CD en niños con diarrea puede confundir al establecer un diagnóstico e iniciar un tratamiento. Por ello, la búsqueda sistemática de CD en menores de 2 años con diarrea sin otros factores de riesgo podría no ser una actitud adecuada, al menos hasta determinar su significado en esta población25.
La patogenia de la ICD en niños no es bien conocida3. En adultos, las toxinas A y B de la bacteria se unen a receptores de membrana específicos de los colonocitos, desencadenando una reacción inflamatoria que conduce a la apoptosis y al cuadro de colitis y diarrea. Al igual que lo observado en animales26,27, se piensa que los lactantes carecen de la maquinaria necesaria para la internalización celular de la toxina. Asimismo, se ha detectado un aumento con la edad de los títulos séricos de inmunoglobulina antitoxina A y B en menores de 2 años, apareciendo niveles altos en lactantes colonizados28. Por último, se ha demostrado que la lactancia materna es un factor protector frente a la colonización debido a diferencias en la acidez gastrointestinal29, a la secreción de IgA30 y a la competencia con la flora de la leche materna31,32.
Un hallazgo relevante de nuestro estudio son los antecedentes patológicos en la mayoría de los niños con ICD, siendo un potente factor de riesgo para su aislamiento (OR 40, IC 95% 6,8-232,3). Dicha comorbilidad sería la responsable de que estos niños presenten recientemente mayor contacto con el sistema sanitario, altas tasas de hospitalización –incluyendo UCI– e ingresos prolongados. La exposición reciente a antibióticos, principal factor de riesgo de ICD en adultos y niños19,33, también es más frecuente en nuestro estudio. Sin embargo, al no encontrarse asociación en el análisis multivariante, creemos que el consumo de antibióticos podría ser una característica de los pacientes con comorbilidad, comportándose como un factor de confusión. Son necesarios estudios más amplios con población control para profundizar en dicha relación. Otro factor de riesgo es la enfermedad gastrointestinal19,34,35, aunque dicha asociación no resultó significativa. La utilización de inhibidores de la bomba de protones, asociada a CD en otros estudios pediátricos, no fue adecuadamente analizada en nuestra muestra36.
Nuestro estudio revela interesante información acerca del perfil clínico de los niños con ICD y otras causas de diarrea. Característicamente, los cuadros bacterianos aparecen en niños mayores y son más sintomáticos, presentando con frecuencia fiebre, hematoquecia, mayor ritmo de deposiciones y alteraciones analíticas. Los cuadros víricos tienen lugar en menores de 2 años, y presentaron mayor intensidad de vómitos, sin diferencias en otras variables. Al comparar entre sí los cuadros de ICD productores o no de enterotoxina, no encontramos diferencias en las variables estudiadas, a pesar de que los pacientes con ICD con criterios de gravedad fueron productores de toxina. Esto contradice los hallazgos de otras series pediátricas37–39, aunque nuestra muestra fue menor. Esta baja gravedad clínica encontrada en niños con ICD podría ser debida, en parte, a que la escala de valoración empleada, diseñada inicialmente para el diagnóstico de la diarrea por rotavirus, no es adecuada para identificar los cuadros graves de ICD, al no considerar variables importantes relacionadas con la gravedad del cuadro. De hecho, en adultos, la ICD grave con frecuencia cursa sin diarrea21. No obstante, parece acorde con estudios epidemiológicos pediátricos que la escasa gravedad clínica de los niños con ICD en este estudio sea debida al estado de colonización de estos pacientes y no a una verdadera infección.
Este estudio tiene algunas limitaciones. Se trata de un análisis retrospectivo, lo que puede haber limitado la identificación de los pacientes. Sin embargo, al ser la incidencia de CD similar a la descrita por otros autores, pensamos que probablemente hayan sido identificados la mayoría de los niños hospitalizados con diarrea. El carácter retrospectivo del estudio, por otro lado, nos permite pensar que podría haber otros sesgos, como la inadecuada identificación de variables analizadas. En segundo lugar, el estudio se realiza en pacientes con diarrea, por lo que el papel de CD como agente causal o como colonizador no puede establecerse con seguridad. Además, existen patógenos asociados a diarrea en niños, como norovirus o E. coli enterotoxigénico, que no permiten ser identificados en nuestro hospital de manera sistemática. Por último, el estudio se desarrolla en un hospital terciario, por lo que la comorbilidad podría estar sobrestimada.
En resumen, nuestro estudio demuestra que el aislamiento de CD es frecuente en niños ingresados por diarrea, particularmente en menores de 2 años con enfermedad crónica. El espectro clínico difiere del de otras causas infecciosas de diarrea, cursando de forma oligosintomática en la mayoría de los casos, aunque una proporción de ellos podrían representar meras colonizaciones. Son necesarios estudios prospectivos más amplios, con controles asintomáticos y fuera del medio hospitalario, para esclarecer el verdadero significado de CD en la población infantil.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue presentado como Póster en el VI Congreso Nacional de la Sociedad Española de Infectología Pediátrica (Bilbao, marzo de 2012).