La principal medida de prevención frente a la enfermedad meningocócica invasiva es la vacunación. El objetivo de este estudio es evaluar la aceptabilidad y las desigualdades socioeconómicas en el acceso a la vacuna frente a meningococo B (MenB) en la Comunidad de Madrid en el periodo previo a la introducción de la misma en el calendario.
Materiales y métodosSe realizó un estudio observacional descriptivo en la cohorte de niños/as nacidos entre 2016 y 2019, de tipo ecológico, empleando registros poblacionales electrónicos. Se describieron las coberturas de vacunación, se analizaron los factores asociados al estado vacunal, se describieron las distribuciones espaciales de cobertura de vacunación y de índice de privación (IP) y se analizó la asociación entre ambas mediante regresión espacial.
ResultadosSe observó una tendencia creciente de las coberturas de primovacunación, pasando de un 44% en la cohorte de nacidos en el año 2016 a un 68% en la cohorte de 2019. Se encontró asociación estadísticamente significativa entre el estado vacunal y el IP (OR de primovacunación en zonas con IP5 respecto a zonas con IP1: 0,38; IC 95%: 0,39-0,50; p<0,001). El análisis espacial mostró correlación inversa entre el IP y la cobertura de vacunación.
ConclusionesEl ascenso de las coberturas de esta vacuna muestra aceptación por parte de la población. La relación entre nivel socioeconómico y cobertura de vacunación confirma la existencia de una desigualdad en salud, y subraya la importancia de su inclusión en el calendario.
The main preventive measure against invasive meningococcal disease is vaccination. The aim of our study was to evaluate the acceptability of the meningococcal B (MenB) vaccine and socioeconomic inequalities in the access to the vaccine in the Community of Madrid in the period prior to its introduction in the immunization schedule.
Materials and methodsWe conducted an observational and ecological descriptive study in the cohort of children born between 2016 and 2019 using population-based electronic records. We calculated the vaccination coverage and analysed factors associated with vaccination status, determined the spatial distribution of vaccination coverage and the deprivation index (DI) and assessed the association between them by means of spatial regression.
ResultsWe observed an increasing trend in primary vaccination coverage, from 44% in the cohort born in 2016 to 68% in the 2019 cohort. We found a statistically significant association between vaccination status and the DI (OR of primary vaccination in areas with DI5 compared to areas with DP1, 0.38; 95% confidence interval: 0.39-0.50; P<.001). The spatial analysis showed an inverse correlation between the DI and vaccination coverage.
ConclusionsThe rise in the coverages of the MenB vaccine shows acceptance by the population. The association between socioeconomic level and vaccination coverage confirms the existence of health inequality and underlines the importance including this vaccine in the immunization schedule.
La enfermedad meningocócica invasiva supone un importante problema de Salud Pública dado que, aunque afortunadamente la incidencia es baja, presenta alta tasa de letalidad (10%) y alta probabilidad de producir secuelas graves a largo plazo1–3.
Esta enfermedad está causada por Neisseria meningitidis o meningococo, un diplococo gramnegativo, cuya cápsula polisacárida nos permite diferenciar hasta 13 serogrupos, de los cuales hay 6 que son los causantes de prácticamente el 100% de los casos de enfermedad meningocócica invasiva: los serogrupos A, B, C, W, X e Y1–3. De entre ellos, el serogrupo B (MenB) es el que mayor número de casos ha causado en nuestro entorno en las últimas 2 décadas, tanto a nivel nacional como a nivel de la Comunidad de Madrid (CAM)4,5.
La vacunación es la principal medida de prevención que tenemos frente a esta enfermedad1–3. El calendario vacunal a lo largo de la vida del Consejo Interterritorial del Sistema Nacional de Salud (CISNS) indica la vacunación frente a meningococo C, introducida en el año 2000, a los 4 y a los 12 meses de edad, y la vacunación tetravalente frente a los serogrupos A, C, W e Y, introducida en el año 2019, a los 12 años, con una estrategia de catch-up hasta los 18 años6. Desde el año 20157,8, el Comité Asesor de Vacunas de la Asociación Española de Pediatría recomienda la vacunación frente a meningococo B de los lactantes, y desde enero de 2023 esta vacuna se incluye en el calendario de vacunación para toda la vida del SNS6 de manera financiada, para todos los lactantes.
La vacuna recientemente incluida en calendario es 4CMenB, una vacuna proteica formada por 4 componentes subcapsulares9. Esta vacuna fue aprobada por la Agencia Europea del Medicamento en el año 2013, para su uso en mayores de 2 meses10. En los últimos años se han publicado diversos estudios que estiman una alta eficacia y efectividad vacunal en distintos entornos sanitarios en Reino Unido11, Portugal12 o Canadá13. En el año 2021, se presentó en España un estudio de casos y controles realizado a nivel nacional, que demostró una efectividad vacunal del 73% en aquellos que habían recibido la pauta completa de vacunación en el último año, y del 97% en menores de un año con vacunación completa14. La vacuna ha demostrado ser segura9. La evaluación económica de cara a la inclusión en el calendario vacunal infantil en España hasta el momento ha sido desfavorable15,16. Aunque en anteriores evaluaciones realizadas por el Grupo de Trabajo de Ponencia de Vacunas del SNS se decidió no incluir esta vacuna en el calendario en base a la situación epidemiológica17, algunas comunidades autónomas, como Canarias18, Castilla y León19, Andalucía20 y Cataluña21, optaron por incluirla entre los años 2019 y 2022. Durante el último trimestre de 2022, y a la vista de nueva evidencia científica sobre su efectividad en el territorio, el Grupo de Trabajo de MenB de la Ponencia de Programa y Registro de Vacunaciones realizó una nueva evaluación sobre la inclusión de esta vacuna en el calendario de vacunación para toda la vida del SNS, siendo aprobada por el CISNS su incorporación en el calendario de 2023, en pauta de 3 dosis a los 2, 4 y 12 meses de edad16.
La disponibilidad de la vacuna, así como su recomendación por parte de los pediatras, en los años previos a su incorporación en el calendario común de vacunación del CISNS, nos permitió valorar, por un lado, la aceptación de esta vacuna por parte de la población y, por otro, la posible relación entre vacunación y nivel socioeconómico en la CAM en este periodo. Estas dos características representan aspectos éticos importantes a tener en cuenta a la hora de fundamentar modificaciones en el calendario de vacunación22 y, de hecho, este estudio presenta resultados en los que se pudo fundamentar la decisión de incluir esta vacuna en calendario. El criterio de efectividad, junto con otros como los que se pretendieron discutir en vista a los resultados de este trabajo, ha primado por encima del criterio económico para su inclusión en el calendario de vacunación.
El objetivo del estudio es, por tanto, describir la cobertura de vacunación frente a meningococo B en niños y niñas nacidos entre 2016 y 2019 en la CAM, así como evaluar la relación entre cobertura de vacunación e índice de privación (IP) de cada Zona Básica de Salud (ZBS), en la etapa previa a la inclusión de esta vacuna en el calendario de vacunación.
Material y métodosDiseño del estudioSe realizó un estudio observacional descriptivo de base poblacional y ecológico, siendo la unidad del análisis espacial la ZBS23 en la CAM.
Población de estudioEn la población de estudio se incluyó a todos los niños y niñas nacidas durante los años 2016-2019 incluidos en la base de datos de tarjeta sanitaria de la CAM.
Fuentes de información y variables de estudioLas fuentes de información empleadas fueron el registro de vacunación (SISPAL Vacunas)24, el repositorio de información de la población con tarjeta sanitaria de la CAM (CIBELES)25 y la base cartográfica de la comunidad, así como las capas de división por ZBS.
Para el cálculo de las coberturas de vacunación se revisaron los registros de vacunación desde enero 2016 hasta marzo 2022, donde se incluyen número de dosis y fecha de vacunación. Se construyeron las variables: al menos una dosis recibida antes de los 24 meses de edad (MenB1d), al menos 2 dosis recibidas antes de los 24 meses de edad (MenB2d) y al menos 3 dosis recibidas antes de los 24 meses de edad (MenB3d). Para el análisis de factores asociados al estado vacunal y para el análisis espacial, se emplearon solo las variables MenB2d, entendida como primovacunación, y MenB3d, entendida como vacunación completa.
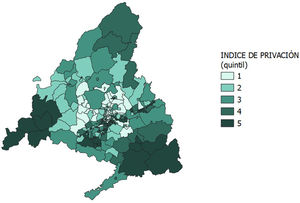
Las variables independientes sobre sexo, fecha y país de nacimiento se obtuvieron de la base de datos de tarjeta sanitaria. Otra variable de estudio fue el IP26, que se empleó como proxy del nivel socioeconómico. Se trata de una medida del grado de privación socioeconómica, creado por la Sociedad Española de Epidemiología (SEE) a través de una serie de indicadores extraídos del censo 2011, como son los porcentajes de población trabajadora manual, de población trabajadora eventual, de población en desempleo, de población con instrucción insuficiente, de población joven con instrucción insuficiente y de viviendas principales sin acceso a Internet. El IP de la SEE está desagregado por sección censal, en este estudio se calculó el IP por ZBS, obtenido por la media del IP de las secciones censales que incluye. Esta variable puede utilizarse como variable numérica continua o como variable ordinal si se categoriza, y tiene una interpretación ecológica. En este caso, se categorizó en quintiles, siendo el primer quintil aquel con menor nivel de privación socioeconómica y el quinto aquel con mayor nivel de privación.
AnálisisAunque existen 286 ZBS en la CAM, 19 de ellas son nuevas ZBS que no cuentan con ningún centro de salud, por lo que no tienen población adscrita por domicilio. Para el análisis ecológico, se asignó a cada una de estas ZBS los datos de cobertura vacunal de la ZBS contigua.
Se calcularon las coberturas de vacunación según el porcentaje de vacunados con al menos una, dos o tres dosis de vacuna MenB utilizando como numerador a los niños/as, nacidos entre 2016-2019 y con tarjeta sanitaria en la CAM, con MenB1d, MenB2d o MenB3d, según constaba en registro SISPAL vacunas; como denominador se incluyeron a todos los niños/as nacidos entre 2016-2019 que constaban en el repositorio poblacional CIBELES.
El análisis de factores asociados al estado vacunal se realizó mediante dos modelos de regresión logística, obteniéndose el odds ratio de estar vacunado con MenB2d (primovacunación) o con MenB3d (vacunación completa) en función del IP (categorizado en quintiles), ajustado por sexo y país de origen.
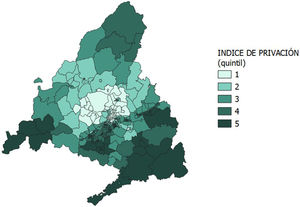
La distribución espacial de las coberturas vacunales con MenB2d y con MenB3d y del IP según las ZBS se describió mediante mapas de coropletas. Se realizó un suavizado espacial empirical bayes de los mismos, de manera que las coberturas de vacunación y el IP resultantes en cada ZBS serán las medias de los valores de la propia ZBS y de sus ZBS contiguas. Esto sirvió para identificar posibles patrones espaciales.
Además, se realizó un análisis exploratorio de autocorrelación espacial de cobertura por ZBS calculando el Índice de Morán y el estudio de clusters espaciales a nivel local mediante el Índice Local de Autocorrelación Espacial (LISA).
Se realizó un diagrama de dispersión para analizar si existe correlación entre la cobertura vacunal y el IP por ZBS.
Por último, se crearon 2 modelos de regresión espacial (spatial lag) para cuantificar la magnitud de la asociación entre cobertura de vacunación y el IP, teniendo en cuenta el espacio. El primer modelo utiliza como variable respuesta la cobertura vacunal con MenB2d, y el segundo emplea como variable respuesta la cobertura con MenB3d.
Para el manejo de datos y análisis estadístico se empleó el software STATA® v.15. Para el análisis espacial se utilizaron los sistemas de información geográfica de acceso libre QGIS y Geoda.
Consideraciones éticasDadas las características del estudio no fue posible recabar el consentimiento informado de los sujetos incluidos en el mismo. Toda la información utilizada procedía de bases de datos poblacionales, estaba anonimizada y se trató de manera confidencial, bajo el cumplimiento de la legislación vigente de protección de datos y del protocolo de trabajo de la Dirección General de Salud Pública, por el cual, al trabajar en el marco de uso de datos poblacionales con fines de Salud Pública, no requirió la valoración por un Comité de Ética.
ResultadosLa población de estudio estaba compuesta por un total de 232.901 niños y niñas.
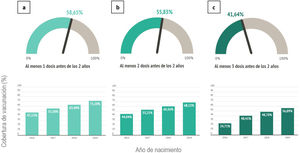
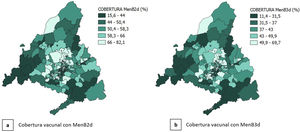
La cobertura de vacunación con MenB1d alcanzó un 58,65% en el total del periodo de estudio, observándose una evolución temporal creciente, ya que aumenta del 47% en los nacidos en 2016 al 71% en los nacidos en 2019. Con MenB2d se alcanzó un 55,83% en el total del periodo, pasando del 44% en la cohorte de 2016 al 68% en la de 2019. Con MenB3d se alcanzó un 41,64% de cobertura global, aumentando del 25% al 56% entre ambas cohortes (fig. 1).
En el análisis de factores asociados al estado vacunal, se encuentra asociación estadísticamente significativa entre el estado de vacunación y el IP. La probabilidad de estar vacunado en los niños cuyo domicilio se encuentra en ZBS del quinto quintil del IP (IP5) es 62% menor para MenB2d (OR ajustado: 0,38; IC 95%: 0,37-0,39; p<0,001) y 51% menor para MenB3d (OR ajustado: 0,49; IC 95%: 0,47-0,50; p<0,001) que aquellos cuyo domicilio se encuentra en ZBS del primer quintil del IP (IP1), independientemente del sexo y del país de origen. Se extraen asimismo de este análisis que existen diferencias estadísticamente significativas en cuanto a la probabilidad de estar vacunado según el país de origen, siendo esta notablemente menor en los niños y niñas de origen extranjero, respecto a la población originaria de España. No se encontraron diferencias estadísticamente significativas en la probabilidad de estar vacunado según el sexo (tabla 1).
Modelos de regresión logística: análisis de los factores asociados al estado vacunal de MenB
| MenB2d | MenB3d | |||||||
|---|---|---|---|---|---|---|---|---|
| ORa | Valor de p | IC 95% | Reducción observada (%) | ORa | Valor de p | IC 95% | Reducción observada (%) | |
| IP1 | ||||||||
| IP2 | 0,7651 | <0,001 | 0,7450; 0,7858 | 23,49 | 0,8609 | <0,001 | 0,8392; 0,8831 | 13,91 |
| IP3 | 0,7090 | <0,001 | 0,6915; 0,7269 | 29,10 | 0,8386 | <0,001 | 0,8188; 0,8589 | 16,14 |
| IP4 | 0,4756 | <0,001 | 0,4626; 0,4890 | 52,44 | 0,5759 | <0,001 | 0,5603; 0,5921 | 42,41 |
| IP5 | 0,3769 | <0,001 | 0,3666; 0,3875 | 62,31 | 0,4871 | <0,001 | 0,4738; 0,5009 | 51,29 |
| Sexo: varón | 0,9925 | 0,386 | 0,9757; 1,0096 | — | 0,9905 | 0,270 | 0,9739; 1,0074 | — |
| Lugar de origen: España | ||||||||
| Norte de África | 0,0178 | <0,001 | 0,0113; 0,0279 | 98,22 | 0,0198 | <0,001 | 0,0112; 0,0350 | 98,02 |
| Resto de África | 0,0464 | <0,001 | 0,0288; 0,0747 | 95,36 | 0,0358 | <0,001 | 0,0177; 0,0722 | 96,42 |
| América Central y del Sur | 0,0330 | <0,001 | 0,0292; 0,0747 | 96,70 | 0,0272 | <0,001 | 0,0228; 0,0325 | 97,28 |
| Resto de América | 0,1489 | <0,001 | 0,1316; 0,1685 | 85,11 | 0,1567 | <0,001 | 0,1347; 0,1823 | 84,33 |
| Filipinas | 0,0664 | <0,001 | 0,0286; 0,1543 | 93,56 | 0,0388 | <0,001 | 0,0095; 0,1589 | 96,12 |
| China | 0,2204 | <0,001 | 0,1733; 0,2804 | 77,96 | 0,2042 | <0,001 | 0,1518; 0,2747 | 79,58 |
| Resto de Asia | 0,0478 | <0,001 | 0,0354; 0,0646 | 95,22 | 0,0282 | <0,001 | 0,0169; 0,0471 | 97,18 |
| Países europeos occidentales | 0,1367 | <0,001 | 0,1206; 0,1593 | 86,33 | 0,1369 | <0,001 | 0,1417; 0,2303 | 86,31 |
| Rumanía | 0,1757 | <0,001 | 0,1437; 0,2148 | 82,43 | 0,1806 | <0,001 | 0,1417; 0,2303 | 81,94 |
| Resto de Europa | 0,1652 | <0,001 | 0,1482; 0,1842 | 83,48 | 0,2170 | <0,001 | 0,1921; 0,2451 | 78,30 |
| Desconocido | 0,1008 | 0,032 | 0,0125; 0,8161 | 89,92 | 0,1832 | 0,111 | 0,0228;1,4753 | — |
MenB2d: estado vacunal con al menos 2 dosis de vacuna frente a meningococo B recibidas antes de los 2 años de edad; MenB3d: estado vacunal con al menos 3 dosis de vacuna frente a meningococo B recibidas antes de los 2 años de edad; IC 95%: Índice de confianza del 95%; IP: índice de privación; IP1: primer quintil del IP; IP2: segundo quintil del IP; IP3: tercer quintil del IP; IP4: cuarto quintil del IP; IP5: quinto quintil del IP; ORa: odds ratio ajustado; p: nivel de significación estadística.
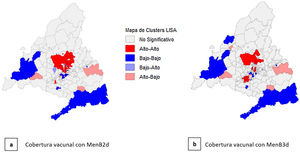
La distribución espacial por ZBS del IP y de la cobertura de vacunación con MenB2d y con MenB3d se muestra en las figuras 2 y 3. Se observa bastante heterogeneidad entre ZBS, sobre todo en la ciudad de Madrid, aunque se puede ver un predominio de IP alto y cobertura vacunal baja en la zona sur de la ciudad, así como en la zona sur y suroeste de la CAM.
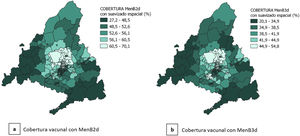
Al realizar el suavizado espacial (figs. 4 y 5), los patrones de distribución se homogeneizan: se observan índices de privación bajos y coberturas vacunales altas en la zona norte de la ciudad de Madrid y en los municipios al norte de esta, e índices de privación altos y coberturas vacunales bajas en el sur de la ciudad de Madrid y en las zonas más periféricas de la CAM, principalmente en las zonas sur y suroeste de la CAM.
El análisis exploratorio de datos espaciales realizado, muestra que existe una autocorrelación espacial moderada en cuanto a la cobertura vacunal, tanto con MenB2d (índice de Moran: 0,297) como con MenB3d (Índice de Moran: 0,225). En el estudio de clusters mediante LISA se encuentra que existen 39 ZBS para MenB2d y 24 ZBS para MenB3d con alta cobertura de vacunación rodeadas por otras ZBS con alta cobertura, principalmente en el norte de la ciudad de Madrid y los municipios al norte de ésta. Existen asimismo 31 ZBS para MenB2d y 24 ZBS para MenB3d con baja cobertura de vacunación rodeadas por otras ZBS con baja cobertura, en la zona sur de la ciudad de Madrid, así como en la zona sur y suroeste de la CAM (fig. 6).
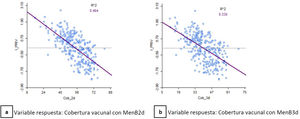
Existe una correlación inversa moderada entre el IP y la cobertura de vacunación de la ZBS, tanto con MenB2d (R2=0,464) como con MenB3d (R2=0,33) (fig. 7).
La regresión espacial muestra que por cada punto que aumenta el IP de la ZBS, disminuye la cobertura de vacunación con MenB2d en un 7,31% (p<0,001) y con MenB3d en un 5,44% (p<0,001), teniendo en cuenta el efecto espacial.
DiscusiónLa vacunación frente a la enfermedad meningocócica es una importante estrategia de salud pública cuya implementación debe ser asegurada. En este estudio se ve que, en los años previos a la introducción de la vacunación frente a MenB en el calendario del CISNS, la cobertura de vacunación entre la población infantil de la CAM alcanzó valores por encima de lo esperado al no estar incluida en el calendario sistemático, con una tendencia cada vez mayor. Esto habla de que existía entre la población no solo la aceptación de la vacuna, sino un interés creciente por ella.
En base a la evidencia existente, uno de los principales factores que potenciarían esta aceptación es el hecho de que los pediatras recomienden la vacunación27, así como la percepción de los padres o cuidadores de la susceptibilidad del lactante ante la enfermedad meningocócica28. Existen otros muchos factores que pueden influir en esta aceptación, como factores sociodemográficos, sociales, culturales y, por supuesto, socioeconómicos27,28. Resulta esperable que la cobertura de vacunación frente a meningococo B, que según los resultados de este estudio ya rozaba el 70% en primovacunación en la cohorte de 2019, aumente considerablemente tras la introducción de la vacuna en calendario. De hecho, dado que ciertas Comunidades Autónomas incluyeron esta vacuna en calendario con anterioridad, contamos con datos a nivel regional: en Andalucía, donde se inició la campaña de vacunación en 2021 para los nacidos entre octubre de 2021 y marzo 2022, se alcanzaron coberturas de primovacunación del 98% en esta cohorte29. Asimismo, contamos con la experiencia de otras vacunas. Por ejemplo, la vacuna antineumocócica conjugada, que es recomendada en edad infantil por los pediatras desde su comercialización en España en el año 200130, pero no fue incluida en el calendario de vacunación del CISNS hasta el año 201531. En los años previos a su introducción, las coberturas eran bajas (en torno al 46%)30 pero tras la misma, se alcanzaron coberturas de primovacunación del 95% en la cohorte de 2016 y de 97,7% en la de 201732.
Este estudio aporta además evidencia en cuanto a la relación entre el nivel socioeconómico y la vacunación frente a meningococo B, demostrando la existencia de una desigualdad en salud en el periodo previo a la inclusión de esta vacuna en calendario. Los resultados nos muestran que la probabilidad de estar vacunado frente a MenB con la pauta de primovacunación es un 62% menor para aquellos que residen en los barrios de menor nivel socioeconómico que para aquellos que residen en los barrios de mayor nivel socioeconómico. En la literatura se encuentran estudios a nivel internacional con evidencia en la misma línea. Un estudio realizado en Japón en 2018 muestra cómo los niños de familias más pobres tienen una probabilidad 51% menor de recibir vacunación frente a rotavirus, vacuna no financiada públicamente en ese país33. Ganczak et al. publicaron en 2013 un artículo que mostraba cómo en Polonia las familias de mayor nivel socioeconómico vacunaban 3,46 veces más a sus hijos e hijas con vacunas no financiadas públicamente que aquellas de menor nivel socioeconómico34.
Los criterios para modificar el calendario de vacunación fueron establecidos por la Ponencia de Programas y Registro de Vacunaciones en el año 2011. Se consideran cinco criterios de evaluación que, conjuntamente, proporcionan un marco para el análisis sistemático de los argumentos a favor y en contra de la inclusión y priorización de cambios en el programa de vacunación: carga de enfermedad, efectividad y seguridad de la vacuna, repercusiones de la modificación en el programa de vacunación, aspectos éticos y evaluación económica22.
Los resultados de este estudio sirvieron para fundamentar la decisión de incluir la vacuna frente a MenB en el calendario común de vacunación a lo largo de toda la vida recomendado para el año 2023, en cuanto a los aspectos éticos en los que podía repercutir esta decisión21 y respecto a los cuales no existía evidencia anteriormente en este contexto.
Como principales limitaciones de este estudio, cabe destacar que tanto la exclusión del estudio de los niños vacunados con otro tipo de cobertura sanitaria distinta a la sanidad pública madrileña —que suponen en torno a un 3% según datos del año 202135,36—, como el probable infrarregistro de vacunas en ese momento no incluidas en el calendario sistemático, hace pensar que las coberturas de vacunación puedan estar infraestimadas. Por otro lado, el hecho de que el IP fuese creado a partir de indicadores del censo del año 2011, hace que los datos relativos a éste puedan estar desactualizados. Asimismo, al tratarse de un estudio ecológico, debemos tener en cuenta el sesgo que esto puede acarrear. El análisis espacial realizado aporta datos de las ZBS en su conjunto, y por tanto es importante no realizar inferencia individual de los datos obtenidos para no incurrir en una falacia ecológica. Este estudio no analiza cómo otros factores socioculturales (religiosos, ideológicos…) pueden influir en la relación entre nivel socioeconómico y vacunación.
Sería recomendable reproducir este estudio como monitorización de la desigualdad, para comprobar que, efectivamente, el hecho de financiar la vacuna públicamente aumenta el acceso a la misma en los estratos socioeconómicos más bajos. De este modo se podría evaluar el impacto de la inclusión de la vacuna en calendario en términos de desigualdad en salud.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A mis tres maravillosas tutoras, por acompañarme de la mejor manera posible en mis inicios en la Salud Pública.