La leucemia linfoblástica aguda (LLA) se ha asociado a un exceso de variantes fenotípicas menores (VFM), que incluyen las variantes comunes y las anomalías menores, indicadoras de una fenogénesis alterada. El objetivo fue determinar la asociación entre VFM y LLA.
Pacientes y métodosEstudio de casos y controles basado en hospital de 120 niños con LLA y 120 niños sanos como grupo control, emparejados por edad y sexo, atendidos en el Hospital Civil de Guadalajara Dr. Juan I. Menchaca (México). En ambos grupos, se realizaron 28 mediciones antropométricas y la búsqueda sistemática de un listado de 405 VFM mediante un examen físico minucioso. Se estimaron las odds ratio ajustadas (ORa) con sus variables intervinientes por regresión logística. El intervalo de confianza fue del 95% (IC del 95%).
ResultadosLos signos antropométricos asociados con LLA fueron: segmento superior largo (ORa=2,19; IC del 95%, 1,01-4,76), mandíbula ancha (ORa=2,62; IC del 95%, 1,29-5,30), pabellones estrechos (ORa=6,22, IC95%: 2,60-14,85) y teletelia (ORa=2,53; IC del 95%m 1,07-5,98). Las VFM hipoplasia mesofacial, frente ancha, nariz pequeña, columnela corta, pabellones estrechos, teletelia, línea Sídney, pie griego y manchas café con leche (MCL) tuvieron una frecuencia de 3 a 17 veces mayor en los niños con LLA. Por número, encontramos asociación a partir de ≥ 4 VFM (ORa=2,14; IC del 95%, 1,25-3,66; p=0,004).
ConclusionesA partir de ≥ 4 VFM, se encontró asociación con LLA, lo que indica la existencia de factores prenatales en la fenogénesis y leucemogénesis. Confirmamos las MCL y la línea Sídney como VFM asociada a niños con LLA.
Acute lymphoblastic leukemia (ALL) has been associated with an excess of minor phenotypic variants (MPV), including common variants and minor anomalies, indicative of an altered phenogenesis. The objective of the study was to determine the association between MPV and ALL.
Patients and methodsIn a hospital based case-control study, we studied 120 children with ALL (including standard and high risk) and 120 healthy children as a control group, matched for age and sex, seen in the Hospital Civil de Guadalajara Dr. Juan I. Menchaca (Guadalajara, Mexico). In both groups, 28 anthropometric measurements were made, as well as a systematic search for 405 MPV, through a physical examination. Adjusted odds ratio was estimated (aOR) with its intervening variables by logistic regression. The confidence interval was 95% (95%CI).
ResultsAnthropometric signs associated with ALL were: long upper segment (aOR= 2.19, 95%CI: 1.01-4.76), broad jaw (aOR= 2.62, 95%CI: 1.29-5.30), narrow ears (aOR= 6.22, 95%CI: 2.60-14.85), and increase in internipple distance (aOR= 2.53, 95%CI: 1.07-5.98). The hypoplasia mesofacial, broad forehead, small nose, short columella, narrow ears, telethelia, Sydney crease (SC), Greek type feet and café-au-lait spots (CALS), had a 3 to 17 times higher frequency in children with ALL. By number, an association was found from ≥4 MPV (aOR= 2.14, 95%CI: 1.25-3.66, P=.004).
ConclusionsFrom ≥4 MPV, an association was found with ALL, suggesting prenatal factors in phenogenesis and leukemogenesis. CALS and SC were confirmed as MPV in children with ALL.
Las anormalidades morfológicas, según la propuesta integradora de Merks et al.1, se clasifican en: a) anomalías mayores, que incluyen las malformaciones (defectos en la embriogénesis) y otras anormalidades no malformativas, como las deformaciones severas, disrupciones y las displasias, y b) variantes fenotípicas menores (VFM) o defectos de la fenogénesis, subdivididas según su prevalencia en la población general en anomalías menores (AM) (≤ 4%) y variantes comunes (VC) (> 4%). Diferentes tipos de anormalidades morfológicas han sido asociadas con diversos tipos de cáncer infantil, aunque estos trabajos han sido enfocados principalmente a las anomalías mayores, tanto en forma aislada en síndromes (p. ej., aniridia y tumor de Wilms en el complejo WAGR), como no sindrómicas (p. ej., cardiopatías congénitas y malformaciones del tracto pancreático-digestivo con leucemias, o malformaciones del sistema nervioso central y tumores cerebrales)2–5. Además, es bien conocida la predisposición a cáncer en aneuploidías (leucemia linfoblástica aguda [LLA] en el síndrome de Down)6, síndromes por microdeleciones/duplicaciones (tumor de Wilms y otros tumores embrionarios en el síndrome de Wiedemann-Beckwith)7 y en varias entidades monogénicas con inestabilidad cromosómica (leucemia en la anemia de Fanconi)8. Los estudios sobre anomalías mayores en niños con cáncer2–4,6–15 identifican esta clara asociación y han contribuido significativamente al conocimiento de los genes participantes, tanto de la carcinogénesis como la organogénesis, aunque la etiología para muchas de estas asociaciones continúa siendo elusiva y tienen como inconveniente el haber sido realizados sobre la base de expedientes médicos individuales, registros poblacionales o entrevistas telefónicas.
De igual importancia, aunque menos estudiadas, las VFM son características físicas fácilmente reconocibles que afectan mínimamente al desarrollo normal de un niño y que pueden servir como indicadores de una fenogénesis alterada y también indicar, por lo tanto, el origen prenatal de un determinado cáncer16–24. A diferencia de las anomalías mayores, el estudio de las VFM requiere de un examen físico externo minucioso y de mediciones antropométricas en cada paciente, pero tienen como inconveniente el que muchas VFM son evaluadas de manera subjetiva y son referidas según una terminología y clasificación variables25,26. Los estudios de asociación entre las VFM y diferentes tipos de tumores sólidos en niños18,23 y neoplasias hematológicas16,19–21,27,28 concuerdan en que estos niños presentan un exceso en el número de VFM, sin lograr consenso aún en cuanto a los tipos específicos o los patrones de VFM asociados. Las leucemias agudas son la principal neoplasia en los niños y en México se estima que se diagnostican entre 1.000 y 1.200 casos nuevos de este cáncer pediátrico cada año29, correspondiendo a la LLA el mayor porcentaje. El objetivo de este estudio fue evaluar clínica y antropométricamente la asociación informada entre la presencia de VFM (incluyendo AM y VC) y LLA, en pacientes atendidos en una unidad de alta especialidad, acreditada para la atención en Hematología para pacientes del Seguro Popular, del Gobierno de México.
Pacientes y métodosCaracterísticas de la muestraCon un diseño de casos y controles basado en hospital, se estudió a niños con diagnóstico de LLA (incluyendo riesgo alto y estándar) tratados en la Clínica de Leucemias del Servicio de Hematología y Oncología Pediátrica del Hospital Civil de Guadalajara Dr. Juan I. Menchaca (Guadalajara, México) durante el periodo comprendido entre 2009 y 2012. La muestra de estudio incluyó como casos a 120 niños con LLA no sindrómica, es decir, no afectados por ninguna entidad genética. La confirmación del tipo de leucemia se realizó en todos los casos sobre la base de la morfología en el frotis de médula ósea, citometría de flujo y citogenética, siguiendo los criterios de diagnóstico y clasificación de la Organización Mundial de la Salud (2008)30. Los datos oncológicos fueron obtenidos del expediente hospitalario y los demás antecedentes se obtuvieron mediante un interrogatorio a la madre por uno de los investigadores entrenado para tal fin. En el grupo control, se incluyó a 120 niños considerados como sanos por sus madres, sin dismorfias aparentes ni problemas del desarrollo y con una historia personal y familiar negativa para cáncer, seleccionados de manera aleatoria simple entre los hermanos y hermanas que acompañaron a otros niños que acudieron a la consulta externa de Pediatría de nuestro hospital por alguna afección infecciosa aguda y que fueran del mismo sexo y edad que los casos.
Evaluación antropométricaEn cada uno de los sujetos de estudio se realizaron 28 diferentes mediciones antropométricas para evaluar morfotipo, cráneo, cara, tronco y extremidades, que incluyeron: peso (P), talla (T), segmento superior (SS), segmento inferior (SI), perímetro cefálico (PC), diámetros cefálicos anteroposterior, biparietal y bicigomático, longitudes suprafacial, mesofacial, infrafacial y total de cara, anchura mandibular, distancia intercantal interna y externa, fisuras palpebrales, anchura de pabellones auriculares, longitud de columnela nasal, distancia interalar, longitud de filtrum, distancia intercomisural, longitud total del miembro torácico, longitud de la mano, longitud total del miembro pélvico, longitud del pie, perímetro torácico, distancia interpezones y longitud del esternón. Todas las mediciones fueron realizadas por una misma persona (SAEP), previo entrenamiento y estandarización. Se utilizaron los instrumentos apropiados para cada medición: infantómetro, estadiómetro de pared, básculas pediátrica y de piso, cinta métrica no distendible, antropómetro y calibrador tipo vernier. Las técnicas de medición y los valores de referencia para el P, la T, el SS, el SI y el PC fueron acordes a Ramos-Galván31 y para el resto, se utilizaron las incluidas en las compilaciones antropométricas de Hall et al.32 y Lapunzina y Aiello33, interpretadas cada una de ellas de acuerdo con los límites de normalidad para cada medición por edad y sexo.
Evaluación de las variantes morfológicas menoresEn presencia de uno de los padres, se realizó un examen físico minucioso y sistemático en cada caso y su control, dirigido a la detección de VFM. Utilizamos un listado de VFM modificado del propuesto por Merks et al.1 para registrar la presencia o ausencia de 405 variantes físicas (132 VC y 273 AM), agrupadas en 29 regiones corporales. Las definiciones utilizadas para cada una de las VFM estudiadas fueron tomadas de fuentes dismorfológicas convencionales34,35. Todas las AM y VC estudiadas, cumplieron el requisito de poder ser evaluadas plenamente mediante un examen externo, el cual fue realizado por médicos con experiencia en dismorfología clínica. No se incluyeron anomalías mayores internas, ya que estas requieren de evaluaciones complementarias al examen físico.
Análisis estadísticoLos promedios de las mediciones antropométricas se compararon con la t de Student. Las frecuencias de las características demográficas y de las anormalidades fenotípicas se contrastaron con la prueba de la chi al cuadrado. La asociación entre el tipo y el número de VFM con LLA se midió con la odds ratio (OR). El efecto de las variables intervinientes sobre la asociación entre el tipo y el número de VFM con LA se evaluó con regresión logística. En todos los cálculos estadísticos, el intervalo de confianza elegido fue del 95% (IC del 95%).
La investigación fue aprobada por los Comités de Ética e Investigación de nuestro hospital y se obtuvo el consentimiento informado para participar en el estudio a todos los sujetos de estudio.
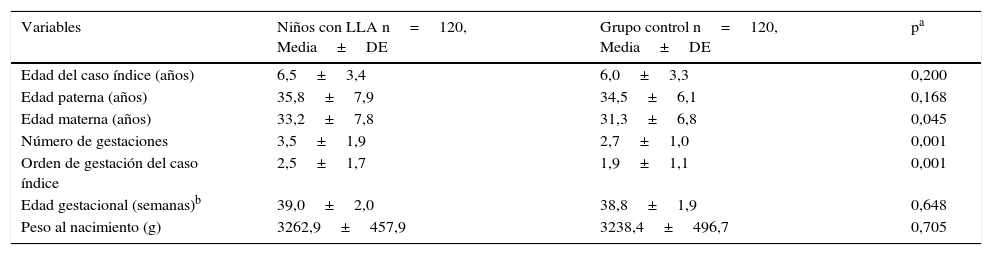
ResultadosDe los 120 pacientes con LLA, 71 fueron varones (59,2%) y 49 mujeres (40,8%), y el grupo control tuvo igual número de participantes, todos eran población mestiza. De las características sociodemográficas y los antecedentes de los sujetos de estudio, destacan que los niños con LLA ocuparon un mayor orden de gestación, sus madres tuvieron un mayor promedio de edad, mayor número de gestaciones y una menor frecuencia de consumo de tabaco, mientras que los padres de niños con LLA tuvieron una mayor frecuencia de escolaridad baja. Las demás características sociodemográficas y antecedentes de los sujetos de estudio se distribuyeron de manera semejante en los 2 grupos de estudio (tabla 1).
Características sociodemográficas y antecedentes de los sujetos de estudio
| Variables | Niños con LLA n=120, Media±DE | Grupo control n=120, Media±DE | pa |
|---|---|---|---|
| Edad del caso índice (años) | 6,5±3,4 | 6,0±3,3 | 0,200 |
| Edad paterna (años) | 35,8±7,9 | 34,5±6,1 | 0,168 |
| Edad materna (años) | 33,2±7,8 | 31,3±6,8 | 0,045 |
| Número de gestaciones | 3,5±1,9 | 2,7±1,0 | 0,001 |
| Orden de gestación del caso índice | 2,5±1,7 | 1,9±1,1 | 0,001 |
| Edad gestacional (semanas)b | 39,0±2,0 | 38,8±1,9 | 0,648 |
| Peso al nacimiento (g) | 3262,9±457,9 | 3238,4±496,7 | 0,705 |
| n (%) | n (%) | ||
|---|---|---|---|
| Peso al nacimiento (g) | |||
| < 2.500 | 6/105 (5,7) | 5/113 (4,4) | 0,449 |
| 2.500-2.999 | 22/105 (20,9) | 23/113 (20,3) | 0,523 |
| 3.000-3.999 | 71/105 (67,6) | 81/113 (71,7) | 0,307 |
| ≥ 4.000 | 6/105 (5,7) | 4/113 (3,5) | 0,329 |
| Escolaridad materna | |||
| ≤ 7 años | 53/120 (44,2) | 40/120 (33,3) | 0,118 |
| 7-12 años | 43/120 (35,8) | 42/120 (35,0) | 1,000 |
| ≥ 12 años | 24/120 (20,0) | 38/120 (31,7) | 0,055 |
| Enfermedad materna crónica | 13/120 (10,8) | 9/120 (7,5) | 0,502 |
| Consumo materno de alcohol | 16/120 (13,3) | 11/120 (9,2) | 0,413 |
| Consumo materno de tabaco | 7/120 (5,8) | 18/120 (15,0) | 0,035 |
| Escolaridad paterna | |||
| < 7 años | 60/120 (50,0) | 39/115 (33,9) | 0,018 |
| 7-12 años | 41/120 (34,2) | 45/115 (39,1) | 0,513 |
| ≥ 12 años | 19/120 (15,8) | 31/115 (26,9) | 0,054 |
| Enfermedad paterna crónica | 13/120 (10,8) | 4/117 (3,4) | 0,050 |
| Consumo paterno de alcohol | 59/119 (49,6) | 49/117 (41,8) | 0,290 |
| Consumo paterno de tabaco | 15/119 (12,6) | 21/117 (17,9) | 0,336 |
| Consanguinidad | 6/120 (5,0) | 1/120 (0,8) | 0,059 |
DE: desviación estándar; LLA: leucemia linfoblástica aguda.
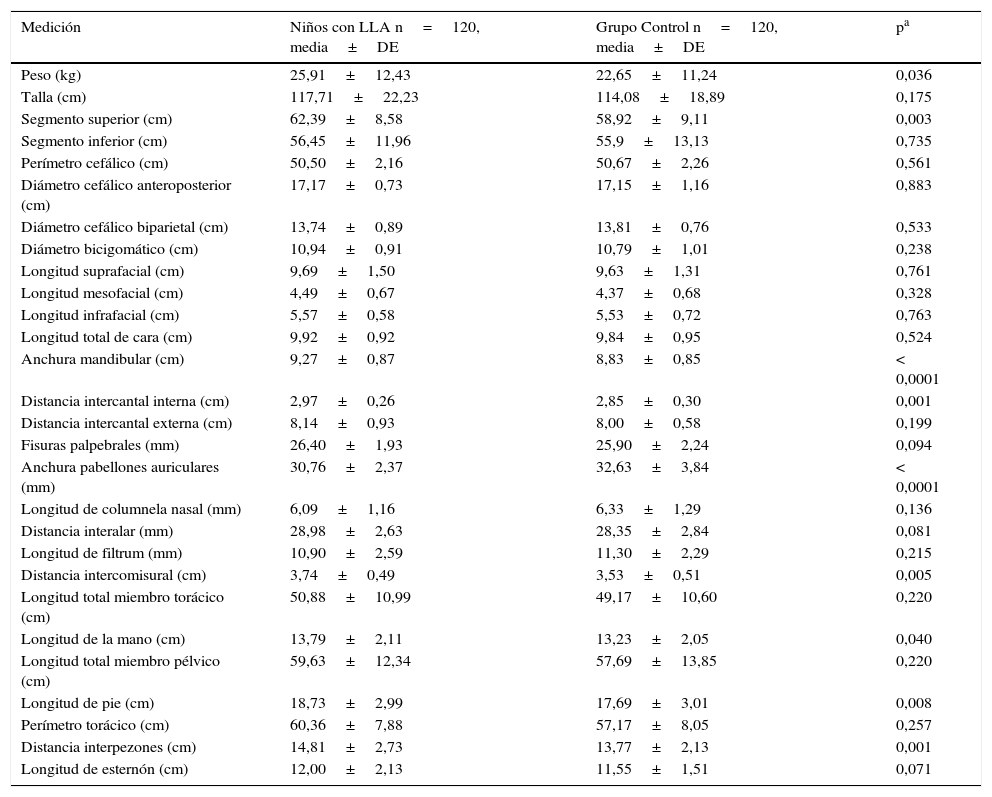
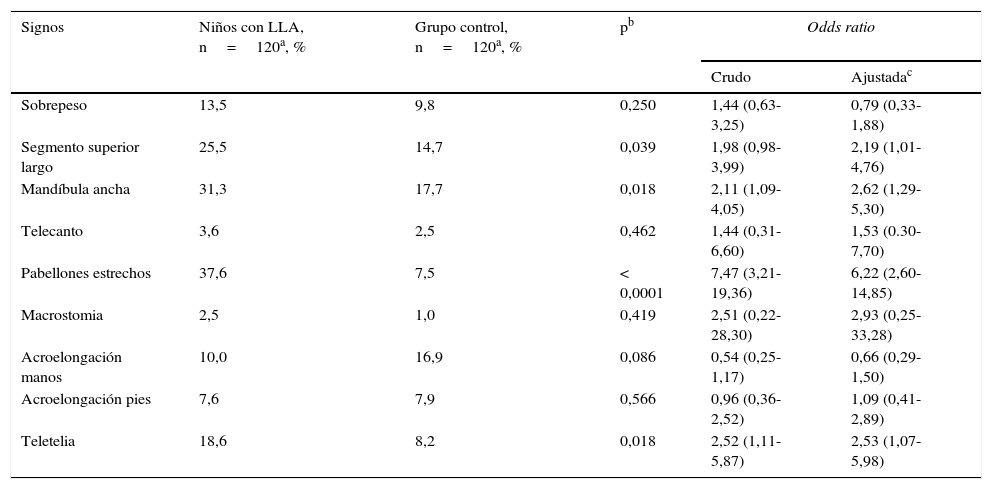
De las 28 mediciones antropométricas realizadas en ambos grupos, solo 9 mostraron diferencias estadísticas significativas en los niños con LLA (tabla 2). Excluyendo las mediciones en las que se identificó una variación extrema, estas 9 mediciones fueron posteriormente traducidas a 9 signos clínicos derivados de su interpretación antropométrica31–33 y se observó que 3 mostraron asociación con LLA en el análisis bivariado (tabla 3). Se construyó un modelo multivariado con regresión logística con el método de introducción forzosa, que incluyó la edad, el sexo y el P al nacimiento como variables intervinientes y mostró que sus OR ajustadas permanecieron siendo significativas solo para el SS largo, la mandíbula ancha, los pabellones auriculares estrechos y la teletelia (tabla 3).
Mediciones antropométricas en niños con leucemia y su grupo control
| Medición | Niños con LLA n=120, media±DE | Grupo Control n=120, media±DE | pa |
|---|---|---|---|
| Peso (kg) | 25,91±12,43 | 22,65±11,24 | 0,036 |
| Talla (cm) | 117,71±22,23 | 114,08±18,89 | 0,175 |
| Segmento superior (cm) | 62,39±8,58 | 58,92±9,11 | 0,003 |
| Segmento inferior (cm) | 56,45±11,96 | 55,9±13,13 | 0,735 |
| Perímetro cefálico (cm) | 50,50±2,16 | 50,67±2,26 | 0,561 |
| Diámetro cefálico anteroposterior (cm) | 17,17±0,73 | 17,15±1,16 | 0,883 |
| Diámetro cefálico biparietal (cm) | 13,74±0,89 | 13,81±0,76 | 0,533 |
| Diámetro bicigomático (cm) | 10,94±0,91 | 10,79±1,01 | 0,238 |
| Longitud suprafacial (cm) | 9,69±1,50 | 9,63±1,31 | 0,761 |
| Longitud mesofacial (cm) | 4,49±0,67 | 4,37±0,68 | 0,328 |
| Longitud infrafacial (cm) | 5,57±0,58 | 5,53±0,72 | 0,763 |
| Longitud total de cara (cm) | 9,92±0,92 | 9,84±0,95 | 0,524 |
| Anchura mandibular (cm) | 9,27±0,87 | 8,83±0,85 | < 0,0001 |
| Distancia intercantal interna (cm) | 2,97±0,26 | 2,85±0,30 | 0,001 |
| Distancia intercantal externa (cm) | 8,14±0,93 | 8,00±0,58 | 0,199 |
| Fisuras palpebrales (mm) | 26,40±1,93 | 25,90±2,24 | 0,094 |
| Anchura pabellones auriculares (mm) | 30,76±2,37 | 32,63±3,84 | < 0,0001 |
| Longitud de columnela nasal (mm) | 6,09±1,16 | 6,33±1,29 | 0,136 |
| Distancia interalar (mm) | 28,98±2,63 | 28,35±2,84 | 0,081 |
| Longitud de filtrum (mm) | 10,90±2,59 | 11,30±2,29 | 0,215 |
| Distancia intercomisural (cm) | 3,74±0,49 | 3,53±0,51 | 0,005 |
| Longitud total miembro torácico (cm) | 50,88±10,99 | 49,17±10,60 | 0,220 |
| Longitud de la mano (cm) | 13,79±2,11 | 13,23±2,05 | 0,040 |
| Longitud total miembro pélvico (cm) | 59,63±12,34 | 57,69±13,85 | 0,220 |
| Longitud de pie (cm) | 18,73±2,99 | 17,69±3,01 | 0,008 |
| Perímetro torácico (cm) | 60,36±7,88 | 57,17±8,05 | 0,257 |
| Distancia interpezones (cm) | 14,81±2,73 | 13,77±2,13 | 0,001 |
| Longitud de esternón (cm) | 12,00±2,13 | 11,55±1,51 | 0,071 |
DE: desviación estándar; LLA: leucemia linfoblástica aguda.
Signos antropométricos asociados a niños con leucemia linfoblástica aguda
| Signos | Niños con LLA, n=120a, % | Grupo control, n=120a, % | pb | Odds ratio | |
|---|---|---|---|---|---|
| Crudo | Ajustadac | ||||
| Sobrepeso | 13,5 | 9,8 | 0,250 | 1,44 (0,63-3,25) | 0,79 (0,33-1,88) |
| Segmento superior largo | 25,5 | 14,7 | 0,039 | 1,98 (0,98-3,99) | 2,19 (1,01-4,76) |
| Mandíbula ancha | 31,3 | 17,7 | 0,018 | 2,11 (1,09-4,05) | 2,62 (1,29-5,30) |
| Telecanto | 3,6 | 2,5 | 0,462 | 1,44 (0,31-6,60) | 1,53 (0.30-7,70) |
| Pabellones estrechos | 37,6 | 7,5 | < 0,0001 | 7,47 (3,21-19,36) | 6,22 (2,60-14,85) |
| Macrostomia | 2,5 | 1,0 | 0,419 | 2,51 (0,22-28,30) | 2,93 (0,25-33,28) |
| Acroelongación manos | 10,0 | 16,9 | 0,086 | 0,54 (0,25-1,17) | 0,66 (0,29-1,50) |
| Acroelongación pies | 7,6 | 7,9 | 0,566 | 0,96 (0,36-2,52) | 1,09 (0,41-2,89) |
| Teletelia | 18,6 | 8,2 | 0,018 | 2,52 (1,11-5,87) | 2,53 (1,07-5,98) |
LLA: leucemia linfoblástica aguda.
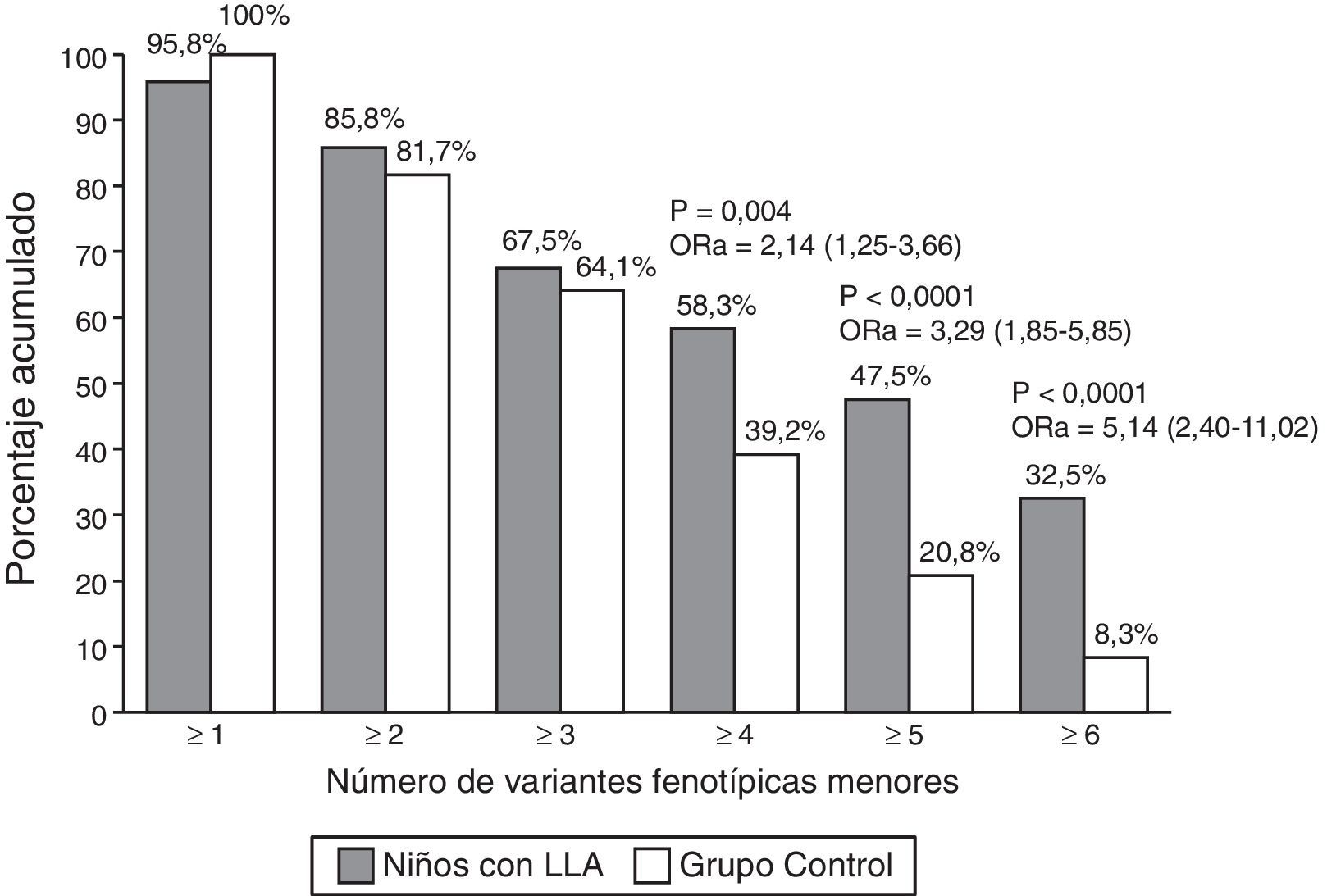
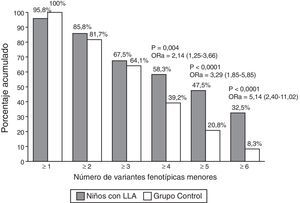
El número total de VFM encontradas en el grupo de niños con LLA (incluyendo VC y AM) fue de 629 (media ± desviación estándar de 5,6 ± 3,3 por paciente) vs. 497 (media de 4,2 ± 1,7 por niño) en el grupo control (p < 0,0001). La comparación de los porcentajes acumulados de niños de ambos grupos con una o más y hasta 6 o más VFM (fig. 1) mostró diferencias significativas solo a partir de la presencia de 4 o más VFM en los niños con LLA y sus OR ajustadas para edad y sexo fueron de 2 a 5 veces mayores que en el grupo control.
Porcentaje acumulado de variantes morfológicas menores (VFM). Se presentan las odds ratio de los porcentajes de VFM que tuvieron una presentación de 2 a 7 veces mayor en los niños con LLA con respecto a los niños del grupo control y en todas ellas el valor de p fue menor de 0,05. ORa=odds ratio ajustada (intervalo de confianza del 95%).
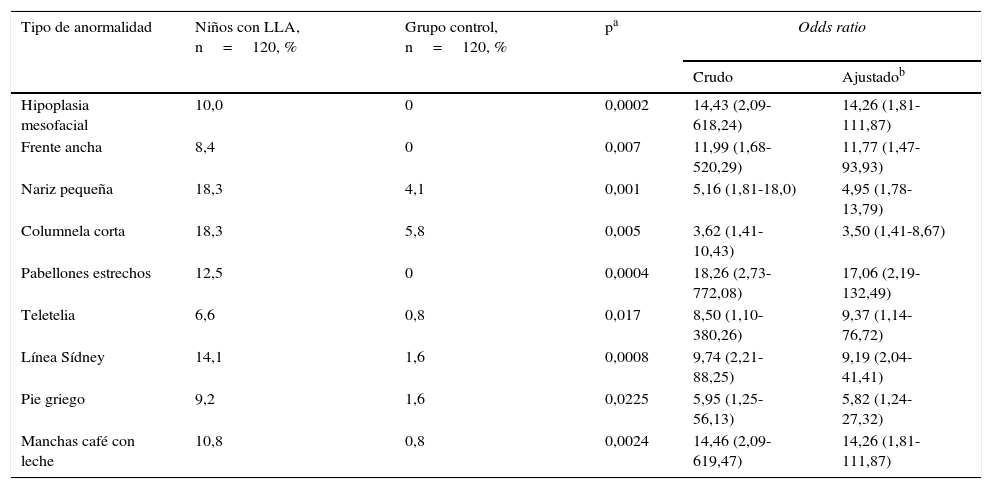
En el análisis bivariado hubo 9 VFM observadas al examen físico que ocurrieron de 3 a 17 veces más en los niños con LLA que en los controles y cuyo análisis multivariado mostró solo cambios marginales en la fuerza de asociación (tabla 4). Por tipo de VFM, la hipoplasia mesofacial, los pabellones estrechos y la teletelia correspondieron a AM y el resto fue VC. Aunque también se encontró asociación entre LLA y las VFM pelo ralo, pelo seco, carrillos prominentes y piel seca, no las incluimos en la tabla 4, ya que las atribuimos al tratamiento recibido o bien a la enfermedad. Para el resto de las frecuencias de VFM evaluadas, no encontramos asociación con la presencia de LLA.
Variantes fenotípicas menores asociadas a niños con leucemia aguda
| Tipo de anormalidad | Niños con LLA, n=120, % | Grupo control, n=120, % | pa | Odds ratio | |
|---|---|---|---|---|---|
| Crudo | Ajustadob | ||||
| Hipoplasia mesofacial | 10,0 | 0 | 0,0002 | 14,43 (2,09-618,24) | 14,26 (1,81-111,87) |
| Frente ancha | 8,4 | 0 | 0,007 | 11,99 (1,68-520,29) | 11,77 (1,47-93,93) |
| Nariz pequeña | 18,3 | 4,1 | 0,001 | 5,16 (1,81-18,0) | 4,95 (1,78-13,79) |
| Columnela corta | 18,3 | 5,8 | 0,005 | 3,62 (1,41-10,43) | 3,50 (1,41-8,67) |
| Pabellones estrechos | 12,5 | 0 | 0,0004 | 18,26 (2,73-772,08) | 17,06 (2,19-132,49) |
| Teletelia | 6,6 | 0,8 | 0,017 | 8,50 (1,10-380,26) | 9,37 (1,14-76,72) |
| Línea Sídney | 14,1 | 1,6 | 0,0008 | 9,74 (2,21-88,25) | 9,19 (2,04-41,41) |
| Pie griego | 9,2 | 1,6 | 0,0225 | 5,95 (1,25-56,13) | 5,82 (1,24-27,32) |
| Manchas café con leche | 10,8 | 0,8 | 0,0024 | 14,46 (2,09-619,47) | 14,26 (1,81-111,87) |
LLA: leucemia linfoblástica aguda.
En referencia a los estudios de asociación clínica mediante el uso de VFM, Méhes et al.27 enfatizan la importancia de hacerlos con la más estricta objetividad posible y recomiendan el uso de una lista que recuerde al examinador la presencia o ausencia de cada VFM e idealmente, su evaluación antropométrica en búsqueda de correspondencias con el examen físico, considerando la posible influencia de factores como el grupo étnico, el sexo, la edad o variaciones familiares y, además, tener cuidado de no incluir sujetos con síndromes reconocibles. Tomando en cuenta casi todos estos elementos, nuestros resultados apoyan la hipótesis referente a la existencia de un factor etiológico o patogénico común entre el desarrollo fetal y la leucemogénesis16–23, aunque limitados aún en cuanto al tipo específico de VFM. Otros factores de riesgo reportados para LLA36, como la edad de la madre, las exposiciones durante el embarazo o el peso al nacimiento de los niños que desarrollaron la LLA, junto a fuertes evidencias genéticas, como la disrupción del gen mixed lineage leukemia (¿ MLL?) en niños menores de un año de edad con LLA37, apoyan también este inicio in utero. Con respecto a dichos factores, las madres de los niños con LLA de nuestro estudio fueron más añosas, tenían un mayor número de gestaciones y, por lo tanto, los niños con LLA ocuparon un mayor orden de nacimiento dentro de sus respectivas hermandades (tabla 1). Von Behren et al.38 atribuyen este riesgo al mayor tiempo que los óvulos permanecen expuestos a potenciales agentes ambientales desconocidos.
Debido a que la LLA es el cáncer más frecuente en la infancia29, consideramos justificado su estudio por separado en relación con las VFM. Las diferencias entre los estudios previos18–21,27 en cuanto al tamaño muestral (de 49 a 195 pacientes con LLA), el número de VFM estudiadas (de 55 a 405) o su tipo (solo AM, o VC y AM) dificultan la comparación de resultados. El uso de un listado que incluyó a la casi totalidad de las VC y AM conocidas en el humano1 explica el que en nuestro estudio encontráramos un mayor número de VFM. Pese a estas limitaciones, los trabajos previos18–21,27 y el nuestro concuerdan en que los niños con leucemia tienen un exceso de VFM, lo que indica que uno o más factores prenatales causan tanto las VFM como el cáncer, aunque no han permitido identificar de manera concluyente los tipos de VFM asociadas. Las VFM que parecen emerger por mostrar asociación o diferencias estadísticamente significativas en niños con leucemia en al menos 2 o más estudios incluyen: variaciones de los pliegues de flexión palmar18,21, nevos pigmentados19,20 y las manchas café con leche (MCL)19,20,27, mientras que el hipertelorismo, el epicanto, la sinofridia, el paladar alto y arqueado, las orejas de implantación baja, el lóbulo auricular ausente, la sindactilia, la clinidactilia y el hallux valgus son VFM reportadas en un solo estudio21. La línea Sídney es una variación de los pliegues de flexión palmar originalmente descrita en niños con leucemia por Menser y Purvis-Smith, y es una característica dependiente de la edad39, definida como una prolongación del pliegue palmar proximal hasta el borde cubital de la palma. Nuestros resultados, junto a los de Méhes et al.18 y Durmaz et al.21, permiten identificarla como una característica morfológica asociada a niños con leucemia. La asociación reportada con MCL19,20,27,28 observada también por nosotros, ha sido confirmada en ausencia de neurofibromatosis u otras entidades asociadas a MCL7,8. La asociación entre MCL y leucemia resulta interesante, ya que también ilustra la sobreposición fenotípica que existe entre los pacientes con cáncer multifactorial y los síndromes monogénicos con cáncer, hecho que podrá contribuir a la identificación futura de genes causales2,7,8. Mediante análisis estadístico progresivo Merks et al.16 identificaron 2 patrones de anormalidades morfológicas en niños con cáncer: a) el patrón blefarofimosis (junto con angulación anteroposterior incrementada de la columna, hipopigmentación cutánea en parches y MCL múltiples), y b) el patrón de extremidades inferiores asimétricas (junto con talla alta, hipoplasia mediofacial o malar hipoplásico, ptosis y pectus excavatum o carinatum). Al respecto, resaltamos nuevamente las MCL y la hipoplasia mesofacial como hallazgos vistos también en nuestro estudio. También encontramos que pocos trabajos han incluido una evaluación antropométrica para la definición de la presencia de las diferentes VFM. Méhes et al.18 reportan una significativa mayor frecuencia de microcefalia en niños con leucemia; sin embargo, dicho hallazgo no fue confirmado en nuestro estudio, ni tampoco la talla alta reportada por Merks et al.16. Aunque no observada en los trabajos previos16,18, resaltamos la presencia de pabellones estrechos y teletelia observadas en el examen físico y confirmadas antropométricamente dentro de nuestro estudio (tablas 3 y 4), ya que pueden constituir elementos de reproducibilidad para ser considerados como otros signos candidatos con asociación a LLA.
En cuanto a su significado, Méhes y Kosztolányi40 consideran que las anormalidades fenotípicas constituyen una manifestación clínica de la inestabilidad genómica que causa el cáncer, aunque deben ser consideradas como asociaciones no específicas. El concepto de inestabilidad genómica también se relaciona con la ocurrencia familiar del cáncer y sus trastornos acompañantes, ya sean inmunitarios, no inmunitarios, del crecimiento, desarrollo, reproducción y envejecimiento prematuro, ya que estos son inherentes, o están asociados y sobrepuestos, al desarrollo de las neoplasias malignas18,27,40. Como conclusión, los hallazgos de nuestro trabajo y los previamente publicados en la literatura indican que la asociación de los patrones específicos de VFM en niños con leucemia es de carácter preliminar y se requiere de estudios futuros que incluyan las nuevas tecnologías genéticas para diferenciar aquellas variaciones con un verdadero significado patogénico o etiológico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.