Introducción
En los últimos años han aumentado los aislamientos de Mycobacterium tuberculosis multirresistente en algunas zonas del mundo1. En España, el aumento de la inmigración procedente de países que no cuentan con programas para el control de la enfermedad ha favorecido la aparición de cepas multirresistentes2. Los niños inmigrantes y los adoptados procedentes de países con altas tasas de resistencia representan un grupo especialmente vulnerable2. Sin embargo disponemos de pocos datos sobre la situación en España de niños con tuberculosis multirresistente (TB-MDR), encontrando tan sólo descripciones de casos aislados en la literatura especializada3-5. Nuestro estudio representa la primera serie publicada en España en niños. En ella describimos las características clínicas y epidemiológicas de 8 pacientes, así como el tratamiento y seguimiento realizados.
Material y métodos
Se realiza un estudio retrospectivo, revisando las historias clínicas de pacientes menores de 15 años diagnosticados de enfermedad tuberculosa multirresistente en 3 hospitales de referencia de Madrid durante un período de 12 años (de enero de 1994 a diciembre de 2005). Se definió enfermedad tuberculosa como la presencia de signos radiológicos o síntomas de tuberculosis activa según los criterios de la Organización Mundial de la Salud (OMS)6, acompañados o no del aislamiento de M. tuberculosis en una muestra clínica. Se definió multirresistencia como la resistencia demostrada al menos a isoniazida y rifampicina (H y R)1. Los criterios de inclusión fueron: a) pacientes con enfermedad tuberculosa en los que se aisló M. tuberculosis multirresistente; b) pacientes con enfermedad tuberculosa sin aislamiento microbiológico que debutaron tras convivir con enfermo bacilífero diagnosticado de TB-MDR.
El diagnóstico microbiológico se realizó mediante tinción fluorescente con auramina o Ziehl-Neelsen y cultivo en medios sólidos (Coletsos-Biomedics) y sistema automatizado de medios líquidos (BacT/Alert, BioMérieux, Francia) específicos para micobacterias. La identificación de los aislados se realizó mediante técnicas de hibridación con sondas específicas del complejo tuberculoso (Accuprobe, GenProbe) y los estudios de sensibilidad se realizaron mediante el método de las proporciones. El estudio de resistencias a H y R se realizó de forma rutinaria en todas las cepas aisladas desde el año 2000.
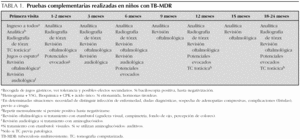
Todos los pacientes fueron seguidos durante al menos 18 meses, realizándose controles clínicos mensuales y controles analíticos, radiológicos, estudio de potenciales evocados, revisiones oftalmológicas y/o audiológicas sucesivas (tabla 1). Para asegurar el correcto cumplimiento terapéutico y vigilar la toxicidad, todos los niños ingresaron durante un mínimo de 3 semanas. Posteriormente el seguimiento se realizó mediante estrecho control ambulatorio y a partir del año 2002 mediante terapia directamente observada (TDO) con el programa de la Cruz Roja.
Resultados
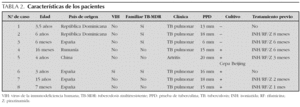
Desde el año 1994 fueron diagnosticados 8 casos de enfermedad tuberculosa multirresistente (7 tuberculosis pulmonares y 1 artritis tuberculosa). La edad media de los pacientes fue de 4 años (rango: 6 meses-15 años). Siete niños eran inmunocompetentes y uno presentaba infección por el virus de la inmunodeficiencia humana (VIH). El 50 % de los niños eran inmigrantes (tabla 2). Cuatro pacientes (50 %) convivían con familiares con TB-MDR (tabla 2). En 3 casos, los familiares habían sido diagnosticados previamente a la primera consulta. En el cuarto caso, el familiar estaba pendiente del resultado del estudio de resistencias, confirmándose posteriormente el diagnóstico de TB-MDR. Dos de los 4 pacientes en los que no se identificó fuente de contagio presentaban factores de riesgo al proceder de zonas con alta tasa de TB-MDR (China y Rumanía).
Los motivos de consulta fueron: tos y síndrome febril prolongado (4), contacto con enfermo bacilífero (3) y tumefacción articular (1). Se realizó radiografía y tomografía computarizada (TC) torácica en todos los pacientes observándose adenopatías hiliares, paratraqueales o mediastínicas (5), lesión cavitada en lóbulo superior derecho (1), infiltrado en lóbulo superior derecho sin adenopatías (1) e infiltrado perihiliar (1). En la TC articular de la paciente con artritis se observó derrame con engrosamiento sinovial, destrucción del cartílago articular, irregularidades articulares tibioastragalinas y depósitos de calcio. La prueba de tuberculina fue positiva en todos los casos, presentando una induración media de 15 mm (rango: 6-20 mm) (tabla 2). La única paciente vacunada de bacilo de Calmette-Guérin (BCG) procedía de la República Dominicana, tenía 6 años y presentó una induración de 18 mm. La baciloscopia (tinción de Ziehl-Neelsen o auramina) fue positiva en jugo gástrico en 2 de los 7 casos de tuberculosis pulmonar y en la muestra de biopsia sinovial. Sólo se realizó reacción en cadena de la polimerasa (PCR) para M. tuberculosis en la muestra de biopsia sinovial siendo positiva. En 5 pacientes se aisló M. tuberculosis multirresistente (tabla 2). Los aislamientos se obtuvieron en muestras de jugo gástrico (5) y biopsia sinovial (1). En la paciente con artritis el aislamiento se obtuvo tanto en la muestra de biopsia sinovial como en jugo gástrico. En 3 pacientes no se obtuvo aislamiento, aunque todos habían convivido con enfermos diagnosticados de TB-MDR (tabla 2). Las cepas aisladas en los pacientes o en el caso índice fueron en 2 casos resistentes a H y R, en cuatro a H, R y estreptomicina (S), y en uno a H, R, S y pirazinamida (Z). El paciente procedente de Rumanía presentó resistencia a 11 fármacos (tabla 3). Se realizó estudio de epidemiología molecular en la cepa aislada de líquido articular, identificándose una cepa Beijing.
Seis pacientes recibieron inicialmente tratamiento con H, R y Z durante una media de 4,3 meses (rango: 1-8 meses) sin observarse mejoría clínica (tabla 2). El tratamiento una vez conocido el estudio de resistencias se administró durante una media de 15,1 meses (rango: 12-18 meses) (tabla 3). Siete casos recibieron tratamiento con 4 o 5 fármacos efectivos según el estudio de sensibilidades obtenido y un paciente con resistencia a 11 fármacos recibió tratamiento con 3 fármacos durante 18 meses (tabla 3).
En 2 casos se realizó TDO mediante el programa de la Cruz Roja Española, consistente en la visita de trabajadores sociales al domicilio cinco veces por semana para garantizar el adecuado cumplimiento terapéutico, así como en el acompañamiento de los pacientes en las revisiones clínicas y realización de pruebas.
La tolerancia a la medicación fue buena en todos los casos. Se observaron efectos secundarios en el 50 % de los casos (4/8): aumento de creatinfosfocinasa (1) y tendinitis transitoria del aquíleo (1) por levofloxacino, alteración discreta de potenciales evocados visuales sin repercusión clínica tras tratamiento con etambutol (1) y psicosis transitoria por cicloserina (1) que se resolvió tras suspender la medicación. Durante el seguimiento se realizaron controles radiológicos comprobándose la resolución de los hallazgos previos en 5 casos y persistencia de lesiones residuales en los otros 3 pacientes: atelectasia de lóbulo superior derecho (1), pequeñas bronquiectasias bibasales (1) y adenopatía hiliar calcificada (1).
Una paciente precisó lobectomía pulmonar por presentar lesión cavitada de mala evolución y hemoptisis persistente. La paciente procedente de China regresó a su país tras 12 meses de tratamiento, por lo que no se pudo completar su seguimiento. En el momento de la última revisión presentaba mejoría clínica franca con disminución de la inflamación articular y mejoría de la movilidad. Todos los demás pacientes evolucionaron satisfactoriamente hacia la curación.
Discusión
En la última década se ha producido un aumento de cepas multirresistentes de M. tuberculosis en determinadas zonas del mundo1,2. En el año 2000, el 3,4 % de los nuevos casos de tuberculosis fueron producidos por estas cepas1. Los países del este de Europa, determinadas regiones de China y algunos países de Sudamérica representan las zonas donde este incremento es más alarmante1, observándose una incidencia de TB-MDR de hasta el 14,2 %2. La mayor parte de las resistencias son secundarias, adquiridas tras la selección de cepas en pacientes con mal cumplimiento terapéutico. La multirresistencia primaria es la más frecuente en niños, ya que son pacientes infectados inicialmente por una cepa resistente.
La inmigración procedente de áreas de riesgo se ha incrementado en España y, aunque la incidencia global de tuberculosis está disminuyendo7-9, la aparición de cepas resistentes en la población inmigrante está aumentando de manera significativa10-12, oscilando la tasa de resistencias primarias en esta población entre el 13 y el 33,3 %10,13. Según datos de la OMS, el 1,2 % de los nuevos casos de tuberculosis en el año 2004 en España fueron multirresistentes14. Además, la media de edad de los pacientes inmigrantes con tuberculosis es significativamente menor que la de pacientes autóctonos, afectando predominantemente a niños y a jóvenes12. Esta población es especialmente vulnerable, por el mayor riesgo que presentan los niños de desarrollar enfermedad después del contagio15.
Sin embargo, disponemos de pocos estudios que aporten datos sobre el tratamiento de TB-MDR en la edad pediátrica16 y carecemos de datos concretos sobre la situación en España, no existiendo ninguna serie española publicada sobre TB-MDR en niños y encontrando tan sólo descripciones de casos aislados en la literatura médica3-5. La dificultad en el diagnóstico es uno de los principales problemas. Hasta en un 70 % de los casos no es posible obtener aislamiento microbiológico17 y por tanto, realizar estudio de sensibilidades. La naturaleza paucibacilar de la primoinfección tuberculosa1 y la baja rentabilidad del cultivo de jugo gástrico impiden frecuentemente la confirmación de la enfermedad. Por estos motivos, es necesario realizar una búsqueda exhaustiva del foco primario de infección para identificar la cepa responsable e instaurar un tratamiento basado en el estudio de sensibilidades16,18.
También es fundamental sospechar la presencia de resistencias en pacientes con determinados factores de riesgo1, e instaurar un tratamiento adecuado lo más precozmente posible. El retraso en el inicio de un tratamiento correcto se asocia a aumento en el número de complicaciones y peor evolución17. Ante una tuberculosis en un niño inmigrante o adoptado procedente de áreas con alta tasa de resistencias debemos considerar la posibilidad de resistencias primarias, aunque no identifiquemos el contacto con un adulto enfermo17. En nuestra serie el 50 % de los niños eran inmigrantes y dos de ellos, en los que no se identificó familiar enfermo, procedían de países con alta tasa de multirresistencia, Rumanía (2,8 %)19 y China (6,6 %)1. En estos niños se recomienda iniciar tratamiento con 4 fármacos hasta obtener el estudio de resistencias1. Sin embargo, tres de nuestros pacientes inmigrantes acudieron a nuestra consulta habiendo recibido inicialmente una pauta inadecuada con 3 fármacos. Otros grupos de riesgo son los niños convivientes con adultos infectados por el VIH20 y los niños con mala evolución clínica o cultivos positivos persistentes tras 2 meses de tratamiento antituberculoso17.
El tratamiento de la TB-MDR en pediatría se ve dificultado por la ausencia de ensayos clínicos que determinen la eficacia y toxicidad de fármacos de segunda línea, los regímenes terapéuticos y la duración adecuada de los mismos1,16. La aparición de cepas multirresistentes obliga a sustituir la H y R por otros fármacos de menor eficacia1, debiendo utilizar pautas que incluyan al menos 3 fármacos con sensibilidad comprobada para la cepa aislada1,18, dos de los cuales deben tener actividad bactericida1. Estos tratamientos deben mantenerse de forma prolongada, aumentando por tanto la aparición de efectos secundarios1 e incrementando los costes2. No existen evidencias en pediatría sobre terapia intermitente en TB-MDR, por lo que debemos realizar un régimen de tratamiento diario1.
La duración del tratamiento representa otra cuestión controvertida16,17. En adultos se recomienda mantener el tratamiento entre 18 y 24 meses tras la negativización de cultivos21. En niños no existe una duración establecida, aunque la mayor parte de los autores recomiendan mantener el tratamiento al menos 12 meses a partir de la negativización del cultivo, utilizando pautas prolongadas (18-24 meses)1,16. Sin embargo, encontramos en la literatura médica series de niños con tuberculosis pulmonar multirresistente no cavitada tratados con pautas de 9 meses y evolución satisfactoria17,18.
La ausencia de formulaciones pediátricas, así como de datos sobre la seguridad de algunos medicamentos en tratamientos prolongados dificulta la elección de la pauta terapéutica1. La aparición de toxicidad tras la utilización de fármacos de segunda línea no es despreciable, siendo sin embargo menor que la observada en adultos15,16. En una serie pediátrica reciente, Drobac et al16 describen un 42 % de efectos adversos, aunque todos los casos mejoraron tras tratamiento sintomático o ajuste de dosis. En nuestro estudio un 50 % de los casos mostraron algún tipo de toxicidad, aunque sólo en 2 pacientes (25 %) ésta tuvo repercusión clínica. Además la tolerancia a la medicación parece ser mejor en niños pequeños y lactantes que en adolescentes y adultos16.
En los regímenes terapéuticos de TB-MDR debemos incluir aquellos fármacos de primera elección a los que la cepa sea sensible1 y con los que se tenga mayor experiencia en niños, como Z o etambutol (E). Este último es considerado fundamental para el tratamiento de enfermedad MDR22, y ha sustituido a la S, que presenta además mayores tasas de resistencia1. Se recomienda la utilización inicial de dosis bactericidas (25 mg/kg/día) hasta la negativización de cultivos, reduciendo posteriormente la dosis a 15 mg/kg/día1. La toxicidad ocular secundaria a este fármaco en niños es similar a la observada en adultos23,24, aunque su aparición es poco frecuente cuando se utilizan dosis de 15 mg/kg/día25. Otros fármacos muy utilizados por su actividad bactericida son la amikacina y las quinolonas. La amikacina no presenta resistencia cruzada con la S1 y en adultos se utiliza con frecuencia durante los primeros 4-6 meses de tratamiento1. Su principal inconveniente es la necesidad de administración parenteral y el control seriado de sus niveles plasmáticos para evitar la aparición de nefrotoxicidad y ototoxicidad. Las quinolonas pueden tener efectos secundarios musculoesqueléticos26, aunque en general son poco frecuentes, leves y transitorios y suelen aparecer en las primeras semanas de tratamiento26. Se han utilizado en niños con TB-MDR durante períodos prolongados sin presentar efectos adversos8,20. Por estos motivos, debemos considerarlas como un pilar fundamental en el tratamiento1, siendo el principal fármaco bactericida de segunda elección de administración oral16. Las nuevas quinolonas como moxifloxacino y levofloxacino tienen mayor actividad bactericida por lo que deben ser de elección en estos casos1.
En pacientes con múltiples resistencias, la elección de 3 fármacos de segunda línea puede ser complicada. En ellos, la administración de H en altas dosis (15-20 mg/kg/ día) puede ser beneficiosa, ya que algunas cepas presentan resistencias de bajo nivel, siendo sensibles a este fármaco a dosis superior a la habitual1. Sin embargo, debemos tener en cuenta que este tipo de resistencia suele ir asociado con resistencia a etionamida. Otros fármacos de segunda línea como cicloserina, ácido paraaminosalicílico (PAS) o amoxicilina-ácido clavulánico pueden presentar efectos secundarios gastrointestinales con mayor frecuencia y son peor tolerados1. El linezolid es un nuevo fármaco con acción bactericida demostrada in vitro1 y utilizado actualmente en el tratamiento de adultos con TB-MDR, aunque su experiencia en niños es aún reducida.
Para asegurar el cumplimiento del tratamiento se recomienda realizar TDO1. De esta manera, mejoraremos el pronóstico y evitaremos la aparición de nuevas resistencias16. Igualmente, la existencia de personal especializado y con experiencia responsable del seguimiento de estos pacientes, favorecerá la vigilancia de aparición de efectos secundarios16.
Correspondencia: Dra. A. Méndez Echevarría.
Unidad de Infectología Pediátrica. Hospital Infantil La Paz.
P.º de la Castellana, 261. 28046 Madrid. España.
Correo electrónico: amendezes@yahoo.es
Recibido en octubre de 2006.
Aceptado para su publicación en abril de 2007.