Las dificultades alimentarias y los trastornos digestivos son frecuentes en pacientes con enfermedades neurológicas, como el síndrome de Rett (SR). Pueden alterar el crecimiento y ocasionar malnutrición. El objetivo del presente estudio fue caracterizar el estado nutricional y gastrointestinal de un grupo de niñas con SR y evaluar los beneficios de la intervención clínica.
Pacientes y métodosSobre la base de un protocolo previamente diseñado, los autores procedieron a la evaluación nutricional y gastrointestinal de 25 niñas con SR con mutación identificada del gen MECP2. Se realizó una intervención individualizada y posteriormente se revaluaron 7 pacientes.
ResultadosSe identificaron dificultades alimentarias en 11 pacientes (44%) y solamente una paciente era parcialmente independiente para la autoalimentación. El índice de masa corporal (IMC) fue inferior al P5 en el 40% de las pacientes. Los principales trastornos gastrointestinales fueron el estreñimiento (75%) y el reflujo gastroesofágico (RGE) (32%). La anemia ferropénica se identificó en el 12% de las pacientes y la deficiencia en hierro y ferritina fue baja en otro 12%. El 44% de las pacientes presentó hipocalcemia. Después de la intervención, todas las niñas revaluadas obtuvieron una mejoría del IMC, del estreñimiento y de los síntomas del RGE.
ConclusionesEl tratamiento de los pacientes con SR necesita un equipo multidisciplinario que debe incluir a gastroenterólogos y a nutricionistas. La identificación precoz de trastornos nutricionales y digestivos y su tratamiento individualizado contribuyen a mejorar la calidad de vida de estos pacientes.
Feeding difficulties and digestive disturbances are common in patients with neurological disorders, particularly Rett syndrome. They may compromise weight and growth, often leading to malnutrition. The aim of the present study was to characterize the nutritional and gastrointestinal status of a group of children with Rett syndrome and to evaluate the benefits of clinical intervention.
Patients and methodsBased on a previously designed protocol, the authors performed gastrointestinal and nutritional assessment of 25 girls with Rett syndrome with identified MECP2 mutation. Intervention was performed individually and a subsequent evaluation involved 7 patients.
ResultsFeeding problems were present in 11 patients (44%), and only one had partial self-feeding ability. Body mass index (BMI) was under the 5th percentile in 40%. Constipation (75%) and gastroesophageal reflux (32%) were the main gastrointestinal problems. Iron deficient anemia was present in 12% and iron deficiency/low ferritin in another 12%. Hypocalcemia occurred in 44%. After therapeutic intervention all the girls re-evaluated showed improvements in BMI, constipation and gastroesophageal reflux symptoms.
ConclusionsManagement of patients with Rett syndrome requires a multidisciplinary team that should include Gastroenterologists. Individually tailored feeding strategies are essential to provide adequate nutrition. Early identification of nutritional and gastrointestinal disturbances and their proper management contribute to the improvement in the quality of life of these patients.
El síndrome de Rett (SR) es un trastorno del neurodesarrollo definido clínicamente mediante criterios establecidos en 1988 por el Rett Syndrome Criteria Work Group y revisados en 20021,2. Su etiología se identificó en 1999 tras la identificación de mutaciones del gen MECP2, codificador de la proteína 2 de fijación de la metil-citosinaguanosina, localizado en el Xq283. Desde entonces, los pacientes que cumplen los criterios revisados de diagnóstico pueden dividirse en 2 grupos: aquellos pacientes con SR con una mutación del gen MECP2 (SRm) y aquellos pacientes con SR sin una mutación identificada (SR0).
Se han publicado varios estudios relativos a las alteraciones nutricionales y gastrointestinales en pacientes con SR independientemente de la identificación de una mutación del gen MECP24–20. En este trabajo, los pacientes incluidos en esas publicaciones se designarán como pacientes con SR (incluidos, por tanto, pacientes con SRm y SR0).
Se han descrito trastornos nutricionales y gastrointestinales en aproximadamente el 80% de los pacientes con SR. Su gravedad suele ser paralela a la de la afectación neurológica y puede conducir a malnutrición, fallo de medro, caquexia y hasta la muerte4,7,11,14,21. Son varios los factores que pueden estar en el origen de los trastornos digestivos, y su fisiopatología aún no se ha esclarecido. Típicamente, los pacientes pierden la capacidad de autoalimentación cuando se presentan las estereotipias manuales y cuando la función práxica de las manos desaparece.
Son frecuentes los trastornos de la masticación y de la deglución (posiblemente relacionados con la disminución de los movimientos voluntarios de la lengua media y posterior), los movimientos involuntarios de la lengua, el paso rápido de los alimentos de la boca a la faringe y el retraso de la fase orofaríngea de la deglución; todo esto conduce a una disfunción orofaríngea grave11,15. Estos trastornos parecen ser más frecuentes con los alimentos líquidos, como se observa en los pacientes afectados de parálisis cerebral infantil14. Los trastornos de la masticación y de la deglución, asociados a un tono oral anormal y a una disfunción gastroesofágica, contribuyen al atragantamiento, a la disfagia y al reflujo gastroesofágico (RGE) que se presentan comúnmente en el SR. Por otra parte, en particular ante la presencia de las irregularidades respiratorias frecuentemente observadas en el SR, los trastornos digestivos representan un riesgo considerable de aspiración y de infecciones respiratorias11,12.
El estreñimiento es el trastorno gastrointestinal más común del SR, y ocurre en hasta el 85% de los pacientes15,16. Su etiología es multifactorial y se relaciona con alteraciones del tono muscular, actividad física disminuida, factores dietéticos y algunos factores terapéuticos.
Aunque la prevalencia de RGE en pacientes con SR no se ha establecido claramente, es uno de los problemas comúnmente referidos8,14,15,19.
El fallo de medro y los trastornos nutricionales se han relacionado con ingesta reducida, saldo energético negativo y enfermedad gastrointestinal, todos frecuentes en el SR9,13.
El objetivo del presente estudio es la caracterización de los trastornos nutricionales y gastrointestinales en un grupo de pacientes con SR y la evaluación del efecto de medidas preventivas y terapéuticas.
Material y métodosSe realizó una evaluación nutricional y gastrointestinal en un grupo de 25 pacientes con SRm.
La misma neuropediatra (T. Temudo) había observado y filmado previamente a todas las pacientes que habían completado un protocolo previamente diseñado. Se analizaron muestras de sangre de las pacientes y de sus progenitores: se extrajo el ácido desoxirribonucleico genómico con el uso del Puregene DNA isolation kit (Gentra, Minneapolis, MN, EE. UU.). La región codificadora y los límites exon-intron del gen MECP2 se amplificaron por PCR (polymerase chain reaction 'reacción en cadena de la polimerasa') y se secuenciaron. Se utilizó el método RD-PCR (PCR de dosificación robusta) como se ha descrito previamente para la identificación de reordenamientos grandes en el gen MECP222. Los cebadores y las condiciones de la PCR están disponibles si se solicitan.
Se han clasificado y agrupado las mutaciones del gen MECP2 para su análisis de acuerdo con lo siguiente: a) tipo de alteración de la secuencia: missense (cambio de sentido) o truncante (incluido nonsense [sin sentido] y frameshift [de cambio de fase o pauta de lectura], pero también grandes deleciones) y b) ubicación de la mutación (dominio afectado): dominio de represión transcripcional y dominio de ligación metil-CpG.
La evaluación clínica de las pacientes se basó en un protocolo previamente diseñado. Las pacientes se clasificaron respecto a la progresión de la enfermedad de acuerdo con el sistema de puntuación de Pineda que incluye datos clínicos actuales y anteriores —edad de inicio, microcefalia, sentarse sin apoyo, deambulación, lenguaje, epilepsia, función respiratoria, uso de las manos e inicio de estereotipias— y a cada uno de éstos se le atribuye una puntuación de gravedad creciente2,23,24. Se documentaron los signos de malnutrición y de dismotilidad digestiva en el examen físico. Se evaluaron las medidas antropométricas —peso, talla e índice de masa corporal (IMC)— y se compararon con las tablas del CDC (Centers for Disease Control ‘Centros para el Control de las Enfermedades’)25.
El RGE se diagnosticó sobre la base de los síntomas clínicos y con pHmetría cuando los síntomas no eran claros. El estreñimiento se definió de acuerdo con los criterios de Roma III26,27. Se consideraron dificultades alimentarias un tiempo de alimentación prolongado (superior a 30min), la incapacidad para la autoalimentación y la presencia de comportamientos anormales a la hora de las comidas, como tos o atragantamiento.
Las investigaciones de laboratorio incluyeron hemograma completo, perfil de hierro (Fe) y de lípidos, aminotransferasas, proteínas, albúmina del suero, función renal, sodio (Na), potasio (K), cloro (Cl), calcio (Ca), fósforo, vitaminas D y B12, y ácido fólico.
Se estableció un plan terapéutico individualizado con atención a los problemas nutricionales y digestivos identificados sobre la base de la ingesta alimentaria que comunicaron los padres y de la evaluación clínica y de laboratorio. La ingesta calórica se incrementó a través de ajustes en los alimentos, por ejemplo en su contenido lipídico, y con el suplemento con dextrinomaltosa. Se evaluó la capacidad de autoalimentación y la función oro motriz (masticación y deglución), en función de ésta se ajustaron la consistencia, la textura de los alimentos, la posición y el apoyo de la cabeza y del cuello durante las comidas, y se propusieron métodos alternativos de alimentación.
Las pacientes se revaluaron en un intervalo de 3 meses. Los datos se recogieron en el Epi InfoTM (versión 3.4.1 CDC, Atlanta, EE. UU.) y se analizaron con la prueba exacta de Fisher mediante el programa SPSS 12.0 para Windows (rel. 09-08-2003, Chicago, SPSS Inc.).
El Comité de Ética del hospital aprobó el protocolo. Se obtuvo el consentimiento informado de los padres para recoger la sangre y para tomar y usar vídeos y fotografías.
ResultadosSe evaluó a 25 pacientes de sexo femenino con SR (tabla 1). La mediana de edad en la primera evaluación fue de 7,4 años (media de 8,4, rango de 2 a 17,8). El 56% de las niñas tenía epilepsia y había recibido tratamiento con uno o más de los siguientes antiepilépticos: ácido valproico, carbamacepina y lamotrigina.
Resumen de las características de las pacientes
| Paciente, n | Edad (años) | Estadio | Marcador | Mutación | Tipo de mutación | Marcha | Escoliosis | Epilepsia | Autoalimentación | Dificultades alimentarias | P del IMC | Marcador Z del IMC | Estreñimiento | RGE |
| 1 | 7,4 | iii | 9 | R306C | Missense | Sí | Sí | Sí | No | No | 94,38 | 1,59 | Sí | No |
| 2 | 5,6 | ii | 9 | R294X | Truncante | Sí | Sí | Sí | No | No | 9,06 | −1,34 | Sí | No |
| 3 | 11,2 | ivA | 13 | R294X | Truncante | No | Sí | Sí | No | Sí | 0,65 | −2,48 | Sí | Sí |
| 4 | 9,9 | iii | 9 | R168X | Truncante | Sí | No | No | No | Sí | 0,04 | −3,32 | Sí | No |
| 5 | 17,0 | ivA | 15 | K39fsX43 | Truncante | No | Sí | Sí | No | Sí | 3,00 | −1,88 | Sí | Sí |
| 6 | 10,2 | iii | 7 | T158M | Missense | Sí | Sí | No | No | No | 0,82 | −2,40 | Sí | No |
| 7 | 4,3 | iii | 11 | R294X | Truncante | Sí | No | Sí | No | No | 10,54 | −1,25 | No | No |
| 8 | 6,0 | iii | 18 | R168X | Truncante | No | Sí | Sí | No | Sí | 5,49 | −1,60 | Sí | Sí |
| 9 | 8,9 | iii | 4 | R133C | Missense | Sí | No | No | No | Sí | 0,00 | −5,36 | Sí | No |
| 10 | 7,9 | iii | 11 | T158M | Missense | Sí | Sí | Sí | Sí | Sí | 97,07 | 1,89 | Sí | No |
| 11 | 2,0 | ii | 10 | R270X | Truncante | Sí | No | No | No | No | 28,13 | −0,58 | Sí | No |
| 12 | 7,4 | iii | 14 | T158M | Missense | Sí | Sí | Sí | No | Sí | 62,11 | 0,31 | No | Sí |
| 13 | 7,3 | iii | 15 | R106W | Missense | No | Sí | Sí | No | Sí | 62,75 | 0,33 | Sí | Sí |
| 14 | 16,3 | ivB | 17 | Deleción de todo el gen | Truncante | No | Sí | No | No | No | 12,99 | −1,13 | Sí | No |
| 15 | 7,2 | iii | 14 | Deleción l de exones 3 y 4 | Truncante | Sí | Sí | Sí | No | No | 4,82 | −1,66 | No | Sí |
| 16 | 2,4 | iii | 14 | S113P; P251P | Missense | No | Sí | Sí | No | No | 48,70 | −0,03 | Sí | No |
| 17 | 2,4 | iii | 15 | R168X | Truncante | No | No | No | No | No | 1,46 | −2,18 | Sí | No |
| 18 | 4,2 | iii | 6 | R306H | Missense | Sí | No | No | No | No | 48,01 | −0,05 | Sí | No |
| 19 | 17,8 | ivB | 16 | R168X | Truncante | No | Sí | Sí | No | No | 30,82 | −0,50 | Sí | No |
| 20 | 6,4 | iii | 13 | V300fsX318 | Truncante | Sí | No | No | No | No | 20,09 | −0,84 | Sí | No |
| 21 | 13,9 | ivB | 17 | P322A | Missense | Sí | Sí | No | No | Sí | 29,33 | −0,54 | Sí | Sí |
| 22 | 3,1 | iii | 13 | T158M | Missense | No | No | No | No | No | 14,53 | −1,06 | Sí | No |
| 23 | 12,3 | iii | 11 | R133C | Missense | No | Sí | Sí | No | No | 48,73 | −0,03 | No | No |
| 24 | 4,5 | iii | 8 | R294X | Truncante | Sí | No | Sí | No | Sí | 71,97 | 0,58 | No | No |
| 25 | 4,8 | iii | 9 | R133C | Missense | No | No | No | No | Sí | 60,31 | 0,26 | No | Sí |
IMC: índice de masa corporal; RGE: reflujo gastroesofágico.
Se identificaron dificultades alimentarias en la masticación y la deglución, así como regurgitación nasal y oral en el 44% de las pacientes. Estos problemas se observaron en diferentes edades, desde el período neonatal hasta la edad de 14 años (mediana de 24,0 meses, media de 38,2 meses). Se recomendó el fraccionamiento de los alimentos, la disminución del tiempo de las comidas y evitar alimentos masticables que se sustituyeron por papillas. Sólo una paciente (caso 10) tenía capacidad de autoalimentación, aunque solamente parcial.
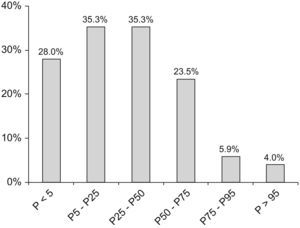
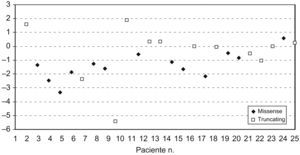
El 56% de las pacientes tenía el peso en el rango normal (P5–P95), el 40% estaba por debajo del P5 y el 1% estaba por encima del P95. El marcador Z para el peso osciló entre −6,77 y 1,7 (mediana de −1,1). En el 32% de las pacientes la estatura estaba por debajo del P5 y en el 64% de las pacientes estaba entre el P5 y el P95. La estatura de una paciente (caso 17) estaba por encima del P95, lo que corresponde a una desviación estándar de +3,15. El IMC se encontraba en el rango normal en el 68% de las pacientes y por debajo del P5 en el 28% de las pacientes (fig. 1). El marcador Z del IMC (fig. 2) osciló entre -5,36 y 1,9 (mediana de −0,8, media de −0,9).
Siete pacientes se evaluaron más de una vez (tabla 2). En todas se observó una mejoría del estado nutricional, como lo demuestra una desviación positiva del marcador Z del IMC (rango de 0,43 [caso 21] a 1,96 [caso 8]).
Evolución de las pacientes revaluadas
| Paciente, n | Edad (años) | Estadio | Tipo de mutación | Evolución del marcador Z del IMC* | Mejoría del estreñimiento | Mejoría del RGE |
| 2 | 5,6 | ii | Truncante | 1,47 | Sí | NA |
| 6 | 10,2 | iii | Missense | 0,60 | Sí | NA |
| 7 | 4,3 | iii | Truncante | 0,67 | NA | NA |
| 8 | 6,0 | iii | Truncante | 1,96 | Sí | Sí |
| 9 | 8,9 | iii | Missense | 0,87 | Sí | NA |
| 21 | 13,9 | ivB | Missense | 0,43 | Sí | Sí |
| 22 | 3,1 | iii | Missense | 1,05 | Sí | NA |
IMC: índice de masa corporal; NA: no aplicable; RGE: reflujo gastroesofágico.
No se encontró correlación entre un IMC bajo o su marcador Z y el estadio o la gravedad de la enfermedad y el tipo de mutación (missense frente a truncante) (tabla 3).
El estreñimiento fue el problema gastrointestinal más común, y ocurrió en el 76% de las pacientes. No hubo correlación entre él y la independencia para deambular, la escoliosis, la epilepsia, el marcador de gravedad de la enfermedad o el tipo de mutación. La mayoría de las pacientes con estreñimiento (84,2%) se había medicado anteriormente para este problema con dieta rica en fibras, lactulosa y enemas, pero el cumplimiento había sido deficiente. Se reforzaron las medidas y se subrayó la necesidad de una dieta rica en fibras y líquidos. Se prescribió lactulosa a todas las pacientes. En el 68,8%, debido a la gravedad del estreñimiento, se prescribió un curso inicial de 3 días de bisacodilo. En la revaluación se observó una mejoría en todas las pacientes, reflejada en una mayor frecuencia de defecación y de heces más blandas.
Los síntomas de RGE estaban presentes en el 32% de las pacientes. A 2 niñas (casos 8 y 11), con síntomas no claros, se les realizó una monitorización del pH esofágico durante 24h. A todas se les recomendó un abordaje conservador y a aquéllas a las que les realizó pHmetría se las trató con metoclopramida. Ambas se revaluaron y mostraron mejoría clínica. Se encontró una relación estadísticamente significativa entre la puntuación de gravedad de la enfermedad y la presencia de RGE (p = 0,02).
No se encontró correlación entre las dificultades alimentarias, el estreñimiento o el RGE y el tipo de mutación.
Tres pacientes (12%) (casos 12, 20 y 21) tenían anemia ferropénica y otras 3 pacientes (12%) (casos 11, 16 y 18) tenían valores bajos de Fe y ferritina. Su percentil de IMC osciló entre 20,1 y 62,1. Se prescribió Fe a todas ellas, pero el control no se ha realizado todavía.
En el 100% de las pacientes, los valores de creatinina se encontraban por debajo de los límites normales.
Hubo desequilibrios en el metabolismo fosfocálcico en 16 pacientes (64%): hipocalcemia en 11 pacientes, hipofostatemia en 5 pacientes e hiperfosfatemia en 4 pacientes. La vitamina D estaba por debajo de la normalidad en 5 pacientes (20%). De éstas, 3 tenían también hipocalcemia y una tenía hipofosfatemia.
La mayoría de las niñas tenía un perfil lipídico normal. Tres pacientes (casos 3, 16 y 25) tenían valores elevados de colesterol total, todos asociados a colesterol de las lipoproteínas de baja densidad, también aumentado. Otra niña (caso 5), aunque con colesterol total normal, tenía valores de lipoproteínas de baja densidad elevados y de colesterol ligado a lipoproteínas de alta densidad bajos. Otras 5 pacientes (casos 1, 7, 11, 18 y 22) tenían valores bajos de lipoproteínas de alta densidad con los otros parámetros lipídicos normales.
Los valores plasmáticos de ácido fólico así como los de urea, de Na, de Cl y de K fueron normales.
DiscusiónSe han publicado varios estudios acerca de los trastornos nutricionales y gastrointestinales en pacientes con SR pero, de acuerdo con el conocimiento de los autores de este trabajo, éste es el primero en el que se incluyen sólo pacientes con mutaciones identificadas del gen MECP2.
Ninguna de las pacientes tenía autonomía alimentaria completa. Curiosamente, la única niña con alguna capacidad de autoalimentación (caso 10), aunque se encontraba en el estadio iii de enfermedad, como la mayoría de las pacientes, era portadora de una mutación R133C y tenía una puntuación de gravedad de enfermedad más baja. Parece que las capacidades manuales son más dependientes de la puntuación de gravedad que del estadio de la enfermedad.
El porcentaje de pacientes con IMC inferior al P5 fue menor que lo anteriormente descrito en pacientes con SR4,11,13,15,28. Esto podría tener relación con la tendencia actual hacia un diagnóstico precoz y, en consecuencia, hacia una terapéutica temprana con un abordaje cultural particular de la familia hacia la ingesta alimentaria de sus hijos. La dieta mediterránea equilibrada también podría haber contribuido para un mejor estado nutricional de las pacientes en comparación con otras series. Sin embargo, no se puede excluir un cierto grado de sobrestimación del IMC atribuible a la presencia de escoliosis (en el 60% de las pacientes), con la consecuente infraestimación de la talla.
En todos las pacientes con una segunda evaluación, se ha observado una mejoría del estado nutricional. Aunque las necesidades nutricionales sigan siendo un tema controvertido, la orientación nutricional y la corrección de la postura durante las comidas ha contribuido, probablemente, a la mejoría de las pacientes4,8,13.
El estreñimiento fue la disfunción gastrointestinal más común, en una proporción similar a series previas11,15. Sin embargo, su etiología todavía no se ha establecido claramente. Deguchi et al consideraron normal la expresión intestinal del gen MECP2 en niñas con SR, por tanto, es poco probable que pueda contribuir a este síntoma17. Las medidas aconsejadas y el tratamiento farmacológico también han sido valiosos en esta materia, con mejoría de todas las niñas revaluadas.
En este estudio, el porcentaje de niñas con síntomas indicativos de RGE fue similar al anteriormente descrito14,19. Es posible que el RGE pueda haber sido infraestimado debido a la incapacidad de queja por las pacientes. El RGE se debe investigar activamente en todas las pacientes, especialmente en aquéllas con falla de medro. Las 2 niñas de este trabajo con RGE comprobado y con necesidad de tratamiento farmacológico tuvieron mejorías en la revaluación. Sin embargo, la pesquisa de RGE sólo se realizó ante la presencia de síntomas indicativos, ya que estos estudios son de difícil ejecución en pacientes que no cooperan.
La inexistencia de una diferencia estadísticamente significativa entre la enfermedad gastrointestinal, el bajo IMC o su marcador Z y el tipo de mutación (missense frente a truncante) podría deberse a la pequeña dimensión de la muestra. En otro estudio con un número mayor de pacientes (n = 60: 28 missense frente 32 truncante), se encontró una diferencia estadísticamente significativa entre el peso y la altura por debajo del P5 y del tipo de mutación29. Además, en un trabajo reciente, Oddy et al sugirieron que el genotipo tiene una influencia sobre el crecimiento en pacientes con SR20.
La presencia de anemia ferropénica o de bajos valores de Fe y de ferritina no se correlacionó con dificultades alimentarias o con un IMC bajo, lo que subrayó la importancia de buscar estas alteraciones, incluso en ausencia de malnutrición o signos clínicos de anemia o de deficiencia de Fe.
Todas las niñas tenían valores bajos de creatinina para su edad, lo que en algunas podría deberse a la disminución de su masa muscular.
Más de la mitad de las pacientes tenía un metabolismo fosfocálcico anormal, por lo que necesitaría un estudio más detallado. Los pacientes con SR tienen una mineralización ósea deficiente, lo mismo comparados con otros grupos de discapacitados, como aquéllos afectados de parálisis cerebral infantil30. La osteopenia parece ser independiente del estado nutricional; lo mismo ocurre ante una ingesta calórica normal, de Ca y de vitamina D. Los resultados de los estudios sobre el efecto de los fármacos antiepilépticos y el estado del contenido mineral óseo han sido contradictorios20,31,32. La fisiopatología de la osteopenia en el SR aún no se ha establecido, pero puede ser la causante de una anomalía metabólica o neuroendocrina que influya en la mineralización ósea o que aumente su reabsorción, posiblemente bajo la influencia del gen MECP220,30,33,34. De todos modos, cualquiera que sea el mecanismo, los trabajos anteriores son unánimes en señalar la importancia de una intervención en este campo, con vista a la prevención de la osteoporosis y de fracturas espontáneas, que pueden ser difíciles de diagnosticar en esta población no verbal y con retraso mental10,20,33. El estudio de las pacientes con densitometría ósea se encuentra actualmente en curso.
El perfil lipídico fue anormal en el 36% de las pacientes. Son necesarios más estudios con determinaciones seriadas del perfil lipídico de las pacientes y de sus padres para aclarar mejor estos trastornos.
Se han propuesto varias estrategias para el abordaje nutricional y digestivo de los pacientes con SR, como alimentos calóricos, dieta cetogénica, suplementos vitamínicos, alimentación por sonda, fundoplicatura y gastrostomia4–6,11,14,15. Los autores de este artículo creen que la opción adoptada deberá ajustarse a las necesidades individuales de acuerdo con el carácter progresivo de la enfermedad.
El tratamiento del SR requiere un equipo multidisciplinario que debe incluir un gastroenterólogo pediátrico y un nutricionista. En este estudio, aunque sólo unas pocas pacientes se hayan revaluado, todas han mejorado su estado nutricional y gastrointestinal. Los médicos deben tener en cuenta estos aspectos y aconsejar a los padres prestar atención a posibles alteraciones alimentarias o digestivas y deben instruirlos en los signos de alerta. Esta estrategia permitirá un diagnóstico precoz y un tratamiento individualizado, que sin duda contribuirá a una mejor calidad de vida de los pacientes con SRm.