En la actualidad, la infección por el virus de la inmunodeficiencia humana (VIH) en niños es una enfermedad crónica con un excelente pronóstico a largo plazo, pero que precisa tratamiento combinado con fármacos antirretrovirales de por vida. Sin embargo, la mejoría en la calidad de vida está limitada por los efectos secundarios de los fármacos; el más importante es la predisposición a un síndrome de toxicidad metabólica más o menos completo con: hiperlipidemia, lipodistrofia, resistencia a la insulina, acidosis láctica, osteopenia, hipertensión arterial y toxicidad específica de órganos como riñón, hígado, sistema nervioso central (SNC) y médula ósea. El riesgo de enfermedad cardiovascular en la vida adulta y la previsible alteración en la masa ósea definitiva son el coste metabólico más importante que hay que pagar por la supervivencia a largo plazo. Aunque muchas de estas alteraciones pueden tratarse adecuadamente, las interacciones farmacológicas, las intolerancias y el elevado número de pastillas ponen en riesgo el correcto cumplimiento, esencial para asegurar la eficacia terapéutica.
Presentamos en este artículo a cuatro pacientes pediátricos que describen un abanico de posibilidades de toxicidad metabólica en niños infectados por el VIH, así como un enfoque práctico del tratamiento terapéutico.
Paediatric Human Immunodeficiency Virus infection (HIV) nowadays is a chronic disease with an excellent long term prognosis, but lifelong combined antiretroviral treatment is required. However, an improved quality of life in this population is limited by adverse drug effects. The highest risk of treatment toxicity is developing a complete metabolic syndrome including: Hyperlipemia, lipodystrophy, insulin resistance, lactic acidosis, osteopenia, hypertension, and specific system and organ toxicity, such as the kidney, liver, CNS or bone marrow.
The risk of cardiovascular disease adult life and also definitive bone mass damage are the most significant metabolic costs that have to paid for increased survival. Most of these toxicities were able to be adequately treated but, pharmacological interferences, patient intolerance and the high number of drugs are the problems that limit the adherence to treatment, which is essential for a good therapeutical efficacy.
In this article, we present four HIV paediatric patients who presented with almost the whole range of metabolic toxicities, and a practical overview of therapeutical management
Con la introducción de los nuevos regímenes de tratamiento antirretroviral de gran actividad (TARGA) en niños infectados por el virus de la inmunodeficiencia humana (VIH) se ha producido un aumento de la supervivencia de estos pacientes1, transformando la infección en una enfermedad crónica con un excelente pronóstico. Sin embargo, los fármacos antirretrovirales no están exentos de efectos secundarios, toxicidad e interacciones con otras medicaciones. Éste es el coste metabólico que hay que pagar para conseguir una mayor esperanza y calidad de vida.
Actualmente, la edad media de los niños infectados verticalmente es de 13 años en la cohorte pediátrica de Madrid2, lo que refleja, además de una gran duración de la enfermedad, múltiples regímenes terapéuticos3 y una gran exposición acumulativa a fármacos antirretrovirales que previsiblemente continuará por el carácter crónico de la enfermedad.
Las complicaciones metabólicas descritas en adultos son las mismas que aparecen en los niños4,5, implicándose además de TARGA, el propio VIH y la respuesta inmunológica del sujeto, como responsables en su patogenia. Las más importantes son:
- –
Redistribución anómala de la grasa corporal: lipodistrofia morfológica.
- –
Hipercolesterolemia a expensas de colesterol de las lipoproteínas de baja densidad (c-LDL) y/o hipertrigliceridemia.
- –
Síndrome de lipodistrofia (SLD): hiperlipidemia asociada a lipodistrofia
- –
Resistencia periférica a insulina, hiperinsulinemia y diabetes.
- –
Toxicidad mitocondrial y acidosis láctica.
- –
Defecto en la mineralización ósea, osteoporosis y fracturas patológicas.
Se ha imputado al TARGA la responsabilidad de las primeras alteraciones metabólicas descritas y las más frecuentes en niños: lipodistrofia e hiperlipidemia6,7 y más tarde la alteración del metabolismo de hidratos de carbono8, toxicidad mitocondrial9 y alteraciones en el metabolismo del hueso4,5,10. La mayoría de ellas no son clínicamente visibles al principio y su valoración es únicamente analítica o detectada por técnicas de imagen; sin embargo, resultan preocupantes, pues no se conoce qué repercusión van a tener en el futuro. Uno de los aspectos menos conocidos es la alteración del metabolismo óseo, que puede comenzar en la niñez o en la pubertad, mantenerse en la adolescencia y persistir en la edad adulta, y es un reto planteado en el tratamiento de niños infectados por el VIH. Recientemente se ha comunicado que el TARGA que incluye inhibidores de la proteasa (IP) puede estar asociado con la aparición precoz del síndrome metabólico en niños11 que predispone a un futuro riesgo cardiovascular.
Se ha descrito, además, toxicidad específica por algunos IP que pueden dejar alteraciones permanentes, como nefropatía en caso de tenofovir (TDF) o indinavir (IDV) e hipertensión arterial con IDV o lopinavir (LPV)12,13. Se han confirmado interferencias importantes de los IP que pueden potenciar toxicidad de fármacos de uso habitual en la práctica pediátrica como antihistamínicos y corticoides14.
Por tanto, muchos de estos factores que determinan toxicidad metabólica en niños infectados por el VIH abocan a la exposición a factores de riesgo cardiovascular, a veces imposible de suprimir. La importancia que puede tener en esta población de alto riesgo el tratamiento profiláctico con dieta y hábitos de vida saludables es de tal magnitud, que debe formar parte del tratamiento sistemático del niño infectado desde los primeros meses de vida y antes aun de que pueda indicarse una terapia con antirretroviral.
Presentamos a cuatro niños infectados por el VIH que reflejan un abanico de toxicidad metabólica y las actitudes diagnósticas y terapéuticas utilizadas, aportando un repaso clínico de los efectos de los antirretrovirales como del tratamiento terapéutico general y específico de las alteraciones metabólicas secundarias al TARGA.
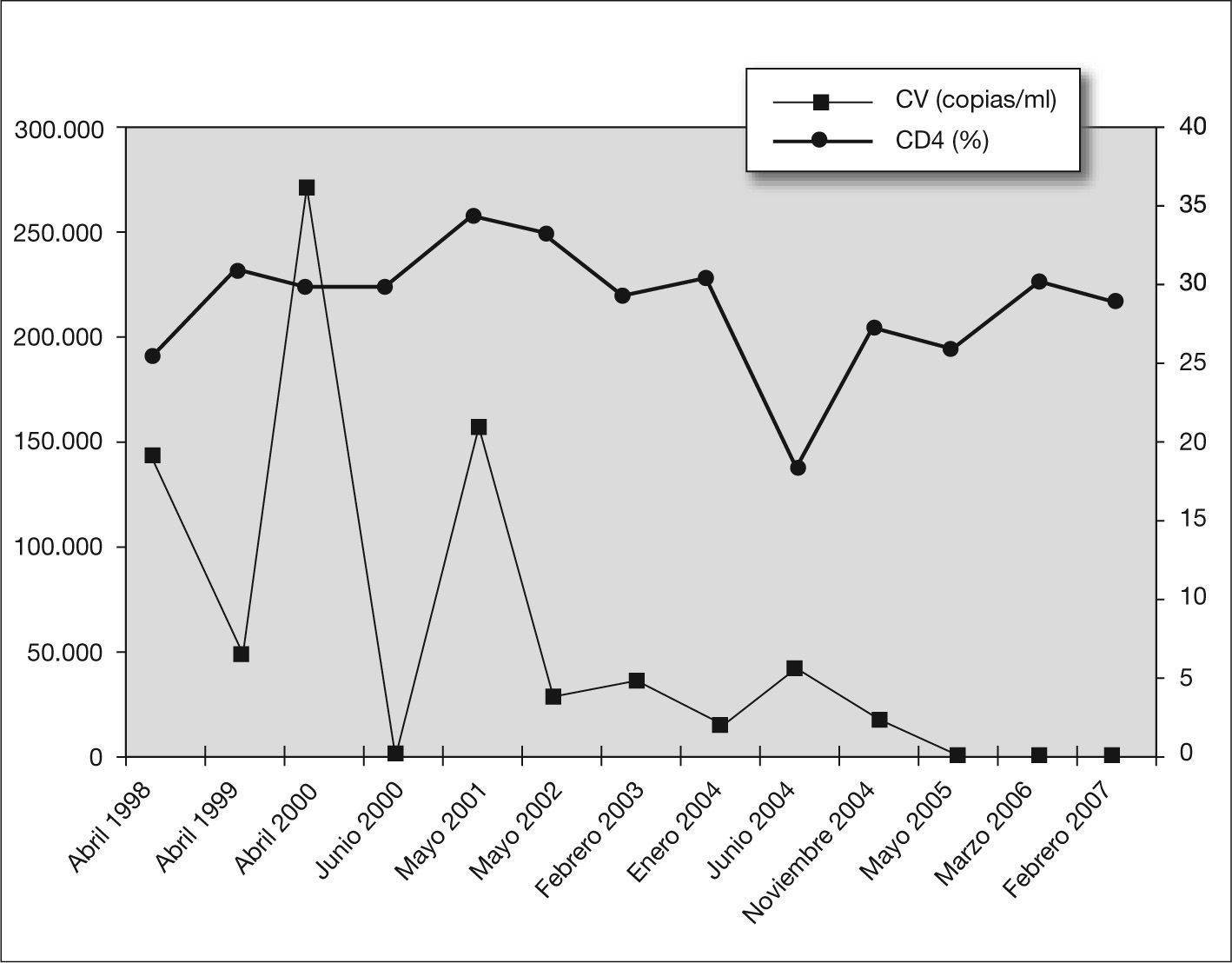
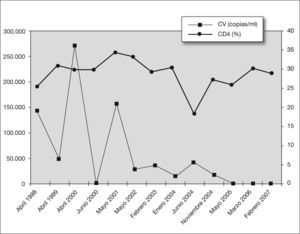
CASOS CLÍNICOSCaso 1Niña de 13 años con infección vertical del VIH estadio A3 (nadir CD4 10 %). Inició TARGA en 1997: lamivudina (3TC) + estavudina (d4T) + nefilnavir (NFV). Por fallo virológico y resistencia a antirretrovirales, se modificó en 2001: didanosina (ddI) + d4T + abacavir (ABC) + efavirenz (EFV), desarrolló lipoatrofia facial y periférica e hiperlipidemia que no mejoraron con dieta y ejercicio. Debido a la escasa respuesta inmunovirológica, se intensifica terapia: d4T + ABC + EFV + ritonavir (RTV) con buena respuesta. A los 6 meses presenta colesterol (377mg/dl) y triglicéridos (1.523mg/dl) y, debido al excelente control inmunovirológico, se decidió la interrupción temporal de TARGA para normalizar los valores lipídicos; 16 meses más tarde se evidenció caída de los linfocitos cooperadores inductivos (CD4), que obligó, en 2005, a reiniciar el TARGA con ddI + ABC + lopinavir/ritonavir (LPV/r) dados los datos de multirresistencia. En 2006 de nuevo se constató colesterol (597mg/dl) y triglicéridos (367mg/dl) y se decidió tratamiento compasivo combinando ezetimiba (10mg/24h) + gemfibrozilo (300mg/12h) y modificar la pauta antirretroviral sustituyendo LPV/r por atazanavir (ATV). Tras 6 meses con hipolipidemiantes presenta colesterol (225mg/dl) y triglicéridos (238mg/dl), sin efectos secundarios con carga viral (CV) indetectable y CD4 del 30 % (fig. 1). Diagnóstico: síndrome de lipodistrofia morfológico y metabólico grave secundario a TARGA.
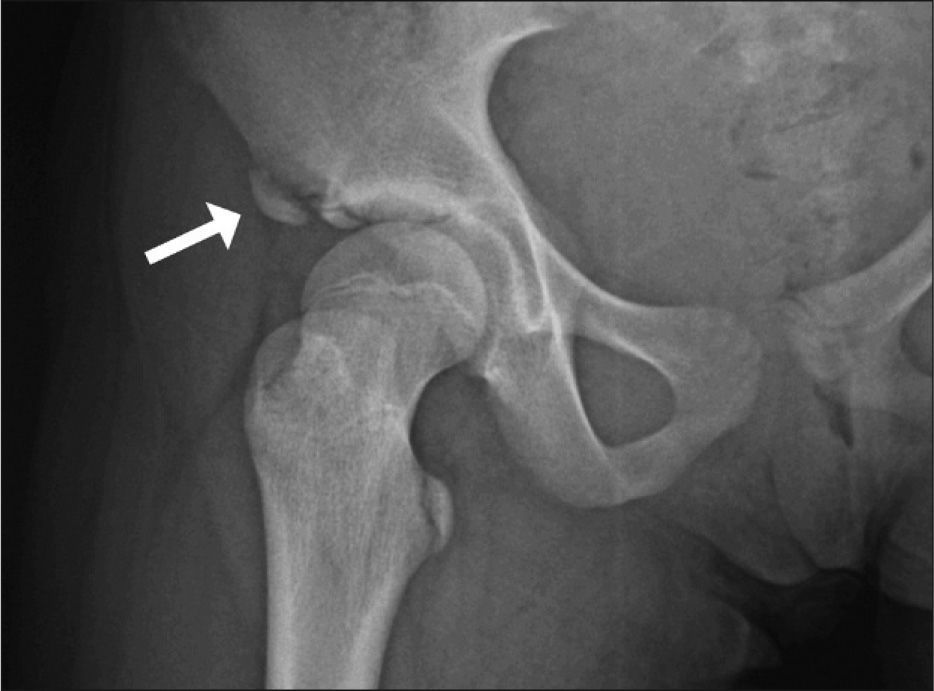
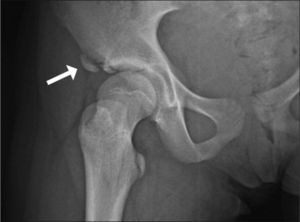
Caso 2Niña de 12 años coinfectada verticalmente por el VIH y virus de la hepatitis C (VHC) estadio A2 (nadir CD4 del 27%). Inició TARGA en 1999: azidotimidina (AZT) + 3TC + IDV. En 2002, por fallo terapéutico cambió a d4T + ddI + EFV. En 2005, tras constatar escasa recuperación inmune y guiados por el test de resistencia, se modificó a LPV/r + ABC + 3TC, tratamiento que se mantiene en la actualidad. En 2006, tras pegarle una patada a un balón, cayó al suelo. En la radiografía de cadera se objetivó arrancamiento de la espina ilíaca anteroinferior (fig. 2). En el momento de la fractura ósea la paciente presentaba buen estado nutricional y sin menarquia, CD4 de 379 (23 %), CV de 4.078 copias/ml (3,61 log), ácido láctico, hormonas tiroideas, perfil hepatorrenal, desoxipiridinolina, 1,25-dihidroxi-vitamina D, 25-hidroxi-vitamina D, hormona paratiroidea (PTH) y osteocalcina normales. La fosfatasa alcalina ósea era de 90,86μg/l. Densitometría femoral por rayos X: T score −1,5 y de columna lumbar: T score −1,9. Conversión a valores de referencia de Z score: normales. Tratamiento: reposo hasta conseguir la recuperación. Diagnóstico: fractura patológica sin osteopenia secundaria a VIH-VHC y TARGA.
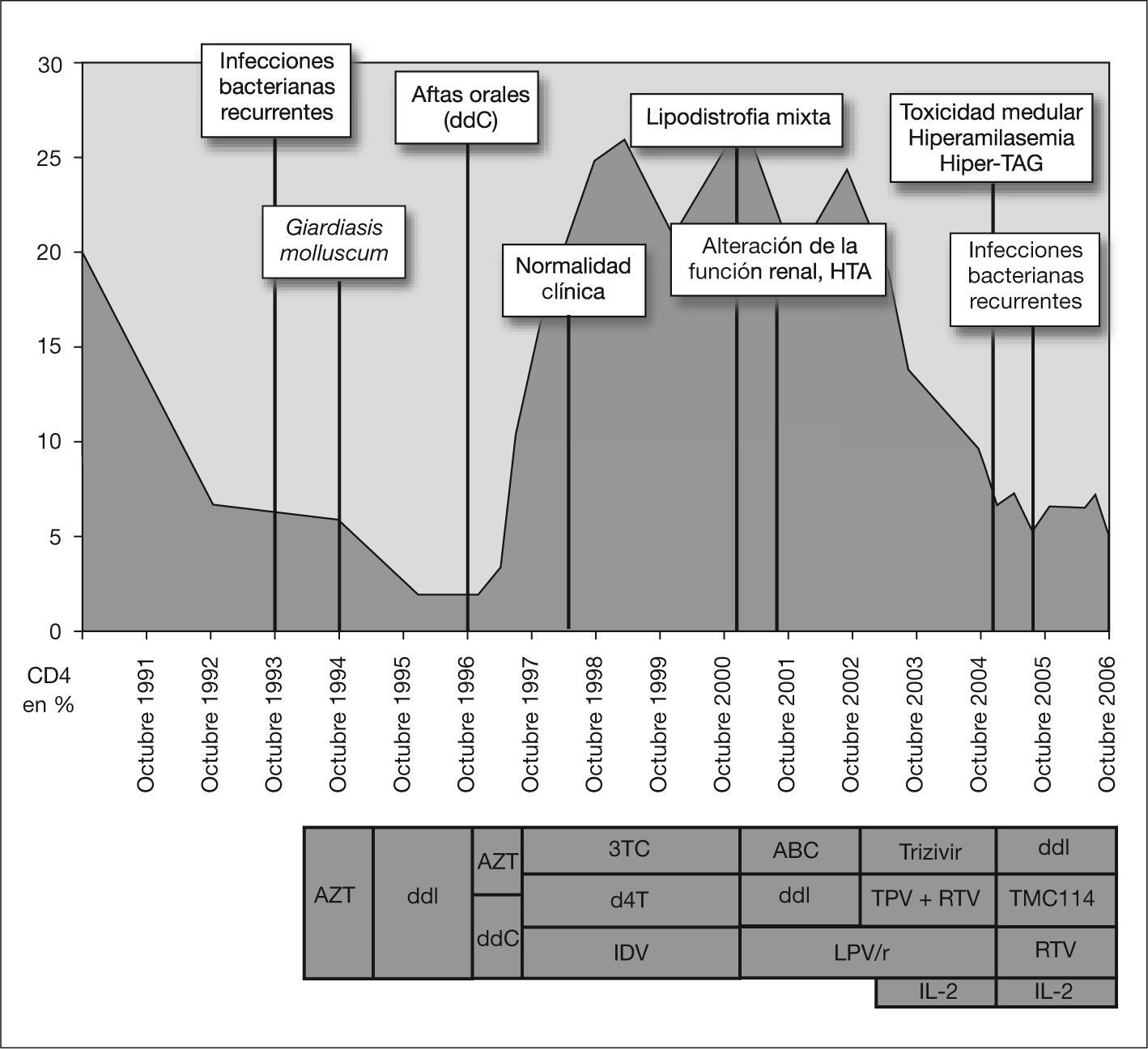
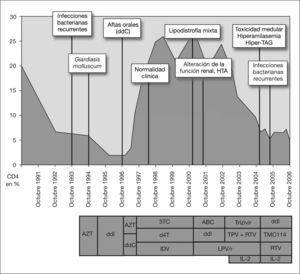
Caso 3Varón, hijo de prostituta de Cabo Verde, diagnosticado a los 2 años de infección vertical del VIH-2 estadio B3 (nadir CD4 del 2 %). Recibió, en 1993, monoterapia con zidovudina (ZDV); en 1994–1995, monoterapia con ddI y, en 1996, biterapia con ZDV + zalcitavina (ddC). En 1997–2000 inició TARGA con 3TC + d4T + IDV y, tras 4 años, presentó caída importante de CD4, por lo que se cambió, en 2000–2002, a ABC + ddI + LPV/r. En 2002–2005, por fracaso inmunológico grave, se intensificó terapia con AZT + 3TC + ABC + tripanavir/ritonavir (TPV/r), pero, valorando la escasa respuesta inmune, se asoció interleucina 2 durante 12 meses sin conseguir respuesta. Desde 2006 está en tratamiento compasivo con TMC114/r + ddI, guiados por test de resistencia, hasta la actualidad (fig. 3). Durante el primer tratamiento con TARGA (3TC + d4T + IDV) desarrolló lipodistrofia mixta: hipertrofia central + lipoatrofia facial y de extremidades inferiores y dislipidemia moderada, con concentraciones de colesterol y triglicéridos inferiores a 300mg/dl y, además, se manifestó hipertensión arterial (HTA) con valores de desviación estándar (DE) superiores a 2 para edad/ sexo y talla, confirmándose con estudio Holter-TA de 24h e iniciando terapia con enalapril. Presentó alteración de función renal: hipostenuria y leucocituria; creatinina, 1,3mg/dl; aclaración de creatinina, 70ml/min/ 1,73m2; filtrado glomerular, 65ml/min/1,73m2. El análisis de orina de 24h presentó valores de proteinuria de 87mg/día y microalbuminuria de 51mg/día. La eco Doppler renal, la tomografía computarizada (TC) abdominal, la arteriografía y el estudio del sistema renina-angiotensina fueron normales. Se suspendió IDV y, a los 3 meses de la retirada, la función renal se normalizó, pero persistió la HTA. Diagnóstico: nefropatía tubulointersticial e HTA por IDV, síndrome de lipodistrofia mixto por TARGA.
Evolución clínica, inmunológica (CD4 en porcentaje) y terapéutica del caso clínico 3. ABC: abacavir; AZT: azidotimidina; CD4: linfocitos cooperadores inductivos; ddC: zalcitavina; ddI: didanosina; d4T: estavudina; HTA: hipertensión arterial; IDV: indinavir; IL-2: interleucina 2; LPV/r: lopinavir/ritonavir; RTV: ritonavir; TAG: hipertrigliceridemia; TPV: tripanavir; 3TC: lamivudina.
Niño de 13 años con infección vertical por el VIH estadio B3 (nadir CD4 del 12 %) que inició TARGA a los 5 años. En 1997 recibía ZDV + ddI + IDV, pero, por intolerancia a ZDV, se cambió en 1997–1999 a d4T + ddI + IDV. Al no poder controlar la CV se decidió intensificar a d4T + ddI + RTV + saquinavir (SQV) en 1999–2000, pero por intolerancia a SQV nos vimos obligados, en 2000–2001, a sustituir la asociación de los 2 IP por un no análogo (d4T + ddI + EFV). Al año del tratamiento, tras múltiples rebrotes de CV y descenso de CD4, se decidió volver a IP y asociarlo a una terapia menos tóxica (LPV/r + ABC + 3TC), que se ha mantenido desde 2001 hasta la actualidad con buen control inmunovirológico. A los 12 años comenzó con cuadros de broncospasmo grave recurrente por sensibilización a inhalantes, por lo que se administraron por vía inhalatoria broncodilatadores y corticoides. A las 7 semanas de estar recibiendo fluticasona 250μg/12h, con un peso de 42kg, acudió a urgencias por presentar cuadro de astenia, vómitos y diarrea de 24h de evolución. Presentó fenotipo cushingoide y signos de deshidratación y ante la sospecha de insuficiencia suprarrenal se realizó hemograma, bioquímica, coprocultivo, estudio del eje corticosuprarrenal (hormona adrenocorticotropa [ACTH] basal < 10pg/ml, cortisol basal < 1mg/dl) y test de Synacthen alterado, que confirman el diagnóstico. En el coprocultivo se aisló Salmonella C1. Se ingresó, administró antibiótico y se inició tratamiento con 6-metil-prednisolona parenteral. La evolución clínica y analítica fueron satisfactorias. Se sustituyeron los corticoides inhalados como terapia de mantenimiento del asma por antagonistas de leucotrienos, continuando con TARGA con excelente evolución. Diagnóstico: síndrome de cushing iatrogénico secundario a aumento de exposición a corticoides exógenos por interferencia medicamentosa entre fluticasona y RTV e insuficiencia suprarrenal por supresión del eje, desencadenada por cuadro infeccioso de salmonelosis.
DISCUSIÓNLos primeros trabajos pediátricos que demuestran las alteraciones del metabolismo lipídico en niños infectados por el VIH aparecen a finales de la década de 1990 y, casi simultáneamente, se describe la existencia de alteraciones morfológicas en la distribución de la grasa corporal. Aunque están implicados múltiples factores, entre ellos el propio VIH, los estudios confirman que es el empleo de TARGA el factor más determinante y responsable tanto de la redistribución de grasa como del trastorno de los lípidos15–17. Posteriormente, se describen otras alteraciones metabólicas asociadas también con TARGA en niños: alteración del metabolismo de los hidratos de carbono, toxicidad mitocondrial y, más recientemente, alteraciones en el metabolismo del hueso5,10,18. El síndrome de lipodistrofia que asocia dislipidemia con alteración de la distribución corporal es, con mucho, la toxicidad metabólica secundaria a TARGA que con más frecuencia se describe en los niños6,7.
El caso 1 es un caso típico de una adolescente de 13 años con infección, con exposición acumulativa y prolongada a TARGA y con el agravante, como en otros casos históricos cuando escaseaban los antirretrovirales, del empleo habitual de fármacos más tóxicos como asociación d4T + ddI, que era la regla. Se ha descrito que los fenómenos más graves de lipodistrofia morfológica se asocian con la mayor duración del TARGA, con la pubertad y con el uso de d4T19–21, todos ellos presentes en nuestra paciente. En este caso, a pesar de realizar medidas higiénico-dietéticas y modificaciones de los antirretrovirales, llegando incluso a la interrupción del mismo, precisó finalmente fármacos hipolipidemiantes. En niños hay poca experiencia con gemfibrozilo y sólo debe utilizarse cuando los triglicéridos superan los 500mg/dl por el riesgo de pancreatitis y cuando han fracasado otras estrategias. Los fibratos no están exentos de efectos secundarios, miositis o toxicidad medular; por ello, su uso en niños debe limitarse a indicaciones muy concretas22,23. Existen publicaciones en adultos tanto en infectados por VIH como en pacientes con dislipemias familiares que asocian ezetimiba con estatinas o fibratos con buenos resultados24,25 (tabla 1). No existe experiencia pediátrica que valore la eficacia de esta asociación, de ahí la actitud expectante en nuestra paciente.
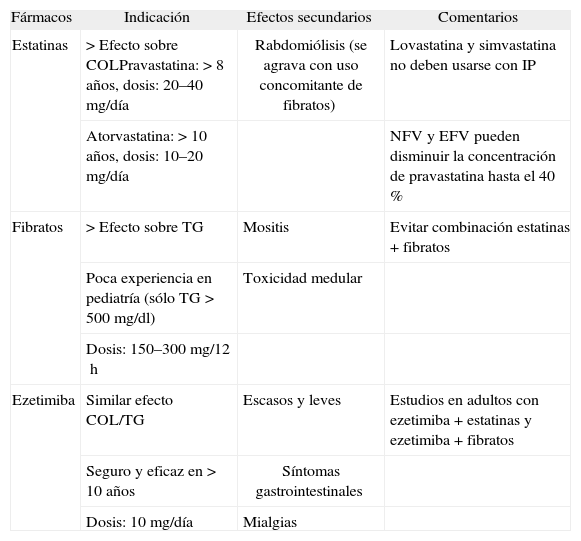
Indicaciones, efectos secundarios y contraindicaciones de fármacos hipolipidemiantes usados en pacientes con infección por VIH
| Fármacos | Indicación | Efectos secundarios | Comentarios |
| Estatinas | > Efecto sobre COLPravastatina: > 8 años, dosis: 20–40mg/día | Rabdomiólisis (se agrava con uso concomitante de fibratos) | Lovastatina y simvastatina no deben usarse con IP |
| Atorvastatina: > 10 años, dosis: 10–20mg/día | NFV y EFV pueden disminuir la concentración de pravastatina hasta el 40 % | ||
| Fibratos | > Efecto sobre TG | Mositis | Evitar combinación estatinas + fibratos |
| Poca experiencia en pediatría (sólo TG > 500mg/dl) | Toxicidad medular | ||
| Dosis: 150–300mg/12h | |||
| Ezetimiba | Similar efecto COL/TG | Escasos y leves | Estudios en adultos con ezetimiba + estatinas y ezetimiba + fibratos |
| Seguro y eficaz en > 10 años | Síntomas gastrointestinales | ||
| Dosis: 10mg/día | Mialgias |
COL: colesterol; EFV: efavirenz; IP: inhibidores de la proteasa; NFV: nelfinavir; TG: triglicéridos.
El caso 2 es el de una adolescente con fractura patológica de cadera tras un traumatismo mínimo, con marcadores de remodelación ósea, función tiroidea, perfil hepatorrenal y estado nutricional normales. Cualquiera de ellos si hubiese estado presente, podría haber sido responsable de la fractura. La etiología de estas alteraciones es multifactorial y pueden intervenir la propia infección del VIH, el tratamiento antirretroviral y factores generales como la malnutrición, hipogonadismo, etc.5,26. En niños y adolescentes infectados por el VIH con TARGA se ha demostrado que no se alcanza un adecuado pico de masa ósea10. En nuestro caso, la densitometría de cabeza y cuello femoral estaban dentro del rango de la normalidad, por lo que se desestimó el tratamiento con bifosfonatos, que es el único tratamiento posiblemente eficaz en casos de osteopenia. Posiblemente, la infección por el VIH en una niña cercana a la pubertad o incluso la coinfección con el VHC puedan haber desempeñado un papel en la patogenia de la fractura18,27.
El caso 3 presentó lipodistrofia mixta y la lipohipertrofia28 se atribuyó a IDV y la lipoatrofia, principalmente a d4T21 y a la asociación d4T + ddI29. La nefropatía tubulointersticial se relacionó claramente con el uso prolongado de IDV12,30 con normalización de las pruebas analíticas tras la retirada. No obstante, este paciente continúa presentando proteinuria y leucocituria tras el uso de fármacos nefrotóxicos como cotrimoxazol, y este daño renal le limita además para opciones terapéuticas de antirretrovirales con probable toxicidad renal como tenofovir. La HTA en artículos en adultos se ha asociado con IDV31 e, inicialmente, creemos que fue el responsable del desencadenamiento de la misma en nuestro paciente que respondió a tratamiento con enalapril, y se pudo disminuir la dosis a la mitad una vez suspendido el IDV. Sin embargo, no podemos retirarlo totalmente porque persisten cifras de presión arterial elevadas. Otros factores implicados en el desarrollo de HTA pueden ser: esencial, familiar, raza negra, etc., que podrían explicar esta situación.
El caso 4 es un ejemplo claro de cómo la cronicidad de la infección por el VIH hace que las interacciones farmacológicas de los antirretrovirales adquieran cada vez mayor importancia y, por otro lado, el aumento de supervivencia y sus características específicas hace a los niños ser cada vez más susceptibles a polimedicación, facilitando a su vez las interacciones. La vía metabólica más implicada en el metabolismo de antirretrovirales es la del citocromo P450, siendo la isoenzima CYP3A4 responsable del metabolismo de más del 50 % de los fármacos de uso humano, entre los que se encuentran los IP, los no análogos de nucleósidos y los corticoides inhalados14. Se conoce la actividad tanto inductora como inhibidora de los fármacos antirretrovirales en la actividad del citocromo P45032. El RTV, IP con el que estaba siendo tratado nuestro paciente como potenciador del efecto del LPV, ejerce un importante efecto inhibidor en la actividad del citocromo P450 y especialmente de CYP3A4, lo que explicaría el aumento franco en el nivel de exposición al corticoide y el desarrollo del fenotipo cushingoide en nuestro caso. Posteriormente, el mantenimiento de concentraciones elevadas de corticoides exógenos, que no pueden ser detectadas en la analítica sanguínea, justifica la supresión del eje suprarrenal con el consiguiente desarrollo de la insuficiencia suprarrenal secundaria33, que en nuestro paciente pudo estar facilitada por un cuadro infeccioso como la salmonelosis.
COMENTARIOSUn amplio abanico de posibilidades de efectos tóxicos e interacciones medicamentosas se presenta en el tratamiento de estos pacientes. La toxicidad metabólica en niños infectados por el VIH debida a TARGA es superponible a la del adulto; sin embargo, la repercusión a largo plazo, sobre todo en los que iniciaron la exposición intrauterina a antirretrovirales, no puede extrapolarse de los estudios de adultos. Los niños probablemente sean más vulnerables a la toxicidad de TARGA prolongada, ya que tiene un potencial efecto sobre el crecimiento somático, un mayor tiempo acumulativo de exposición y la peculiaridad de que los efectos metabólicos se producen sobre un organismo en desarrollo con consecuencias futuras imprevisibles.
Un aspecto esencial que hay que considerar en niños infectados por el VIH es la exposición a factores de riesgo cardiovascular, a veces imposibles de suprimir, y para lo cual no disponemos de ningún tratamiento eficaz34,35. Un conjunto de medidas dietéticas y hábitos de vida más saludables, junto con un planteamiento juicioso de los antirretrovirales en terapia de inicio o de simplificación en los ya tratados, son las únicas medidas disponibles actualmente. La aproximación terapéutica de las alteraciones morfológicas y metabólicas dependerá de la patología más prevalente; no obstante, en todos los casos será el denominador común: fomentar un hábito de vida saludable, dieta de protección cardiovascular, ejercicio físico habitual, ingesta adecuada de calcio y vitamina D y exposición solar moderada. El inicio juicioso de TARGA con antirretrovirales que conocemos menos tóxicos debe ser la recomendación habitual. En casos de hiperlipidemia grave en mayores de 10 años pueden estar indicados los hipolipidemiantes y si se constata osteopenia, la administración de bifosfonatos. Son necesarios un estricto seguimiento de los niños en tratamiento con antirretrovirales y un meticuloso conocimiento de las interacciones farmacológicas y efectos secundarios de los fármacos utilizados para prevenir toxicidad para afrontar la infección crónica por el VIH en niños.