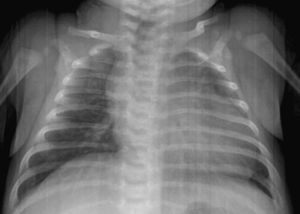
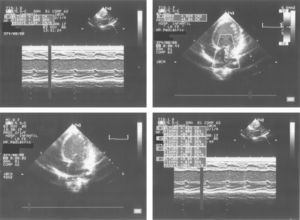
Lactante de 2 meses asintomática remitida para estudio de una masa abdominal de consistencia dura en flanco izquierdo. En la ecografía se observa tumoración yuxtarrenal izquierda solido-quística. La alfa-fetoproteina cercana a 2.000ng/ml. La metayodobenzilguanidina (123-I-MIBG) no demostró captación tumoral. A las 48h, presenta cuadro de shock hipovolemico. En la radiografía de tórax presenta cardiomegalia con índice cardiotorácico de 0,7 y congestión pulmonar. La ecocardiografía muestra dilatación de ventrículo izquierdo con fracción de eyección del 35–40%. Se descartaron anemia, hipertensión, hipervolemia e hipersecreción de catecolaminas. Los estudios virológicos y de despistaje metabólico fueron normales. Se resecó un tumor retroperitoneal muy vascularizado sin incidencias y se confirmó el diagnóstico de teratoma inmaduro grado 2 de Norris. A los 3 meses la evolución fue satisfactoria. Los teratomas son tumores raros en la infancia que tienen en general un comportamiento benigno. Está descrita la miocardiopatía dilatada (MCD) secundaria a tumores de células cromafines (feocromocitoma, neuroblastoma, ganglioneuroblastoma), así como a infiltrados leucémicos y secundariamente al tratamiento con antraciclinas, pero no existe ningún caso publicado en la literatura que relacione el teratoma con la miocardiopatía dilatada. Diversas citocinas como INF-α, IL-1, IL-6 podrían ser secretadas por el tumor, promoviendo a nivel cardiaco la actividad de los fibroblastos, induciendo la apoptosis celular y la fibrosis miocárdica. Así, la resección de la masa tumoral responsable de la producción de las mismas, permitiría la regresión de la disfunción miocárdica, como en el caso expuesto.
Asymptomatic 2 month-old infant referred for evaluation of a hard abdominal mass on the left side. The ultrasound examination showed a solid-cystic tumour above the left kidney. The alpha-fetoprotein level was 2000ng/ml. The meta-iodobenzylguanidine (123-I-MIBG) showed no tumour uptake. At 48h, she showed signs of hypovolemic shock. The chest X-ray showed cardiomegaly with a cardiothoracic ratio of 0.7 and pulmonary congestion. The echocardiogram showed a dilated left ventricle with ejection fraction 35–40%. Anaemia, hypertension, hypervolemia and hyper-secretion of catecholamines were ruled out. The virology and metabolic screens were normal. The highly vascularised retroperitoneal tumour was resected without incident and confirmed the diagnosis of an immature Norris grade 2 teratoma grade. At 3 months the outcome was satisfactory. Teratomas are rare tumours in childhood that generally have a benign course. Dilated cardiomyopathy (DCM) secondary to, chromaffin cell tumours (phaeochromocytoma, neuroblastoma, ganglioneuroblastoma), leukaemia infiltrates, and treatment with anthracyclines have been described, but there is no case reported in the literature regarding a teratoma with dilated cardiomyopathy. Various cytokines, such as INF-α, IL-1, IL-6 may be secreted by tumour, promoting fibroblast activity in the heart and inducing apoptosis and myocardial fibrosis. Thus, in the case presented resection of the tumour mass responsible for this production, enables the heart to return to normal.
Una masa abdominal asintomática es la forma de presentación más común de los tumores sólidos en los niños1–3. En lactantes debe hacerse el diagnostico diferencial principalmente con el neuroblastoma, el nefroma mesoblástico y el tumor de Wilms; los teratomas son menos probables1. La presentación clínica más frecuente de los teratomas es la de una tumoración presacra asintomática en recién nacidos. La ubicación retroperitoneal1,2 es extremadamente rara y representa solo el 3,5% de los tumores de las células germinales. Está descrita la miocardiopatía dilatada (MCD) secundaria a tumores de células cromafines como el feocromocitoma o el neuroblastoma4–7,10. Son varios los mecanismos fisiopatológicos potenciales que pueden ocasionar disfunción sistólica e insuficiencia cardiaca asociados a hallazgos histológicos de necrosis focal, miocarditis y fibrosis secundaria que producen lesión en el músculo cardiaco8,9.
Caso clínicoAcude a nuestro centro una lactante de 2 meses, sin antecedentes perinatales de interés, remitida para estudio de una gran masa abdominal apreciada durante una exploración física rutinaria. La niña se encontraba desde el nacimiento completamente asintomática, y en la exploración al ingreso solo llama la atención la palpación de una masa de consistencia dura en flanco izquierdo. Durante la anamnesis se constató además que se había producido retardo en la caída de cordón umbilical. Las tensiones arteriales a su ingreso fueron normales, medidas en los cuatro miembros.
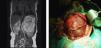
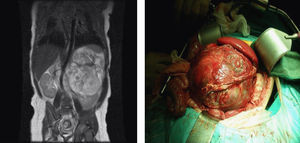
En la ecografía abdominal se observa una tumoración yuxtarrenal izquierda de características solido-quísticas. En la resonancia magnética nuclear abdominal, se aprecia una masa en hemiabdomen izquierdo de unos 86×96×99mm de diámetro, con algunas zonas hipercaptantes en su porción central, desplazando de forma severa el riñón izquierdo en sentido postero-inferior y el bazo en sentido superior, cruzando la línea media y desplaza la cava inferior y la aorta sin infiltración aparente de las mismas (fig. 1). En la radiografía de tórax (RXT) no se identifican anomalías.
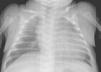
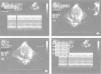
Se completa el estudio con hemograma y bioquímica básica con estudio ferrocinético, marcadores tumorales (antígeno carcinoembrionario [CEA], alfafetoproteína [α-FP], gonadotropina coriónica [β-HCG], antígeno CA-125), lactato deshidrogenasa (LDH), enolasa sérica, estudio de catecolaminas en orina de 24h, estudio de cortisol en orina, siendo todos ellos normales, salvo valores de α-FP de casi 2.000ng/ml. Así mismo se realiza estudio con metayodobenzilguanidina (123-I-MIBG) en la cual no se aprecia captación tumoral del radiotrazador, siendo la zona hipocaptante. Comentado en comité de oncología, se considera poco probable el diagnóstico de neuroblastoma, y se programa intervención para realización de biopsia de la masa (con estudio anatomopatológico intraoperatorio) y exéresis en caso de precisarlo, en los próximos 4 días. A las 48h la paciente presenta crisis de dificultad respiratoria e hipoperfusión periférica, por lo que con sospecha de shock hipovolémico, ingresa en la unidad de cuidados intensivos pediátricos, donde se intuba, se administra precarga de volumen y se inicia una perfusión de dopamina. Mediante ecografía abdominal se descarta sangrado intratumoral. En la RXT se aprecia cardiomegalia moderada (índice cardiotorácico de 0,7) con signos de congestión pulmonar (fig. 2). La ecocardiografía muestra una importante dilatación de ventrículo izquierdo con moderada-severa depresión de la función sistólica, calculándose una fracción de eyección aproximada del 35–40% (fig. 3). Tras estabilización inicial y comentado de nuevo en comité multidisciplinario, se piensa en la tumoración como factor etiológico de la miocardiopatía dilatada, por lo que se decide intervención quirúrgica, realizando laparotomía media supra-infraumbilical, encontrando un gran tumor retroperitoneal de aspecto muy vascularizado. La resección fue completa y sin incidencias.
El informe anátomo-patológico lo describe como tumoración de 12,5×10×8cm (fig. 1), de superficie externa multinodular, de aspecto irregular, con algunas formaciones quísticas y al corte se aprecian múltiples áreas quísticas, con contenido mucinoso en su interior, con otras áreas de consistencia más duras, que impresionan cartílagos. Se aprecia además algunas áreas blancas, hemorrágicas y otras de color amarillento. En el estudio microscópico se observan diferentes tejidos distribuidos desordenadamente, tejido óseo maduro, tejido cartilaginoso, y tejido adiposo y muscular estriado. Se observa abundante tejido nervioso inmaduro constituido por túbulos neurales primitivos, tejido glial inmaduro, y plexos coroideos. Existen también pequeños focos de piel. También se observa pequeñas luces revestidas por epitelio respiratorio así como pequeñas glándulas digestivas. El número de campos de bajo aumento con tejido inmaduro es mayor de tres en una preparación histológica, confirmando el diagnóstico de teratoma inmaduro grado 2 según la clasificación de Norris.
El postoperatorio inmediato transcurrió sin complicaciones, salvo aparición de hipertensión arterial (HTA) transcurridas 48h desde la cirugía. En principio se sospechó etiología reno-vascular (atribuible a la elongación de las arterias renales durante la cirugía) y se controló con captopril. La evolución posterior ha sido satisfactoria, no evidenciándose restos tumorales en ecografías y RMN de control. Se ha apreciado una normalización progresiva de los valores de α-FP en los sucesivos controles analíticos. Los controles cardiológicos han demostrado una gradual disminución de la dilatación ventricular, con mejoría de la fracción de eyección. La HTA se mantuvo controlada con tratamiento farmacológico, consiguiendo una paulatina normalización y estabilización de las cifras de tensión arterial (TA). A los tres meses de la cirugía se retira el Captopril en pauta descendente, sin apreciar recurrencias en posteriores controles. Las cifras de TA se encuentran actualmente en percentil 75 para su edad.
DiscusiónLos tumores de células germinales (TCG) extracraneales en la infancia son poco frecuentes en los niños menores de 15 años al representar aproximadamente 3% de los casos de cáncer en este grupo de edad. En el grupo de edad fetal o neonatal, la mayoría de los TCG extracraneales que se presentan son teratomas benignos que surgen en lugares de la línea media, incluso en las regiones sacrococcígea, retroperitoneal, mediastínica y cervical1. A pesar del bajo porcentaje de teratomas malignos que se presentan en este grupo de edad, los tumores perinatales tienen una morbilidad alta debido a la hidropesía fetal y los partos prematuros. Los TCG extracraneales (especialmente los de testículo) son mucho más comunes entre los adolescentes de 15 a 19 años (14% de los diagnósticos de cáncer en este grupo). Según la localización de la masa y la edad de la paciente, en principio el diagnóstico más probable a priori sería un neuroblastoma o ganglioneuroblastoma. Al ser negativos todos los estudios negativos para despistaje de neuroblastoma negativos, excepto los valores de α-FP, explicables por otra parte por la edad de la paciente, en principio se programa para biopsia y manejo en función de resultado anatomopatológico.
El resultado de la biopsia intraoperatoria y confirmación posterior muestran teratoma ovárico inmaduro grado 2. Los teratomas inmaduros también contienen tejidos de las tres capas de células germinales, pero además tienen tejidos inmaduros, especialmente neuroepiteliales. Los teratomas inmaduros se pueden clasificar en grados de 0 a 3 con base en la cantidad de tejido inmaduro que se encuentre en el espécimen. Los tumores de grado alto son más propensos a tener focos de tumor del saco vitelino. Los teratomas inmaduros se presentan principalmente en sitios extragonadales en niños pequeños y en los ovarios de las niñas en la pubertad, pero no hay correlación entre el grado del tumor y la edad del paciente2.
En los lactantes y los niños pequeños, los teratomas inmaduros exhiben un comportamiento clínico benigno; sin embargo y de acuerdo con lo notificado, los teratomas inmaduros en adultos (principalmente de ovarios) tienen un comportamiento clínico agresivo y necesitan de cirugía y quimioterapia. En un estudio del Pediatric Oncology Group y el Children's Cancer Group3 que evaluó el uso de resección quirúrgica seguida de observación cuidadosa para pacientes con teratomas inmaduros, se cuestionó el beneficio de la quimioterapia adyuvante para los niños. La cirugía de por sí fue curativa para la mayoría de las niñas y adolescentes con teratoma inmaduro de ovario resecado de cualquier grado, pese a que se presentaron concentraciones altas de AFP sérica o focos microscópicos de tumor de saco vitelino. El estudio demostró una supervivencia sin complicaciones a los tres años de 97,8% para los pacientes con tumores de ovario.
La aparición de MCD en este caso es una rareza no descrita en la literatura médica asociada a esta estirpe tumoral. La MCD es una enfermedad del músculo cardiaco caracterizada por dilatación ventricular (generalmente del ventrículo izquierdo) y disfunción sistólica. En la mayoría de los casos la etiología es desconocida, habiéndose sugerido enfermedades metabólicas, infecciosas e inmunológicas como factores causales4,5. Está descrita la MCD secundaria a tumores de células cromafines secretores de catecolaminas como el feocromocitoma, el neuroblastoma, así como a ganglioneuroblastomas. También es bien conocida la asociación a leucemias tanto desde el punto de vista de la propia infiltración tumoral, como secundariamente al tratamiento asociado con antraciclinas6,7. Son varios los mecanismos fisiopatológicos potenciales que pueden ocasionar disfunción sistólica e insuficiencia cardiaca como sobrecarga de presión por HTA, lesión miocárdica secundaria a toxicidad por catecolaminas e isquemia por aumento del tono coronario, todo ello junto a los hallazgos histológicos de necrosis focal, miocarditis y fibrosis secundaria producen una lesión en el músculo cardiaco8,9. No existe ningún caso publicado en la literatura que relacione el teratoma con la MCD, aunque pensamos que al igual que en la etiopatogenia de esta y en ausencia de otros factores de sobrecarga cardiacos (HTA, hipervolemia, anemia…), diversas citoquinas proinflamatorias como el INF-α, IL-1, IL-6 pudieran ser secretadas por el tumor, promoviendo a nivel cardiaco la actividad de los fibroblastos, induciendo la apoptosis celular y la fibrosis miocárdica. Así, la resección de la masa tumoral responsable de la producción de las mismas, permite la regresión de la disfunción miocárdica. Es muy importante descartar causas reversibles de miocardiopatía, pues el tratamiento y el pronóstico dependerán en gran parte de la causa de la misma10.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.