El síndrome de Wolfram, también conocido con la denominación DIDMOAD (por asociar diabetes insípida, diabetes mellitus [DM], atrofia óptica y sordera), es una causa muy poco frecuente de diabetes mellitus. Se encuentra dentro de los síndromes genéticos que pueden asociarse con diabetes en la clasificación de la American Diabetes Association (ADA). Es un cuadro neurodegenerativo con transmisión autosómica recesiva. Cursa con diversas manifestaciones clínicas, como la DM, la atrofia óptica, la diabetes insípida (DI), la sordera, la dilatación de las vías urinarias, alteraciones en el sistema nervioso central, alteraciones psiquiátricas y alteraciones gonadales; entre las más frecuentes destaca la DM, que es de aparición precoz y con poca prevalencia de cetoacidosis, y la atrofia óptica, la cual se considera el criterio diagnóstico fundamental en este síndrome. La DI suele aparecer más tarde. Este síndrome se presenta en la infancia, lo que da lugar a una mayor dificultad diagnóstica y terapéutica, con una elevada morbimortalidad y deterioro de la calidad de vida por las afectaciones neurológicas y urológicas. En el presente artículo describimos las características clínicas de 3 pacientes con síndrome de Wolfram y su evolución. En todos ellos existían antecedentes de consanguinidad. Se practicó análisis genético en los tres casos, uno presentó en homocigosis la mutación del gen WFS1 G736A en el exón 8, y los otros dos, que eran hermanos, homocigosis con la mutación del gen 425ins16 en el exón 4.
Wolfram syndrome (WS), also known as DIDMOAD (due to its association with diabetes insipidus, diabetes mellitus, optic atrophy and deafness), is an infrequent cause of diabetes mellitus. This syndrome is included among the genetic disorders associated with diabetes in the American Diabetes Association's classification. WS is an autosomal recessive neurodegenerative disease characterized by various clinical manifestations such as diabetes mellitus, optic atrophy, diabetes insipidus, deafness, neurological symptoms, renal tract abnormalities, psychiatric disorders and gonadal disorders. The most frequent of these disorders is early onset diabetes mellitus, with a low prevalence of ketoacidosis, and optic atrophy, which is considered a key diagnostic criterion in this syndrome. Diabetes insipidus usually develops later. This syndrome manifests in childhood, hampering diagnosis and treatment. Morbidity and mortality are high and quality of life is impaired due to neurological and urological complications. This article describes the clinical characteristics and outcome in three patients with WS. All three patients had antecedents of consanguinity. Genetic study was performed in all patients. One was homozygotic for the WFS1 gene that encodes the WFS1 G736A mutation in exon 8 and the remaining two patients, who were siblings, were homozygotic for the 425ins16 mutation in exon 4.
Este síndrome, también denominado DIDMOAD, es un trastorno autosómico recesivo, constituido por la asociación de diabetes insípida (DI), diabetes mellitus (DM), atrofia óptica y sordera. Fue descrito por primera vez por D.J. Wolfram en 19381.
Su prevalencia en España es desconocida. La frecuencia de portadores de la enfermedad es de 1/3542. Existe el 27 % de consanguinidad en los casos. La patogenia no se conoce y se ha postulado una degeneración gradual de los tejidos derivados del neuroectodermo. El diagnóstico debe basarse en la clínica, y los estudios genéticos son una herramienta disponible para confirmarlo.
En 1997 se identificó el gen WFS1 en la región 4p16.1 como gen responsable3,4. Está constituido por ocho exones y sintetiza una proteína transmembrana de 890 aminoácidos, denominada wolframina. Este gen está presente en el 75 % de las familias españolas afectadas5.
La DM observada en el síndrome de Wolfram (SW) se encuentra dentro de los síndromes genéticos que pueden asociarse a diabetes según la última clasificación de la American Diabetes Association (ADA) 2007. Es de aparición precoz, insulinodependiente y no autoinmune. Se ha descrito menor prevalencia de cetoacidosis.
La atrofia óptica es un hallazgo constante y progresivo, que lleva a la ceguera en la edad adulta, y suele seguir a la DM.
La mayoría tienen una sordera neurosensorial bilateral para tonos agudos (con posterioridad se extiende a frecuencias más bajas), que aparece en la segunda década6.
La DI central se debe a una atrofia de los núcleos supraópticos y paraventriculares en la hipófisis posterior y en hipotálamo.
La historia natural de este síndrome sugiere que casi todos los pacientes desarrollarán la mayoría de las complicaciones de esta enfermedad neurodegenerativa progresiva. Evoluciona lentamente pero con mayor rapidez cuanto más precoz sea el inicio. El curso es progresivo en 10–20 años. El buen control de la diabetes no influye en el pronóstico. La edad de fallecimiento es en la tercera o cuarta década generalmente por fallo respiratorio central con atrofia del troncoencéfalo7,8.
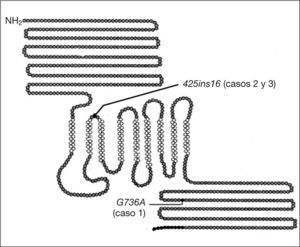
PacientesCaso 1Se trata de una niña de 11 años con padres sanos consanguíneos (primos en segundo grado). Tiene antecedente personal de comunicación interventricular, comunicación interauricular e hipertensión pulmonar, con resolución espontánea. A los 5,6 años inicia poliuria, polidipsia, polifagia y pérdida de peso de 1 mes de evolución; la analítica muestra glucemia de 217mg/dl. Se diagnostica DM insulinodependiente con anti-GAD (anticuerpos contra la enzima del ácido glutámico descarboxilasa) negativos. A los 6 años es remitida a oftalmología por mala visión. Se observa disminución de agudeza visual en ojo derecho, palidez de papila derecha y lentificación de potenciales evocados visuales (PEV) compatible con atrofia óptica. Ante sospecha de SW, se solicita estudio genético, que confirma el diagnóstico de presunción. Aparece en el exón 8 un patrón anómalo, la presencia de un cambio de guanina por citosina en el nucleótido 2206, el cual produce un cambio de una glicina a arginina en el aminoácido 736 de la proteína. Esta mutación se denomina G736A (fig. 1) en homocigosis y la heterocigosis en los padres. En la actualidad, con 6 años de evolución, ha iniciado DI. En un nuevo embarazo de la madre el estudio genético en el feto mostró que era portador de la misma mutación en heterocigosis9.
Caso 2Paciente varón con antecedentes familiares de consanguinidad (los abuelos eran primos hermanos) y antecedentes personales de tetralogía de Fallot intervenida (Blalock derecho). A los 3,6 años presenta clínica de poliuria, polidipsia y afectación del estado general. Se realizan analíticas y presenta glucemia 375mg/dl, junto con acidosis metabólica y cetonuria positiva, por lo que es diagnosticado de DM-1. A los 5 años del diagnóstico, en la revisión oftalmológica se aprecia discreta palidez de papilas, la cual se intensifica progresivamente, evolucionando a atrofia óptica. Se sospecha la posibilidad de SW. A los 6 años de evolución se aprecia temblor fino de extremidades superiores de discreto aumento intencional, junto con marcha en tándem inestable. Tras 8 años del diagnóstico, en el estudio otorrinológico presenta dificultad para la audición e hipoacusia perceptiva; con el tiempo precisó audífono en el oído derecho. A los 11 años del diagnóstico comenzó con clínica de poliuria no osmótica y fue diagnosticado de DI. A los 14 años de edad inicia desarrollo puberal, que se mantiene durante 2 años llegando a alcanzar un volumen testicular de 8ml, sin progresar. En el test de la hormona liberadora de la hormona luteinizante (LHRH) se aprecian valores muy elevados de hormona luteinizante (LH) y hormona foliculoestimulante (FSH), y bajos de testosterona. Se le diagnostica hipogonadismo hipergonadotrópico. El paciente presenta cierto deterioro mental con alteraciones psiquiátricas conductuales y síndrome depresivo.
Caso 3Paciente varón hermano del caso anterior descrito (caso 2). A los 3 años acude por cuadro de poliuria, polidipsia y pérdida de peso con glucemia capilar 373mg/dl. Se le diagnostica DM-1 cuando su hermano ya lleva 7 años de evolución. Se realiza estudio genético en ambos para confirmar la sospecha de SW. En el estudio genético muestra un patrón anómalo en el exón 4, la presencia de una inserción de 16 bases en el nucleótido 425. Esta mutación se denomina 425insl6 (fig. 1). Ambos hermanos presentan dicha mutación en homocigosis. Se realizó también estudio genético a la hermana, que presenta la mutación en heterocigosis. A los 15 años, en la revisión oftalmológica se observan papilas pálidas y atróficas, junto con alteraciones campimétricas, todo ello compatible con atrofia del nervio óptico. A los 17 años dejó de venir voluntariamente a nuestra consulta, sin haber constatado hasta entonces más problemas asociados al SW.
DiscusiónEl SW se trata de un trastorno autosómico recesivo; nuestra serie de casos muestra que existe consanguinidad entre los progenitores.
Presentan DM y atrofia óptica, que son considerados criterios diagnósticos fundamentales del SW. La progresión clínica de nuestros casos puede apreciarse en la tabla 1. La DM parece deberse a un trastorno degenerativo primario de la célula beta. Se trata de una diabetes insulinopénica con anticuerpos negativos. Suele ser la primera manifestación clínica, y aparece en la primera década de la vida; la edad media de aparición son los 4 años. La DM aparece en el 100% de los pacientes, sin tendencia a la cetosis generalmente. El desarrollo de complicaciones como la retinopatía es poco frecuente, menos grave y de progresión más lenta. Existe, asimismo, una baja incidencia de nefropatía y neuropatía. En el control de la evolución diabetológica de nuestros pacientes no se ha constatado la aparición de ninguna complicación asociada a la diabetes.
La atrofia óptica que suele aparecer en la primera década de la vida se presenta en el 100% de los pacientes. Causa una reducción de la visión del color y pérdida de la agudeza visual progresiva, pérdida de la visión periférica, llegando a ceguera en la mayoría de los pacientes por atrofia bilateral del disco óptico10. Dos de nuestros casos iniciaron la disminución de agudeza visual y palidez de la papila a la edad media de 5,5 años, sin embargo el caso 3 la presentó a los 15 años.
La DI aparece en la segunda década1, con una prevalencia estimada del 87 %, o incluso puede estar ausente. En una revisión española de 23 casos7 se observó una prevalencia de DI del 82,6%. Todos nuestros casos la han desarrollado.
La mayoría desarrollan una sordera neurosensorial bilateral con una prevalencia de casi el 65–73 %6 en nuestros casos 1 y 2. La sordera neurosensorial evoluciona con lentitud, aunque con mayor rapidez cuanto más precoz sea su inicio. Suele aparecer en la segunda década.
Las alteraciones urológicas asociadas suelen aparecer en la tercera década. Existe una alta prevalencia de vejiga neurogénica, por la alteración autonómica y también debida al elevado flujo de orina que se produce por la DI. Ello origina la hidronefrosis bilateral e hidrouréteres (afectación urinaria en el 58 % de los casos)7. Es importante el control farmacológico de la DI para disminuir estas alteraciones.
La afectación neurológica más común es la ataxia del tronco, que causa inestabilidad al andar y caídas. Así aparece en uno de nuestros casos. Suelen aparecer en la cuarta década. En 2001 se describieron varios casos homocigotos para una deleción 4bp en la posición 2648–2651, en el exón 8 del gen WFS111. En estos casos se observó una marcada atrofia cerebral en la resonancia magnética y todos fallecieron por insuficiencia respiratoria de origen central12.
En el SW la prevalencia de enfermedades graves mentales es del 25 %. A pesar de que la afectación psicológica es frecuente en enfermedades crónicas degenerativas, diversos estudios proponen que las enfermedades psiquiátricas son primariamente consecuencia de la alteración genética que se muestra en el SW13. También aparece alguna alteración en este sentido en los dos hermanos descritos. Aunque los síntomas que presentan son complejos, el más frecuente es la depresión y los trastornos del comportamiento. En una serie de 68 pacientes homocigotos, el 60 % presentaban depresión grave, psicosis y agresividad verbal y física13.
El gen del SW puede predisponer a homocigotos a defectos cardíacos congénitos del tronco arterial con una frecuencia baja de malformaciones cardíacas como la tetralogía de Fallot o arritmias ventriculares y auriculares presentadas en dos de nuestros casos.
Otras anormalidades incluyen atrofia gonadal (generalmente hipogonadismo hipergonadotrófico). En general, se produce un retraso en la maduración sexual con testículos pequeños, blandos, atróficos, menstruaciones irregulares y retraso de la menarquia. En la serie española mencionada7 presentaban también atrofia gonadal en el 75 % de los casos en varones y trastornos menstruales en el 62,5% de las mujeres.
En la actualidad parece existir correlación entre genotipo y fenotipo, y es mayor en aquellos pacientes con alteraciones en la cola COOH-terminal del gen de la wolframina y fenotipo más grave con sordera. Aunque existe una amplia variedad de mutaciones, la bibliografía médica sugiere que hay ciertos hot spot relacionados con manifestaciones psiquiátricas y sordera14.
A modo de conclusión, el SW presenta una morbilidad elevada con gran deterioro en la calidad de vida, así como alta mortalidad. El pronóstico de vida se halla en 25–49 años (media, alrededor de 30 años)1,5.
El seguimiento de estos pacientes es complejo pues precisan un enfoque multidisciplinario, tanto para el diagnóstico precoz de toda la patología que puede ir apareciendo, como para su tratamiento. El apoyo psicológico o psiquiátrico es también fundamental.
En la actualidad el estudio genético permite el diagnóstico antes de que aparezcan las manifestaciones clínicas, y se puede realizar incluso diagnóstico prenatal8.