El cambio en el manejo obstétrico y el avance de los cuidados perinatales ha conseguido mejorar la supervivencia de los RN prematuros, pero es fundamental conocer si esto conllevará un aumento de la discapacidad.
ObjetivoComparar en 2 periodos de tiempo las cifras de mortalidad y discapacidad a los 2 años de edad corregida, de niños con peso al nacimiento ≤1.500g y edad gestacional ≤32 semanas.
MetodologíaEstudio de seguimiento que incluyó 963 niños, nacidos en nuestra maternidad, entre 1991–2004 que reunían los criterios de estudio. Se ha evaluado la morbilidad neonatal, mortalidad y discapacidad a los 2 años de edad corregida en 2 periodos de tiempo 1991–1998 (periodo I) y 1999–2004 (periodo II) y analizado por subgrupos de peso (peso <1.000g y 1.000–1.500g).
ResultadosLa mortalidad disminuyó significativamente en el segundo periodo, tanto en los niños con peso ≤1.000g (32 vs. 44%) como en los de 1.000–1.500g (3,6 vs. 9%). Analizando en conjunto los niños ≤1.500g, se observó un aumento de los supervivientes sin discapacidad en el segundo periodo (69 vs. 60%, p=0,003); pero por subgrupos este incremento solo fue significativo en los de peso 1.000–1.500g, pasando del 67–82%.
ConclusionesEn nuestro estudio, analizando globalmente todos los niños ≤1.500g a lo largo del tiempo se ha objetivado un aumento de la supervivencia con disminución de la discapacidad. Analizando por subgrupos de peso, la supervivencia ha aumentado en ambos grupos y sin embargo, la discapacidad ha disminuido exclusivamente en los mayores de 1.000g.
Advances in perinatal care have resulted in increased survival rates for extremely low birth weight children, but it is fundamental to know if these improved survival rates have been accompanied by increased impairment rates.
ObjectiveTo compare, over two different time periods, the survival and disability rates at 2 years of corrected age, among newborns ≤32 weeks and weighed ≤1500g at birth.
MethodologyFollow-up study that included 963 children born in the hospital between 1991 and 2004 who met the study criteria. Neonatal morbidity, mortality and disability to 2 years of corrected age in 2 time periods 1991–1998 (period I) and 1999–2004 (period II) have been evaluated and analysed by subgroups of weight (weight <1000g and 1000–1500g).
ResultsMortality decreased significantly during the second period, both for children with birth weight <1000g (32% vs 44%) as for those with birth weight between 1000 and 1500 g ( 3,6% vs 9%). Analysing all children ≤1500g, an increase in the survivors without disability was observed in the second period (69% vs 60%, p=0.003); but by subgroups this increase only was significant in children with birth weight 1000–1500g (67% vs 82%).
ConclusionsIn our study, globally analysing all children with birth weight ≤1500g, it can be seen that there has been an increase in survival without an increase in the frequency of disabilities. Analysing by weight subgroups, survival has increased in both groups, but disability has decreased only in the birth weight 1000–1500g subgroup.
El cambio en el manejo obstétrico y el avance en los cuidados perinatales, fundamentalmente el empleo de los corticoides prenatales1 y la administración del surfactante exógeno2,3 han contribuido a un claro aumento de la supervivencia de los niños prematuros de muy bajo y de extremo bajo peso al nacer. Sin embargo, surge la preocupación de si este incremento en la supervivencia, no conllevará un aumento de la discapacidad. Hasta la fecha, los resultados de varios estudios efectuados son dispares4–25.
La tasa de supervivencia aislada no es el mejor indicador de calidad de una unidad neonatal, es fundamental considerar también la tasa de supervivencia sin discapacidad. Las implicaciones médicas, éticas y económicas derivadas del tratamiento de este grupo de niños son siempre objeto de debate y la única manera de conocer la adecuación del costebeneficio es mediante los estudios de seguimiento22.
Durante la primera mitad de la década de los 90s, los estudios efectuados a este respecto solían analizar la evolución de los niños de muy bajo peso al nacer (peso <1.500g)6–14, pero actualmente la mayoría de los artículos analizan la evolución de los RN de extremo bajo peso (peso <1.000g) porque es el grupo con mayor morbilidad a corto y a largo plazo15–25. La revisión de los datos de supervivencia con y sin discapacidad a nivel nacional, regional y por unidades de neonatología permite la comparación con otros grupos, sirve para valorar la calidad asistencial y ayuda en la toma de decisiones.
El objetivo de este trabajo es conocer si existen diferencias en cuanto a mortalidad durante el ingreso y discapacidad a los 2 años de edad corregida (EC) en los niños muy prematuros nacidos en nuestra maternidad, durante 2 periodos de tiempo (1991–1998 vs. 1999–2004) y en 2 subgrupos de peso. Se analizarán los factores perinatales que hayan podido influir en la evolución.
Pacientes y métodosDiseño del estudio: estudio de seguimiento de una cohorte de RN.
Población estudiada: todos los niños nacidos vivos con peso ≤1.500g y edad gestacional ≤32 semanas en la maternidad del Hospital 12 de Octubre de Madrid, sin malformaciones graves o cromosomopatías, entre el 01-01-1991–31-12-2004.
La población se dividió en 2 grupos: periodo I: nacidos entre el 01-01-1991–31-12-1998 y periodo II: nacidos entre el 01-01-1999–31-12-2004; haciendo a la vez 2 subgrupos en cada periodo según el peso al nacimiento (<1.000g y entre 1.000–1.500g).
Protocolo de estudio:
Los supervivientes al alta fueron controlados en la consulta de seguimiento, efectuándose revisiones de forma protocolizada por un neonatólogo, neurólogo y oftalmólogo infantil. La audición se valoró antes de los 6 meses de EC mediante otoemisiones acústicas y se realizaron potenciales evocados auditivos cuando las otoemisiones fueron negativas. A los 2 años de EC se realizó una valoración del cociente de desarrollo (CD), mediante la prueba de Brunet-Lézine hasta el año 2001 y de Bayley posteriormente.
Definición de las variables de interés:
a) Morbilidad durante el ingreso: displasia broncopulmonar: necesidad de oxígeno a las 36 semanas de EC. Enterocolitis necrotizante ≥2, según los criterios de Bell26. Ecografía cerebral con patología grave: hemorragia intraventricular grado III, según la clasificación de Papile27 o lesión parequimatosa grado 3 o 4, según adaptación de la clasificación de Hesser28 y de Kuban29. Retinopatía de la prematuridad ≥3, según la clasificación internacional30.
b) Seguimiento:
Estado de los supervivientes a los 2 años de EC: normal, con secuela leve o con discapacidad (secuela moderada o grave). Cuando un niño presentó más de una secuela se clasificó valorando la repercusión sobre su calidad de vida de todas las secuelas que presentaba.
Secuela leve: secuela no discapacitante que permite llevar una vida independiente sin precisar ningún tipo de cuidado especializado. Se incluyen la parálisis cerebral (PC) leve y el CD entre 71–84.
Secuela moderada: permite una vida normal, pero precisa algún tipo de cuidado no muy especializado. Se incluyen la PC moderada y el CD entre 60–70.
Secuela grave: impide la vida normal, con imposibilidad de deambulación o necesidad de cuidados especializados de manera permanente. Se incluyen la PC grave, el CD<60, la hipoacusia bilateral con necesidad de amplificación y la ceguera bilateral.
PC: desorden persistente, no progresivo y fijo de la postura y el movimiento de aparición precoz. Según la capacidad funcional, se consideró leve: la alteración del tono y los reflejos sin limitación funcional (cualquier niño diagnosticado de PC que hubiera conseguido la sedestación y la marcha antes de los 2 años de EC); moderada: niños que hubieran conseguido la sedestación sin apoyo pero aún no tuvieran marcha autónoma a los 2 años de EC; grave: no conseguida la sedestación sin apoyo a los 2 años de EC.
Análisis de los datos: se recogieron los datos de forma prospectiva durante todo el periodo de estudio y se incluyeron en una base de datos. Se realizó un análisis estadístico descriptivo de las variables de estudio según su naturaleza mediante el programa SSPS 15. Para comparación de variables cuantitativas se utilizó la t de Student y para variables cualitativas la prueba de chi cuadrado (χ2) o test de Fisher cuando era preciso. En los contrastes de hipótesis y comparación de medias se utilizó un nivel de significación estadística de p<0,05.
ResultadosPoblación: durante el periodo de estudio nacieron en nuestra maternidad 963 niños (474 en el periodo I y 489 en el periodo II) que reunían los criterios de inclusión.
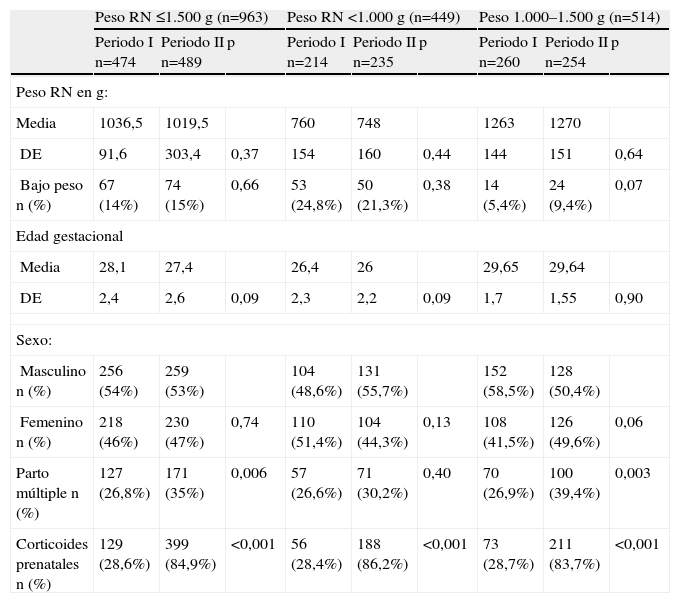
Características perinatales (tabla 1): la distribución por peso, edad gestacional y sexo de los niños en cada periodo fue similar. El porcentaje de parto múltiple fue mayor en el periodo II para el grupo de peso entre 1.000–1.500g (p=0,003). Se observó un aumento significativo en la administración de corticoides prenatales durante el periodo II, en ambos subgrupos de peso.
Datos perinatales de la población de estudio por subgrupos de peso
| Peso RN ≤1.500g (n=963) | Peso RN <1.000g (n=449) | Peso 1.000–1.500g (n=514) | |||||||
| Periodo I n=474 | Periodo II n=489 | p | Periodo I n=214 | Periodo II n=235 | p | Periodo I n=260 | Periodo II n=254 | p | |
| Peso RN en g: | |||||||||
| Media | 1036,5 | 1019,5 | 760 | 748 | 1263 | 1270 | |||
| DE | 91,6 | 303,4 | 0,37 | 154 | 160 | 0,44 | 144 | 151 | 0,64 |
| Bajo peso n (%) | 67 (14%) | 74 (15%) | 0,66 | 53 (24,8%) | 50 (21,3%) | 0,38 | 14 (5,4%) | 24 (9,4%) | 0,07 |
| Edad gestacional | |||||||||
| Media | 28,1 | 27,4 | 26,4 | 26 | 29,65 | 29,64 | |||
| DE | 2,4 | 2,6 | 0,09 | 2,3 | 2,2 | 0,09 | 1,7 | 1,55 | 0,90 |
| Sexo: | |||||||||
| Masculino n (%) | 256 (54%) | 259 (53%) | 104 (48,6%) | 131 (55,7%) | 152 (58,5%) | 128 (50,4%) | |||
| Femenino n (%) | 218 (46%) | 230 (47%) | 0,74 | 110 (51,4%) | 104 (44,3%) | 0,13 | 108 (41,5%) | 126 (49,6%) | 0,06 |
| Parto múltiple n (%) | 127 (26,8%) | 171 (35%) | 0,006 | 57 (26,6%) | 71 (30,2%) | 0,40 | 70 (26,9%) | 100 (39,4%) | 0,003 |
| Corticoides prenatales n (%) | 129 (28,6%) | 399 (84,9%) | <0,001 | 56 (28,4%) | 188 (86,2%) | <0,001 | 73 (28,7%) | 211 (83,7%) | <0,001 |
Comparación entre los periodos I y II.
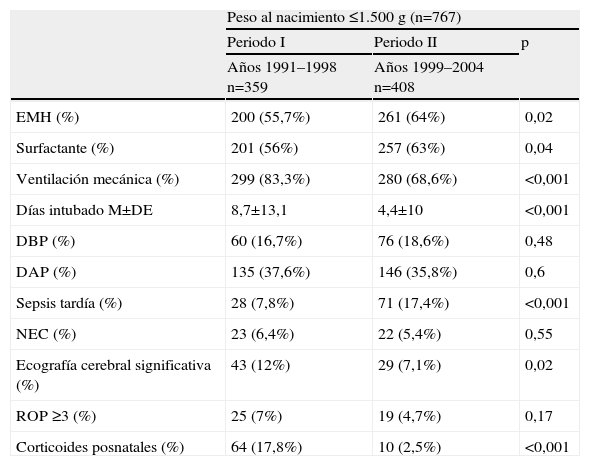
La morbilidad neonatal de los 767 supervivientes al alta que pudo influir en el seguimiento, se refleja en las tablas 2 y 3. El diagnóstico de membrana hialina fue mayor en los menores de 1.000g durante el periodo II. Se observaron cambios significativos en el manejo respiratorio durante el segundo periodo: en los menores de 1.000g fue mayor el número de niños que recibieron surfactante y en los 2 grupos de peso fue menor el porcentaje de niños con ventilación mecánica, el número de días de intubación y la administración de corticoides posnatales. La frecuencia de displasia broncopulmonar permaneció estable a lo largo del tiempo.
Morbilidad neonatal durante el ingreso de los supervivientes al alta peso RN ≤1.500g
| Peso al nacimiento ≤1.500g (n=767) | |||
| Periodo I | Periodo II | p | |
| Años 1991–1998 n=359 | Años 1999–2004 n=408 | ||
| EMH (%) | 200 (55,7%) | 261 (64%) | 0,02 |
| Surfactante (%) | 201 (56%) | 257 (63%) | 0,04 |
| Ventilación mecánica (%) | 299 (83,3%) | 280 (68,6%) | <0,001 |
| Días intubado M±DE | 8,7±13,1 | 4,4±10 | <0,001 |
| DBP (%) | 60 (16,7%) | 76 (18,6%) | 0,48 |
| DAP (%) | 135 (37,6%) | 146 (35,8%) | 0,6 |
| Sepsis tardía (%) | 28 (7,8%) | 71 (17,4%) | <0,001 |
| NEC (%) | 23 (6,4%) | 22 (5,4%) | 0,55 |
| Ecografía cerebral significativa (%) | 43 (12%) | 29 (7,1%) | 0,02 |
| ROP ≥3 (%) | 25 (7%) | 19 (4,7%) | 0,17 |
| Corticoides posnatales (%) | 64 (17,8%) | 10 (2,5%) | <0,001 |
DAP: ductus arterioso persistente; DBP: displasia broncopulmonar; EMH: enfermedad de membrana hialina; NEC: enterocolitis necrotizante; ROP: retinopatía de la prematuridad.
Comparación entre los periodos I y II.
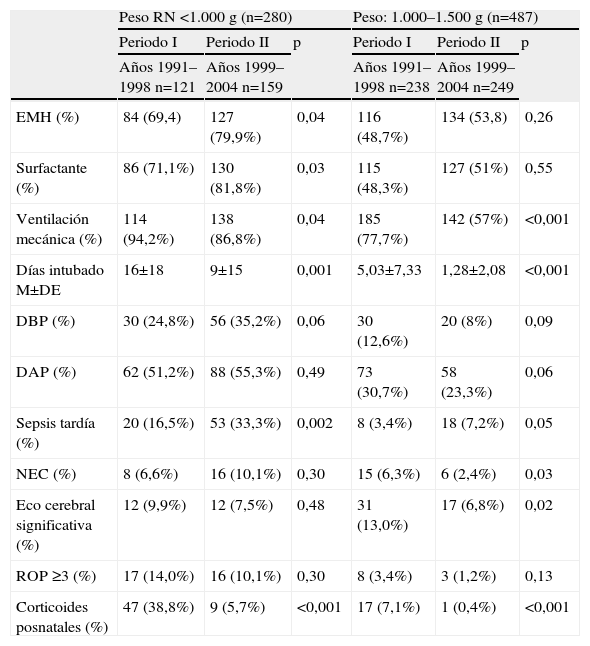
Morbilidad neonatal durante el ingreso de los supervivientes al alta por subgrupos de peso
| Peso RN <1.000g (n=280) | Peso: 1.000–1.500g (n=487) | |||||
| Periodo I | Periodo II | p | Periodo I | Periodo II | p | |
| Años 1991–1998 n=121 | Años 1999–2004 n=159 | Años 1991–1998 n=238 | Años 1999–2004 n=249 | |||
| EMH (%) | 84 (69,4) | 127 (79,9%) | 0,04 | 116 (48,7%) | 134 (53,8) | 0,26 |
| Surfactante (%) | 86 (71,1%) | 130 (81,8%) | 0,03 | 115 (48,3%) | 127 (51%) | 0,55 |
| Ventilación mecánica (%) | 114 (94,2%) | 138 (86,8%) | 0,04 | 185 (77,7%) | 142 (57%) | <0,001 |
| Días intubado M±DE | 16±18 | 9±15 | 0,001 | 5,03±7,33 | 1,28±2,08 | <0,001 |
| DBP (%) | 30 (24,8%) | 56 (35,2%) | 0,06 | 30 (12,6%) | 20 (8%) | 0,09 |
| DAP (%) | 62 (51,2%) | 88 (55,3%) | 0,49 | 73 (30,7%) | 58 (23,3%) | 0,06 |
| Sepsis tardía (%) | 20 (16,5%) | 53 (33,3%) | 0,002 | 8 (3,4%) | 18 (7,2%) | 0,05 |
| NEC (%) | 8 (6,6%) | 16 (10,1%) | 0,30 | 15 (6,3%) | 6 (2,4%) | 0,03 |
| Eco cerebral significativa (%) | 12 (9,9%) | 12 (7,5%) | 0,48 | 31 (13,0%) | 17 (6,8%) | 0,02 |
| ROP ≥3 (%) | 17 (14,0%) | 16 (10,1%) | 0,30 | 8 (3,4%) | 3 (1,2%) | 0,13 |
| Corticoides posnatales (%) | 47 (38,8%) | 9 (5,7%) | <0,001 | 17 (7,1%) | 1 (0,4%) | <0,001 |
DAP: ductus arterioso persistente; DBP: displasia broncopulmonar; EMH: enfermedad de membrana hialina; NEC: enterocolitis necrotizante; ROP: retinopatía de la prematuridad.
Comparación entre los periodos I y II.
La incidencia de sepsis tardía fue mayor durante el periodo II, en los menores de 1.000g y la de enterocolitis necrotizante fue menor en el periodo II, en los niños con peso entre 1.000–1.500g. Respecto a la ecografía cerebral, el porcentaje de patología grave se redujo en los niños entre 1.000–1.500g en el periodo II. No hubo cambios significativos en el porcentaje de ROP entre ambos periodos.
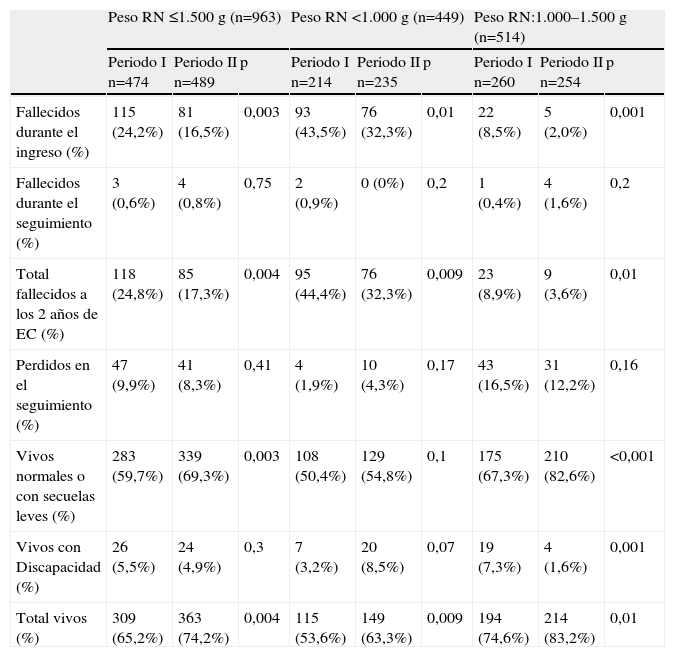
La mortalidad durante el ingreso disminuyó en ambos subgrupos de peso (tablas 4 y 5) y en el global de ≤1.500g descendiendo del 24% en el periodo I al 16% en el periodo II (p=0,003). La causa más frecuente de mortalidad en el conjunto de ≤1.500g fue durante el primer periodo, la patología respiratoria y durante el segundo, la infección nosocomial.
Estado de la población a los 2 años de edad corregida por subgrupos de peso
| Peso RN ≤1.500g (n=963) | Peso RN <1.000g (n=449) | Peso RN:1.000–1.500g (n=514) | |||||||
| Periodo I n=474 | Periodo II n=489 | p | Periodo I n=214 | Periodo II n=235 | p | Periodo I n=260 | Periodo II n=254 | p | |
| Fallecidos durante el ingreso (%) | 115 (24,2%) | 81 (16,5%) | 0,003 | 93 (43,5%) | 76 (32,3%) | 0,01 | 22 (8,5%) | 5 (2,0%) | 0,001 |
| Fallecidos durante el seguimiento (%) | 3 (0,6%) | 4 (0,8%) | 0,75 | 2 (0,9%) | 0 (0%) | 0,2 | 1 (0,4%) | 4 (1,6%) | 0,2 |
| Total fallecidos a los 2 años de EC (%) | 118 (24,8%) | 85 (17,3%) | 0,004 | 95 (44,4%) | 76 (32,3%) | 0,009 | 23 (8,9%) | 9 (3,6%) | 0,01 |
| Perdidos en el seguimiento (%) | 47 (9,9%) | 41 (8,3%) | 0,41 | 4 (1,9%) | 10 (4,3%) | 0,17 | 43 (16,5%) | 31 (12,2%) | 0,16 |
| Vivos normales o con secuelas leves (%) | 283 (59,7%) | 339 (69,3%) | 0,003 | 108 (50,4%) | 129 (54,8%) | 0,1 | 175 (67,3%) | 210 (82,6%) | <0,001 |
| Vivos con Discapacidad (%) | 26 (5,5%) | 24 (4,9%) | 0,3 | 7 (3,2%) | 20 (8,5%) | 0,07 | 19 (7,3%) | 4 (1,6%) | 0,001 |
| Total vivos (%) | 309 (65,2%) | 363 (74,2%) | 0,004 | 115 (53,6%) | 149 (63,3%) | 0,009 | 194 (74,6%) | 214 (83,2%) | 0,01 |
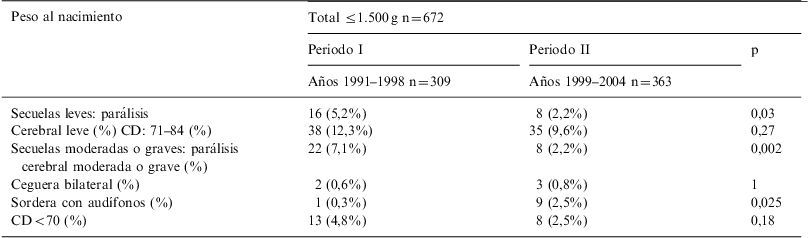
Tipos de secuelas de los supervivientes a los 2 años de edad corregida. Peso RN ≤1500g
| Peso al nacimiento | Total ≤1.500g n=672 | ||
| Periodo I | Periodo II | p | |
| Años 1991–1998 n=309 | Años 1999–2004 n=363 | ||
| Secuelas leves: parálisis | 16 (5,2%) | 8 (2,2%) | 0,03 |
| Cerebral leve (%) CD: 71–84 (%) | 38 (12,3%) | 35 (9,6%) | 0,27 |
| Secuelas moderadas o graves: parálisis cerebral moderada o grave (%) | 22 (7,1%) | 8 (2,2%) | 0,002 |
| Ceguera bilateral (%) | 2 (0,6%) | 3 (0,8%) | 1 |
| Sordera con audífonos (%) | 1 (0,3%) | 9 (2,5%) | 0,025 |
| CD<70 (%) | 13 (4,8%) | 8 (2,5%) | 0,18 |
CD: cociente de desarrollo.
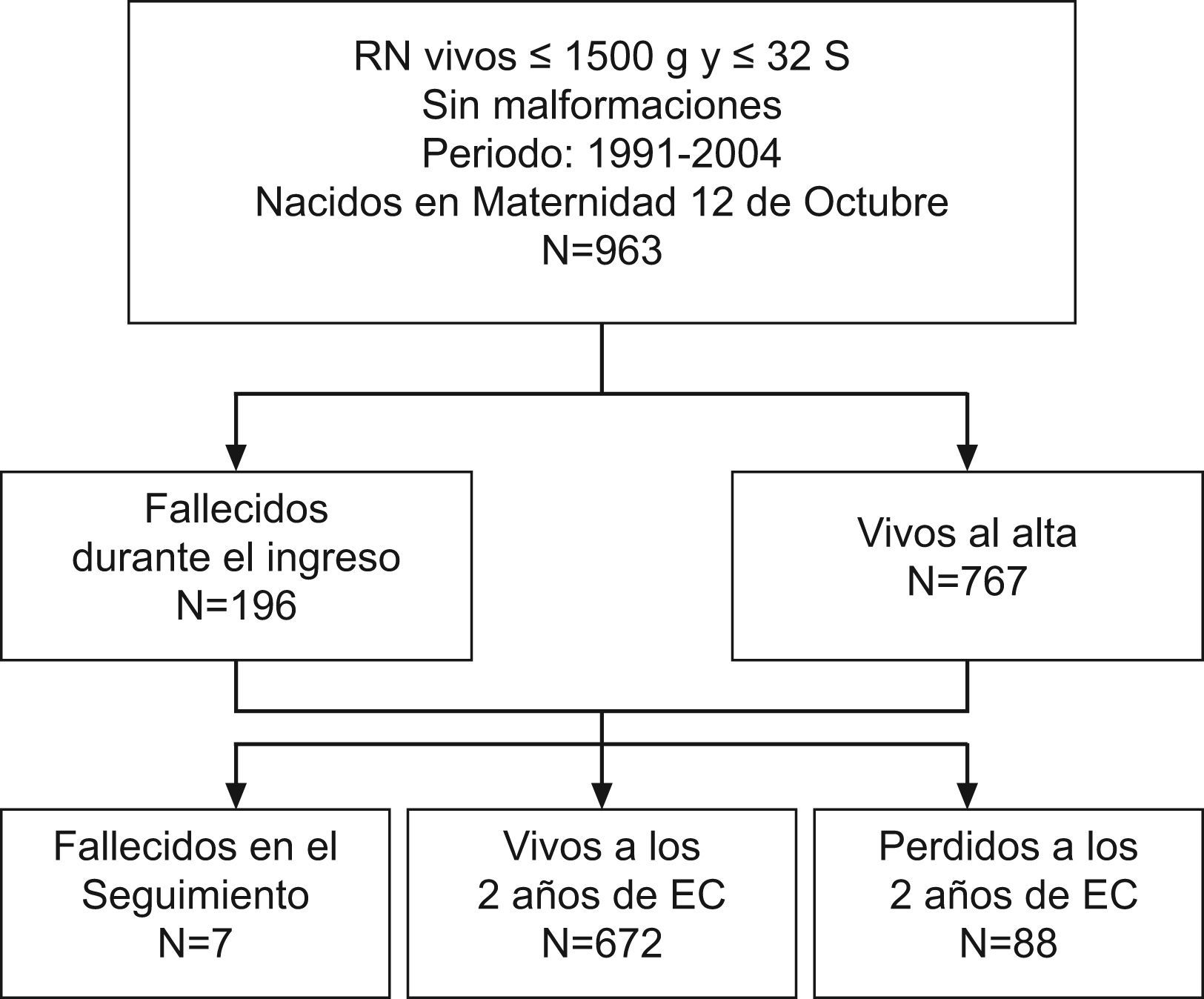
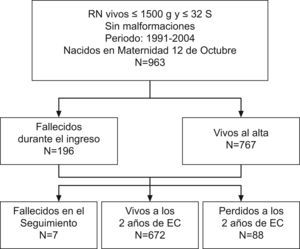
Estado de la población a los 2 años de EC. En la figura 1 y en las tablas 4 y 5 aparece reflejada la evolución de la población. El porcentaje de niños ≤1.500g perdidos en el seguimiento fue de un 9,9% en el periodo I y de un 8,3% en el periodo II. No hubo diferencias significativas en cuanto a los datos perinatales y de morbilidad entre los niños perdidos y los que se siguieron, que pudieran afectar la valoración de los resultados.
Analizando en conjunto los niños ≤1.500g, se observó un aumento de los supervivientes sin discapacidad en el segundo periodo (69 vs. 60%, p=0,003); pero por subgrupos este incremento solo fue significativo en los de peso entre 1.000–1.500g (tablas 4 y 5).
El tipo de secuelas aparece reflejado en las tablas 5, 6 y 7.
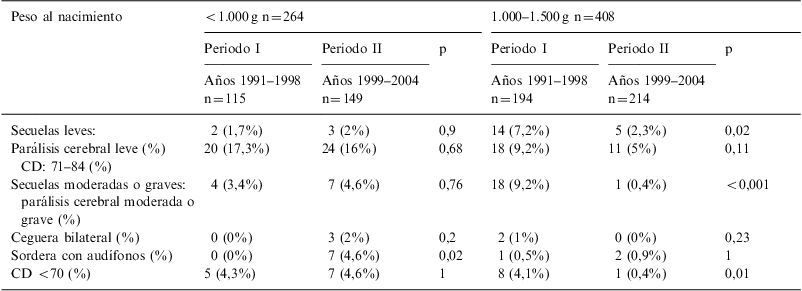
Tipos de secuelas de los supervivientes a los 2 años de edad corregida por subgrupos de peso
| Peso al nacimiento | <1.000g n=264 | 1.000–1.500g n=408 | ||||
| Periodo I | Periodo II | p | Periodo I | Periodo II | p | |
| Años 1991–1998 n=115 | Años 1999–2004 n=149 | Años 1991–1998 n=194 | Años 1999–2004 n=214 | |||
| Secuelas leves: | 2 (1,7%) | 3 (2%) | 0,9 | 14 (7,2%) | 5 (2,3%) | 0,02 |
| Parálisis cerebral leve (%) CD: 71–84 (%) | 20 (17,3%) | 24 (16%) | 0,68 | 18 (9,2%) | 11 (5%) | 0,11 |
| Secuelas moderadas o graves: parálisis cerebral moderada o grave (%) | 4 (3,4%) | 7 (4,6%) | 0,76 | 18 (9,2%) | 1 (0,4%) | <0,001 |
| Ceguera bilateral (%) | 0 (0%) | 3 (2%) | 0,2 | 2 (1%) | 0 (0%) | 0,23 |
| Sordera con audífonos (%) | 0 (0%) | 7 (4,6%) | 0,02 | 1 (0,5%) | 2 (0,9%) | 1 |
| CD <70 (%) | 5 (4,3%) | 7 (4,6%) | 1 | 8 (4,1%) | 1 (0,4%) | 0,01 |
CD: cociente de desarrollo.
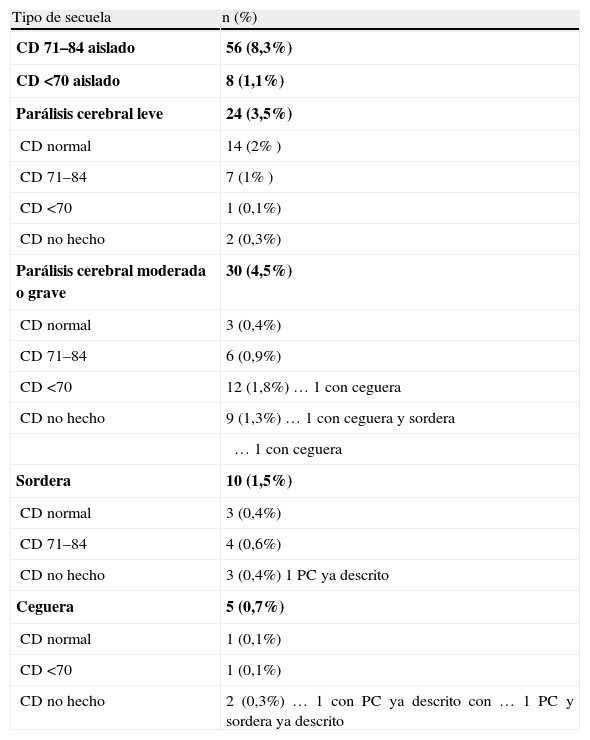
Descripción de las secuelas de forma combinada
| Tipo de secuela | n (%) |
| CD 71–84 aislado | 56 (8,3%) |
| CD <70 aislado | 8 (1,1%) |
| Parálisis cerebral leve | 24 (3,5%) |
| CD normal | 14 (2% ) |
| CD 71–84 | 7 (1% ) |
| CD <70 | 1 (0,1%) |
| CD no hecho | 2 (0,3%) |
| Parálisis cerebral moderada o grave | 30 (4,5%) |
| CD normal | 3 (0,4%) |
| CD 71–84 | 6 (0,9%) |
| CD <70 | 12 (1,8%) … 1 con ceguera |
| CD no hecho | 9 (1,3%) … 1 con ceguera y sordera |
| … 1 con ceguera | |
| Sordera | 10 (1,5%) |
| CD normal | 3 (0,4%) |
| CD 71–84 | 4 (0,6%) |
| CD no hecho | 3 (0,4%) 1 PC ya descrito |
| Ceguera | 5 (0,7%) |
| CD normal | 1 (0,1%) |
| CD <70 | 1 (0,1%) |
| CD no hecho | 2 (0,3%) … 1 con PC ya descrito con … 1 PC y sordera ya descrito |
CD: cociente de desarrollo; PC: parálisis cerebral.
La secuela más frecuente fue el retraso del desarrollo, no variando significativamente su incidencia a lo largo del tiempo.
La PC fue la segunda secuela más frecuente, disminuyendo de forma marcada su incidencia durante el segundo periodo en el conjunto de los ≤1.500g (leve: 5,2 vs. 2,2%, p=0,03; moderada o grave: 7 vs. 2%, p=0,002). Analizando por subgrupos, solo en el grupo de peso entre 1.000–1.500g se objetivó disminución significativa de su incidencia.
La sordera bilateral con necesidad de amplificación en los pacientes <1.000g, pasó de no haber ningún caso en el periodo I al 4,6% en el periodo II. La ceguera bilateral fue la secuela menos frecuente, sin variaciones significativas en los 2 periodos.
DiscusiónLos cuidados intensivos neonatales han permitido aumentar la supervivencia de los RN de muy bajo peso. Sin embargo, en contrapartida, varios autores refieren un aumento concomitante de la discapacidad sobre todo en los RN de extremo bajo peso17,18.
En nuestro estudio, analizando globalmente todos los ≤1.500g se ha objetivado a lo largo de los años, no solo un aumento significativo de la supervivencia sino de la supervivencia sin discapacidad. Por subgrupos de peso, la supervivencia ha aumentado en ambos; sin embargo, la supervivencia sin discapacidad lo hizo exclusivamente en los mayores de 1.000g.
Resulta complicado comparar nuestros datos con los de otros estudios debido tanto a la disparidad de criterios para definir las secuelas como a otras diferencias metodológicas. A pesar de ello, las cifras de mortalidad y discapacidad de nuestra serie son equiparables e incluso más bajas a las de otros estudios4–25. Además hay que tener en cuenta que solo se incluyeron los niños con peso ≤1.500g y edad gestacional ≤32 semanas, que son los de mayor riesgo de mortalidad y secuelas.
El tipo de secuela más frecuente en los 2 grupos de peso y en ambos periodos de estudio fue el retraso del desarrollo que con frecuencia estuvo unido a otras secuelas. La PC fue la segunda en frecuencia. Los porcentajes de PC en el último periodo en el grupo ≤1.500g son inferiores a los de la mayoría de las series publicadas31, pero solo disminuyó de forma significativa en los que pesaban entre 1.000–1.500g, al igual que en el estudio de Platt et al31,32. Respecto a la ceguera bilateral, el porcentaje osciló entre 0–2%, comparable al de otras series24,25. El porcentaje de niños con hipoacusia bilateral que precisaran amplificación se incrementó de forma significativa entre los menores de 1.000g en el último periodo, situándose en torno al 5% similar a otras series24,25; esto pudo deberse a una mejora diagnóstica más que a un incremento real de la misma.
Se eligió la valoración a los 2 años de EC con la finalidad de que la muestra de pacientes fuera amplia y a la vez adecuada para valorar resultados. A esta edad pueden detectarse la mayoría de los trastornos sensoriales y psicomotores graves, si bien se escapan alteraciones más leves del aprendizaje y de la conducta.
El porcentaje de pacientes perdidos en el seguimiento fue de un 9%, cifra que se considera aceptable para catalogar como válidos los resultados obtenidos33.
Respecto a aspectos perinatales vinculados con la evolución, los cambios más significativos a lo largo de los años han sido un incremento del número de partos múltiples como resultado de los tratamientos de esterilidad y un claro aumento de la administración de corticoides prenatales.
Durante el segundo periodo se implementaron una serie de cambios en el manejo de la patología respiratoria que pueden haber influido en la mejor evolución. Destacan el aumento de la administración de surfactante y la disminución del número de niños y de días que recibieron ventilación mecánica así como del uso de corticoides posnatales, que claramente se asocian a mejor evolución34,35.
A pesar de estas mejoras, la frecuencia de displasia broncopulmonar no disminuyó, tal vez uno de los factores que puede haber contribuido a este hecho fue el incremento de la sepsis nosocomial. Uno de nuestros objetivos actuales es disminuir la tasa de infección nosocomial que constituyó la causa más frecuente de mortalidad durante el último periodo.
En nuestra unidad en los últimos años se ha conseguido aumentar la supervivencia y disminuir la discapacidad en los niños mayores de 1.000g, pero se precisan nuevas estrategias dirigidas a mejorar el pronóstico a largo plazo de los menores de 1.000g, en los que solo se ha conseguido incrementar la supervivencia. Entre las medidas que nos pueden permitir mejorar el pronóstico de estos niños se encuentra la política encaminada a disminuir la infección nosocomial y la instauración cada vez más amplia de los cuidados centrados en el desarrollo36.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen el apoyo prestado para la elaboración de este trabajo a la Red de Salud Materno Infantil y Desarrollo financiada por el Instituto de Salud Carlos III (Ref RD08/0072).