Analizar la restricción posnatal del crecimiento en una cohorte de recién nacidos de muy bajo peso (RNMBP) y de no más de 32 semanas de gestación de 55 unidades de neonatología españolas (SEN 1500).
MétodosSe estudiaron peso, longitud y perímetro craneal al nacer y en el momento del alta. El peso se registró también a los 28 días de vida y 36 semanas de edad posmenstrual. Se analizó la relación entre restricción de crecimiento y datos perinatales y neonatales.
ResultadosSe incluyeron 2.317 niños. La puntuación Z de peso al nacer, a los 28 días, a las 36 semanas de edad posmenstrual y al alta fue, respectivamente, −0,66±1,3, −2,54±1,35, −3,12±1,7, −1,56±1,1. La puntuación Z de longitud al nacer y al alta fue −0,88±1,8 y −1,97±1,56, respectivamente; la puntuación Z del perímetro craneal al nacer fue −0,83±1,87 y en el momento del alta −0,60±1,96. Los factores relacionados con el grado de restricción de peso a los 28 días fueron: corticoides prenatales, edad gestacional, lugar de nacimiento, tipo de hospital, puntuación CRIB, ductus arterioso persistente sintomático y sepsis tardía. Estos factores sólo explicaron el 14 % de la variabilidad del grado de restricción. El peso y la longitud al alta fueron inferiores a P10 en el 77 % y el 80 % de los RNMBP, respectivamente.
ConclusionesLos RNMBP de no más de 32 semanas de gestación durante su estancia en las unidades de neonatología sufren una “restricción de crecimiento” respecto al patrón intrauterino. Esta restricción ocurre sobre todo en los primeros 28 días de vida y es diferente en distintas unidades españolas. Las variables estudiadas explican en escasa medida este fenómeno.
To analyze postnatal growth restriction in a cohort of very low birth weight (VLBW) infants with gestational age ≤ 32 weeks in 55 Spanish neonatal units (SEN 1500 Network) during 2002 and 2003.
MethodsWeight, length and head circumference were recorded at birth, and at discharge. Weight was also recorded at 28 days postnatal, and 36 weeks of postmenstrual age. Growth restriction was measured as the shift in weight z score from birth to 28th day.
ResultsThe study included 2317 VLBW infants. Weight z score at birth, 28 days, 36 weeks of postmenstrual age and discharge were: −0.66±1.3, −2.54±1.35, −3.12±1.7, −1.56±1.1, respectively. Length z score at birth and at discharge were: −0.88±1.8, and −1.97±1.56. Head circumference z score at birth and at discharge: −0.83±.87, and −0.60±1.96. Prenatal steroids, gestational age, place of birth, type of hospital, CRIB score, symptomatic patent ductus arteriosus and late-onset bacterial sepsis were related with the shift in weight z score at 28 days (multiple linear regression), but explained very little (14 %) of his change. Weight and length at discharge were under the 10th percentile in 77 % and 80 % of the infants, respectively.
ConclusionsVLBW infants ≤ 32 GA suffer postnatal growth restriction with respect to intrauterine growth pattern, which is more relevant in the first 28 days of life, in patients with more severe illnesses, and differs among neonatal units. Perinatal and neonatal items evaluated are poorly related with restriction.
La American Academy of Pediatrics1 sugiere que, con un cuidado y soporte nutricional óptimos, los recién nacidos prematuros extremos deberían crecer en las unidades de neonatología como lo hacen los fetos de la misma edad de gestación intrauterina. Sin embargo, en el momento actual, a pesar de los avances de la medicina perinatal y de protocolos nutricionales más agresivos2–4, la restricción posnatal de crecimiento (RPC) es la morbilidad más frecuente en los recién nacidos de muy bajo peso (RNMBP), especialmente en los prematuros extremos más graves5–10.
La RPC en RNMBP evidencia la dificultad que tienen los prematuros para adaptarse al medio extrauterino. Su cuantificación es sencilla, pero no existe consenso en su definición ni se utiliza de forma sistemática como indicador de gravedad o pronóstico de riesgo.
El objetivo de este trabajo es evaluar la magnitud de la RPC y los factores relacionados con ella, en prematuros de muy bajo peso (< 1.500g) y de hasta 32 semanas de gestación, tratados en 55 unidades de neonatología españolas pertenecientes a la red SEN 1500. Además, se pretende ofrecer los valores medios de RPC en nuestro país, de forma que cada unidad neonatal pueda comparar la RPC de sus RNMBP con relación a los de un elevado número de unidades españolas.
MétodosPacientesSe seleccionaron de la base de datos SEN 1500 los RNMBP con edad gestacional de hasta 32 semanas nacidos entre el 1 de enero de 2002 y el 31 de diciembre de 2003 (2.834 casos). Se excluyeron los que requirieron traslado a otro centro a partir del primer día de vida (64 casos, el 2 % del total) y los fallecidos antes del alta (453, el 16 %). La selección final incluyó a 2.317 pacientes.
SEN 1500 es una base de datos de RNMBP (peso al nacer < 1.500g) desarrollada por la Sociedad Española de Neonatología. En ella se registran de forma estructurada los datos perinatales, características de salud, complicaciones y tratamientos más significativos de los RNMBP. Las variables están definidas de acuerdo con los criterios de la red Vermont Oxford (Vermont Oxford Network Database Manual of operations [Release 2.0] Burlington, VT: Vermont Oxford Network, 1993).
Para mantener el anonimato en este estudio se eliminaron los campos de identificación de pacientes y a cada unidad de neonatología se le asignó un número aleatorio.
Las 55 unidades neonatales participantes son diferentes en cuanto a complejidad estructural (niveles 2 y 3) y en cuanto al volumen de pacientes. Las unidades se clasificaron según el número de pacientes tratados durante el período del estudio (2 años). Se establecieron cinco grupos: categoría A, menos de 25 casos; categoría B, 25–49 casos; categoría C, 50–74 casos; categoría D, 75–99 casos y categoría E, a partir de 100 casos tratados.
Valoración del crecimientoSe utilizaron como patrones de referencia para el cálculo de la puntuación Z de peso, longitud y perímetro craneal las curvas desarrolladas en España por Carrascosa et al11 para estas variables al nacimiento, según edad gestacional y sexo. El cálculo de la puntuación Z se realizó con la fórmula: (peso del paciente – peso medio para la misma edad de gestación según las curvas de referencia)/desviación estándar del patrón de referencia para la misma edad gestacional. La “desviación de crecimiento” respecto al patrón intrauterino se evaluó mediante la puntuación Z de peso al nacimiento, a los 28 días de vida, a las 36 semanas de la edad posmenstrual (EPM) y al alta. Se cuantificó la RPC mediante la disminución entre la puntuación Z de peso a los 28 días y la puntuación Z de peso al nacer. También se calculó la puntuación Z para la longitud y el perímetro craneal al nacer y alta.
A partir del peso al nacer, a los 28 días, a las 36 semanas y al alta, se calculó la ganancia en gramos/día para cada uno de estos períodos (0–28 días, 28–36 días, 36 días-alta). Además, se calculó para cada niño el incremento de la longitud y el perímetro craneal, en centímetros/semana, a partir de los respectivos valores al nacer y al recibir el alta.
Objetivo nutricionalEl objetivo nutricional común en las unidades de neonatología de la red SEN 1500 es alcanzar 130kcal/kg/día entre el octavo y décimo días de vida, empezando con nutrición trófica y aporte parenteral de 1g/kg/día de proteínas en las primeras 24h. Los datos sobre la ingesta real de nutrientes no se registraron en la base de datos y, por tanto, no están disponibles.
Análisis estadísticoLas variables cuantitativas se expresan como media ± desviación estándar y las cualitativas como porcentajes (%). Se evaluó la variación en el grado de disminución de la puntuación Z entre distintas categorías de hospitales mediante la comparación de Bonferroni. Para evaluar la relación entre RPC y variables cualitativas se utilizó el análisis de la varianza (ANOVA); la relación entre RPC y variables cuantitativas se estudió mediante la correlación de Pearson. Todas las variables que en el análisis univariante se asociaron significativamente a RPC (p < 0,05) se introdujeron en análisis de regresión lineal múltiple utilizando como variable dependiente la RPC a los 28 días de vida (puntuación Z de nacimiento – puntuación Z a los 28 días); la selección de variables para el modelo de regresión lineal múltiple se realizó mediante stepwise. La variación de la puntuación Z de peso, longitud y perímetro craneal entre el nacimiento y el alta se estudió mediante comparación de medias apareadas. Los análisis estadísticos se realizaron con el paquete SPSS versión 1212.
ResultadosCaracterísticas prenatales y al nacerSe estudiaron 2.317 RNMBP. La edad gestacional fue 29,1 ± 2,1 semanas. Fueron varones 1.139 (49 %). Se obtuvieron el 19 % de las gestaciones mediante técnicas de reproducción asistida, el 38 % fueron múltiples, el 91% recibieron adecuado control prenatal y el 80 % fueron tratadas con esteroides prenatales. Nacieron intramuros el 93 % y el 73 % de éstos mediante cesárea. El test de Apgar al minuto fue 6,4 ± 2,2 y a los 5min, de 8,3 ± 1,5. En el paritorio precisaron oxígeno el 74 %; ventilación con mascarilla, el 47 %; intubación, el 35 %, y agente tensiactivo, el 10,3 %. La puntuación CRIB (índice de riesgo clínico para niños) en las primeras 12h de vida fue 2,8 ± 2,8 puntos.
Complicaciones durante el ingresoLa estancia en las unidades de cuidados intensivos fue de 26,6 ± 24 días, mientras que la estancia hospitalaria total fue de 65 ± 26 días. Presentaron enfermedad de la membrana hialina el 54,7 %, recibieron agente tensiactivo el 52,8 % y precisaron presión positiva continua en la vía respiratoria (CPAP) 56 %. El 59,2 % requirió ventilación mecánica, que se mantuvo durante 6,9 ± 13 días; fueron tratados con ventilación de alta frecuencia el 7,2 %. Recibieron oxígeno el 82 % de los RNMBP, durante 21,7 ± 31 días; a los 28 días de vida precisaba oxígeno suplementario el 30 %, y a las 36 semanas de EPM, el 14 %. Se diagnosticó ductus arterioso persistente sintomático en el 23,6 %, que requirió tratamiento quirúrgico en el 3,7 % de las veces. La incidencia de sepsis precoz fue el 5,8 %; sepsis tardía, el 33 %, y sepsis por cándidas, el 4,9 %. Tuvieron enterocolitis necrosante el 6 %, hemorragia intraventricular el 24 % (grados III-IV 4,2 %), leucomalacia periventricular el 5,5 % (quística el 3,3 %) y retinopatía de la prematuridad el 22 % (estadio 3: el 3,3 %). Recibieron lactancia materna exclusiva durante todo el ingreso el 16,8 % de los niños; lactancia mixta, el 25,4 %, y lactancia artificial, el 57,9 %.
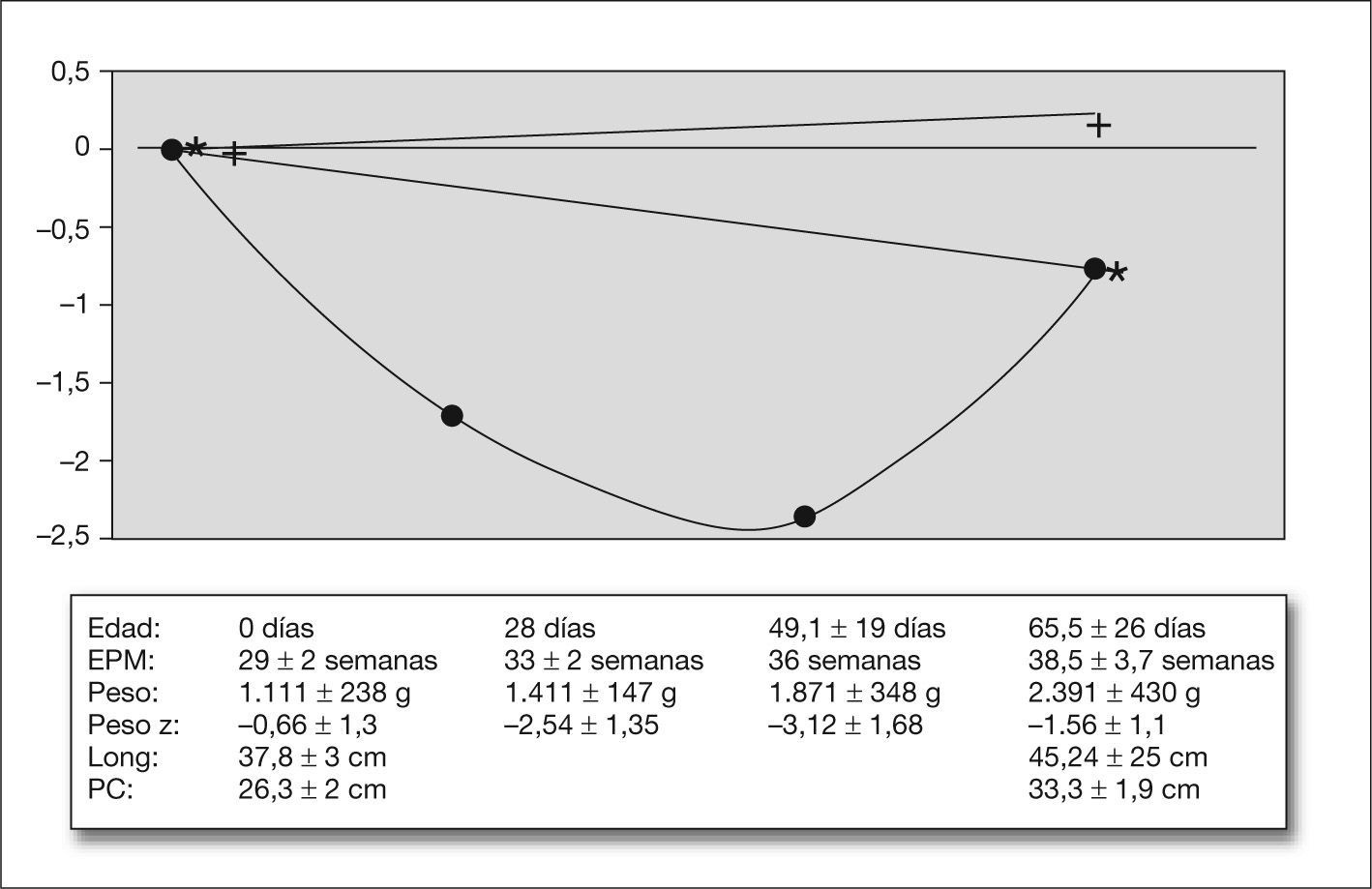
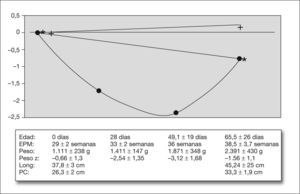
CrecimientoEl peso, longitud y perímetro craneal al nacer y en el momento del alta, así como los pesos a los 28 días y 36 semanas de EPM y las correspondientes puntuaciones Z, se muestran en el pie de la figura 1; el gráfico representa la evolución de la puntuación Z relativa con respecto al nacimiento. Tuvieron un peso por debajo del percentil 10 al nacer el 27 % de los recién nacidos estudiados.
El gráfico muestra los cambios relativos en el la puntuación de peso (•), longitud (*) y perímetro craneal (+) a los 28 días de vida, 36 semanas de EPM y al recibir el alta, con respecto a la puntuación Z al nacer. Debajo: peso y puntuación Z de peso al nacer, 28 días de vida, 36 semanas de EPM y al alta; longitud y perímetro craneal al nacer y al recibir el alta. EPM: edad posmenstrual; Long: longitud; PC: perímetro craneal.
Se objetivaron importantes diferencias en la RPC entre hospitales. Los RNMBP del hospital con mayor restricción de crecimiento posnatal perdieron una media de 2,7 puntos de puntuación Z a los 28 días, es decir, en este período ganaron sólo 5,1g/kg/día, mientras que en el hospital con mejor crecimiento la pérdida media de puntuación Z fue de 1,06 y la ganancia de peso de 14,5g/kg/día. Cuando se agruparon los hospitales por categorías según volumen de pacientes, se observó menor RPC en los RNMBP atendidos en hospitales con menos de 25 casos durante el período de estudio (disminución de la puntuación Z hospitales categoría A = 1,71 ± 0,85, categoría B = −1,88 ± 0,81, categoría C = −1,98 ± 0,88, categoría D = −1,79 ± 0,82, categoría E = −1,88 ± 0,81, p < 0,001); sin embargo, no se objetivó una relación proporcional entre número de casos y grado de RPC.
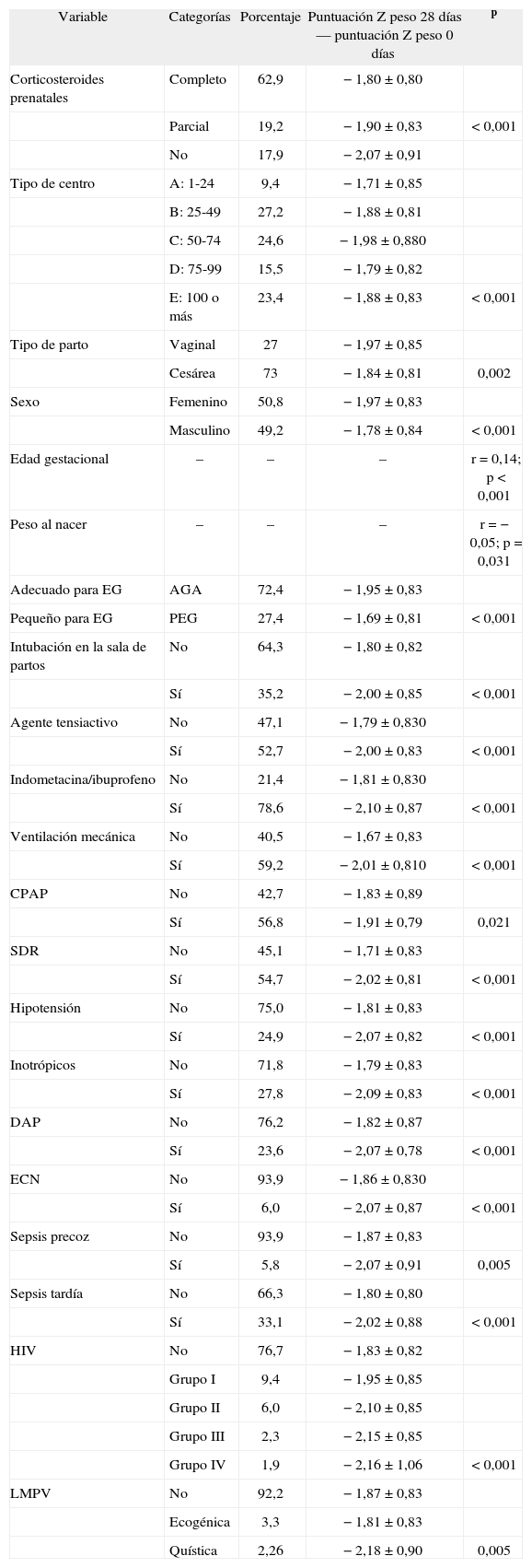
Variables relacionadas con el grado de RPC a los 28 días de vidaEn la tabla 1 se resume la relación entre variables cualitativas y RPC. Todas las variables cualitativas se relacionaron significativamente con la RPC excepto de tratarse de una gestación múltiple o única, nacimiento intramuros o extramuros y ausencia de atención prenatal. Entre las variables cuantitativas se relacionaron significativamente con la RPC los siguientes datos: edad gestacional (r = 0,14; p < 0,001), peso (r = −0,05; p = 0,031), puntuación Z de peso al nacer (r = −0,3; p < 0,001), puntuación Z de longitud al nacer (r = 0,06; p < 0,001), perímetro craneal al nacer (r = 0,06; p = 0,006), Apgar 1min (r = 0,08; p < 0,001), Apgar a los 5min (r = 0,08; p < 0,001), puntuación CRIB (r = −0,09; p < 0,000), FiO2 máxima (r = −0,16; p < 0,001), días con oxígeno (r = −0,09; p < 0,001), días con ventilación mecánica (r = −0,07; p = 0,001) y días de estancia en UCIN (r = −0,14; p < 0,001). Todas las correlaciones excepto el peso, fueron significativas en el sentido de que a mayor gravedad de la variable estudiada, mayor disminución de puntuación Z a los 28 días se observó. Los RNMBP con peor puntuación Z de peso y de longitud al nacer tuvieron menos caída de puntuación Z a los 28 días.
Relación entre variables cualitativas y restricción de crecimiento posnatal
| Variable | Categorías | Porcentaje | Puntuación Z peso 28 días — puntuación Z peso 0 días | p |
| Corticosteroides prenatales | Completo | 62,9 | −1,80 ± 0,80 | |
| Parcial | 19,2 | −1,90 ± 0,83 | < 0,001 | |
| No | 17,9 | −2,07 ± 0,91 | ||
| Tipo de centro | A: 1-24 | 9,4 | −1,71 ± 0,85 | |
| B: 25-49 | 27,2 | −1,88 ± 0,81 | ||
| C: 50-74 | 24,6 | −1,98 ± 0,880 | ||
| D: 75-99 | 15,5 | −1,79 ± 0,82 | ||
| E: 100 o más | 23,4 | −1,88 ± 0,83 | < 0,001 | |
| Tipo de parto | Vaginal | 27 | −1,97 ± 0,85 | |
| Cesárea | 73 | −1,84 ± 0,81 | 0,002 | |
| Sexo | Femenino | 50,8 | −1,97 ± 0,83 | |
| Masculino | 49,2 | −1,78 ± 0,84 | < 0,001 | |
| Edad gestacional | – | – | – | r = 0,14; p < 0,001 |
| Peso al nacer | – | – | – | r = −0,05; p = 0,031 |
| Adecuado para EG | AGA | 72,4 | −1,95 ± 0,83 | |
| Pequeño para EG | PEG | 27,4 | −1,69 ± 0,81 | < 0,001 |
| Intubación en la sala de partos | No | 64,3 | −1,80 ± 0,82 | |
| Sí | 35,2 | −2,00 ± 0,85 | < 0,001 | |
| Agente tensiactivo | No | 47,1 | −1,79 ± 0,830 | |
| Sí | 52,7 | −2,00 ± 0,83 | < 0,001 | |
| Indometacina/ibuprofeno | No | 21,4 | −1,81 ± 0,830 | |
| Sí | 78,6 | −2,10 ± 0,87 | < 0,001 | |
| Ventilación mecánica | No | 40,5 | −1,67 ± 0,83 | |
| Sí | 59,2 | −2,01 ± 0,810 | < 0,001 | |
| CPAP | No | 42,7 | −1,83 ± 0,89 | |
| Sí | 56,8 | −1,91 ± 0,79 | 0,021 | |
| SDR | No | 45,1 | −1,71 ± 0,83 | |
| Sí | 54,7 | −2,02 ± 0,81 | < 0,001 | |
| Hipotensión | No | 75,0 | −1,81 ± 0,83 | |
| Sí | 24,9 | −2,07 ± 0,82 | < 0,001 | |
| Inotrópicos | No | 71,8 | −1,79 ± 0,83 | |
| Sí | 27,8 | −2,09 ± 0,83 | < 0,001 | |
| DAP | No | 76,2 | −1,82 ± 0,87 | |
| Sí | 23,6 | −2,07 ± 0,78 | < 0,001 | |
| ECN | No | 93,9 | −1,86 ± 0,830 | |
| Sí | 6,0 | −2,07 ± 0,87 | < 0,001 | |
| Sepsis precoz | No | 93,9 | −1,87 ± 0,83 | |
| Sí | 5,8 | −2,07 ± 0,91 | 0,005 | |
| Sepsis tardía | No | 66,3 | −1,80 ± 0,80 | |
| Sí | 33,1 | −2,02 ± 0,88 | < 0,001 | |
| HIV | No | 76,7 | −1,83 ± 0,82 | |
| Grupo I | 9,4 | −1,95 ± 0,85 | ||
| Grupo II | 6,0 | −2,10 ± 0,85 | ||
| Grupo III | 2,3 | −2,15 ± 0,85 | ||
| Grupo IV | 1,9 | −2,16 ± 1,06 | < 0,001 | |
| LMPV | No | 92,2 | −1,87 ± 0,83 | |
| Ecogénica | 3,3 | −1,81 ± 0,83 | ||
| Quística | 2,26 | −2,18 ± 0,90 | 0,005 |
CPAP: presión positiva continua en la vía respiratoria; DAP: ductus arterioso persistente; ECN: esterocolitis necrosante; EG: edad gestacional; HIV: hemorragia intraventricular; LMPV: leucomalacia periventricular; RPC: restricción posnatal de crecimiento; SDR: síndrome de dificultad respiratoria.
En el modelo de regresión lineal, los predictores de RPC fueron: corticoides prenatales (menor RPC en los RNMBP que habían recibido corticoides), edad gestacional (mayor RPC a menor edad gestacional), puntuación Z de peso al nacimiento (menos RPC los que tuvieron menor puntuación Z al nacer), CRIB en las primeras 12h (mayor RPC cuanto peores son las puntuaciones), ductus arterioso sintomático (mayor RPC), sepsis tardía (incrementa la RPC) y categoría de hospital (mayor RPC en unidades con mayor número de pacientes tratados). El conjunto de estos factores explicó sólo el 14 % de la variabilidad de la RPC.
DiscusiónNuestro estudio muestra que la RPC en RNMBP es un fenómeno general y grave en las unidades de neonatología españolas. Los 2.317 RNMBP estudiados tuvieron al nacer una puntuación Z de peso de −0,66 ± 1,3 (percentil 32). Durante los primeros 28 días de vida sufrieron una disminución de la puntuación Z de 1,88 ± 0,84 puntos (bajo el percentil 3). Aunque la pérdida de peso fue más acusada durante los primeros 28 días, la desviación con respecto al patrón de referencia continuó hasta las 36 semanas EPM (siete semanas después del nacimiento). A partir de este momento se observó una recuperación del peso (catch-up), aun así la puntuación Z de peso al alta seguía siendo menor que la puntuación Z al nacimiento (el peso al alta se encontraba por debajo del percentil 10 para la EPM en el 77 % de los RNMBP).
Actualmente no existe consenso en la forma de definir ni de medir la RPC. La variación secuencial de la puntuación Z entre el nacimiento, los 28 días de vida, las 36 semanas de EPM y/o el alta parece la forma adecuada. Algunos autores han encontrado que la máxima pérdida de peso ocurre durante los primeros 14 días de vida y, a partir de este momento, aunque no hay recuperación de lo perdido, el incremento de peso sigue paralelo al intrauterino hasta las 8 semanas; sin embargo, no aportan datos de peso entre los 14 y 56 días5,6. Otros refieren que el incremento de peso semejante al intrauterino se inicia a partir de que se ha recuperado el peso del nacimiento (entre los 11 y 15 días de edad)7. Embleton et al10 sólo apreciaron una estabilización a partir de la segunda semana de vida en prematuros mayores de 30 semanas de gestación, mientras que en los niños de menor edad gestacional la puntuación Z continuó disminuyendo hasta las 5 semanas de vida posnatal. Recientemente, se ha descrito un retraso de crecimiento tardío en niños con peso al nacer inferior a 1.000g que se habían mantenido por encima del percentil 10 hasta las 33 semanas de EPM, debido a que su ganancia ponderal fue menor que la rápida aceleración de peso fetal que se observa entre las semanas 32 y 3813; asimismo, se ha observado una disminución transitoria de la velocidad de crecimiento alrededor de las 3 semanas y de los 3 meses de vida14. También nosotros hemos observado un aumento en la RPC entre los 28 días de vida (33 ± 2 semanas de EPM) y las 36 semanas de EPM (49,1 ± 19 días), cuando la mayoría de los niños están clínicamente más estables.
A pesar de esta variabilidad respecto al modo y momento de medir la RPC, ésta queda bien reflejada en que los diferentes modelos de curvas de peso posnatal para RNMBP9,15–18 se alejan indefectiblemente de las de crecimiento intrauterino. En los últimos años, los avances en medicina perinatal y una nutrición más agresiva en el período posnatal inmediato2–4,7,18 han reducido algo este fenómeno.
Múltiples factores se han relacionado con la RPC5–10. Entre los RNMBP españoles, los más inmaduros y más graves son los que mayor RPC presentaron. Sin embargo, como ya se había detectado en estudios previos, los
indicadores de gravedad explicaron muy poco (el 14 %) de la variación de la restricción de peso. Desafortunadamente, SEN 1500 no dispone de información nutricional que permita cuantificar el déficit calórico y proteico acumulado en los primeros días de vida posnatal; en otras series, este déficit, aunque no explica suficientemente el fenómeno, es el que más se relaciona con él10,19.
En nuestro estudio, los RNMBP con peso al nacer inferior al P10 (27,4 %), sufrieron una menor RPC que los niños con peso adecuado a su edad gestacional. Este fenómeno había sido descrito previamente7,20. Es posible que la pérdida de líquido que tiene lugar en las dos primeras semanas de vida sea menor en los niños con restricción de crecimiento intrauterino, o bien que prenatalmente hayan sufrido modificaciones en su metabolismo para hacer frente a la precariedad nutricional. Recientemente, se han implicado factores genéticos individuales que modulan tanto la regulación del crecimiento posnatal como la adaptación a situaciones de malnutrición21,22.
La RPC que ocurre en prematuros extremos tiene similitudes con la restricción del crecimiento intrauterino secundario a la insuficiencia placentaria que ocurre intraútero en fetos de la misma edad gestacional, y sobre cuyos efectos adversos a largo plazo existen abundantes datos, tanto en experimentación animal23–25 como en el ser humano26–29. Por ello, el estudio de la RPC y de sus repercusiones no debiera limitarse al período entre el nacimiento y el alta30. La experiencia en las clínicas de seguimiento demuestra que algunos de estos neonatos recuperan el perímetro craneal y, posteriormente, el peso y la longitud en los primeros meses de vida, mientras que otros pueden tardar años en recuperar el carril de crecimiento que les corresponde31. Todavía no conocemos qué patrón de crecimiento recuperador (catch-up) es el mejor para los RNMBP: un catch-up insuficiente se ha relacionado con problemas de desarrollo neurológico32, mientras que un catch-up excesivo se ha asociado a síndrome metabólico, enfermedad cardiovascular y diabetes tipo 1 en la edad adulta21,28.
La RPC en las distintas unidades de neonatología españolas estudiadas no es uniforme. Existen diferencias importantes, tanto entre hospitales como entre categorías de hospitales según el número de pacientes tratados; las unidades que trataron menor número de casos son las que tuvieron menor RPC. Otros estudios también han mostrado diferencias en la RPC entre centros33,34. La variabilidad en ganancia ponderal no dependiente de factores demográficos ni de complicaciones médicas entre los RNMBP de distintas unidades sugiere que existen diferencias locales en los protocolos de actuación; la identificación de estas diferencias entre hospitales y el desarrollo de programas educativos para implementar las pautas de actuación de los centros con mejores resultados ha mostrado ser eficaz para aumentar el crecimiento de los RNMBP35.
La determinación de la longitud fetal y neonatal es más imprecisa que la del peso, por lo que habitualmente los cambios se calculan en intervalos de 4 semanas. Entre las semanas 29 y 38 los fetos crecen intraútero alrededor de 5cm/4 semanas (1,2cm/semana). En este intervalo los RNMBP españoles crecieron: 4,1 ± 1,8cm/4 semanas o 0,9 ± 0,7cm/semana, es decir, frenaron su velocidad y se apartaron de su carril de crecimiento intrauterino. La puntuación Z de longitud continuó por debajo de la puntuación Z al nacer (la longitud en el momento del alta se situó bajo el percentil 10 para la EPM en el 80 % de los RNMBP). El “freno” en longitud durante la RPC también ha sido descrito por otros autores4,30 y pone en evidencia la gravedad del fenómeno. Una malnutrición que repercute en la longitud siempre es patológica32,36.
Hay algunas limitaciones que es necesario tener en cuenta al interpretar los resultados de este estudio. Las mediciones de peso, longitud y perímetro craneal no estaban rigurosamente estandarizadas y se realizaron según los protocolos locales. El aporte nutricional real que recibió cada niño no se conoce. Es posible que existan diferencias en las pautas de tratamiento y nutrición entre centros relevantes con respecto al crecimiento posnatal, pero esos datos no están disponibles.
En conclusión, la RPC es un fenómeno general en gran número de unidades de neonatología españolas, que afecta con mayor intensidad a los niños más inmaduros y más graves. La disparidad en el crecimiento posnatal de los RNMBP observada entre hospitales sugiere que se puede reducir este fenómeno, aunque para ello se requiere identificar las diferencias de actuación más relevantes entre los centros con mejores y peores resultados, e implementar los cambios necesarios. Se necesitan estudios de seguimiento a largo plazo para determinar los patrones de crecimiento asociados con una mejor evolución y conocer el impacto real de este fenómeno en el desarrollo de los RNMBP hasta la vida adulta.
AgradecimientosQuisiéramos expresar nuestro agradecimiento a todas las unidades que participan en la base de datos SEN 1500.