Determinar el rendimiento de espirometría y oscilometría respiratoria (RO) para predecir crisis de asma graves (CAG) en niños.
MétodosEn un estudio prospectivo, 148 niños (6-14 años) con asma realizaron RO, espirometría y prueba broncodilatadora. Se clasificaron en fenotipos de atrapamiento aéreo (ATA), limitación del flujo aéreo (LFA) y normal, según la espirometría y prueba broncodilatadora. A las 12 semanas fueron revalorados respecto a aparición de CAG. Se analizó el rendimiento de los parámetros de RO, espirometría y fenotipos ATA/LFA para predecir la aparición de CAG con cocientes de probabilidad positivos y negativos (LR+/LR−), área bajo la curva de curvas ROC y análisis multivariante ajustado por posibles factores de confusión.
ResultadosUn 7,4% tuvo CAG en el seguimiento, con diferencias según fenotipo (Normal 2,4%; LFA 17,9%; ATA 22,2%; p=0,005). La mejor área bajo la curva fue del flujo espiratorio forzado 25-75% (FEF25-75): 0,787; intervalo de confianza 95%: 0,600-0,973. También tuvieron áreas bajo la curva significativas el área de reactancia (AX), el volumen espiratorio forzado en el primer segundo (FEV1), el cambio post-broncodilatador en capacidad vital forzada (FVC), y FEV1/FVC. Todas las variables tenían una baja sensibilidad para predecir CAG. La mejor especificidad correspondía al fenotipo ATA: 93,8% (intervalo de confianza del 95% 87,9-97,0), pero solo FEF25-75 tenía tanto LR+ como LR− significativos. En el análisis multivariante, solo algunos parámetros de espirometría fueron significativos para predecir CAG (fenotipo ATA, FEF25-75 y FEV1/FVC).
ConclusionesLa espirometría tiene un rendimiento superior a la RO para predecir CAG a medio plazo en escolares con asma.
To determine the performance of spirometry and respiratory oscillometry (RO) in the prediction of severe asthma exacerbations (SAEs) in children.
MethodsIn a prospective study, 148 children (age 6–14 years) with asthma were assessed with RO, spirometry and a bronchodilator test. Based on the findings of spirometry and the bronchodilator test, they were classified into 3 phenotypes: air trapping (AT), airflow limitation (AL) and normal. Twelve weeks later, they were re-evaluated in relation to the occurrence of SAEs. We analysed the performance of RO, spirometry and AT/AL phenotypes for prediction of SAEs by means of positive and negative likelihood ratios (LR+/LR–), ROC curves with the corresponding areas under the curve and a multivariate analysis adjusted for potential confounders.
ResultsDuring the followup, 7.4% of patients had SAEs, and there were differences between phenotypes (normal, 2.4%; AL, 17.9%; AT, 22.2%, P=.005). The best area under the curve corresponded to the forced expiratory flow between 25% and 75% of vital capacity (FEF25–75): 0.787; 95% confidence interval, 0.600-0.973. Other significant areas under the curve were those for the reactance area (AX), forced expiratory volume in the first second (FEV1), the post- bronchodilator change in forced vital capacity (FVC), and the FEV1/FVC ratio. All of the variables had a low sensitivity for prediction of SAEs. The AT phenotype had the best specificity (93.8%; 95% confidence interval, 87.9-97.0), but LR+ and LR– were both significant only for the FEF25–75. In the multivariate analysis, only some spirometry parameters were significative for prediction of SAEs (AT phenotype, FEF25–75 and FEV1/FVC).
ConclusionsSpirometry performed better than RO for prediction of SAEs in the medium term in schoolchildren with asthma.
La principal morbilidad del asma en niños se debe a crisis graves, que en la definición de la American Thoracic Society (ATS) y la European Respiratory Society (ERS) se corresponden con las crisis que requieren tratamiento con corticoides sistémicos1. La historia de crisis recientes es su principal factor predictor2, pero se han identificado otros muchos factores y marcadores de riesgo (clínicos, sociales, ambientales, psicológicos, biomarcadores), y no hay un estándar definitivo para la predicción de crisis a corto o medio plazo3. Se han desarrollado varias reglas y scores clínicos, con múltiples variables, que podrían ser herramientas útiles de predicción de crisis en niños4–6.
Una de las variables habitualmente consideradas es la función pulmonar. Su capacidad para predecir el riesgo de crisis de asma se ha estudiado con métodos convencionales, como la espirometría7. La creciente utilización de la oscilometría respiratoria (RO), una técnica que exige poca colaboración por parte del paciente8, ha llevado también a investigar su utilidad para predecir la aparición de crisis. La RO es especialmente sensible para identificar alteraciones en las vías aéreas pequeñas (VAP)9, y puede que las VAP tengan importancia clínica, terapéutica y pronóstica en el asma10. En adultos, potentes estudios prospectivos han encontrado una asociación entre la alteración de VAP y el riesgo de crisis o mal control del asma en el año siguiente11. En niños, un reciente metanálisis concluye que algunos parámetros de RO podrían predecir la aparición de crisis12. Sin embargo, los estudios prospectivos en niños son pocos, de pequeño tamaño, y con problemas metodológicos que impiden obtener conclusiones firmes.
Por otra parte, algunos parámetros de la espirometría también pueden ser indicadores de una afectación de las VAP. El flujo espiratorio forzado entre el 25-75% (FEF25-75) de la capacidad vital forzada (FVC) es un indicador clásico de obstrucción de la VAP13. Además, la obstrucción de las VAP induce atrapamiento aéreo (ATA), un fenómeno que puede evaluarse indirectamente mediante la espirometría14. Sorkness et al.15 describieron un fenotipo ATA en niños con asma, definido mediante espirometría como una disminución de la FVC o un aumento significativo de FVC tras administrar un broncodilatador, y lo diferenciaron de otro fenotipo con limitación al flujo aéreo (LFA) pero sin atrapamiento (sin una afectación apreciable de la VAP). Encontraron que ese fenotipo ATA se asociaba a la historia reciente de crisis15. Sin embargo, otros autores han observado que ese fenotipo ATA es infrecuente en niños con asma, se encuentra en muchas otras enfermedades respiratorias, y se hace más frecuente con la edad16.
Son necesarios estudios prospectivos que contribuyan a identificar los patrones de función pulmonar asociados con el riesgo de crisis en niños, incluyendo los que exploran las VAP. El objetivo de este estudio es comparar la capacidad de la RO y la espirometría para predecir la aparición de crisis de asma graves (CAG) en niños en edad escolar.
MétodosDiseñoEstudio prospectivo de evaluación de precisión diagnóstica.
MuestraLos pacientes fueron reclutados en consultas de atención primaria y en la consulta de neumología pediátrica de un hospital terciario. Los criterios de inclusión fueron: a) edad 6-14 años, b) diagnóstico clínico de asma (síntomas episódicos típicos, reversibles con el tratamiento antiasmático, y sin síntomas, signos ni historia sugerentes de otros diagnósticos), c) haber tenido síntomas de asma o haber recibido tratamiento para el asma en los 12 meses previos. Se incluyó a pacientes de cualquier espectro de gravedad. Se excluyó a los niños con contraindicaciones relativas de la espirometría17.
ProcedimientoEn una primera visita (V0) se recogieron datos demográficos, historia reciente de crisis, consultas y hospitalizaciones por asma, nivel de tratamiento según la Global Initiative for Asthma18, se realizaron las pruebas de función pulmonar y se determinó el grado de control del asma. En una segunda visita (V1), 12 semanas después, se registró la evolución clínica entre V0-V1 (necesidad de consulta no programada o urgente en atención primaria o en el hospital [NPU], crisis de asma que precisaron el uso de corticoides sistémicos [CAG] y hospitalización por asma), cambios en el nivel de tratamiento entre V0-V1, y se volvió a determinar el grado de control del asma. La información clínica se obtuvo mediante entrevista con los cuidadores principales y revisión de los registros clínicos. Los estudios de función pulmonar se realizaron durante 7 meses consecutivos (octubre-abril) en consultas específicas no relacionadas con la asistencia clínica, y los pediatras responsables no fueron informados de sus resultados hasta después de V1.
MedicionesSe instruyó a los participantes para evitar el uso de cualquier medicación para el asma en las 18 horas anteriores a la realización de los estudios de función pulmonar, que se hicieron siempre en el mismo orden8: RO→espirometría→prueba broncodilatadora (BD). Se utilizaron filtros vírico-bacterianos de alta eficacia, y los aparatos fueron calibrados diariamente.
La RO se realizó mediante un sistema Tremoflo C-100 (Thorasys Thoracic Medical Systems, Montreal, Canadá), siguiendo las recomendaciones ERS8. Una prueba se consideró válida cuando se consiguieron 3 maniobras aceptables con coeficiente de variación de la resistencia a 5Hz (R5)≤15%. Para el análisis se utilizó la media de los valores obtenidos de R5, de la diferencia entre la resistencia a 5 y 19Hz (R5-19) y del área bajo la curva (AUC) de reactancia (AX), expresados como z-scores o desviaciones estándar (DE) según las ecuaciones de referencia de Ducharme et al19. Los resultados más altos de resistencia y del área de reactancia implican peor mecánica respiratoria, y se consideraron alterados cuando z-score>1,645 DE20.
La espirometría se realizó con un espirómetro Pneumotrac y software Spirotrac-5 (Vitalograph Ltd, Buckingham, Reino Unido) siguiendo las recomendaciones ATS/ERS17. Las variables recogidas fueron: FVC, volumen espiratorio forzado en el primer segundo (FEV1), su relación (FEV1/FVC) y FEF25-75. Se consideraron válidas solo las pruebas en las que se consiguieron≥2 maniobras aceptables con diferencia≤0,15litros tanto para FEV1 como para FVC17. Los resultados se expresaron como z-scores según las ecuaciones de referencia Global Lung Initiative21, y se consideraron alterados cuando z-score<−1,645 DE20.
Se realizó una prueba BD mediante la administración de 4 dosis de un inhalador presurizado de salbutamol (100μg/dosis), a través de una cámara de inhalación Optichamber Diamond (Philips Respironics, Eindhoven, Países Bajos), repitiéndose la espirometría 20min después. El cambio en FEV1 y FVC se midió como porcentaje de cambio respecto al valor teórico, y se consideró un aumento>10% como respuesta broncodilatadora positiva, de acuerdo con las últimas recomendaciones ERS/ATS20.
Los pacientes se clasificaron en fenotipos de función pulmonar según Sorkness et al.15:
- 1)
ATA: FVC<−1,645 DE o cambio en FVC tras BD>10%.
- 2)
LFA: FEV1/FVC<−1,645 DE y no cumple criterios ATA.
- 3)
Normal: los que no cumplían criterios ATA ni LFA.
El control del asma se determinó mediante el cuestionario CAN (versión cuidadores)22, que evalúa el control del asma en las 4 semanas anteriores mediante 9 ítems en escala Likert. Las respuestas se puntúan de 0 a 4 (puntuación total del cuestionario, 0 a 36), correspondiendo la menor puntuación a un mejor control. Un CAN≥8 identifica el asma mal controlada. La versión del CAN para ser respondida por los niños no se utilizó para hacer homogénea la recogida de información en todo el rango de edad.
AnálisisLa variable primaria del estudio fue la ocurrencia de CAG entre V0-V1. Variables secundarias fueron consultas NPU entre V0-V1, y mal control del asma en V1.
Las variables se describieron con medias, medianas, DE e intervalos intercuartílicos (rango intercuartílico), según el caso. Las frecuencias se compararon mediante chi cuadrado y las variables cuantitativas con pruebas de Kruskal-Wallis.
La capacidad predictiva de los parámetros de RO y espirometría se analizó mediante curvas ROC, determinando el AUC y su intervalo de confianza del 95% (IC95%). Para los parámetros con límite inferior del IC95% de AUC>0,5, y para los fenotipos LFA y ATA, se calculó la sensibilidad, especificidad y cocientes de probabilidad positivo (LR+) y negativo (LR−) respecto a la variable principal (CAG).
Para controlar el efecto de otras variables sobre el rendimiento predictivo de RO, espirometría y fenotipos LFA/ATA, se calcularon odds ratio (OR) ajustadas mediante modelos de regresión logística, incorporando como variables de ajuste: edad, sexo, recibir tratamiento de mantenimiento del asma en V0, aumento de intensidad de tratamiento entre V0-V1, y mal control del asma en V0. Estas variables de ajuste se seleccionaron para replicar el análisis realizado por Fielding et al.7.
Las comparaciones con error α<0,05, las AUC con IC95% que excluía 0,5, y los LR+/LR− con IC95% que excluía el 1, se consideraron estadísticamente significativos.
Tamaño muestralPara estimar valores de sensibilidad/especificidad de un 90% con una precisión del 5% en un IC95%, se precisaría una muestra de 139 pacientes. En previsión de que algunos pacientes no consiguieran pruebas de función pulmonar válidas o se perdiera su seguimiento, se aumentó ese tamaño muestral un 10%.
ÉticaEl estudio fue aprobado por el Comité de Ética en la Investigación Clínica del centro promotor. Los padres de los niños recibieron información escrita y firmaron un consentimiento de participación.
ResultadosSe reclutaron 154 pacientes en V0, y 148 (96,1%) fueron evaluados en V1. En la tabla 1 se muestran sus características demográficas y clínicas. Casi la mitad de los pacientes no utilizaba tratamiento diario de mantenimiento, y el 29,3% tenía asma mal controlada en V0. Se obtuvo una RO válida en 124 pacientes (83,8%) y una espirometría válida en 122 (82,4%).
Características clínicas y demográficas (n=148)
| Sexo varón (%) | 63,5 |
| Edad, años. Mediana (RIC) | 9,6 (7,9-12,2) |
| Peso, kg. Mediana (RIC) | 34,3 (27,0-47,0) |
| Talla, cm. Mediana (RIC) | 137,5 (127,0-153,0) |
| Alergia a inhalantes (%) | 73,0 |
| RO válida (%) | 83,8 |
| Espirometría válida (%) | 82,4 |
| Hospitalización, alguna vez (%) | 24,5 |
| Hospitalización, últimos 12 meses (%) | 3,4 |
| Hospitalización, últimos 3 meses (%) | 0,7 |
| Corticoides orales por crisis, últimos 3 meses (%) | 13,2 |
| Consulta no programada en atención primaria, últimos 3 meses (%) | 24,3 |
| Consulta en urgencias, últimos 3 meses (%) | 10,8 |
| Nivel de tratamiento (%) | |
| 1- Sin tratamiento de mantenimiento | 48,6 |
| 2- Monoterapia (CI dosis bajas o AL) | 23,6 |
| 3- Monoterapia (CI dosis media) o politerapia (CI dosis bajas+AL/LABA) | 18,9 |
| 4- CI dosis alta (±LABA y/o AL) o CI dosis media+LABA (±AL) | 8,1 |
| 5- CI dosis media/alta+LABA+LAMAa | 0,7 |
| CAN score. Mediana (RIC) | 4 (2-9) |
| Mal control (%) | 29,3 |
AL: antileucotrienos; CAN: cuestionario de control del asma; CI: corticoides inhalados; LABA: beta-adrenérgicos de acción prolongada; LAMA: antimuscarínicos de acción prolongada; RIC: rango intercuartílico; RO: oscilometría respiratoria.
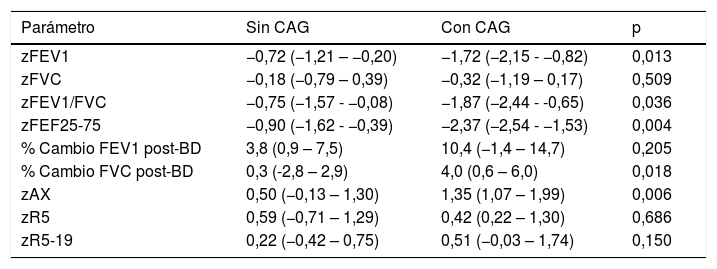
Durante el seguimiento, 11 pacientes (7,4%) tuvieron CAG, el 18,2% realizó alguna consulta NPU y el 11,5% recibió un aumento de intensidad de tratamiento. La probabilidad de CAG no se relacionaba con recibir tratamiento de mantenimiento en V0 (9,2 vs. 5,6%; p=0,397) ni con el sexo (varones=mujeres=7,4%; p=0,993), pero sí con el aumento del nivel de tratamiento entre V0-V1 (29,4 vs. 4,6%; p<0,001), con el mal control en V0 (14,0 vs. 4,8%; p=0,055) y con la edad (con CAG, media [DE] 8,2 [1,6] años; sin CAG 10 [2,5] años; p=0,002). La tabla 2 muestra los parámetros de función pulmonar según la aparición o no de CAG, con diferencias significativas en zFEV1, zFEV1/FVC, zFEF25-75, zAX y cambio post-BD en FVC.
Comparación de parámetros de función pulmonar entre pacientes con/sin CAG
| Parámetro | Sin CAG | Con CAG | p |
|---|---|---|---|
| zFEV1 | −0,72 (−1,21 – −0,20) | −1,72 (−2,15 - −0,82) | 0,013 |
| zFVC | −0,18 (−0,79 – 0,39) | −0,32 (−1,19 – 0,17) | 0,509 |
| zFEV1/FVC | −0,75 (−1,57 - −0,08) | −1,87 (−2,44 - -0,65) | 0,036 |
| zFEF25-75 | −0,90 (−1,62 - −0,39) | −2,37 (−2,54 - −1,53) | 0,004 |
| % Cambio FEV1 post-BD | 3,8 (0,9 – 7,5) | 10,4 (−1,4 – 14,7) | 0,205 |
| % Cambio FVC post-BD | 0,3 (-2,8 – 2,9) | 4,0 (0,6 – 6,0) | 0,018 |
| zAX | 0,50 (−0,13 – 1,30) | 1,35 (1,07 – 1,99) | 0,006 |
| zR5 | 0,59 (−0,71 – 1,29) | 0,42 (0,22 – 1,30) | 0,686 |
| zR5-19 | 0,22 (−0,42 – 0,75) | 0,51 (−0,03 – 1,74) | 0,150 |
BD: broncodilatador; CAG: crisis de asma graves; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada.
Las cifras representan la mediana (intervalo intercuartílico). Contrastes mediante prueba de Mann-Whitney.
Hubo un 4,9% de pacientes con zFEF25-75 reducido pero zFEV1/FVC y zFVC normales; todos ellos pertenecían al fenotipo Normal, ninguno tuvo CAG ni mal control del asma en V1, y solo uno realizó consultas NPU entre V0-V1.
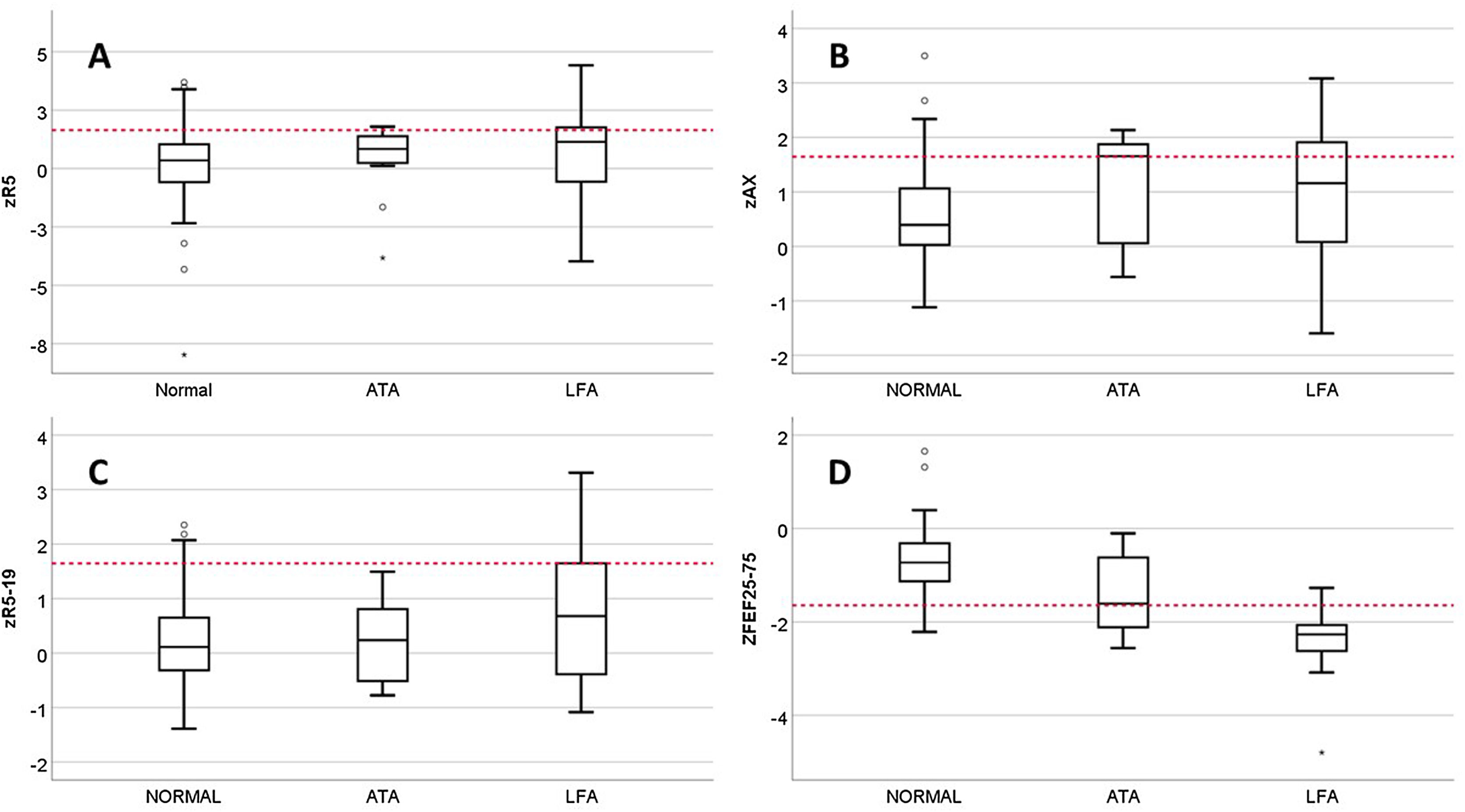
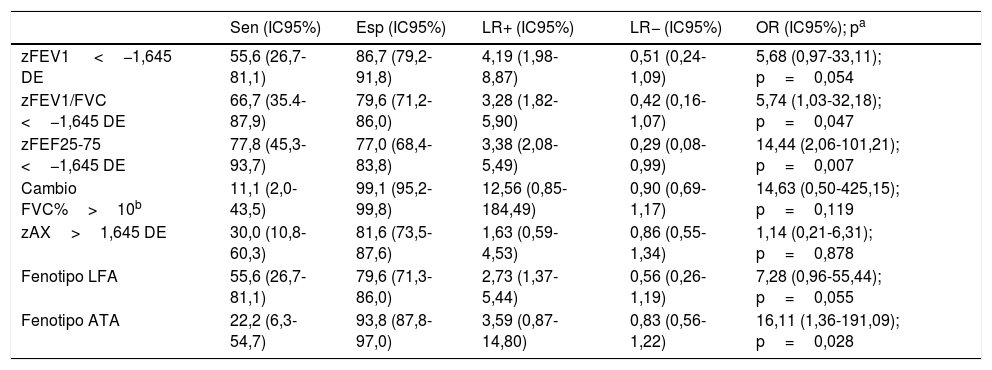
Los fenotipos de función pulmonar se identificaron en los pacientes con espirometría válida: 85/122 (69,7%) Normal; 28/122 (22,9%) LFA; y 9/122 (7,4%) ATA. En el fenotipo ATA, solo un paciente tenía también FEV1/FVC reducida, y ninguno se incluyó en este fenotipo solo por el criterio del cambio post-BD en FVC con FVC basal normal. No había diferencias entre los fenotipos en prevalencia de alergia a inhalantes, sexo, edad actual, control del asma en V0, fecha de estudio ni estar recibiendo tratamiento de mantenimiento en V0, pero sí en la edad de inicio de los síntomas de asma, que era (mediana, rango intercuartílico): 1,0 (0,5-1) años en ATA; 2,0 (1,0-3,0) en LFA; y 3,0 (2,0-5,8) en Normal (p=0,007). La frecuencia de CAG fue diferente en cada fenotipo: 2,4% en Normal; 17,9% en LFA; y 22,2% en ATA (p=0,005). La figura 1 muestra los resultados en zR5, zR5-19, zAX y zFEF25-75 según el fenotipo. Solo había diferencias en zFEF25-75, que estaba reducido en el 7,1% del fenotipo Normal, en el 33,3% del ATA y en el 85,7% del LFA.
Comparación de resultados de zR5 (A), zAX (B), zR5-19 (C) y FEF25-75 (D) entre los fenotipos de función pulmonar. ATA: atrapamiento aéreo; DE: desviación estándar; LFA: limitación al flujo aéreo. Las líneas rojas punteadas marcan el límite de la normalidad (+1,645 DE para zR5, zAX y zR5-20, y -1,645 DE para FEF25-75).
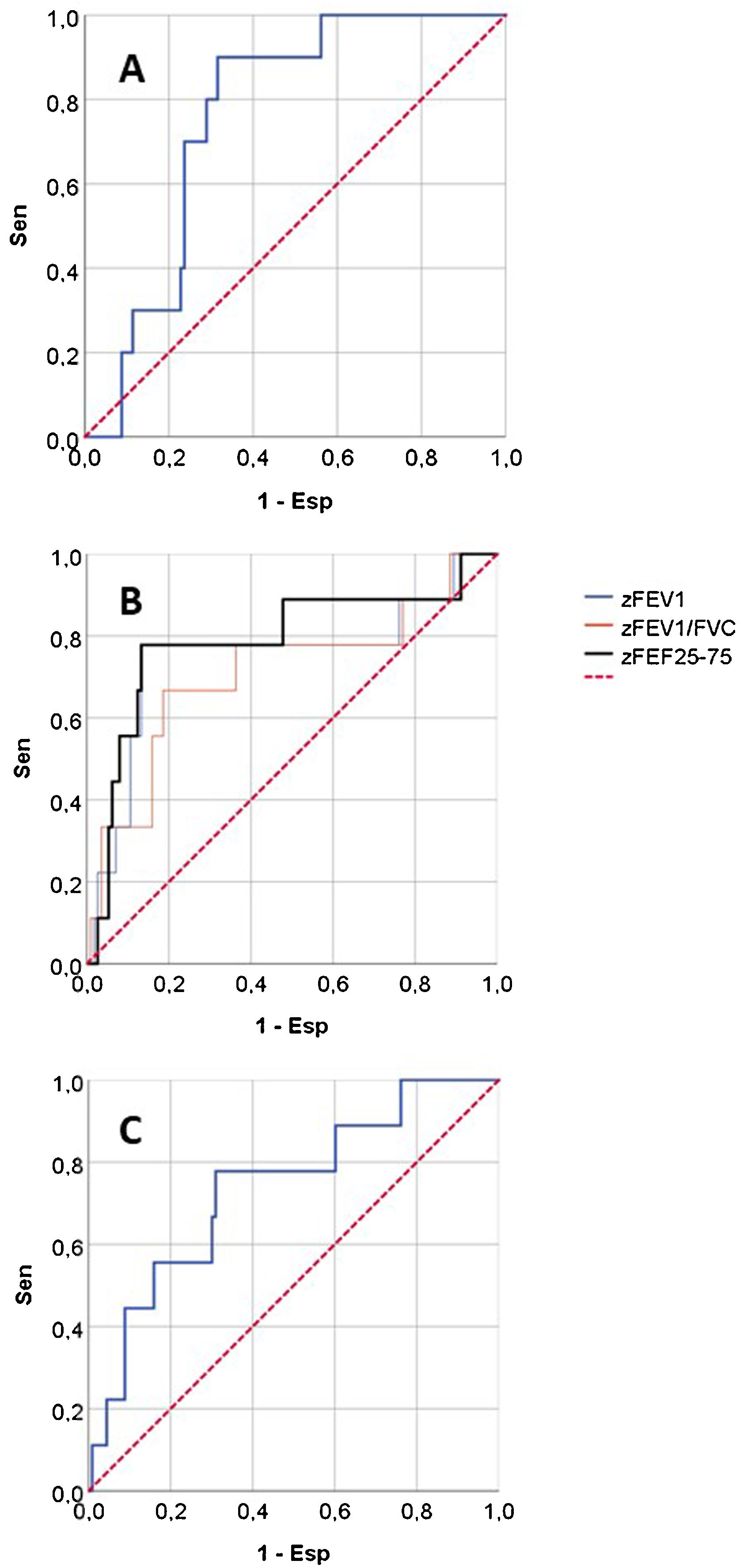
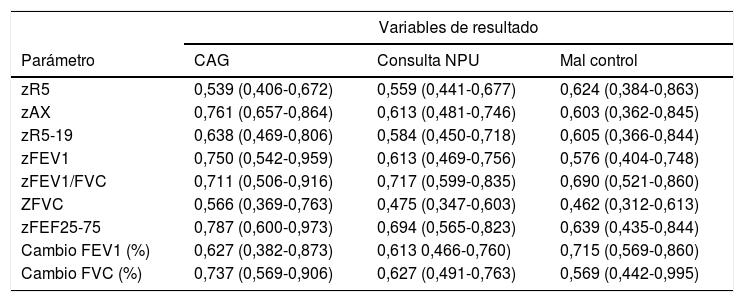
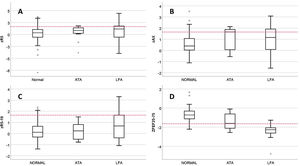
La figura 2 muestra las curvas ROC de los parámetros de RO y espirometría para predecir CAG, y la tabla 3 presenta sus AUC para predecir CAG y otras variables de resultado. Ningún parámetro RO tenía buena capacidad predictiva de consultas NPU o mal control del asma. Para predicción de CAG, tenían AUC significativa zFEV1, zFEV1/FVC, zFEF25-75, zAX y cambio post-BD en FVC, es decir, los mismos parámetros con diferencias significativas entre CAG/no CAG (tabla 2). Esas fueron las variables de función pulmonar sobre las que se hicieron posteriores análisis.
Área bajo la curva (e intervalos de confianza 95%) de parámetros de función pulmonar para predecir las variables de resultado
| Variables de resultado | |||
|---|---|---|---|
| Parámetro | CAG | Consulta NPU | Mal control |
| zR5 | 0,539 (0,406-0,672) | 0,559 (0,441-0,677) | 0,624 (0,384-0,863) |
| zAX | 0,761 (0,657-0,864) | 0,613 (0,481-0,746) | 0,603 (0,362-0,845) |
| zR5-19 | 0,638 (0,469-0,806) | 0,584 (0,450-0,718) | 0,605 (0,366-0,844) |
| zFEV1 | 0,750 (0,542-0,959) | 0,613 (0,469-0,756) | 0,576 (0,404-0,748) |
| zFEV1/FVC | 0,711 (0,506-0,916) | 0,717 (0,599-0,835) | 0,690 (0,521-0,860) |
| ZFVC | 0,566 (0,369-0,763) | 0,475 (0,347-0,603) | 0,462 (0,312-0,613) |
| zFEF25-75 | 0,787 (0,600-0,973) | 0,694 (0,565-0,823) | 0,639 (0,435-0,844) |
| Cambio FEV1 (%) | 0,627 (0,382-0,873) | 0,613 0,466-0,760) | 0,715 (0,569-0,860) |
| Cambio FVC (%) | 0,737 (0,569-0,906) | 0,627 (0,491-0,763) | 0,569 (0,442-0,995) |
CAG: crisis de asma graves; NPU: consulta no programada en atención primaria o en urgencias.
La tabla 4 muestra el rendimiento para predecir CAG de los parámetros de función pulmonar y de los fenotipos LFA/ATA, así como la OR ajustada en los modelos de regresión. Todos los parámetros tenían baja sensibilidad, especialmente los 2 con mayor especificidad (cambio post-BD en FVC y fenotipo ATA). Solo zFEF25-75 tenía tanto LR+ como LR− significativos. La OR ajustada era significativa para zFEV1/FVC, zFEF25-75 y fenotipo ATA, aunque su estimación era poco precisa, con IC muy amplios. zAX tenía baja sensibilidad (30,0%), una especificidad moderada (81,6%), y LR+, LR− y OR ajustada no significativos.
Rendimiento de los parámetros de espirometría y RO, y de los fenotipos de función pulmonar, para predecir CAG
| Sen (IC95%) | Esp (IC95%) | LR+ (IC95%) | LR− (IC95%) | OR (IC95%); pa | |
|---|---|---|---|---|---|
| zFEV1 <−1,645 DE | 55,6 (26,7-81,1) | 86,7 (79,2-91,8) | 4,19 (1,98-8,87) | 0,51 (0,24-1,09) | 5,68 (0,97-33,11); p=0,054 |
| zFEV1/FVC <−1,645 DE | 66,7 (35.4-87,9) | 79,6 (71,2-86,0) | 3,28 (1,82-5,90) | 0,42 (0,16-1,07) | 5,74 (1,03-32,18); p=0,047 |
| zFEF25-75 <−1,645 DE | 77,8 (45,3-93,7) | 77,0 (68,4-83,8) | 3,38 (2,08-5,49) | 0,29 (0,08-0,99) | 14,44 (2,06-101,21); p=0,007 |
| Cambio FVC%>10b | 11,1 (2,0-43,5) | 99,1 (95,2-99,8) | 12,56 (0,85-184,49) | 0,90 (0,69-1,17) | 14,63 (0,50-425,15); p=0,119 |
| zAX>1,645 DE | 30,0 (10,8-60,3) | 81,6 (73,5-87,6) | 1,63 (0,59-4,53) | 0,86 (0,55-1,34) | 1,14 (0,21-6,31); p=0,878 |
| Fenotipo LFA | 55,6 (26,7-81,1) | 79,6 (71,3-86,0) | 2,73 (1,37-5,44) | 0,56 (0,26-1,19) | 7,28 (0,96-55,44); p=0,055 |
| Fenotipo ATA | 22,2 (6,3-54,7) | 93,8 (87,8-97,0) | 3,59 (0,87-14,80) | 0,83 (0,56-1,22) | 16,11 (1,36-191,09); p=0,028 |
ATA: atrapamiento aéreo; DE: desviación estándar; Esp: especificidad; IC95%: intervalo de confianza del 95%; LFA: limitación al flujo aéreo; LR+: cociente de probabilidad positiva; LR−: cociente de probabilidad negativa; OR: odds ratio; Sen: sensibilidad.
De los parámetros de RO, solo el z-score del área de reactancia (zAX) se relaciona con el riesgo de CAG a medio plazo, pero con un rendimiento predictivo muy bajo y peor que el de la espirometría. El fenotipo ATA es muy específico, y su identificación hace que el riesgo de CAG a medio plazo sea mayor, pero por su baja sensibilidad no puede excluirse la posibilidad de CAG cuando este fenotipo no está presente.
InterpretaciónSegún un reciente metanálisis12, la RO podría ser útil para identificar a niños con riesgo de crisis de asma. Sin embargo, ese trabajo incluyó principalmente estudios de diseño transversal23–26, y hasta ahora solo se han publicado 3 estudios prospectivos que relacionan RO con el riesgo posterior de mala evolución del asma en niños27–29. Esos estudios analizaron muestras pequeñas (54-72 pacientes) de escolares-adolescentes27 o preescolares28,29, y estudiaron la asociación de RO con la pérdida de control del asma 8-12 semanas después27,29 o con el riesgo de crisis moderadas (no CAG) durante los 12 meses posteriores28. Encontraron R5, AX y R5-20 elevados en relación con la pérdida de control del asma27,29, y R5 elevado (junto a, extrañamente, R5-20 disminuido) en relación con el riesgo de crisis en los 12 meses posteriores28. Aunque un estudio incluyó algunos resultados RO estandarizados respecto a un patrón de referencia28, todos utilizaron resultados absolutos de R5, AX y R5-20. Esto introduce una grave confusión en los análisis de esos estudios, porque tanto los parámetros de RO como el riesgo de mala evolución estaban inversamente relacionados con la edad. Nuestros resultados con RO también serían más llamativos utilizando valores absolutos, sobre todo de R5 y R5-19, pero sin duda serían resultados sesgados. El único parámetro de RO asociado al riesgo de CAG era zAX, pero resultó poco potente como predictor.
En cuanto a la espirometría, un metanálisis con datos individuales de 7 estudios en escolares/adolescentes7 encontró que la determinación aislada de FEV1 no predecía la aparición de CAG en los 3 meses siguientes, mientras que FEV1/FVC y el cambio evolutivo de FEV1 sí tenían cierta capacidad predictiva. En ese artículo no se analizaron FEF25-75 ni cambios post-BD. En nuestro estudio, sin embargo, FEV1/FVC era solo un poco mejor que FEV1 para predecir CAG, y FEF25-75 tenía mejor rendimiento que esos 2 parámetros.
La utilidad clínica de FEF25-75 se puso en duda en un influyente artículo30, que encontró, en niños y adultos, muy baja probabilidad (<3%) de observar anomalías de FEF25-75 en espirometrías con FEV1/FVC y FVC normales, y que cuando esto ocurría, generalmente se debía a una mala técnica (FVC incompleta). Otros estudios en niños31,32 han confirmado esos resultados. Como los autores reconocen31, estos estudios tienen la limitación de basarse en datos retrospectivos y no analizar la correlación con la clínica. En nuestra muestra, un 4,9% tenía FEF25-75 reducido con FEV1/FVC y FVC normales. Al revisar los resultados de esos pacientes, no encontramos indicios de FVC incompleta (todos ellos consiguieron una prueba de máxima calidad, con reproducibilidad de FEV1 y FVC≤0,10 L, mejor que la exigida). Sin embargo, ninguno de esos pacientes tuvo CAG, y por tanto eran «falsos positivos» y no contribuían al rendimiento predictivo de FEF25-75.
Por otra parte, tampoco encontramos que la reducción de FEF25-75 sea un fenómeno específico del fenotipo ATA (afectación de las VAP). Era mucho más frecuente un FEF25-75 bajo en el fenotipo LFA que en el ATA. Esto coincide con el estudio de Sorkness et al.15, en el que no había asociación de FEF25-75 con el fenotipo ATA. De modo que, si el rendimiento predictivo de FEF25-75 es superior a otros índices, es porque este parámetro disminuye tanto cuando hay atrapamiento como cuando solo hay limitación al flujo, y por tanto no es específico de las alteraciones de las VAP.
Hemos definido el fenotipo ATA según lo describieron Sorkness et al.15, pero el fenotipo ATA en ese estudio tenía características algo diferentes al nuestro: era más frecuente (14%), se acompañaba habitualmente (62%) de FEV1/FVC disminuido, y bastantes casos se clasificaron como ATA solo por el cambio post-BD en FVC, con FVC basal normal. Sí que hay coincidencia casi perfecta en la edad de inicio de los síntomas de asma en cada fenotipo, y en que esa edad de inicio es menor en ATA. Sorkness et al. encontraron una relación entre ATA y la frecuencia de crisis en los 12 meses anteriores. Hasta ahora no se había estudiado su rendimiento en un estudio prospectivo. Nosotros observamos que el fenotipo ATA parece un marcador específico de riesgo de CAG. Aunque su baja sensibilidad limita de manera importante su utilidad clínica, encontrar en un niño con asma un ATA en una espirometría técnicamente correcta indica un riesgo aumentado de CAG a medio plazo.
Limitaciones1) Aunque nuestra muestra es mayor que la de otros estudios prospectivos que han investigado el rendimiento de RO27–29, no ha sido suficiente para hacer estimaciones precisas de los parámetros estudiados. A ello ha contribuido la baja incidencia de crisis en relación con la baja carga de enfermedad asmática consecuencia de la pandemia Covid-1933. 2) El estudio se ha limitado a evaluar el rendimiento individual de RO y espirometría, y no estudiamos su utilidad dentro de modelos multivariantes de predicción de crisis. 3) No hemos incluido la respuesta BD de RO, ya que no se ha establecido su relación con diversos fenotipos funcionales en el asma, y su utilización tiene aún aspectos controvertidos, como la mejor métrica para analizar el cambio post-BD (valor absoluto, % de inicial, cambio en z-score), o la posibilidad de respuestas paradójicas debido a su dependencia del volumen (con aparente empeoramiento en niños con ATA que mejora tras BD)8. 4) No se conoce la estabilidad de los fenotipos ATA/LFA en pacientes individuales con asma, que podrían cambiar con el tiempo, por lo que nuestros resultados solo pueden aplicarse al intervalo de las 12 semanas siguientes a la identificación de uno de esos fenotipos.
ConclusionesLa RO no es una buena técnica para predecir la evolución de escolares con asma a medio plazo. La afectación de las VAP no parece ser el factor determinante de esa evolución. La espirometría es la prueba funcional respiratoria con mejor rendimiento para predecir CAG a medio plazo.
FinanciaciónGerencia Regional de Salud de Castilla y León, España (GRS 2191/A/2020).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Ana María Alonso-Rubio: Universidad de Valladolid, Centro de Salud Covaresa, Valladolid, España.
Isabel Pérez-García: Universidad de Valladolid, Centro de Salud Covaresa, Valladolid, España.
María Teresa Arroyo-Romo: Centro de Salud Pisuerga, Valladolid, España.
Irene Casares-Alonso: Centro de Salud Huerta del Rey, Valladolid, España.
Ana María Barbero-Rodríguez: Universidad de Valladolid, Centro de Salud Covaresa, Valladolid, España.
Reyes Grande-Álvarez: Centro de Salud Zaratán, Valladolid, España.
María Teresa Martínez-Rivera: Centro de Salud Laguna de Duero, Valladolid, España
Mónica Sanz-Fernández: Centro de Salud Pisuerga, Valladolid, España.