Las recomendaciones incluidas en este documento forman parte de una revisión actualizada de la asistencia respiratoria en el recién nacido. Están estructuradas en 12 módulos y en este trabajo se presenta el módulo 7. El contenido de cada módulo es el resultado del consenso de los miembros del Grupo Respiratorio y Surfactante de la Sociedad Española de Neonatología. Representan una síntesis de los trabajos publicados y de la experiencia clínica de cada uno de los miembros del grupo.
The recommendations included in this document will be part a series of updated reviews of the literature on respiratory support in the newborn infant. These recommendations are structured into twelve modules, and in this work module 7 is presented. Each module is the result of a consensus process including all members of the Surfactant and Respiratory Group of the Spanish Society of Neonatology. They represent a summary of the published papers on each specific topic, and of the clinical experience of each one of the members of the group.
El surfactante pulmonar es una sustancia tensoactiva producida por los neumocitos tipo ii del epitelio alveolar, compuesta básicamente por un complejo de lipoproteínas. El 70% de la parte lipídica lo forma la fosfatidilcolina, mientras que se han descrito 4 tipos diferentes de proteínas en el surfactante, siendo las más importantes la SP-B y la SP-D1. Su función principal es la de disminuir la tensión superficial en la interfase aire-líquido del alvéolo, evitando el colapso pulmonar durante la espiración.
A partir de las 22 semanas de gestación, durante la fase canalicular del desarrollo embrionario del pulmón, se encuentran cuerpos lamelares cargados de surfactante en el interior de los neumocitos tipo ii, pero no será hasta el final de esta cuando el desarrollo pulmonar y el sistema del surfactante sean completamente efectivos en términos de garantizar un adecuado intercambio gaseoso.
Por este motivo, los recién nacidos por debajo de la semana 34 (y en ocasiones incluso hasta la 36 semanas) son susceptibles de presentar déficit de surfactante pulmonar, lo que constituye el origen de la enfermedad de membrana hialina (EMH). La consecuencia de este déficit es el colapso alveolar produciendo distrés respiratorio, hipoxemia e hipercapnia.
El tratamiento con surfactante ha revolucionado el cuidado respiratorio de estos pacientes desde su introducción en el año 1980. Ha contribuido, conjuntamente con la maduración prenatal del pulmón con corticoides y los avances en la asistencia respiratoria, al aumento de la supervivencia de los recién nacidos prematuros. Actualmente, la administración de surfactante se considera un tratamiento seguro y eficaz, ya sea dado de forma profiláctica o en estrategia de rescate, en los recién nacidos con alto riesgo de desarrollar un síndrome de dificultad respiratoria (SDR).
Muchos aspectos de su uso han sido investigados en múltiples estudios controlados multicéntricos que, a su vez, han estado sujetos a revisiones sistemáticas2,3.
En los últimos años, se han desarrollado diferentes preparados comerciales que difieren en su composición y resultados clínicos4. Los más comúnmente utilizados son:
- –
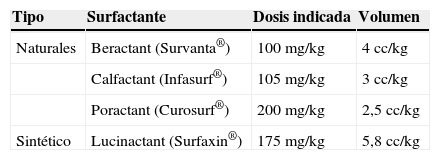
Surfactantes sintéticos: fueron los primeros en aparecer en el mercado. Colfosceril (Exosurf®), exclusivamente compuesto por dipalmitoilfosfatidilcolina, actualmente ha desaparecido del mercado. Posteriormente, se comercializó lucinactant (Surfaxin®), que incluyó en su composición un péptido que simula la acción de la SP-B;
- –
Surfactantes naturales: básicamente se clasifican en aquellos compuestos por extracto de pulmón triturado bovino (beractant, Survanta®) o porcino (poractant, Curosurf®) y los derivados de lavado broncoalveolar bovino (calfactant, Infasurf®).
El tratamiento con surfactantes naturales tiene ciertas ventajas sobre la primera generación de surfactantes sintéticos. Los surfactantes naturales tienen una acción de inicio más precoz y una mayor reducción en el número de fallecimientos y neumotórax cuando fueron comparados con la primera generación de surfactantes sintéticos5.
El lucinactant se ha comparado con surfactantes naturales. Sin embargo, estos estudios fueron criticados por la precocidad del cierre del ensayo y el inadecuado tamaño muestral6-8.
Por lo tanto, en la actualidad disponemos de surfactantes naturales como tratamiento de elección en el SDR del recién nacido prematuro (SDRPRM) y son los únicos disponibles en Europa. El dilema que nos podemos encontrar los neonatólogos será qué surfactante natural sería el elegido.
Todos estos preparados de surfactante natural son ligeramente diferentes en relación con la concentración de fosfolípidos y proteínas, así como la cantidad de dosis recomendada en cada paciente medida en volumen y miligramos por kilo de peso. Se han realizado múltiples estudios controlados con el objetivo de encontrar diferencias clínicas entre los diferentes preparados9,10. Algunos de estos estudios nos indican una mejoría más rápida en la oxigenación, menor necesidad de retratamientos y una menor mortalidad a favor del poractant alfa cuando es comparado con otros surfactantes naturales, como el beractant. Los datos farmacológicos y clínicos de estos estudios indican que utilizar una dosis de 200 mg/kilo tiene una mayor vida media y una mejor respuesta clínica en el momento agudo, siendo esta la dosis recomendada11. Sin embargo, el número de recién nacidos estudiados es relativamente pequeño para establecer una recomendación generalizada.
La Academia Americana de Pediatría concluye que no está claro que existan diferencias significativas en el seguimiento clínico entre los diferentes productos de surfactante natural2.
Indicaciones- –
SDRPRM: es la principal indicación terapéutica del surfactante pulmonar y ha sido el estándar durante más de 2 décadas. En esta patología, su uso es indiscutible, ya que ha demostrado que reduce el riesgo de neumotórax, enfermedad pulmonar intersticial, la necesidad de ventilación mecánica y la muerte neonatal3,12-15.
- –
El surfactante ha sido empleado en otras patologías respiratorias que ocasionan su inactivación, insuficiencia o disfunción transitoria. Son escasos los estudios controlados para realizar unas recomendaciones generales de indicaciones y estrategias terapéuticas en estos casos.
- –
Síndrome de aspiración de meconio (SAM): se ha descrito una mejora en la oxigenación y menor necesidad de ECMO al administrar 4 dosis de surfactante separadas en 6 h16. Por tanto, el uso de surfactante podría recomendarse en el tratamiento de aquellos pacientes con formas más graves de presentación del SAM, con índices de oxigenación > 15, lo más precoz posible (idealmente antes de las 6h de vida)17. Otra posibilidad es el lavado broncoalveolar con surfactante, que ha demostrado beneficios comparado con el lavado con suero salino o con placebo, aunque la cantidad óptima de surfactante a administrar y el proceso de succión no han sido claramente definidos18.
- –
Hemorragia pulmonar: no existe ningún ensayo clínico controlado al respecto. Un estudio observacional obtiene unos resultados prometedores en relación con la mejoría en las necesidades de oxígeno suplementario sin otras complicaciones añadidas19.
- –
Neumonía y sepsis: existen datos en modelos experimentales y estudios en recién nacidos que indican que, en el contexto inflamatorio de las infecciones, se produce una alteración de la tensión superficial en el alvéolo20, sobre todo en el caso de Pseudomonas, virus respiratorio sincitial y estreptococo del grupo B. Lotze et al. realizaron un ensayo clínico en recién nacidos a término con fallo respiratorio y encontraron que, en el subgrupo de pacientes diagnosticados de sepsis o neumonía, el tratamiento con surfactante mejoró significativamente la oxigenación y disminuyó la necesidad de entrar en ECMO21.
- –
Otras indicaciones: en los últimos años, su uso se ha extendido a otras causas de distrés respiratorio, como la hernia diafragmática y la HTP4.
El surfactante necesita ser administrado directamente en el interior del pulmón. Su administración puede realizarse de manera invasiva o no invasiva.
- –
Administración invasiva: precisa de la colocación de un tubo endotraqueal para la instilación del surfactante. Actualmente, se preconiza el uso de la CPAP precoz desde el nacimiento y la administración de surfactante en caso necesario, seguido de extubación lo más precoz posible, base del método INSURE: intubación-surfactante-extubación rápida a CPAP22. Esta técnica ha demostrado una disminución de la necesidad de ventilación mecánica, pero la discusión continúa, ya que los efectos positivos de la administración de surfactante profiláctico podrían estar comprometidos por el corto periodo de ventilación con presión positiva que es necesaria con el INSURE.
- –
Administración no invasiva: consiste en la administración de surfactante sin intubación mientras el paciente respira de forma espontánea.
- –
Administración nebulizada: es una alternativa que todavía requiere de más investigación y discusión, además de resolver problemas técnicos de los sistemas de administración23.
- –
Administración sin intubación: consiste en la administración del surfactante a través de una fina sonda endotraqueal o un catéter rígido durante la respiración espontánea, mientras el paciente permanece con soporte ventilatorio no invasivo24. Precisa de laringoscopia para su aplicación y puede ser traumática, especialmente en recién prematuros activos.
- –
Administración orofaríngea: en los últimos años, se han explorado otras vías alternativas como la administración orofaríngea o a través del uso de una mascarilla laríngea25.
La dosificación del surfactante depende del preparado comercial, debido a su diferente cantidad en lipoproteínas (tabla 1). Las recomendaciones del Consenso Europeo en el tratamiento del SDR neonatal en el recién nacido prematuro propone utilizar poractant alfa a una dosis de 200 mg/kg, siendo mejor que una de dosis de 100 mg/kg del mismo producto o de beractant26.
La revisión sistemática publicada en 2009 por Soll y Eren indica una reducción en las necesidades de soporte ventilatorio y en la incidencia de neumotórax, y una tendencia hacia la disminución de la mortalidad cuando se usan múltiples dosis en el tratamiento de la insuficiencia respiratoria refractaria27. En los estudios publicados, el régimen de administración fue hasta 3 dosis separadas en 12h mientras persistieran las necesidades de oxígeno suplementario. Sin embargo, no está claro cuál es el programa de retratamiento más adecuado. Las casas comerciales de surfactantes naturales aconsejan intervalos diferentes y diferentes guías recomiendan estrategias diferentes. La guía europea es poco específica en sus recomendaciones y se limita a recomendar un programa de tratamiento más flexible, dependiendo de la necesidad de ventilación mecánica y de las necesidades de oxígeno26.
Posiblemente, la dosis utilizada inicialmente (200mg/kg) y la presencia de un SDR complicado (infección, inestabilidad hemodinámica, compromiso perinatal) son factores que influirán en el programa de retratamiento.
Todos los surfactantes se conservan refrigerados entre 2-8°C y deben calentarse a temperatura ambiente previo a su administración.
Modo de administraciónDado que la distribución pulmonar de surfactante depende básicamente de la gravedad, se recomienda mantener al paciente en posición supino horizontal, con la cabeza centrada en línea media, e instilar el surfactante en bolo lento (aproximadamente durante 1 min)28.
En el paciente intubado, aunque se pueden utilizar diferentes dispositivos, el uso de tubos endotraqueales de doble luz ha demostrado su seguridad y eficacia, reduciendo los episodios de hipoxia y bradicardia asociados a la administración29.
Profilaxis versus rescateNumerosos ensayos clínicos han tratado de definir cuál es el mejor momento para administrar surfactante en el curso de la EMH. Un metaanálisis de todos estos trabajos publicado por la Cochrane Review en 2001 mostró una disminución en la incidencia de escape aéreo y mortalidad, y el resultado combinado de DBP o muerte cuando el surfactante era administrado de forma temprana, bien de forma profiláctica (< 30 min de vida) o bien en forma de rescate precoz (<2h de vida en pacientes sintomáticos). Los resultados más significativos se encontraron en la cohorte de recién nacidos prematuros<30 semanas, que precisaron soporte con ventilación mecánica invasiva al nacimiento30.
Sin embargo, en la presente era, con un incremento de la administración de corticoides prenatales y el uso generalizado de CPAP en sala de partos, muchos recién nacidos prematuros pueden ser tratados sin recurrir a la intubación endotraqueal hasta que desarrollen una clínica evidente de EMH. Posiblemente no existan diferencias evidentes en la evolución clínica entre la administración profiláctica y el rescate muy precoz con surfactante dentro de los primeros 30 min de vida, pudiendo retrasar la intubación hasta que sea claramente necesaria. Con los recientes trabajos publicados, podemos afirmar que la estabilización inicial con CPAP y la administración de surfactante de rescate, si es necesario, es tan segura y eficaz en resultados clínicos, en este tipo de pacientes, como la intubación, ventilación mecánica y administración de surfactante inmediatamente después del nacimiento, sumándonos a las estrategias establecidas en los países escandinavos31,32.
La decisión de qué estrategia para el manejo respiratorio precoz podría venir determinada en identificar la población de riesgo definida como recién nacidos prematuros extremos (sin definir de forma generalizada cuál es la edad gestacional de corte) y que no hayan recibido corticoides prenatales.
Efectos adversos- –
Obstrucción de la vía aérea: es más común con aquellos preparados de mayor volumen, pudiendo provocar desaturación y/o bradicardia. En ocasiones, se observa parte del surfactante refluir a través del tubo endotraqueal.
- –
Alteración en el flujo cerebral: la administración de surfactante en el contexto de distrés respiratorio produce un aumento en la velocidad media del flujo sanguíneo en la arterial cerebral media, que se mantiene hasta 45 min posteriores a su administración. La instilación lenta y con menores volúmenes se ha sugerido como posible estrategia para minimizar estos cambios hemodinámicos9.
- 1.
La administración de surfactante es segura y eficaz como tratamiento de elección en el recién nacido prematuro con SDR (A).
- 2.
Puede ser eficaz en otras patologías agudas respiratorias (B).
- 3.
La estrategia terapéutica de rescate precoz es la más indicada (A).
- 4.
La sonda endotraqueal de doble luz, así como las técnicas no invasivas, son formas de administraciones seguras y efectivas (B).
- 5.
Una dosis inicial entre 100-200 mg/kg (según el tipo de surfactante), con un máximo de 3 dosis según evolución del paciente, es el régimen más indicado (A).
El óxido nítrico (ON) es una pequeña molécula gaseosa producida principalmente por el endotelio alveolar y vascular a partir del aminoácido L-arginina, gracias a la ON-sintetasa. A nivel celular, estimula la guanilato-ciclasa, provocando un aumento en el GMPc, que produce un potente efecto vasodilatador sobre la musculatura lisa, favoreciendo la perfusión tisular en el lugar donde se libera.
A nivel comercial, se ha elaborado ON sintético, en forma de gas, que se puede administrar inhalado (ONi), de forma que al llegar al alvéolo difunde rápidamente hacia la musculatura lisa, produciendo una vasodilatación selectiva en el territorio pulmonar y mejorando así la relación ventilación-perfusión donde es absorbido.
Su vida media es entre 3 y 4 s, ya que es rápidamente inactivado en el torrente sanguíneo, dando lugar a metahemoglobina (MetHb). Por este motivo, su efecto no llega más allá del área donde se ha absorbido33.
Indicaciones terapéuticasLa principal indicación terapéutica del ONi es la hipertensión pulmonar (HTP), ya sea primaria o secundaria a patologías pulmonares (SDR del recién nacido, SAM, hernia diafragmática congénita, neumonía) o relacionada con cardiopatías congénitas (tanto en la fase preoperatoria como en la postoperatoria).
Los ensayos clínicos realizados en recién nacidos prematuros tardíos (> 34 semanas) o en recién nacidos a término han observado que el ONi produce una mejoría en los índices de oxigenación y reduce la necesidad de ECMO y la incidencia de displasia broncopulmonar. Sin embargo, la mortalidad no se ve afectada, siendo los peores resultados en recién nacidos afectados de hernia diafragmática34,35.
Los resultados de los estudios publicados en relación con el uso de ONi en el recién nacido prematuro indican que podría mejorar el estado de oxigenación, pero no mejora las tasas de supervivencia36.
Por otra parte, el uso precoz de bajas dosis de ONi en los recién nacidos prematuros no mejora la supervivencia sin displasia broncopulmonar o daño cerebral, por lo que no es una estrategia preventiva satisfactoria37.
Por tanto, se planteará el tratamiento con ONi en el fallo respiratorio hipoxémico grave en el que exista evidencia de HTP (diferencia de SpO2 preposductal > 5%, evidencia ecocardiográfica) cuando presenten un índice de oxigenación (IO) > 25 en 2 controles sucesivos separados al menos 30 min (IO = MAP×FiO2×100/PaO2 posductal). Algunos autores indican que el inicio precoz del tratamiento con ONi con IO entre 10 y 20 tiene beneficios clínicos al reducir el aporte de oxígeno y las necesidades de ECMO38.
No podemos recomendar un uso rutinario de ONi para el tratamiento del fallo respiratorio en el recién nacidos prematuros y se considerará solo en casos de hipoxemia grave, como tratamiento de rescate después de la optimización del reclutamiento pulmonar y a dosis bajas (inferiores a 10ppm).
Manejo práctico- 1.
Dado que el ONi difunde a través del endotelio alveolar, se precisa un correcto reclutamiento pulmonar antes de iniciar el tratamiento con ONi. Si es necesario, iniciar ventilación de alta frecuencia para conseguirlo.
- 2.
Optimización previa de todos los factores favorecedores de la vasoconstricción pulmonar: optimizar la oxigenación, mantener un pH ≥ 7,40 con normocapnia (pCO2 45-40mmHg), sedoanalgesia, normotermia, mantenimiento hemodinámico, normalización electrolítica (particularmente de la glucosa y el calcio) y corrección de la anemia.
- 3.
De acuerdo con la Food and Drug Administration, el ONi habría de ser administrado usando un sistema apropiado que contenga un gas inyector capaz de mantener constante la concentración de ONi durante el flujo inspiratorio. Además, habría que minimizar el tiempo que el ONi se mezcla con el oxígeno para evitar la creación de gases tóxicos potenciales y disponer de un sistema de monitorización, con alarmas, de ON y O2 administrado y NO2 creado36.
- 4.
Iniciar ONi con 10-20ppm (5ppm en prematuros). En general, la respuesta suele ser rápida, en los primeros 60 min (IO<10, FiO2< 70). Se considera mal respondedor si en los siguientes 60-90 min la PaO2 posductal no asciende un 20%, en cuyo caso se puede hacer un ensayo de aumento de dosis hasta 40ppm (10ppm en prematuros), aunque es poco probable que se obtenga una mejoría. Hasta un 40% de los pacientes no responden al ONi.
- 5.
Monitorización de la MetHb cada 24h.
- 6.
En los no respondedores se iniciará la retirada del ONi de forma progresiva y lenta (disminuyendo a la mitad de la dosis cada 10-15 min hasta su retirada). En los respondedores se disminuirá inicialmente el oxígeno suplementario hasta 0,6 y, posteriormente, se reducirá lentamente el ONi hasta llegar a la dosis mínima eficaz. Si al disminuirlo empeora la oxigenación (necesidades > 15% de las previas), se volverá al nivel anterior y se mantendrá durante varias horas hasta volver a intentar la retirada.
- –
Metahemoglobinemia: consiste en la unión del ON a la hemoglobina, de forma que le impide el transporte de oxígeno. Se recomienda monitorizar la MetHb en todo paciente que precise tratamiento con ONi; se disminuirá el ONi cuando la MetHb se encuentre entre 2,5-5% (si el estado del paciente lo permite) y se suspenderá cuando sea > 5%. Los pretérminos tienen más riesgo de toxicidad de la MetHb por tener menores niveles de MetHb reductasa.
- –
Aumento del dióxido de nitrógeno (NO2): se produce al reaccionar el ON con altas concentraciones de oxígeno en el circuito y en la vía aérea. Con niveles superiores a 3ppm puede producirse lesión pulmonar, edema y estrés oxidativo derivado de la producción de peroxinitrito. Sin embargo, con las dosis recomendadas su aparición es infrecuente
- –
Inhibición de la agregación plaquetar: que podría incrementar el riesgo de hemorragia.
Los autores declaran no tener ningún conflicto de intereses.
Al Profesor Adolf Valls, que siempre permanecerá en nuestros recuerdos.