Introducción
La sepsis de transmisión vertical tiene en España una incidencia de 2,5 casos por cada 1.000 nacidos vivos y una mortalidad global del 8,7 %, que en los recién nacidos de menos de 1.500 g llegan al 26,5 y el 30,6 %, respectivamente 1. Los neonatos con riesgo o sospecha clínica de infección reciben rápidamente antibióticos intravenosos, pero a costa de tratar a muchos de ellos de manera innecesaria. Por ello son precisas pruebas complementarias suficientemente sensibles y específicas para ayudar al clínico en la toma de decisiones.
En las últimas décadas se han estudiado diversos marcadores de infección neonatal, fundamentalmente índices leucocitarios y reactantes de fase aguda, algunos de los cuales se utilizan de manera habitual en la práctica clínica. Sin embargo, ninguna prueba de laboratorio ha demostrado ser capaz de proporcionar un diagnóstico suficientemente fiable y precoz, por lo que se siguen buscando nuevos marcadores de infección 2,3.
La procalcitonina (PCT) es la prohormona de la calcitonina. En condiciones normales sólo se sintetiza en pequeña cantidad en la glándula tiroides y en las células neuroendocrinas del pulmón, pero en la sepsis se produce en gran cantidad por casi todos los tejidos, aumentando significativamente sus concentraciones en sangre 4. Su inducción es rápida, detectándose a las 3 h tras un estímulo infeccioso, con pico a las 6 h y semivida de 24 h 5. Por todo ello, la PCT ha sido evaluada como marcador de infección grave tanto en adultos como en niños, con resultados muy prometedores 5. Varios estudios recientes sugieren su utilidad para el diagnóstico precoz de sepsis neonatal6-18, aunque también han surgido interrogantes por su elevación fisiológica en las primeras 48 h de vida 6,19.
El objetivo de este trabajo es estudiar la posible utilidad de la PCT para el diagnóstico de sepsis neonatal de transmisión vertical, y comparar sus resultados con los de la proteína C reactiva (PCR), recuento leucocitario e índice de neutrófilos inmaduros/totales (índice I/T), que son los marcadores de infección más empleados en el momento actual.
Pacientes y método
Se realizó un estudio prospectivo en el Servicio de Neonatología del Hospital Universitario Central de Asturias entre febrero de 2000 y enero de 2002. Se incluyeron en el estudio los pacientes ingresados que reunían criterios para ser clasificados en alguno de los grupos definidos y en los que se pudo realizar de manera adecuada la recogida de muestras y de datos a cargo del equipo investigador. Se excluyeron los recién nacidos de madre con diabetes gestacional. Las extracciones de sangre fueron realizadas cuando la situación clínica de los pacientes lo aconsejaba según los procedimientos habituales, con solicitud previa de consentimiento informado escrito a los padres al ingreso del paciente. Para la medición de la PCT no se extrajo volumen adicional de sangre, sino que se aprovechó el suero sobrante tras la medición de la PCR.
Se establecieron cuatro grupos partiendo de las definiciones de sepsis de transmisión vertical establecidas por el Grupo de Hospitales Castrillo 1,20.
Grupo control: neonatos ingresados en las primeras 24 h de vida en ausencia de signos clínicos de infección, con hemocultivo negativo y sin haber recibido tratamiento antibiótico en el parto.
Procesos no infecciosos: recién nacidos de hasta 72 h de vida diagnosticados de procesos de causa no infecciosa, ausencia de utilización de antibióticos en el parto y hemocultivo negativo.
Sepsis vertical demostrada: para los recién nacidos de hasta 72 h de vida se precisaba hemocultivo positivo a germen patógeno (o en su defecto aislamiento de Streptococcus agalactiae en exudado vaginal materno o en al menos tres exudados periféricos) y al menos tres signos clínicos de infección (tabla 1). Para recién nacidos de más de 72 h de vida se precisaban al menos tres signos clínicos de infección (tabla 1), un hemocultivo positivo a germen típico de transmisión vertical (Streptococcus del grupo B [SGB], Escherichia coli) y aislamiento del mismo germen en exudado vaginal materno o en al menos tres exudados periféricos tomados en las primeras 48 h de vida.
Sepsis vertical clínica: se incluyeron neonatos de hasta 72 h de vida con al menos tres signos clínicos de infección (tabla 1), hemocultivo negativo, y al menos dos factores de riesgo de transmisión vertical (tabla 1) y/o administración de antibióticos intraparto. Para el análisis de eficacia diagnóstica este grupo se consideró, al igual que el grupo anterior, como de sepsis verdaderas.
La PCT se midió mediante análisis inmunoluminométrico (Lumitest® PCT, Brahms Diagnostica GmbH, Alemania), cuyo límite de detección se sitúa en 0,08 ng/ml. La PCR se determinó mediante turbidimetría (Turbitimer®, Dade Behring Marburg GmbH, Alemania), con un límite de detección de 5 μg/ml. El recuento leucocitario se realizó mediante un sistema automatizado Coulter® STKS (Beckman Coulter, Inc., EE.UU.). Para la obtención del índice I/T se realizó recuento manual tras tinción Wright-Giemsa en el sistema Hema-Tek 2000 (Miles, Inc., EE.UU.).
Para el análisis estadístico se utilizaron los programas informáticos SPSS 11.0 (SPSS Inc, 2001, EE.UU.) y Epidat 3.0 (Xunta de Galicia y Organización Panamericana de la Salud, 2003). Para determinar el patrón de normalidad de la PCT durante las primeras 72 h de vida se construyó un rango para un intervalo de confianza del 90 % según el método de seis pasos descrito por Royston 21. La asociación entre los valores de PCT y una serie de variables se estudió mediante regresión lineal múltiple. En la parte analítica, dado que ni la PCT ni la PCR se ajustaron a la distribución normal, se emplearon en general pruebas no paramétricas. El nivel de significación estadística se estableció en p < 0,05. Se calcularon la sensibilidad, especificidad, valores predictivos, índice J de Youden de seguridad diagnóstica y cocientes de probabilidades con sus respectivos intervalos de confianza del 95 %, utilizando una hoja de cálculo proporcionada por el Programa de Habilidades en Lectura Crítica España (CASPe) (http://www.redcaspe.org/herramientas/).
Resultados
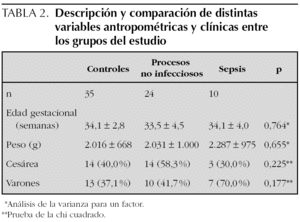
Se incluyeron en el estudio 136 muestras de 69 recién nacidos, cuyas características antropométricas y clínicas se recogen en la tabla 2. Correspondieron 35 recién nacidos al grupo control, 24 al de procesos no infecciosos (8 casos de enfermedad de membrana hialina, nueve con sufrimiento perinatal agudo y siete con otros procesos no infecciosos) y 10 pacientes con sepsis. Se diagnosticaron cinco sepsis clínicas y cinco sepsis confirmadas (tres causadas por Streptococcus agalactiae, uno por Enterococcus faecalis y uno por Streptococcus bovis), sin encontrar diferencias estadísticamente significativas entre ambos grupos al comparar sus características.
Rango de normalidad
Utilizando 61 muestras procedentes de los 35 recién nacidos del grupo control, construimos el rango de normalidad de la PCT para el 90 % de los neonatos sanos durante las primeras 72 h de vida (fig. 1A). Se pudo apreciar un ascenso paulatino durante las primeras 36 h con posterior descenso de los valores. Sólo tres muestras (4,9 %) sobrepasaron el límite superior. Al comparar los valores de PCT encontrados en el grupo de enfermedad de membrana hialina (EMH) con el rango de normalidad, 5 de las 20 muestras (25 %) se situaron por encima de dicho rango y tres de ellas superaron los 20 ng/ml. Un fenómeno similar ocurrió con los 9 recién nacidos que padecieron sufrimiento perinatal agudo, con 4 de las 18 muestras (22,2 %) por encima del rango de referencia. En el caso de los recién nacidos con sepsis (fig. 1B), 12 de 23 muestras (52,2 %) se situaron por encima del límite superior, con valores de PCT de hasta 163,5 ng/ml.
Figura 1. A)Rango de normalidad de la PCT durante las primeras 72 h de vida basado en 61 muestras (triángulos) de 35 recién nacidos del grupo control. La línea continua representa la media y las líneas discontinuas los límites del intervalo de confianza del 90 %.B) Valores de PCT en 10 neonatos con sepsis de transmisión vertical representados sobre el rango de normalidad calculado para el 90 % de recién nacidos del grupo control.
El modelo de regresión lineal múltiple en los grupos control y de patología no infecciosa no encontró asociación entre preeclampsia materna, colonización materna por SGB, gemelaridad, sexo, tiempo de bolsa rota superior a 18 h, parto prematuro espontáneo, cesárea, enfermedad de membrana hialina o sufrimiento perinatal agudo y los valores de PCT. Además de las horas de vida, la única variable que mostró influencia sobre los valores de PCT fue la utilización prenatal de corticoides. Los recién nacidos que habían recibido alguna dosis de corticoides antes del parto tuvieron concentraciones de PCT más bajas que los que no los recibieron (coeficiente estandarizado β = 0,245 con p = 0,01).
Marcadores de sepsis de transmisión vertical
Para esta parte del estudio sólo se consideraron las muestras de sangre para las que se pudieron determinar los 4 marcadores estudiados. Ello supuso eliminar 5 pacientes del grupo control y cuatro del grupo de procesos no infecciosos (43 muestras en total), sin que se afectara la comparabilidad de ambos grupos respecto a la tabla 2.
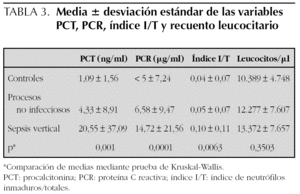
Los valores de PCT, PCR e índice I/T aumentaron sucesivamente en los grupos de control, procesos no infecciosos y sepsis (tabla 3), sin alcanzar significación estadística en el caso del recuento leucocitario.
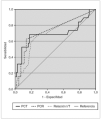
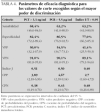
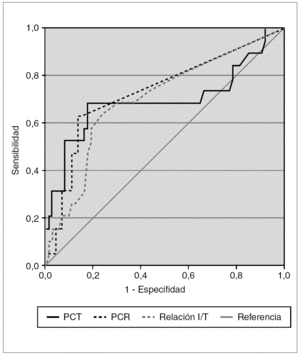
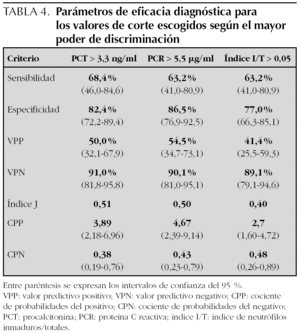
Se estudió la eficacia diagnóstica de PCT, PCR e índice I/T para el diagnóstico de sepsis (incluyendo sepsis clínica y sepsis confirmada) frente a no sepsis (controles y procesos no infecciosos) mediante sus curvas COR (fig. 2), sin encontrar diferencias estadísticamente significativas entre ellas. A partir de las curvas COR se obtuvieron los puntos de corte óptimos para calcular los índices de validez (tabla 4).
Figura 2.Curvas COR de PCT, PCR, y relación índice I/T para el diagnóstico de sepsis de transmisión vertical, calculadas sobre 93 muestras de 60 recién nacidos. Las áreas bajo la curva con sus intervalos de confianza del 95 % fueron: PCT, 0,696 (0,531-0,860); PCR, 0,735 (0,598-0,873); relación índice I/T, 0,703 (0,567-0,840).
Posteriormente, con el fin de estudiar el comportamiento de estos marcadores de infección en función del tiempo, se analizaron por separado las muestras extraídas antes y después de las 24 h de vida. Se apreció una tendencia de la PCT, la PCR y el recuento leucocitario a mejorar notablemente sus rendimientos diagnósticos a partir de las 24 h de vida, con áreas bajo la curva superiores a las de las primeras 24 h de vida (tabla 5).
Discusión
La elevación fisiológica de los valores de PCT sérica en recién nacidos sanos ha sido descrita con anterioridad 6,18,19,22, y parece deberse no tanto a un paso transplacentario como a una producción endógena, dado que los valores de PCT son mayores en la sangre del recién nacido que en sangre materna y las diferencias aumentan a las 24 y 48 h tras el parto 23.
Un estudio previo de Chiesa et al 6 sobre 124 muestras de 83 recién nacidos a término sanos, con un modelo matemático similar al empleado en este trabajo, obtuvo una curva de normalidad con valores máximos cercanos a 20 ng/ml a las 24 h y posterior disminución hasta normalizarse a partir del tercer día. Nuestros resultados muestran una evolución temporal más lenta (fig. 1A), con máximos en torno a los 10 ng/ml hacia las 36 h de vida y vuelta a concentraciones basales a partir de las 72 h. A diferencia del trabajo de Chiesa et al 6, el nuestro incluye prematuros (edad gestacional 39,1 ± 1,2 semanas frente a 34,1 ± 2,8 semanas), lo cual podría haber influido en los resultados.
La elevación fisiológica de la PCT en los primeros días de vida parece relacionarse sobre todo con la situación de estrés desencadenada por el parto y la adaptación al ambiente extrauterino, incluyendo la rápida colonización bacteriana de piel y mucosas. Como se ha podido comprobar 24,25, el incremento de la concentración de PCT no es un hecho aislado, sino que se repite con otros reactantes de fase aguda como la PCR, la interleucina 6 y el amiloide sérico A. Sin embargo, este hecho no ha sido tenido en cuenta hasta ahora para la utilización de estas moléculas como marcadores de infección neonatal. La PCR es utilizada de manera rutinaria y existen gran número de trabajos que establecen puntos de corte fijos sin recurrir a rangos de normalidad adaptados a las horas de vida. Con la PCT sólo un estudio publicado hasta la fecha 6 ha considerado la utilización de un rango de normalidad dinámico. Aunque el resto de trabajos han utilizado con mayor o menor éxito puntos de corte fijos, un trabajo más reciente del grupo de Chiesa demostró mayor eficacia con tres puntos de corte (a las 0, 24 y 48 h de vida) respecto a uno 9. Nuestro trabajo no ha encontrado mayor eficacia diagnóstica con el rango de normalidad dinámico respecto al punto de corte fijo, pero sí permite apreciar que el rendimiento es superior a partir de las 24 h de vida. Lo que parece indudable es que no se puede ignorar la cinética de la PCT (y posiblemente tampoco la de la PCR y otros marcadores de infección), y con probabilidad estudios con mayor número de pacientes y diseño adecuado ayudarían a definir mejor este hecho y a optimizar su rendimiento diagnóstico.
Aunque no encontramos diferencias estadísticamente significativas entre los valores de PCT del grupo control y los de recién nacidos con enfermedad de membrana hialina, el 25 % de las muestras del grupo de EMH superaban el rango de normalidad establecido. Trabajos anteriores 14,26 han encontrado valores de PCT notablemente elevados en recién nacidos con dificultad respiratoria de diversas causas (EMH, mala adaptación pulmonar, aspiración meconial, etc.). Dado que no se ha encontrado correlación con la gravedad ni con la hipoxemia este hecho ha sido atribuido a la síntesis pulmonar de PCT, aunque sin aportar pruebas al respecto. Tampoco se debe olvidar que muchos niños con signos de dificultad respiratoria son tratados empíricamente con antibióticos y, por tanto, podrían incluirse en este grupo sepsis encubiertas. Aunque se han descrito valores elevados de PCT en neonatos con síndrome de mala adaptación pulmonar, los 2 casos recogidos en nuestro estudio se situaron dentro del rango de normalidad.
Las situaciones de sufrimiento perinatal agudo, probablemente en relación con la hipoxia tisular resultante, podrían inducir una elevación importante de la PCT. Esta asociación ha sido evidenciada previamente por Monneret et al 26, y recientemente Chiesa et al 27, encontraron un incremento de la concentración de PCT a las 24 h de vida en recién nacidos intubados en la sala de partos 9. En cambio, otros trabajos previos fallaron a la hora de detectar esta asociación 6,14. Este trabajo tampoco encontró asociación entre sufrimiento perinatal y niveles de PCT en el análisis de regresión lineal múltiple, pero el hecho de que el 22,2 % de las muestras de neonatos con este problema superaran el rango de normalidad establecido hace pensar que el resultado esté influido por el reducido tamaño de la muestra.
La asociación del uso prenatal de corticoides con concentraciones más bajas de PCT no ha sido descrita previamente en la literatura especializada. Los trabajos más enfocados a la detección de posibles asociaciones con los valores de PCT en el recién nacido no han incluido esta variable entre las estudiadas 6,9,23, por lo que no es posible establecer comparaciones. No obstante, dado el diseño del estudio y el tamaño muestral no es posible cuantificar con precisión el efecto del uso prenatal de corticoides sobre la PCT del recién nacido, ni si su influencia es importante a la hora de interpretar los resultados.
Al analizar todas las muestras en conjunto, sólo la PCT, la PCR y el índice I/T mostraron cierta capacidad diagnóstica para la sepsis de transmisión vertical. No se pudo demostrar capacidad diagnóstica para la PCT, PCR y recuento leucocitario durante las primeras 24 h de vida, pero en cambio su eficacia aumentó notablemente entre las 25 y 72 h de vida. Este fenómeno se ha observado en otros estudios recientes 9.
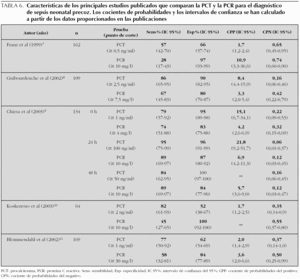
La principal limitación de este estudio reside en su escaso tamaño muestral, lo cual supone amplios intervalos de confianza en los indicadores del rendimiento diagnóstico. Esta limitación es común con todos los principales estudios sobre la PCT en sepsis de inicio precoz publicados hasta la fecha 6-15, por lo que no es de extrañar que existan enormes variaciones entre tales estudios tanto respecto a los puntos de corte seleccionados (0,5-100 ng/ml) como a los resultados obtenidos (sensibilidad 57-100 %, especificidad 50-100 %, CPP 1,7-∞, CPN 0-0,65). Tampoco es posible valorar las diferencias entre la eficacia de los distintos marcadores de infección, dado que en ningún caso alcanzan la significación estadística. A modo de ejemplo, suponiendo una prevalencia de sepsis del 25 % y una diferencia absoluta entre la sensibilidad de la PCT y la PCR del 15 %, sería necesario incluir unos 300 pacientes para tener el 80 % de garantía de detectar esa diferencia. Ninguno de los trabajos publicados hasta la fecha que comparan entre sí estos dos marcadores se acercan a esa cifra y por ello no permiten establecer conclusiones al respecto (tabla 6) 7-11. Por otro lado, el estudio se ha realizado sobre una muestra de oportunidad que no recoge todos los casos de sepsis o de sospecha de sepsis presentes en nuestro centro durante la duración del mismo. Por ello no es posible establecer la incidencia real de sepsis y calcular la probabilidad preprueba, y se introduce un sesgo en los valores predictivos.
La gran heterogeneidad en el diseño de los estudios, sobre todo por la ausencia de un criterio de referencia ideal para el diagnóstico de sepsis neonatal, dificulta la comparación entre estudios y la realización de metaanálisis. De manera tradicional se ha considerado al hemocultivo como patrón de referencia, pero en recién nacidos presenta limitaciones por el empleo de muestras de sangre pequeñas, la utilización de antibióticos en el parto o la presencia de bacterias contaminantes de baja virulencia 27. La propia definición de consenso de sepsis utilizada en la actualidad se refiere a ella como un síndrome de respuesta inflamatoria sistémica causado por una infección, pero no exige necesariamente pruebas microbiológicas 28. Por todo ello en Neonatología se ha extendido el concepto de sepsis clínica, si bien no existe una definición unánime y cada grupo investigador utiliza sus propios criterios. Nosotros hemos optado por unos criterios bastante estrictos, buscando minimizar todo lo posible la probabilidad de falsas sepsis. Tampoco hay acuerdo en cómo interpretar las sepsis clínicas, ya sea equiparándolas a las sepsis microbiológicamente confirmadas 29, eliminándolas de los análisis o considerándolas falsas sepsis 30. Hay que asumir que dentro del grupo de sepsis clínicas habrá tanto sepsis verdaderas con cultivos negativos, como falsas sepsis, pero es evidente que este grupo no puede ser ignorado si queremos que el estudio refleje una situación equivalente a la de la práctica clínica habitual.
Como conclusión, la PCT tiene capacidad discriminativa para la sepsis de transmisión vertical, por lo que podría ser útil como herramienta diagnóstica en la práctica clínica. Son necesarios estudios con mayor número de pacientes y una adecuada definición de los distintos grupos para establecer con precisión su verdadera utilidad y poder realizar comparaciones con otros marcadores como la PCR o el recuento leucocitario.
Correspondencia: Dr. J.B. López Sastre.
Departamento de Pediatría. Hospital Universitario Central de Asturias.
Celestino Villamil, s/n. 33006 Oviedo. España.
Correo electrónico: jlopezs@ya.com
Recibido en marzo de 2005.
Aceptado para su publicación en enero de 2006.