Hace 100 años el científico ruso Iliá Mechnikov, que trabajaba en el Instituto Pasteur de París, publicaba los efectos beneficiosos de determinadas bacterias intestinales que se consumían en forma de leches fermentadas, y textualmente refirió que "la ingestión de microorganismos específicos como Lactobacillus puede desplazar las toxinas producidas por los microorganismos de putrefacción en el tracto intestinal, promoviendo la salud y prolongando la vida".
El uso de estos microorganismos, tanto para la prevención de enfermedades como para su tratamiento1, está teniendo un importante auge en la actualidad y las publicaciones al respecto son cada vez más numerosas.
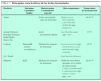
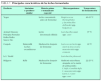
Las posibles áreas potenciales de acción de los probióticos quedan referidas en la tabla 1.
Evidentemente, el uso de probióticos en muchas de estas enfermedades requerirá estudios más amplios para poder ser aceptados como tratamiento habitual.
Diarrea aguda
El efecto más investigado de los probióticos en la infancia es su utilización tanto para la prevención como para el tratamiento de la diarrea aguda.
Prevención de la diarrea aguda nosocomial
En el estudio clásico de Saavedra et al2 se demuestra que el uso de fórmulas con probióticos (Streptococcus termophilus y Bifidobacterium Bb 12) en niños de entre 5 y 24 meses de edad crónicamente hospitalizados para la prevención de la diarrea aguda nosocomial reduce su incidencia en un 7% en el grupo tratado, en comparación con el 31% del grupo control. En otros estudios con Lactobacillus GG se encuentran datos similares3.
Prevención de la diarrea aguda adquirida en la comunidad
También se ha demostrado la eficacia de los probióticos en la prevención de la diarrea aguda adquirida en la comunidad.
Pedone et al4, al usar leche fermentada con Lactobacillus casei DN-114001 comparada con yogur en niños sanos de entre 6 y 24 meses de edad, encuentran una incidencia estadísticamente inferior de diarrea aguda (15,9%) con este probiótico en comparación con el yogur (22%).
En un estudio más reciente en niños entre 4 y 10 meses de edad que recibieron fórmula suplementada con Bifidobacterium lactis BB12 o Lactobacillus reuteri frente a un grupo control sin suplementación, en el grupo de estudio los episodios de diarreas y su duración eran estadísticamente menores que en el grupo control5.
También se ha ensayado en niños desnutridos menores de 2 años de edad, en los que se comprueba una disminución del número de episodios en los pacientes que tomaron Lactobacillus GG, en comparación con placebo, aunque de duración similar6.
En ratas gestantes se ha utilizado Bifidobacterium o placebo hasta el nacimiento. Posteriormente se somete a las ratas lactantes y a sus madres a contacto con rotavirus, se demostró en las ratas madre que tomaron Bifidobacterium con un aumento de la inmunoglobulina (Ig) A secretora con una mejor protección contra los rotavirus, frente al grupo control7.
En humanos se ha ensayado la adición de Lactobacillus al final de la gestación, y se ha comprobado colonización por Lactobacillus en el recién nacido, que es estable al menos 6 meses y puede persistir hasta los 2 años de edad8.
Tratamiento de la diarrea aguda
Los probióticos disminuyen la duración y la gravedad de la diarrea aguda, principalmente en las de origen viral y preferentemente por rotavirus, al limitar la superficie de mucosa en la que se desarrolla la infección y sus efectos inmunológicos. Hoy día está ampliamente aceptado su uso en esta enfermedad.
Sus efectos parecen ser más limitados para las de origen bacteriano, aunque también se ha demostrado su efectividad en Shigellosis y otras infecciones bacterianas (Salmonella, Escherichia coli enterotoxigénica, etc.)9.
Los estudios de probióticos para el tratamiento de la diarrea aguda son numerosos, y se han ensayado varios tipos (L. reuteri, Lactobacillus acidophilus, Lactobacillus GG, L. casei, Lactobacillus plantarum, Saccharomyces boulardii, Enterococcus faecium SF68). En varios metaanálisis se ha confirmado la utilidad de los probióticos en esta entidad10,11, que son más efectivos al inicio de la enfermedad y con una eficacia mayor para Lactobacillus.
Por otra parte, también se ha ensayado con éxito su inclusión en soluciones de rehidratación oral con una alta eficacia.
Según la medicina basada en la evidencia (MBE), los probióticos poseen un grado de recomendación A (nivel de evidencia 1A) tanto para el tratamiento como para la prevención de la diarrea aguda nosocomial o adquirida12.
Diarrea del viajero
Los estudios son discordantes en la prevención de la diarrea del viajero, debido a las diferentes áreas geográficas y a las características de las poblaciones estudiadas.
Lactobacillus GG reduce el riesgo de diarrea del viajero en un 40-50% en personas que viajan de países desarrollados a países en vías de desarrollo. También se ha demostrado eficaz S. boulardii(1) en la prevención de la diarrea del viajero.
Otros estudios no encuentran efectos beneficiosos de Lactobacillus GG frente a placebo para la prevención de la diarrea del viajero.
Diarrea por antibióticos
La diarrea asociada a antibióticos (DAA) es secundaria a una alteración de la flora fecal y es también aceptado el uso de probióticos para su prevención y tratamiento.
Los estudios confirman su alta eficacia en la prevención con un grado de recomendación A (nivel de evidencia 1A)13,14 según la MBE, con menores efectos en el tratamiento.
El uso de probióticos concomitantemente con antibióticos orales reduce hasta en un 75% la aparición de diarrea. Se ha demostrado la eficacia de S. boulardii, L. rhamnosus GG, E. faecium, L. acidophilus, Bifidobacterium infantis, Bifidobacterium longum y Bifidobacterium bifidum, entre otros; los dos primeros son los que se han demostrado más eficaces en la DAA. Cabe recordar que hasta un tercio de las DAA son secundarias a Clostridium difficile y que S. boulardii impide la adhesión de C. difficile a la mucosa intestinal.
Dos metaanálisis realizados en adultos confirman estos resultados13,14.
En niños se ha usado Lactobacillus GG frente a placebo concomitantemente con la toma de antibióticos, que ha demostrado una disminución de la frecuencia de las deposiciones y un aumento de la consistencia de éstas en los grupos tratados con probióticos.
Recientemente dos trabajos realizados en niños15,16 demuestran la alta eficacia de S. boulardii en la prevención de la DAA cuando se administra concomitantemente con el antibiótico.
También se ha ensayado el uso de simbióticos (fructooligosacáridos con Lactobacillus sporogenes) para la prevención de la DAA en niños, y se ha demostrado una reducción significativa en el número y la duración de la diarrea17.
Helicobacter pylori
Se ha sugerido el uso de probióticos para la prevención y el tratamiento de la colonización por Helicobacter pylori1. Los estudios se han realizado principalmente en adultos, aunque existen algunos trabajos en niños18.
Los probióticos son capaces de bloquear la adhesión de H. pylori a la mucosa gástrica, inhibir su crecimiento y disminuir el número de bacterias en la mucosa gástrica, aunque no poseen efecto erradicador. Se ha usado con cierta eficacia junto con el tratamiento habitual, entre otros, L. reuteri, Lactobacillus johnsonii, L. acidophilus, Lactobacillus GG, L. casei, S. boulardii, B. lactis y Bacillus claseii. Estudios in vitro han demostrado que Bacillus subtilus produce un antibiótico específico, la anticoumacina A, contra H. pylori.
Dado el aumento de la resistencia antibiótica para la erradicación de H. pylori, los probióticos podrían desempeñar un papel importante como coadyuvante en el tratamiento.
Otras infestaciones intestinales
Se ha usado con éxito para el tratamiento de Criptosporidium en pacientes inmunodeprimidos y en Giardia lamblia.
Enterocolitis necrosante
Tras los primeros usos de Bifidobacterium en modelo animal (ratas) a las que experimentalmente se les producía enterocolitis necrosante (ECN) --donde se observaba que se reducía la aparición de ECN y muerte en el grupo tratado con probióticos en comparación con otro grupo control tratado con placebo--, se ha ensayado su uso en humanos con B. infantis y L. acidophilus, en los que se demuestra una disminución de la incidencia, de la endotexemia, de la gravedad y de la mortalidad19. Su mecanismo de acción incluye una reducción de la colonización mucosa por patógenos potenciales, un incremento del efecto barrera para las traslocaciones bacterianas, un mecanismo competitivo de adhesión a los enterocitos y una modificación de la respuesta inmunitaria.
Colon irritable
Se ha ensayado en niños el uso de L. plantarum 299V en esta entidad con efectos favorables, aunque sus efectos son discutibles. En algunos estudios se sugiere que mejora la flatulencia y el dolor abdominal.
Sin embargo, en un trabajo reciente, en el que se ha usado Lactobacillus GG en niños con esta enfermedad frente a un grupo placebo, no se encuentra diferencias en cuanto al dolor abdominal ni a ningún otro síntoma, salvo la distensión abdominal percibida20.
Enfermedad inflamatoria intestinal crónica
Los pacientes con enfermedad inflamatoria intestinal crónica (enfermedad de Crohn [EC] y colitis ulcerosa) presentan una hiperrespuesta inmune a las bacterias de la flora intestinal, que es un importante mecanismo fisiopatológico en la génesis de las lesiones de la mucosa intestinal.
En estudios experimentales realizados en ratas con lesión mucosa inducida por metotrexato, el uso de L. plantarum 299V reduce la traslocación bacteriana, la inflamación e incrementa la regeneración de la mucosa.
En pacientes con EC la administración de probióticos es capaz de revertir algunas de las alteraciones de las respuestas inmunes de esta enfermedad, principalmente del factor de necrosis tumoral (TNF) alfa, que parece tener un papel fundamental en la patogenia de la función inmunitaria de la mucosa. Estudios in vitro demuestran que la incubación de mucosa de íleon terminal de pacientes con EC activa con L. casei DN-114001 reduce significativamente la liberación de TNF-α por la mucosa inflamada, que se asocia con una reducción de la expresión de TNF-α en los linfocitos intraepiteliales y con una reducción de la expresión de CD25 en los linfocitos T de la lámina propia, lo que por tanto indica una modulación de la respuesta inflamatoria21.
La administración de Lactobacillus GG en pacientes pediátricos con EC disminuye la permeabilidad intestinal, que se encuentra aumentada en esta enfermedad, y puede tener un efecto beneficioso. Un estudio piloto con Lactobacillus GG demuestra efectos beneficiosos en niños con EC22.
Algunas preparaciones de probióticos se han mostrado eficaces en el tratamiento de la colitis ulcerosa. VSL#3, Lactobacillus GG, L. plantarum y L. reuteri se han ensayado con éxito para el tratamiento de la colitis ulcerosa experimental.
Poseen un claro efecto positivo en la prevención de la "pouchitis" o reservoritis y en el mantenimiento de la remisión con un grado de recomendación A (nivel de evidencia 1B) según la MBE.
El uso de simbióticos (fructooligosacáridos con inulina y B. longum) se ha ensayado en pacientes adultos con colitis ulcerosa activa durante un mes, y en el grupo de estudio se ha logrado una disminución del índice de actividad clínica, una disminución del marcador de actividad endoscópico, una disminución de la proteína C reactiva y de las citocinas proinflamatorias TNF-α e interleucina (IL) 1-alfa, así como una disminución de la inflamación medido en las biopsias obtenidas, comparados con el grupo control23.
El campo de los probióticos para el tratamiento de la enfermedad inflamatoria intestinal crónica parece ser alentador, aunque se necesitan estudios más amplios.
Sobrecrecimiento bacteriano intestinal
Se ha usado con éxito Lactobacillus GG y L. plantarum 299V en niños afectados de síndrome de intestino corto y sobrecrecimiento bacteriano intestinal donde esta complicación es frecuente. La finalidad es sustituir la flora patógena por una beneficiosa para el paciente, que no le cause las graves complicaciones de esta enfermedad, como la atrofia intestinal y la inflamación.
Más recientemente, el uso de simbióticos (galactooligosacáridos con B. breve y L. casei) en niños con síndrome de intestino corto y enterocolitis refractaria logra unos efectos beneficiosos al suprimir las bacterias patógenas, inducir una flora anaeróbica, aumentar los ácidos grasos de cadena corta en heces, suprimir la enterocolitis y mejorar el estado nutricional24.
Encefalopatía hepática
En estudios experimentales en ratas cirróticas se ha usado L. johnsonii para el tratamiento de la encefalopatía hepática. Con este tratamiento vehiculizado con antioxidantes se consiguió una supresión de las traslocaciones bacterianas, una reducción del contenido ileal y cecal de enterobacterias y Enterococcus y una disminución de los niveles de malondialdehído, comparado con el grupo que sólo recibió antioxidantes25. Sin embargo, en un estudio similar con L. rhamnosus GG no se hallan los mismos datos26.
Hígado graso no alcohólico
En esta entidad, entre otros agentes, las bacterias intestinales, las endotoxinas bacterianas y el TNF-α parecen modular la lesión hepática.
Estudios experimentales con VSL#3 en ratas con hígado graso no alcohólico demuestran una disminución de la lesión hepática, de la grasa total hepatocitaria y de los niveles de ALT27.
Estos hallazgos abren un posible tratamiento coadyuvante para esta enfermedad altamente prevalente en los países desarrollados, secundaria principalmente a la obesidad.
Pancreatitis
El uso de probióticos (L. plantarum) se ha ensayado con eficacia en la prevención de complicaciones sistémicas por traslocaciones bacterianas en pacientes adultos con pancreatitis aguda grave, con una disminución muy relevante de la mortalidad28. Estos mismos efectos positivos también se han ensayado con probióticos en pacientes adultos trasplantados hepáticos con complicaciones infecciosas secundarias a traslocaciones bacterianas. Todos estos estudios abren una nueva estrategia terapéutica para la prevención de complicaciones sépticas en pacientes críticos.
Según la MBE, la prevención de sepsis asociada a la pancreatitis aguda grave28 y la prevención de sepsis posquirúrgica poseen un grado de recomendación B (nivel de evidencia 2B).
Intolerancia a la lactosa
El uso de probióticos, como leches fermentadas, mejora la tolerancia a la lactosa en individuos con intolerancia a ésta al degradarse por las enzimas bacterianas (betagalactosidasas), y mejorar su digestibilidad al contribuir a la digestión de la lactosa en el intestino delgado. Varios estudios demuestran una mejor digestión de la lactosa y menor excreción de hidrógeno en el aire espirado en pacientes con intolerancia a la lactosa que consumen yogur.
Hipercolesterolemia
Existen bacterias intestinales que son capaces de modificar enzimáticamente la molécula de colesterol al convertirlo en coprostanol, que es su principal metabolito microbiano en los mamíferos y que es excretado por las heces. Esta función se adquiere en el hombre a partir de los 6 meses de edad.
Por otra parte, los probióticos tienen la capacidad de hidrolizar los ácidos biliares conjugados. Una vez desconjugados, éstos coprecipitan con el colesterol a un pH inferior a 5,5 y posteriormente son eliminados por las heces, compensando al hígado la pérdida de ácidos biliares con la producción de nuevos ácidos a partir del colesterol, que teóricamente tendría efectos positivos en la hipercolesterolemia.
Los estudios realizados hasta la actualidad con leches fermentadas con probióticos aún no son concluyentes, y en algunos se muestra una disminución de las cifras séricas de colesterol y de lipoproteínas de baja densidad cuando son comparadas con un producto control.
Un estudio experimental en ratones con hipercolesterolemia a los que se les administró L. reuteri CRL 1098 (104 UFC/día) durante 7 días disminuyó el colesterol total en un 38%, con niveles séricos de colesterol similares al grupo control29.
Prevención del cáncer
En la fisiopatología del cáncer de colon la flora intestinal interviene de forma preponderante, con una clara relación entre dieta y cáncer de colon. De esta forma, a nivel experimental se han identificado algunos probióticos (Lactobacillus GG) que pueden intervenir en la detoxificación de mutágenos o carcinógenos, al poseer capacidad para inhibir enzimas bacterianas del tubo digestivo (principalmente bacteroides y Clostridium) relacionadas con carcinógenos colónicos como la betaglucuronidasa, la betaglucosidasa, la azorreductasa, la nitrorreductasa y el ácido glucocolicohidrolasa. Por otra parte, en los probióticos se ha sugerido un incremento del mecanismo de la apoptosis, que elimina células que están proliferando de forma descontrolada. Por este motivo, es probable que el uso de probióticos se enmarque en la prevención del cáncer de colon, sobre todo en individuos con factores de riesgo asociados a esta neoplasia (historia familiar, poliposis, etc.).
En otro sentido, en un estudio con B. longum se demostró que este probiótico inhibe el desarrollo de las neoplasias de mama y colon.
En el ámbito experimental se ha ensayado en ratas el uso de simbióticos (inulina y oligofructosa en asociación con Lactobacillus GG y Bifidobacterium B12) en la prevención del cáncer de colon con muy buenos resultados30.
Fenómenos alérgicos
La posible relación entre la flora intestinal y las enfermedades alérgicas ha suscitado numerosos estudios en los últimos años. Se sabe que en los países desarrollados existe una relación inversa entre la presencia de enfermedades infecciosas, tanto virales como bacterianas, que han disminuido, y las enfermedades alérgicas y autoinmunitarias, que han aumentado. Al respecto, y a partir de un componente genético, se ha emitido la hipótesis de la "higiene excesiva" que se basa en una disminución o ausencia de exposición a microorganismos bacterianos desde edades tempranas, la ingestión cada vez mayor de alimentos asépticos y el aumento de enfermedades de base inmunológica, ya que las bacterias intervienen de forma muy importante en el desarrollo y la modulación del sistema inmune.
Un metaanálisis reciente31 apoya estos datos al relacionar la dermatitis atópica de forma inversa con las endotoxinas, ingreso temprano en centros infantiles y exposición temprana con animales. En este mismo estudio se hace hincapié en la precaución para la prescripción de antibióticos en edades tempranas de la vida, sobre todo en niños con antecedentes de dermatitis atópica, y en el papel preventivo de los probióticos.
Tanto en la alergia alimentaria como en la dermatitis atópica, los probióticos pueden regular las reacciones de hipersensibilidad, disminuir la inflamación intestinal y la permeabilidad intestinal, al promover los mecanismos de barrera endógena e inducir la tolerancia oral31.
Isolauri et al32 refieren que en niños con dermatitis atópica que reciben una fórmula altamente hidrolizada suplementada con Lactobacillus GG y B. lactis, comparados con un grupo control que recibe la misma fórmula altamente hidrolizada sin probióticos, las manifestaciones clínicas de la dermatitis son estadísticamente menores.
En otro estudio33 en el que se administraba L. rhamnosus GG o placebo a madres gestantes con antecedentes de atopia, desde 4 semanas previas al parto hasta 3 meses después y con lactancia materna exclusiva, en el grupo estudio se demostraba un aumento de TGF-β, con una disminución del riesgo de atopia hasta en un tercio de los niños, sobre todo en los que presentaban elevación de la IgE en cordón umbilical, y que se mantenía hasta los 2 años de edad, en comparación con el grupo placebo.
De esta forma, los probióticos podrían desempeñar un papel importante en el eccema atópico y en los fenómenos alérgicos.
Infecciones respiratorias. Otitis media
Se ha ensayado el uso de Lactobacillus GG de forma profiláctica y se ha encontrado una disminución del 17% de infecciones respiratorias en niños entre 1 y 6 años de edad34.
En otros estudios35 la adición de B. lactis y S. termophilus en fórmula en niños entre 3 y 24 meses de edad disminuye la frecuencia del uso de antibióticos, así como una reducción de los cólicos y de la irritabilidad en comparación con las fórmulas no adicionadas con estos probióticos.
Sin embargo, un estudio más reciente no encuentra diferencias en las enfermedades respiratorias en niños entre 4 y 10 meses de edad que recibieron fórmula suplementada con B. lactis BB12 o L. reuteri frente a un grupo control sin suplementación.
Fibrosis quística
Lactobacillus GG se ha mostrado altamente eficaz en pacientes afectados de fibrosis quística al disminuir las infecciones pulmonares graves, mejorar la respuesta inmune, disminuir las traslocaciones bacterianas, así como la inflamación intestinal36.
Caries
L. rhamnosus GG inhibe la adherencia de Streptococcus mutans. Por otra parte compite con los microorganismos cariogénicos y disminuye el riesgo de caries.
En un estudio realizado en 594 niños entre 1 y 6 años de edad, en el que se usó leche con Lactobacillus GG 5 días a la semana durante 7 meses o leche sin suplementación, se encuentra estadísticamente un número de caries menor y un contenido de S. mutans menor en el grupo suplementado en relación con el control. Los efectos eran más favorables en los niños con 3-4 años de edad37.
Sin embargo, en otro amplio estudio clínico con 600 niños durante 7 meses no se encontraron diferencias significativas en el efecto preventivo de Lactobacillus GG al compararlo con el grupo control38.
Infecciones urogenitales
Lactobacillus son componentes importantes de la flora urovaginal normal, en donde se encuentran adheridos a las células del epitelio urinario y vaginal.
Los trabajos de laboratorio y los estudios clínicos demuestran que Lactobacillus son protectores de las infecciones urogenitales, tanto por sus mecanismos de adhesión (competición microbiana), por la modulación inmunitaria, así como por la producción de sustancias antimicrobianas y H2O2, que inhiben el crecimiento de los gérmenes patógenos39.
De forma terapéutica, Lactobacillus (principalmente rhamnosus y fermentum) se puede usar de forma oral, en supositorios, óvulos o crema perineal para prepúberes, tanto para el tratamiento como para la prevención de infecciones urogenitales, al reemplazar la flora patógena por otra flora beneficiosa. Se ha demostrado gran eficacia en la Candidiasis vaginal recurrente40.
Cálculos renales
Se ha ensayado el uso de Lactobacillus en adultos para prevenir la litiasis renal con resultados prometedores. El mecanismo fisiopatológico de su beneficio en esta patología se basa en la degradación en el ámbito intestinal de los oxalatos por Lactobacillus, lo que induce a una disminución de la oxaluria con menor riesgo de aparición de cálculos renales41.
Se necesitan estudios más amplios para corroborar estos resultados.
Probióticos y fórmulas
El informe del Comité Científico de los Alimentos de la Comisión Europea ha recomendado que para la adición de probióticos en fórmulas de inicio es necesario disponer de una autorización previa de la Autoridad Europea de Seguridad Alimentaria o de la Agencia Española de Seguridad Alimentaria, mientras que para las fórmulas de continuación autoriza su utilización si se cumple una serie de requisitos, como si son seguros, sobreviven a su paso a través del tracto gastrointestinal, tienen capacidad para reproducirse en el intestino y el contenido tiene que estar comprendido entre 106 y 108 UFC/g de bacterias viables42.
El Comité de Nutrición de la European Society of Paediatric Gastroenterology, Hepatology and Nutrition43 se muestra cauto, asimismo, para la adición de probióticos en fórmulas de inicio y no pone ningún inconveniente a su incorporación en las fórmulas de continuación.
Por otra parte, la Directiva de aditivos autoriza la adición de cultivos no patógenos productores de ácido láctico L (+)44, tanto en fórmulas de inicio como de continuación.
En la actualidad se está a la espera de una legislación al respecto. En la tabla 2 se muestran las fórmulas en nuestro medio con probióticos.
La adición de determinados probióticos en fórmulas es bien tolerada y segura35.
Seguridad y dosis
Se ha comprobado ampliamente la seguridad de Lactobacillus en la especie humana tras su consumo en forma de leches acidificadas durante muchos años. Las leches fermentadas forman parte de la dieta habitual en Asia, Europa y parte de África, y su consumo se está incrementando en Norteamérica.
De forma excepcional se ha descrito casos de bacteriemias con Lactobacillus en forma de endocarditis, neumonía y meningitis, y de forma extraordinaria con Bifidobacterium eriksonii. Todos estos pacientes estaban hospitalizados, presentaban cardiopatía en el caso de endocarditis o portaban catéteres centrales en los cuadros sépticos45. No se han documentado efectos adversos con otros Bifidobacterium ni con S. thermophilus.
En cuanto a S. boulardii hay que tener precaución en pacientes inmunodeprimidos, ya que se han descrito casos de fungemia.
Por otra parte, se han descrito casos de sepsis con Bacillus sp.
Otros posibles potenciales efectos secundarios de los probióticos serían la transferencia génica por plásmidos (descrita para E. faecium vancomicina, resistente a flora endógena o patógena) con riesgo de sepsis, actividades metabólicas perjudiciales y efectos desfavorables en la inmunomodulación.
Por razones de seguridad, la Agencia Francesa de Seguridad Alimentaria no aconseja el uso de probióticos en pretérminos ni en pacientes inmunodeprimidos, aunque también se ha usado Lactobacillus y Bifidobacterium en estas circunstancias sin efectos secundarios46.
En la actualidad no existe consenso en la dosis que hay que emplear con Lactobacillus y Bifidobacterium. En general, se han utilizado dosis que varían entre 1 × 106 a 1 × 1011 UFC por vía oral. La tendencia actual es a usar dosis altas entre 1 × 109 a 1 × 1011 por vía oral. En cuanto a S. boulardii no se recomiendan dosis superiores a 50 mg/kg/día por riesgo de sepsis.
Conclusiones
Los probióticos potencian los efectos beneficiosos de la flora intestinal y controlan sus posibles efectos perjudiciales para la salud. Se abre una nueva etapa en su uso para la prevención y el tratamiento de diferentes enfermedades.
La mayor evidencia científica del uso de probióticos es la reducción de la duración de la diarrea aguda infecciosa. Existe evidencia que indica su eficacia en la prevención de la diarrea aguda nosocomial y adquirida, de la DAA, en enfermedades respiratorias y alérgicas. Se necesitan más estudios básicos y clínicos para ampliar la lista de enfermedades, principalmente en el campo de la inmunidad intestinal, y las nuevas técnicas de biología molecular para el estudio del ecosistema digestivo.