La miocarditis es un trastorno inflamatorio del miocardio que cursa con la necrosis de los miocitos. La principal causa son las infecciones virales. La presentación clínica es muy variada: desde formas leves hasta formas fulminantes que cursan con la muerte y que se inician frecuentemente con síntomas banales.
Presentamos el caso de un niño de 18 meses que acude a urgencias por astenia y anorexia de 24h de evolución, con antecedente de fiebre en el contexto de infección respiratoria de vías altas la semana anterior. A su llegada a urgencias y durante las primeras horas de observación la exploración física fue rigurosamente normal. Posteriormente presentó empeoramiento progresivo del estado general (palidez y mala perfusión periférica) con alteraciones analíticas (acidosis metabólica, insuficiencia renal e hiperglucemia) y de forma brusca parada cardiorrespiratoria sin respuesta a maniobras de reanimación cardiopulmonar.
Myocarditis is an inflammatory disease of the myocardium accompanied by necrosis of myocytes. The main causes are viral infections. The clinical presentation varies from mild forms to devastating ones which usually begin with trivial symptoms with progression, in some cases, to death.
We report the case of an 18 month-old male toddler consulting for asthenia and anorexia for the last 24h and a previous history of respiratory tract infection with high fever in the last week.
Upon arrival at the emergency room and during the first hours of admission, physical examination was perfectly normal. Later, his general state gradually deteriorated,with biochemical disturbances (metabolic acidosis, renal failure and hyperglycaemia) and, eventually, a sudden cardiac arrest, with no response to cardiopulmonary resuscitation manoeuvres.
La miocarditis es un trastorno inflamatorio del miocardio que cursa con la necrosis de los miocitos1. La principal causa son las infecciones virales (fundamentalmente adenovirus tipo 2 y 5 y enterovirus [echovirus y cosackievirus tipo B]). La OMS estima una prevalencia de miocarditis tras infección enteroviral del 1–4%. Es una rara entidad, de manifestación esporádica, ocasionalmente epidémica y con distinta prevalencia según las zonas geográficas. La higiene y ciertos factores socioeconómicos (asistencia sanitaria, vacunaciones, etc.) contribuyen de forma significativa a esta diferencia2. En un estudio realizado en el Texas Children's Hospital en 14.000 pacientes cardíacos, el 0,5% de los niños presentó miocarditis como diagnóstico (hasta un 2–5% en estudio de necropsia)3. Casi un 20% de las muertes súbitas pediátricas puede relacionarse con miocarditis3. La mortalidad de este proceso es inversa a la edad del niño. En los recién nacidos y los menores de un año es cercana al 75% y en niños mayores es en torno al 25%. En estos últimos, otro 50% se recupera completamente y el 25% restante queda asintomático, pero con función cardíaca alterada permanentemente.
La inflamación, el daño muscular o ambos reducen la contractilidad miocárdica. La fibra se elonga y aumenta el volumen telediastólico. En un corazón normal un incremento del volumen de llenado origina un aumento de la contractilidad, de la fracción de eyección y del volumen minuto (ley de Frank-Starling). Sin embargo, el corazón de los pacientes con miocarditis no se adapta de este modo y el volumen minuto disminuye. El aumento de la presión de llenado se transmite retrógradamente y puede generar fallo cardíaco congestivo.
La presentación clínica es muy variada: desde formas leves subclínicas hasta formas graves que derivan en la muerte4. Estas últimas pueden iniciarse simulando enfermedad banal de la consulta pediátrica.
Caso clínicoPresentamos el caso de un niño de 18 meses que acudió a la urgencia por cuadro de astenia y anorexia de 24h de evolución. Refería cuadro respiratorio de vías altas la semana anterior y estaba afebril desde hacía 48h. Antecedentes personales y familiares sin interés.
Al inicio, el niño presentaba buen estado general, con resistencia activa a la exploración. Estaba normohidratado, bien nutrido y perfundido, rítmico sin soplos y con frecuencia cardíaca normal. El resto de la exploración no mostró hallazgos significativos.
Durante la exploración realizó un vómito, por lo que pasó a observación para valorar tolerancia, y realizó 2 vómitos más, motivo por el que se inició fluidoterapia intravenosa y se extrajo analítica. El hemograma inicial mostraba una leucocitosis de 24.000células/mm3 (el 50% linfocitos y el 8% monocitos) con serie roja y plaquetaria normal y proteína C reactiva de 32mg/l.
La gasometría mostraba una acidosis metabólica con pH 7,16, bicarbonato: 16,7mmol/l y exceso de bases: −12. En la determinación bioquímica los iones fueron normales, la glucemia se elevó hasta 224mg/dl y la creatinina hasta 1,1mg/dl.
Con la sospecha inicial de inicio diabético y a la espera de confirmar la presencia de cuerpos cetónicos en orina, se decidió ingreso y tratamiento.
A su ingreso en la planta se volvió a revaluar. Presentaba aceptable estado general, con discreta palidez de la piel, pero no de mucosas, auscultación cardiopulmonar normal sin soplos y buen relleno venocapilar. El niño respondía con normalidad a estímulos sin irritabilidad ni meningismo.
Minutos más tarde presentó taquipnea, cianosis perioral, hipertonía generalizada y revulsión ocular. En ese momento la frecuencia respiratoria era de 46rpm, la presión arterial de 52/34 (media de 40mmHg), la frecuencia cardíaca de 147lpm y la saturación de O2 del 97% (O2 ambiental). De forma brusca, realizó parada respiratoria primero, y cardíaca después por lo que se iniciaron las maniobras de reanimación cardiopulmonar avanzada con bolsa autoinflable y masaje cardíaco e intubación más administración de inotrópicos por bradicardia grave y asistolia. No respondió a ninguna de las maniobras terapéuticas efectuadas, sin recuperar latido cardíaco en ningún momento.
Tras la muerte se recibieron los resultados del examen de orina, en los que no se observó presencia de cuerpos cetónicos ni tóxicos. Otras determinaciones bioquímicas mostraron lactato elevado (11,4mmol/l), aminotransferasa glutámica oxalacética (GOT) (339U/l), con amonio y transaminasa glutámico-pirúvica (GPT) normales.
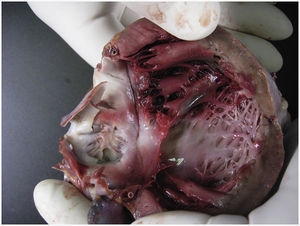
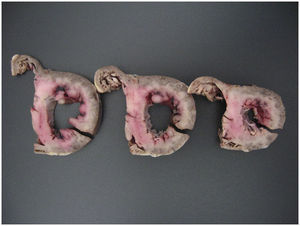
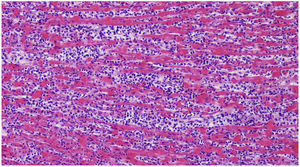
Ante estos nuevos hallazgos se descartó la enfermedad sospechada al ingreso y se solicitó necropsia. Macroscópicamente el ventrículo izquierdo aparecía discretamente dilatado, con intensa retracción y engrosamiento de la valva mitral posterior, que mostraba una superficie rojiza. En la superficie endocárdica, se observaba discoloración de los músculos papilares correspondientes a esta valva (fig. 1). En cortes seriados de ambos ventrículos el miocardio mostraba una coloración blanquecina, que afectaba a todo el espesor del septo interventricular (fig. 2). Histológicamente en todos los bloques de tejido obtenidos de la pared ventricular y auricular existía un denso infiltrado inflamatorio intersticial de predominio mononuclear con focos de necrosis de miocitos que incluían agrupaciones de polimorfonucleares (fig. 3). Los infiltrados, más densos en el septo y los músculos papilares afectaban a todo el espesor de la pared. Se observaron frecuentes células de Anitschkow (histiocitos con la cromatina dispuesta de tal manera que al corte longitudinal el núcleo parece una oruga y al corte transversal, un ojo de búho). No se observaron inclusiones virales ni granulomas. El estudio anatomopatológico demostró además hepatitis reactiva inespecífica, linfoadenopatía generalizada, congestión visceral y signos de isquemia-anoxia del SNC con edema cerebral.
Mediante reacción en cadena de la polimerasa (PCR), tanto en el tejido cerebral como en el ganglio linfático, se observó la presencia de un echovirus 18 y no se evidenciaron cuerpos de inclusión ni partículas virales en el tejido miocárdico.
DiscusiónEn la miocarditis los hallazgos macroscópicos revelan un músculo pálido y flácido con petequias. El músculo ventricular generalmente está adelgazado aunque en ocasiones aparece hipertrofiado. Las válvulas y el endocardio no suelen afectarse, pero en casos crónicos puede aparecer una fibroelastosis endocárdica. A nivel microscópico existe un infiltrado intersticial más o menos difuso de células mononucleares, linfocitos, células plasmáticas y eosinófilos. La necrosis y la desestructuración de los miocitos son típicas de infecciones por coxsackie. En los casos virales pueden verse partículas virales y cuerpos de inclusión. Se puede presentar a cualquier edad, incluso en el feto, y afecta con más gravedad a los recién nacidos y a los lactantes. La incidencia real en niños no está establecida, ya que muchos casos no se diagnostican al ser una de las causas de muerte inesperada en la infancia. Los agentes infecciosos producen la mayoría de las miocarditis, principalmente los virus (coxsackievirus B, echovirus, adenovirus, etc.). Entre las causas no infecciosas destacan múltiples agentes químicos (antraciclinas, ciclofosfamida, antidepresivos tricíclicos, etc.), agentes físicos (hipotermia, golpe de calor, radiación, etc.) y procesos autoinmunes (vasculitis y enfermedades del tejido conectivo).
La presentación clínica es amplia, desde anormalidades leves en el electrocardiograma (ECG) de niños asintomáticos hasta casos de fracaso cardíaco congestivo fulminante. En niños mayores el curso suele ser más insidioso y se inicia típicamente 7–10 días después de una infección viral inespecífica (digestiva o respiratoria). Los signos y los síntomas pueden incluir fiebre, disnea, dolor torácico, palidez, síncopes, mala perfusión distal, arritmias graves, insuficiencia cardíaca, shock cardiogénico y muerte súbita5. Los síntomas son más graves cuanto menor es el niño (menores de un año).
En el examen físico es frecuente la existencia de taquicardia sinusal desproporcionada al grado de fiebre. En otras ocasiones el único hallazgo es la debilidad y los dolores musculares en el curso de un proceso viral. En casos más graves aparece un pulso débil, frialdad de las extremidades, enlentecimiento del relleno capilar, palidez y cutis reticular.
En las pruebas complementarias6 pueden aparecer signos inespecíficos de inflamación, como leucocitosis, elevación de la velocidad de sedimentación globular y de la proteína C reactiva. Se produce también una elevación de la enzima cardíaca CPK-MB, de la GOT7 y de la láctico deshidrogenasa. Las cifras de troponina T y de la interleucina 8 se elevan tempranamente y son indicativas de la evolución del daño.
El ECG es de ayuda diagnóstica. Aunque en ocasiones es normal, es frecuente la aparición de alteraciones de éste (bajo voltaje del complejo QRS, alteraciones difusas del segmento ST y de la onda T, arritmias y trastornos de la conducción). La anormalidad más frecuente es la taquicardia sinusal. La radiografía de tórax es normal en muchos casos, y aparece cardiomegalia con diversos grados de congestión pulmonar en los pacientes con insuficiencia cardíaca.
La ecocardiografía es inespecífica. Puede ser normal o confirmar el fracaso ventricular izquierdo en los pacientes con insuficiencia cardíaca. En los niños es de gran utilidad el estudio con radioisótopos (galio 67, pirofosfato de tecnecio 99 o anticuerpos antimiosina marcados con indio 111), ya que permite identificar el proceso inflamatorio y los cambios necróticos de la miocarditis. La resonancia magnética, sobre todo si se realiza con contraste de gadolinio, es una gran herramienta diagnóstica no invasiva que permite identificar la lesión inflamatoria y precisar tanto su grado como su extensión.
La biopsia endomiocárdica se puede utilizar para establecer el diagnóstico y la clasificación8, si bien su realización es muy debatida por su riesgo de perforación, sobre todo en niños pequeños o enfermos. Para la identificación del agente causal contamos con la posibilidad de realizar cultivo del miocardio en diversos medios para diferentes gérmenes, técnicas de inmunofluorescencia con microscopia electrónica y técnicas de biología molecular (PCR).
La evolución en la mayor parte de los casos (50–90%) es benigna, con curación total. Otros pacientes quedan con secuelas secundarias a la disfunción ventricular (miocarditis crónica o miocardiopatía dilatada)9 y en otros casos cursa de forma fulminante con muerte en pocas horas.
El tratamiento de las miocarditis debe comenzar por la etiología. En los casos asociados a enfermedades autoinmunitarias se comenzará por el tratamiento efectivo de la causa primaria, en los casos relacionados con tóxicos se debe proceder a la suspensión de éste, así como en los casos que se deben a la administración de radioterapia, aunque el riesgo-beneficio debe tenerse en cuenta. En los secundarios a infecciones virales no está clara la utilidad de los antivirales, y las medidas de sostén, incluida la ECMO (oxigenación por membrana extracorpórea), son la única medida en pacientes con afectación masiva y disfunción cardíaca grave, y es necesario el trasplante cardíaco en algunos casos.
Para el control de la insuficiencia cardíaca, hay que mantener al paciente en reposo, con aporte de O2 y restricción hidrosalina. Entre las medidas farmacológicas son útiles los vasodilatadores y los diuréticos para disminuir la precarga. En pacientes con fallo cardíaco y deterioro hemodinámico deben utilizarse inotrópicos (dopamina, dobutamina, etc.). En caso de aparición de arritmias han de utilizarse antiarrítmicos que no disminuyan la contractilidad miocárdica (adenosina, lidocaína, amiodarona y procainamida). En pacientes con bradicardia grave es necesaria la implantación de un marcapasos temporal.
Los inmunosupresores (prednisona, azatioprina y ciclosporina), cuya utilización es controvertida, sólo pueden utilizarse en casos de miocarditis de más de 2 semanas de evolución, confirmados mediante biopsia endomiocárdica y afectación ventricular importante. Actualmente se están utilizando con éxito agentes inmunomoduladores (gammaglobulina intravenosa) que mejoran la función ventricular y la supervivencia10.
En resumen, el brusco deterioro hemodinámico de un paciente en el curso de un cuadro infeccioso que impresiona de banal, con elevación de GOT, nos debe hacer pensar en una miocarditis y en la puesta en marcha de medidas de mantenimiento.