La incidencia de infecciones por Staphylococcus aureus (SA) está aumentando1,2. Describimos un caso de neumonía adquirida en la comunidad (NAC) y derrame pleural tras infección por SA sensible a meticilina (SAMS) productor de leucocidina de Panton-Valentine (LPV).
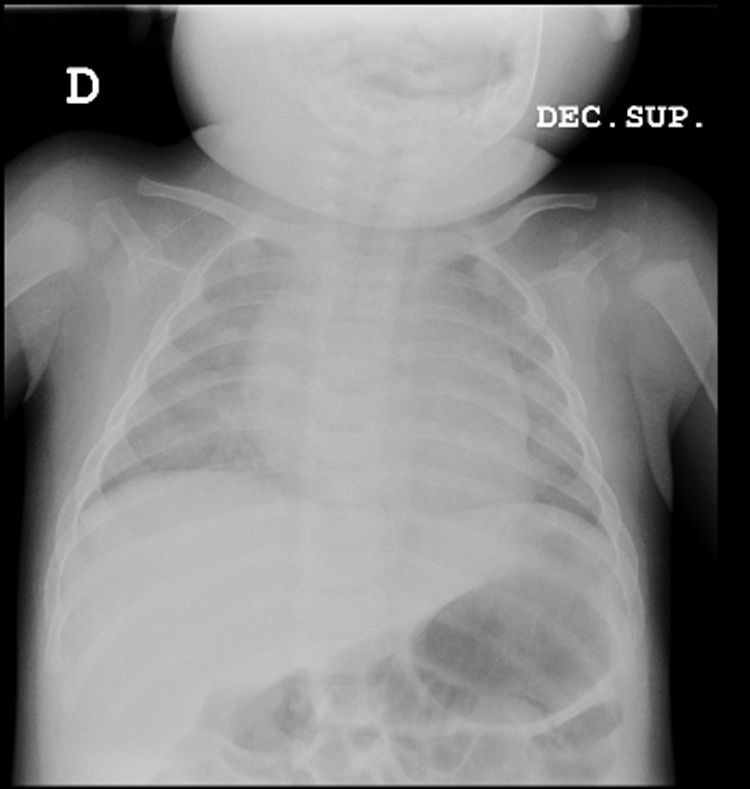
Se trata de un varón de 2 años valorado en urgencias por rinorrea, tos y fiebre (39°C). Español, correctamente vacunado y sin antecedentes de interés. Presentaba regular estado general, taquipnea (45 respiraciones por minuto [rpm]), tiraje intercostal, hipoventilación en el hemitórax derecho, frecuencia cardiaca elevada (FC 170 latidos por minuto [lpm]), presión arterial (PA) normal (96/60) y saturación de oxígeno (SatO2) del 95%. Se administró oxigenoterapia, expansión de volemia y ampicilina (200mg/kg/día). Se solicitaron hemograma (18.140 leucocitos/μl, 10.850 neutrófilos/μl, 8% cayados, 3% metamielocitos), bioquímica (proteína C reactiva [PCR] 25,8mg/dl) y radiografía de tórax (fig. 1). El paciente tras estabilizarse (FC 115 lpm; PA sin cambios, 25rpm, leve tiraje) ingresó con ampicilina intravenosa y diagnóstico presuntivo de NAC.
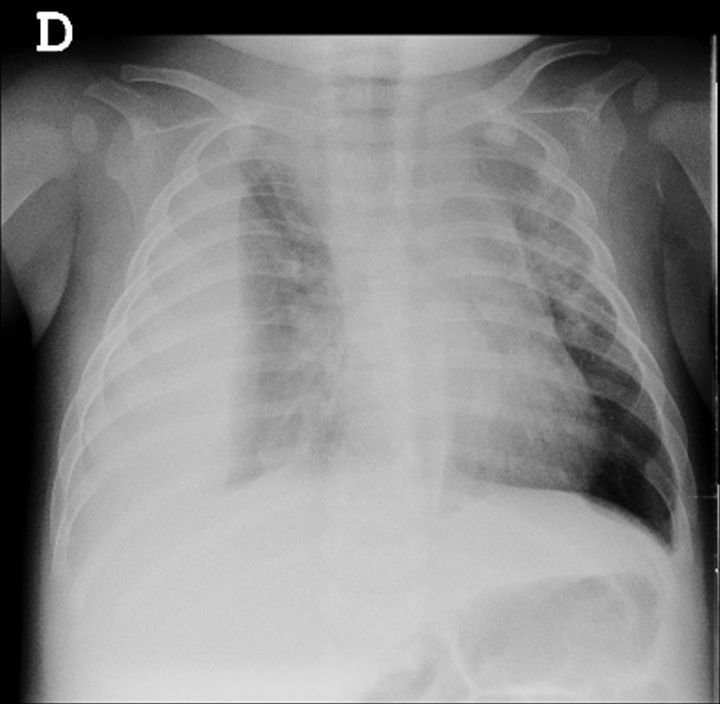
Manteniendo fiebre, dificultad respiratoria e hipoventilación en el hemitórax derecho se objetivó derrame paraneumónico en la radiografía de tórax del tercer día de ingreso (fig. 2). Ingresó en la unidad de cuidados intensivos pediátricos (UCIP) para drenaje pleural, soporte respiratorio y control clínico. A su llegada impresionaba de regular estado general con taquicardia (FC 175 lpm), PA elevada (115/65), taquipnea (90rpm), quejido espiratorio y tiraje subcostal (SatO2 del 100% con gafas nasales). Se realizó drenaje de líquido purulento compatible con empiema (pH 6,97, 318.960 leucocitos/μl, 90% de polimorfonucleares, proteínas 3,3g/dl y glucosa 14mg/dl) objetivándose cocos grampositivos y reacción negativa para antígeno de neumococo. Se sustituyó ampicilina por cefotaxima y se inició vancomicina por probable infección por grampositivo. En el cultivo de líquido pleural se aisló SAMS productor de LPV.
Se descartó evolutivamente alteración inmunológica u otros posibles focos de infección. Recibió el alta de UCIP tras 15 días de ingreso sin complicaciones.
La infección por SA está viendo incrementada su incidencia, alcanzando hasta un 13% en la comunidad de Madrid en base a un reciente estudio prospectivo1. Esto ocurre tanto en niños sanos como en aquellos con factores de riesgo (ingresos hospitalarios, vías centrales e inmunodeficiencia)1,2, lo cual podría influir en la elección de la antibioterapia empírica ante probable infección bacteriana.
SA es una bacteria grampositiva anaerobia facultativa. Afecta típicamente piel y partes blandas1,3,4 siendo posible patógeno en otras afecciones o cuadros nosocomiales (neumonía, endocarditis, infección de material protésico o catéteres…)2,5. Puede desencadenar también enfermedad mediante la producción de toxinas: a) exfoliativas; b) productoras de shock tóxico; c) enterotoxinas; d) LPV (furunculosis recurrente y neumonía hemorrágica grave)6–8.
La infección por SA suele provocar regular o mal estado general sin gran leucocitosis o elevación de reactantes de fase aguda (PCR o procalcitonina). Su prevalencia es mayor en caso de focos previos de infección por SA o factores de riesgo (especialmente portadores de accesos venosos centrales)2,8. Además de aquellas pruebas complementarias indicadas ante toda posible infección bacteriana es básica la realización de una tinción de Gram para el diagnóstico de sospecha2,8 (determinando actividad coagulasa y resistencia a meticilina en caso de cultivo positivo).
Ante posible infección por cepa sensible a meticilina (paciente sano sin antecedentes) el tratamiento de elección es la cloxacilina intravenosa. La epidemiología local tiene que ser siempre considerada puesto que en el contexto de una alta prevalencia de infección por SA meticilina resistente, aún en ausencia de factores de riesgo, se debe tratar de inicio a todos los pacientes del mismo modo que ante probable resistencia o resistencia ya demostrada (glucopéptido con o sin cloxacilina o bien exclusivamente linezolid2,5,9). Por otro lado, la elección de la terapia antimicrobiana será dependiente tanto de la severidad (se puede asociar un aminoglucósido durante los primeros 3-5 días5, lo cual está claramente recomendado si existe endocarditis concomitante) como de la localización de la infección (linezolid para neumonía, meningitis y endoftalmitis5 sin ser de primera elección en bacteriemias).
La producción de LPV otorga mayor virulencia a SA. Aproximadamente un 2% de las cepas generan esta toxina con predominio en las formas resistentes a meticilina2. Está codificada en un profago que, integrándose en el genoma bacteriano, permite su síntesis. Produce un poro en la membrana celular y actúa como superantígeno facilitando la destrucción de leucocitos (monocitos y macrófagos) y el desarrollo de infecciones graves1,2,5,7. Los pacientes afectados suelen mostrar sintomatología gripal previa, fiebre alta y regular estado general, con un rápido empeoramiento clínico y radiológico en 12-36h2. En niños es común el desarrollo de distrés respiratorio requiriendo frecuentemente ventilación mecánica7. La mortalidad es elevada (37-75%) y aumenta en caso de tratamiento empírico inicial inadecuado2 (en nuestro paciente la infección por SA sensible a ampicilina probablemente evitó una peor evolución).
El tratamiento se modificará en función del antibiograma manteniéndose de 14 a 21 días5. En caso de demostrarse síntesis de LPV, se recomienda linezolid como primera opción terapéutica5, siendo la inmunoglobulina un fármaco de rescate ante mala evolución10.
En resumen, presentamos un caso de NAC con derrame pleural por SAMS productor de LPV para destacar dos hechos: a) el incremento de incidencia de infecciones por SA, y b) tanto la resistencia antibiótica como la producción de toxinas por parte de SA son posibles causas de una mala evolución o inesperada respuesta al tratamiento.