Estudiar los hábitos alimentarios en un grupo de pacientes con trastorno de déficit de atención e hiperactividad (TDAH) en tratamiento con metilfenidato de liberación prolongada (MTF-LP).
Material y métodosEncuesta nutricional (consumo de alimentos de 3 días consecutivos) a 150 pacientes con TDAH (100 varones y 50 mujeres) en tratamiento con MTF-LP, y a 150 sujetos sanos de la misma edad (grupo control). Se han comparado la ingesta de alimentos y nutrientes y el estado nutricional entre ambos grupos.
ResultadosLa dosis media de MTF-LP era de 1,02mg/kg/día. En el grupo con TDAH el estado nutricional era significativamente inferior (p<0,05). La ingesta de cereales, carnes, legumbres y frutas era significativamente inferior (p<0,05) en el grupo con TDAH. El aporte calórico del almuerzo, comida del mediodía y merienda era significativamente superior (p<0,05) en el grupo control; mientras que el aporte calórico de la cena era significativamente superior (p<0,05) en el grupo con TDAH. En el grupo control el aporte calórico y de proteínas, hidratos de carbono, grasas y fibra, calcio, hierro, magnesio, cinc, selenio y fósforo, tiamina, niacina, vitamina B6 y folatos era significativamente superior (p<0,05) respecto al grupo TDAH.
ConclusionesEl tratamiento con MTF-LP modifica sustancialmente la distribución porcentual del aporte calórico de las distintas ingestas diarias. El aporte calórico y de nutrientes en los pacientes en tratamiento con MTF-LP es, en general, inferior al de la población sana de la misma edad. Habría que considerar la necesidad de impartir, simultáneamente con el tratamiento multimodal, programas de educación nutricional a estos pacientes y/o sus familias.
To evaluate the dietary patterns in a group of patients diagnosed with attention deficit hyperactivity disorder (ADHD) and under treatment with extended-release methylphenidate (MPH-ER).
Material and methodsA nutrition survey (food intake recall for three consecutive days) was carried out on 100 patients diagnosed with ADHD and under treatment with MPH-ER, and in 150 healthy children (control group). Calorie and nutrient intake, as well as nutrition status, were evaluated and compared in both groups.
ResultsThe mean MPH-ER dose was 1.02mg/kg/day. Nutritional status in the ADHD group was significantly lower (P < .05) than in control group. The consumption of cereals, meat, pulses and fruits in the control group was significantly higher (P < .05) than in ADHD group. Calorie intake in the mid-morning snack, lunch and afternoon snack was significantly higher (P < .05) in the control group. Calorie intake at supper was significantly higher (P < .05) in the ADHD group. Total calorie intake, as well as protein, carbohydrates, fat, fibre, calcium, iron, magnesium, zinc, selenium and phosphorous, thiamine, niacin, vitamin B6 and folate intake in the control group was significantly higher than in ADHD group.
ConclusionsTreatment with MPH-ER substantially modifies the percentage distribution of calorie intake of the different meals. The daily calorie and nutrients intake in patients under treatment with MPH-ER is, generally, lower than in the healthy population of a similar age. Nutrition education should be provided, along with multimodal treatment, to the patients and/or their families.
El tratamiento multimodal del trastorno de déficit de atención e hiperactividad (TDAH) combina la intervención psicosocial con la farmacoterapia que, generalmente, supone la administración a largo plazo de medicación psicoestimulante, siendo el metilfenidato (MTF) el fármaco de elección por su contrastada eficacia frente a los síntomas nucleares del TDAH1–8.
En nuestro país existen 2 formas galénicas comercializadas de metilfenidato de liberación prolongada (MTF-LP): una formulación de liberación controlada mediante tecnología osmótica o Concerta®, y otra compuesta de microesferas de doble acción o Medikinet®9. Las propiedades farmacocinéticas de estos preparados de liberación prolongada garantizan unos niveles plasmáticos relativamente constantes a lo largo del día en contraste con los preparados de liberación inmediata10; sin embargo, dado el efecto hiporexizante del MTF, esta eventualidad hipotéticamente podría interferir en el apetito de distintas ingestas a lo largo del día.
Aunque los conocimientos y evidencias en relación con la «hipótesis nutricional» como factor etiológico y/o tratamiento del TDAH son poco concluyentes11–16, una situación de malnutrición calórico-proteica mantenida podría afectar a la capacidad cognitiva y, más concretamente, a las funciones ejecutivas, como consecuencia de alteraciones estructurales y/o funcionales en la maduración cerebral17,18. En este sentido, cabe considerar que en el momento del diagnóstico la situación nutricional de los pacientes con TDAH suele ser relativamente deficiente19 y que, además, tiende a agravarse con la terapia prolongada con MTF20, lo que justificaría el interés por conocer el patrón alimentario de estos pacientes a lo largo del tratamiento.
El objetivo del presente trabajo consiste en estudiar los hábitos alimentarios en un grupo de pacientes con TDAH en tratamiento con MTF, y analizar la necesidad de diseñar estrategias de intervención nutricional en estos pacientes.
Material y métodosPacientesSe ha realizado una encuesta nutricional a los primeros 150 pacientes diagnosticados de TDAH en una consulta de neuropediatría del Complejo Hospitalario de Navarra que acudieron a su control evolutivo ambulatorio en el año 2012 (las encuestas fueron realizadas entre los meses de enero y junio). Todos los pacientes debían estar en tratamiento continuado y exclusivo con MTF-LP: Concerta® o Medikinet®, al menos durante 12 meses. Para el diagnóstico y clasificación se han aplicado los criterios de la última edición del Manual diagnóstico y estadístico de los trastornos mentales21. Los pacientes fueron agrupados en 2 subtipos clínicos: aquellos con predominio de déficit de atención o subtipo inatento, y aquellos con déficit de atención, hiperactividad e impulsividad o subtipo combinado. Simultáneamente se fue realizando una encuesta nutricional de similares características a un grupo de 150 sujetos sanos (75 varones y 75 mujeres) de las mismas edades que los pacientes encuestados, o grupo control.
Se excluyeron todos aquellos pacientes y/o controles que presentaban alguna enfermedad crónica conocida que pudiera condicionar su estado nutricional, así como aquellos que tomaban complementos energéticos y/o suplementos de minerales y vitaminas. También fueron excluidos todos aquellos pacientes que dejaban de tomar medicación durante las vacaciones escolares o meses de verano.
Encuesta nutricionalLas encuestas se llevaron a cabo mediante una entrevista personal en el momento de la consulta. El método utilizado fue el registro de consumo de alimentos de 3 días lectivos consecutivos. A cada paciente se le preguntaba detalladamente sobre los alimentos que habían consumido durante 3 días consecutivos en cada una de las diferentes ingestas (desayuno, almuerzo, comida del mediodía, merienda y cena). Para el cálculo del tamaño de las raciones correspondientes a las distintas variedades de alimentos que los encuestados referían haber consumido se recurrió a un cuaderno fotográfico de raciones y medidas del Institut Scientifique et Technique de la Nutrition et de l’Alimentation (París, 2002)22.
Los alimentos fueron divididos en los siguientes grupos:
- 1)
Lácteos y derivados (leche, yogures, quesos, etc.).
- 2)
Cereales y derivados (pan, cereales-desayuno, pastas, arroz, etc.).
- 3)
Dulces, bollería y repostería (azúcar, mermeladas, galletas, croissant, magdalenas, bizcochos, etc.).
- 4)
Frutas y zumos.
- 5)
Grasas y aceites.
- 6)
Carnes y derivados.
- 7)
Huevos y derivados.
- 8)
Vegetales (verduras y hortalizas, tubérculos y legumbres).
- 9)
Pescados.
El consumo energético y de macronutrientes (proteínas, hidratos de carbono, grasa total, ácidos grasos saturados [AGS], ácidos grasos monoinsaturados [AGMI] y ácidos grasos poliinsaturados [AGPI], fibra total y colesterol), minerales (calcio, hierro, yodo, magnesio, cinc, selenio y fósforo) y vitaminas (tiamina, riboflavina, niacina, vitamina B6, folatos, vitamina B12, vitamina C, vitamina A, vitamina D y vitamina E) se calculó individualmente mediante el programa de cálculo nutricional CESNID 1.0® (Centro de Enseñanza Superior de Nutrición y Dietética, Universidad de Barcelona)23. Como valores de referencia de los aportes dietéticos recomendados de minerales y vitaminas (ingestas dietéticas de referencia) para las distintas edades se han utilizado las tablas americanas actualizadas de la National Academy of Sciences24.
Estudio nutricionalDe cada paciente y/o controles se registraron el sexo, la edad, el tipo clínico y la dosis de MTF (mg/kg/día), así como el peso, talla, pliegue tricipital y perímetro braquial. Las valoraciones del peso y la talla se realizaron en ropa interior y sin calzado. El peso se midió con básculas Año-Sayol®, con un rango de lectura de 0 a 120kg y una precisión de 100g, y la talla se midió con un tallímetro rígido inextensible de pared de 60 a 210cm, con un rango de precisión de 0,1cm. Para valorar el pliegue tricipital se ha utilizado un calibrador de presión constante tipo Holtain.
Mediante el programa SEINAPTRACKER (Medicalsoft Intercath, S.L. Universidad de Barcelona, 2007-2008) se calcularon los Z-score de los pesos, tallas y del perímetro braquial, así como el índice de masa corporal (IMC) porcentual. Las curvas y tablas de crecimiento utilizadas como referencia para estos cálculos fueron las del Centro Andrea Prader (Zaragoza, 2002).
Los resultados se expresan como medias y porcentajes con sus desviaciones estándar (DE) o intervalos de confianza del 95% (IC 95%). El análisis estadístico fue realizado mediante el programa informático Statistical Packages for the Social Sciences (SPSS) versión 20.0 (Chicago, Illinois, Estados Unidos). La significación estadística fue asumida cuando el valor de p era inferior a 0,05.
ResultadosCaracterísticas de la muestraLa muestra de pacientes estaba compuesta por 100 varones y 50 mujeres. El subtipo combinado representaba el 60% de los casos frente al 40% del subtipo inatento. La proporción del subtipo combinado era significativamente superior (p<0,001) en los varones (68%) respecto a las mujeres (44%). La edad media de los pacientes era de 11,3 años (IC 95%: 11,03-11,57), sin que existieran diferencias estadísticamente significativas con la edad del grupo control que era de 11,12 años (IC 95%: 10,83-11,41). La totalidad de pacientes encuestados estaban en tratamiento con MTF-LP durante un tiempo medio de 28,0 meses (IC 95%: 24,9-31,1) y con una dosis media de 1,02mg/kg/día (IC 95%: 0,97-1,07). Noventa y cinco pacientes eran tratados con Concerta® a una dosis media de 1,06mg/kg/día (IC 95%: 0,98-1,14), y 55 con Medikinet® a una dosis media de 0,93mg/kg/día (IC 95%: 0,84-1,02), sin que la diferencia fuera estadísticamente significativa.
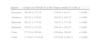
Estudio nutricionalEn la tabla 1 se muestran y comparan los resultados del estudio nutricional en ambos grupos. En el grupo TDAH el valor medio del peso (Z-score), talla (Z-score), IMC (Z-score), perímetro braquial (Z-score) y pliegue tricipital (cm) eran significativamente inferiores a los del grupo control. No existía correlación significativa entre las dosis de MTF-LP y los parámetros antropométricos registrados.
Resultados del estudio nutricional en ambos grupos
| Ítem | Grupo con TDAH, X (DE) | Grupo control, X (DE) | p |
| Peso (Z-score) | −0,755 (0,86) | −0,202 (1,10) | < 0,000 |
| Talla (Z-score) | −0,251 (1,00) | +0,072 (1,11) | < 0,010 |
| IMC (Z-score) | −0,814 (0,76) | −0,369 (0,99) | < 0,000 |
| PB (Z-score) | −0,546 (0,95) | −0,094 (1,07) | < 0,000 |
| PT (cm) | 12,6 (5,3) | 16,4 (6,9) | < 0,000 |
IMC: índice de masa corporal; PB: perímetro braquial; PT: pliegue tricipital.
En la tabla 2 se exponen y comparan los valores medios de la ingesta diaria de los distintos alimentos y grupos de alimentos en ambos grupos. En el grupo control, la ingesta de cereales y derivados, a expensas de pan blanco; de carne y derivados, a expensas de aves; de vegetales, a expensas de legumbres; y de frutas y zumos, a expensas de frutas, era significativamente superior (p<0,05) respecto al grupo con TDAH. Sin embargo, no existían diferencias significativas entre los consumos de lácteos y derivados, huevos, pescados, grasas y aceites y dulces, bollería y repostería, entre ambos grupos.
Consumo medio diario de alimentos en ambos grupos
| Grupos de alimentos | Grupo con TDAH | Grupo Control |
| (g/d) | (g/d) | |
| Lácteos y derivados | 414,9 | 431,7 |
| Leche | 254,5 | 264,7 |
| Yogur | 114,7 | 128,9 |
| Quesos | 22,4 | 22,5 |
| Postres lácteos | 23,3 | 15,6 |
| Cereales y derivados* | 201,4 | 255,4 |
| Pastas/arroz | 49,1 | 56,6 |
| Cereales-desayuno | 16,7 | 9,4 |
| Pan* | 120,0 | 170,1 |
| Carnes y derivados* | 186,8 | 221,1 |
| Carnes rojas | 97,9 | 103,9 |
| Aves* | 27,2 | 58,4 |
| Embutidos | 61,7 | 58,8 |
| Huevos y derivados | 27,1 | 20,1 |
| Vegetales* | 75,5 | 103.3 |
| Hortalizas y verduras | 30,7 | 37,7 |
| Tubérculos | 24,3 | 10,5 |
| Legumbres* | 20,5 | 55,1 |
| Frutas y zumos* | 140,2 | 255,3 |
| Frutas* | 106,9 | 226,3 |
| Zumos | 33,3 | 29,0 |
| Pescados | 41,1 | 31,9 |
| Dulces y otros | 56,3 | 58,1 |
| Galletas | 15,6 | 19,3 |
| Dulces | 20,8 | 21,3 |
| Bollería | 19,9 | 17,5 |
| Grasas y aceites | 2,5 | 4,5 |
En la tabla 3 se muestran y comparan el aporte calórico diario total y el de cada una de las ingestas diarias (desayuno, almuerzo, comida del mediodía, merienda y cena) en ambos grupos. En el grupo control, el aporte calórico diario total, así como el aporte calórico del almuerzo, de la comida del mediodía y de la merienda era significativamente superior (p<0,05) respecto al grupo con TDAH, mientras que en el grupo con TDAH el aporte calórico de la cena era significativamente superior (p<0,05) respecto al grupo control. En el desayuno no existían diferencias estadísticamente significativas en el aporte calórico entre ambos grupos. No existían diferencias estadísticamente significativas entre el aporte calórico diario total y de cada una de las ingestas diarias (desayuno, almuerzo, comida del mediodía, merienda y cena) entre los pacientes tratados con Concerta® y con Medikinet®. Tampoco existía correlación significativa entre las dosis de MTF-LP y la ingesta calórica diaria total.
Aporte calórico total diario (kcal) y de cada una de las ingestas diarias en ambos grupos
| Ingesta | Grupo con TDAH, X±DE | Grupo control, X±DE | p |
| Desayuno | 305,58±127,18 | 314,63±91,87 | < 0,489 |
| Almuerzo | 162,83±130,40 | 262,04±105,27 | < 0,000 |
| Mediodía | 402,11±173,36 | 742,57±177,56 | < 0,000 |
| Merienda | 270,22±127,04 | 309,44±104,25 | < 0,005 |
| Cena | 577,24±205,89 | 476,46±169,62 | < 0,000 |
| Total | 1.778,07±315,98 | 2.072,45±248,11 | < 0,0001 |
En la tabla 4 se muestran y comparan la ingesta diaria de macronutrientes, minerales y vitaminas en ambos grupos. En el grupo control el aporte diario de algunos macronutrientes, como proteínas, glúcidos, grasa total, AGS, AGMI, AGPI y fibra total; minerales, como calcio, hierro, magnesio, cinc, selenio y fósforo; y vitaminas, como tiamina, niacina, vitamina B6, folatos y vitamina A, era significativamente superior (p<0,05) respecto al grupo con TDAH. En el grupo control, salvo en el caso del calcio, yodo, vitamina A, vitamina D y vitamina E se cubrían suficientemente los aportes dietéticos recomendados de minerales y vitaminas, mientras que en el grupo con TDAH no se llegaban a cubrir los aportes dietéticos recomendados correspondientes al calcio, yodo, magnesio, folatos, vitamina A, vitamina D y vitamina E. No obstante, en el grupo control, los porcentajes de individuos que superaban las ingestas recomendadas de algunos minerales como hierro, cinc y fósforo, y algunas vitaminas, como tiamina y vitamina B6, eran significativamente superiores (p<0,05) respecto a los del grupo con TDAH.
Ingesta diaria de macronutrientes, minerales y vitaminas en ambos grupos
| Nutrientes | Grupo con TDAH, X±DE | Grupo control, X±DE | p |
| Proteínas (g) | 81,9±19,1 | 98,5±20,5 | < 0,000 |
| Glúcidos (g) | 210,9±53,7 | 252,7±46,0 | < 0,000 |
| Grasa total (g) | 62,3±18,9 | 69,3±19,1 | < 0,002 |
| AGS (g) | 26,3±8,5 | 28,4±8,3 | < 0,033 |
| AGMI (g) | 22,0±7,6 | 24,8±8,1 | < 0,004 |
| AGPI (g) | 7,1±2,3 | 8,7±2,6 | < 0,000 |
| Fibra total (g) | 15,3±6,3 | 23,3±11,7 | < 0,000 |
| Colesterol (mg) | 310,8±128,5 | 309,5±105,6 | < 0,923 |
| Calcio (mg) | 774,3±206,8 | 859,8±202,3 | < 0,000 |
| Hierro (mg) | 13,2±4,8 | 17,0±5,8 | < 0,000 |
| Yodo (μg) | 75,8±22,3 | 79,8±20,7 | < 0,116 |
| Magnesio (mg) | 222,9±49,8 | 291,2±86,3 | < 0,000 |
| Cinc (mg) | 8,6±2,6 | 10,2±2,7 | < 0,000 |
| Selenio (μg) | 110,0±48,6 | 135,3±43,5 | < 0,000 |
| Fósforo (mg) | 1320,1±294,1 | 1534,8±303,3 | < 0,000 |
| Tiamina (mg) | 1,4±0,5 | 1,6±0,5 | < 0,001 |
| Riboflavina (mg) | 1,8±0,5 | 1,9±0,5 | < 0,694 |
| Niacina (mg) | 34,0±9,0 | 38,4±8,9 | < 0,000 |
| Vitamina B6(mg) | 1,6±0,6 | 2,0±0,7 | < 0,000 |
| Folatos (μg) | 214,5±105,0 | 307,5±163,7 | < 0,000 |
| Vitamina B12(mg) | 6,1±4,2 | 5,4±3,1 | < 0,116 |
| Vitamina C (mg) | 59,2±35,2 | 58,4±35,9 | < 0,330 |
| Vitamina A (μg) | 491,5±210,4 | 431,0±202,6 | < 0,040 |
| Vitamina D (μg) | 2,6±3,4 | 2,28±2,9 | < 0,227 |
| Vitamina E (mg) | 3,4±1,6 | 3,9±1,6 | < 0,160 |
AGMI: ácidos grasos monoinsaturados; AGPI: ácidos grasos poliinsaturados; AGS: ácidos grasos saturados.
En la tabla 5 se muestran y comparan las contribuciones porcentuales de los principios inmediatos y ácidos grasos a la ingesta calórica total en ambos grupos. Se observa en ambos grupos un excesivo aporte proteico preferentemente de origen animal, un aporte muy ajustado de hidratos de carbono y un consumo de grasas saturadas superior al recomendado, sin que existieran diferencias significativas en la contribución porcentual de principios inmediatos y ácidos grasos entre ambos grupos.
Contribución porcentual (%) de los principios inmediatos y ácidos grasos a la ingesta calórica total
| Nutrientes (porcentaje recomendable) | Grupo TDAH | Grupo Control |
| Proteínas (12-15%) | 18,9 | 19,4 |
| Origen animal | 67,8 | 61,7 |
| Hidratos de carbono (50-55%) | 48,7 | 49,8 |
| Lípidos totales (30-35%) | 32,4 | 30,8 |
| AGS (7-10%) | 13,7 | 12,6 |
| AGM (15-20%) | 11,4 | 11,0 |
| AGP (6-10%) | 3,7 | 3,9 |
AGMI: ácidos grasos monoinsaturados; AGPI: ácidos grasos poliinsaturados; AGS: ácidos grasos saturados.
Entre los aspectos epidemiológicos de esta serie cabe destacar que existía un predominio del sexo masculino y que el subtipo combinado era el patrón clínico más prevalente, lo que coincide con las referencias bibliográficas25–28. Estas peculiaridades permiten considerar que la muestra obtenida era representativa de una población estándar de pacientes con TDAH y que, por tanto, no cabría presentir ningún sesgo estadístico en este sentido en los resultados y/o conclusiones.
La medicación psicoestimulante, y en nuestro país concretamente el MTF, constituye el fármaco de primera línea en pacientes con TDAH, existiendo múltiples ensayos clínicos que corroboran la eficacia sostenida del MTF en la sintomatología atencional y conductual de estos pacientes, lo que permite, en gran medida, optimizar su situación académica, familiar y social1,5,6,29–35. La condición sine qua non para que los pacientes fueran incluidos en el estudio era que estuvieran con terapia prolongada y exclusiva con MTF-LP: Concerta® o Medikinet®, ya que las ventajas de sus curvas farmacocinéticas los hacen preferibles frente a la necesidad de la administración de múltiples dosis de los preparados de liberación inmediata10,30,34–37. La pauta de dosificación, dada la variabilidad interindividual en las concentraciones plasmáticas y/o duración del efecto terapéutico, debe acoplarse a las necesidades horarias, académicas y/o conductuales del paciente, lo que obliga al ajuste de las dosis en relación con la respuesta clínica. En esta serie las dosis de MTF-LP estaban dentro de unos supuestos márgenes de seguridad y tolerabilidad farmacológica y, en ningún caso se prescribieron dosis manifiestamente elevadas (la dosis máxima fue de 1,68mg/kg/día) que a priori hicieran pensar en la posibilidad de tener que suspender el tratamiento ante previsibles efectos secundarios1,4,8,32,38–40.
No obstante, al buscar y conseguir con los preparados de MTF-LP un efecto terapéutico mantenido durante gran parte del día, cabría considerar la posibilidad de que estas mismas formulaciones pudieran también incrementar y/o prolongar sus efectos secundarios como, por ejemplo, sería una perdida del apetito en aquellas ingestas cuyos horarios coincidieran con niveles plasmáticos de MTF crecientes o ascendentes. En condiciones normales, la administración del MTF-LP se hace coincidir con el desayuno −entre las 08:00 y 09:00 h− para ajustar su previsible efecto terapéutico a los horarios de la actividad académica y/o social del paciente; sin embargo, esta circunstancia conlleva inevitablemente a que sus concentraciones plasmáticas en ascenso o máximas coincidan con los horarios de la ingesta de media mañana (almuerzo) y de la del mediodía y, por tanto, que este solapamiento cronológico pudiera interferir en la optimización nutricional de estos pacientes.
Los resultados obtenidos ponen de manifiesto cómo el tratamiento con MTF-LP modifica sustancialmente la distribución porcentual del aporte calórico de las distintas ingestas diarias presumiblemente en relación con sus curvas farmacocinéticas. De hecho, en aquellos pacientes con TDAH en tratamiento continuado con Concerta® o Medikinet® se constata una reducción significativa de la ingesta calórica tanto en el almuerzo como en la comida del mediodía, que incluso se prolongaba hasta la hora de la merienda; y que se explicaría por la coincidencia temporal del horario de las comidas con los picos plasmáticos máximos de los componentes de liberación inmediata y modificada de estas formulaciones, respectivamente. Posteriormente, cuando se entiende que la acción farmacológica hubiera concluido, se constataba un «efecto rebote» manifestado por un incremento relativamente exagerado del apetito a la hora de la cena y que, en consecuencia, explicaría la mayor ingesta calórica que presentaban en relación con el grupo control. Sin embargo, este «efecto bulímico» no era lo suficientemente importante para que los aportes calóricos y de nutrientes (principios inmediatos, minerales y vitaminas) de estos pacientes fueran similares a los de la población sana de la misma edad. Es decir, los pacientes en tratamiento con Concerta® o Medikinet® desayunan como lo hacen el resto de niños sanos de su misma edad, pero paralelamente a la aparición de sus pretendidos efectos terapéuticos se produce una pérdida del apetito, que afecta especialmente al desayuno y a la comida del mediodía y, en menor medida, a la merienda, para luego tener lugar en la cena un «efecto rebote» que resulta ineficaz para compensar el menor aporte calórico y de nutrientes derivado del menor consumo de alimentos a lo largo del día. Esta eventualidad podría resultar muy contraproducente en estos pacientes ya que un menor aporte calórico y de nutrientes de forma continuada podría afectar negativamente a sus funciones cognitivas y, en consecuencia, agravar sus dificultades escolares17,18.
Las diferencias entre el modelo dietético de los pacientes con TDAH en tratamiento prolongado con MTF y los niños sanos de su misma edad eran esencialmente cuantitativos. Por una parte, la contribución porcentual de los principios inmediatos al aporte energético diario (excesivo aporte de proteínas animales y grasas saturadas junto a un aporte muy ajustado de hidratos de carbono) era similar en ambos grupos. Y, por otra parte, las diferencias en sus hábitos alimentarios se concretaban en una menor ingesta diaria de pan blanco, carne de aves, legumbres y frutas que justificarían las diferencias en el aporte diario de macronutrientes (proteínas, hidratos de carbono, grasas y fibra), minerales (calcio, hierro, magnesio, cinc, selenio y fósforo) y vitaminas (tiamina, niacina, vitamina B6 y folatos) entre ambos grupos. Salvo en el caso del calcio, yodo y vitaminas A, D y E en el grupo control, y de calcio, yodo, magnesio, folatos y vitaminas A, D y E en el grupo con TDAH, se cubrían suficientemente las ingestas recomendadas de minerales y vitaminas, lo cual explicaría que a pesar de una inferior situación nutricional estos pacientes no desarrollen deficiencias nutricionales específicas con relativa frecuencia. No obstante, los datos obtenidos permiten considerar que en el grupo con TDAH existiría además un mayor riesgo de presentar una deficiencia de hierro, cinc, fósforo, tiamina y vitamina B6 que la población sana de su misma edad, ya que el porcentaje de pacientes con TDHA que no alcanzaban las ingestas recomendadas era sensiblemente superior respecto al grupo control.
Este estudio presenta ciertas limitaciones metodológicas. No se ha incluido un grupo de pacientes con TDAH sin tratamiento con MTF como grupo control, tal y como sería deseable, por razones éticas. Es decir, los resultados obtenidos tanto sobre la ingesta calórica y de nutrientes como sobre el estado nutricional de los pacientes se han comparado con un grupo de niños sanos de su misma edad, aplicando unas curvas y tablas de crecimiento infantil que, por otra parte, son habitualmente utilizadas como patrones de referencia en la práctica clínica diaria. En realidad, se llegó a pensar en conformar un grupo control reuniendo a pacientes con TDAH sin tratamiento farmacológico, pero el número de pacientes en estas circunstancias atendidos en las consultas era más bien escaso y muchos de ellos acababan necesitando MTF, dado su progresivo deterioro psicosocial y educativo, y en los no tratados siempre cabía la duda diagnóstica. Además, tampoco se registraron variables relacionadas con los estilos de vida de los encuestados (status socioeconómico y/o nivel de estudio familiar, práctica de actividad física, hábitos televisivos, etc.) que podrían condicionar, en cierta medida, sus necesidades calóricas y de nutrientes.
En resumen, los aportes calóricos y de nutrientes diarios en los pacientes en tratamiento continuado con MTF-LP son, en general, sensiblemente inferiores a los de la población sana de la misma edad, lo cual justificaría que los parámetros nutricionales registrados en estos pacientes, incluyendo variables que determinan las reserva grasa y proteica, también fueran significativamente inferiores. Por tanto, habría que considerar formalmente la necesidad de impartir, simultáneamente con el tratamiento multimodal, programas de educación nutricional a los pacientes y/o sus familias, así como la aplicación de estrategias nutricionales, como incrementar el aporte calórico ofreciendo alimentos «preferidos» y/o adicionar suplementos energéticos, especialmente a la hora del almuerzo y comida del mediodía, para evitar las consecuencias nutricionales que pudieran derivarse del tratamiento con MTF-LP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.