Los tratamientos con moduladores de la proteína CFTR han mejorado la salud respiratoria y digestiva de los pacientes con fibrosis quística.
ObjetivoAnalizar los cambios en la inflamación intestinal mediante el estudio de la calprotectina fecal en pacientes con fibrosis quística durante el tratamiento con moduladores.
Material y métodosEstudio multicéntrico prospectivo de los cambios en la calprotectina fecal de pacientes con fibrosis quística tratados con moduladores, comparando aquellos constituidos por dos moléculas (lumacaftor/ivacaftor o tezacaftor/ivacaftor) con los de tres moléculas (elexacaftor/tezacaftor/ivacaftor). Se recogen datos antes de iniciar el tratamiento, a los 6 y a los 12meses.
ResultadosAnálisis de 117 pacientes (69% F508del/F508del). Mediana basal de calprotectina fecal 49μg/g (RIC: 23-108); 48,7% con >50μg/g; 11% con >250μg/g. Hubo disminución de calprotectina fecal en ambos grupos, siendo mayor en aquellos con elexacaftor/tezacaftor/ivacaftor. Se observó una disminución progresiva de los valores anormales (>50μg/g) a los 6meses 48,7% vs 33,1% (p=0,0067) y a los 12meses 54% vs 33,5% (p=0,0218). En el grupo elexacaftor/tezacaftor/ivacaftor, solo 2 pacientes a los 6meses y 1paciente a los 12meses tenían >250μg/g. El cambio estimado (IC95%) a 12meses en el grupo con triple terapia en comparación con el otro grupo fue de −133μg/g (−254 a −13, p=0,030), y ajustado por sexo, probióticos y Pseudomonas aeruginosa, de −130μg/g (−259 a −1, p=0,049).
ConclusionesEl tratamiento con moduladores CFTR reduce la inflamación intestinal en pacientes con fibrosis quística, siendo la mejoría más destacada en pacientes tratados con la triple terapia.
Treatments with CFTR protein modulators have improved respiratory and digestive health in patients with cystic fibrosis.
ObjectiveTo assess changes in intestinal inflammation through the analysis of fecal calprotectin in patients with cystic fibrosis during treatment with CFTR modulators.
Material and methodsProspective multicenter study of changes in fecal calprotectin in patients with cystic fibrosis treated with CFTR modulators, comparing double combinations (lumacaftor/ivacaftor or tezacaftor/ivacaftor) and triple combinations (elexacaftor/tezacaftor/ivacaftor). We collected data before treatment initiation and at 6and 12months.
ResultsAnalysis of 117 patients (69% with F508del/F508del). The median baseline fecal calprotectin level was 49μg/g (IQR: 23-108); 48.7% had median levels greater than 50μg/g and 11% levels greater than 250μg/g. Fecal calprotectin decreased in both groups, with a greater decrease in patients treated with elexacaftor/tezacaftor/ivacaftor. We found a progressive decrease in abnormal values (>50μg/g) at 6months (48.7% vs 33.1%; P=.0067) and at 12months (54% vs 33.5%; P=.0218). In the elexacaftor/tezacaftor/ivacaftor group, only two patients at 6months and one patient at 12months had levels greater than 250μg/g. The estimated change at 12months in the triple therapy group compared to the other group was −133μg/g (95%CI: −254 to −13; P=.030); and, adjusting for sex, probiotics and Pseudomonas aeruginosa, −130μg/g (−259 to −1; P=.049).
ConclusionsTreatment with CFTR modulators reduces intestinal inflammation in patients with cystic fibrosis, with a greater decrease in patients treated with triple therapy.
La fibrosis quística (FQ) es una enfermedad causada por mutaciones en el gen que codifica la proteína reguladora de la conductancia transmembrana (CFTR)1, presente en la membrana de las glándulas exocrinas. De las más de 2.000 mutaciones conocidas, la más frecuente es la F508del, en la que hay una pérdida del aminoácido fenilalanina en la posición 508. La proteína CFTR se encarga del transporte del cloro en la membrana celular, y su alteración provocará cambios iónicos que conducirán a la deshidratación de las secreciones en los órganos afectos. La mayor morbimortalidad está relacionada con la enfermedad pulmonar obstructiva crónica, y es lo que va a condicionar el pronóstico y la supervivencia de estos enfermos2.
La reciente introducción de los fármacos moduladores de la proteína CFTR (CFTRm) ha supuesto un gran avance en el tratamiento de la FQ, consiguiendo mejorar notablemente la función de la proteína alterada3-5. Ivacaftor (IVA), lumacaftor (LUM), tezacaftor (TEZ) y elexacafor (ELE) son las moléculas responsables de estos sorprendentes cambios6. Estas se combinan en un mismo comprimido, como LUM/IVA, TEZ/IVA (2 moléculas) o como ELE/TEZ/IVA (ETI) (3 moléculas)6. La eficacia de las primeras combinaciones que salieron a la luz (LUM/IVA o TEZ/IVA) para homocigotos a F508del fue prometedora, pero con resultados modestos en los ensayos clínicos y en vida real. Sin embargo, la combinación de ETI, conocida como la «triple terapia», para pacientes con la mutación F508del en al menos uno de sus alelos, ha logrado una eficacia mucho mayor que la de sus predecesores7. Los CFTRm disminuyen las exacerbaciones respiratorias, mejoran la función pulmonar y la calidad de vida de los pacientes, lo que ha cambiado drásticamente el curso y el pronóstico de la enfermedad8-10. Todavía son pocas las publicaciones que valoran los cambios nutricionales, antropométricos11 o digestivos de los CFTRm, pero cada vez existen más estudios que demuestran mejoras en otros aspectos, como en la disminución de la inflamación intestinal.
La calprotectina fecal (CF) es un biomarcador que indica la presencia de inflamación intestinal, y suele estar más elevada en pacientes con FQ en comparación con controles sanos. Esta elevación puede ser debida a una inflamación crónica del intestino por acumulación de moco espeso, a la alteración en la composición de la microbiota intestinal debido al uso de antibióticos o a infecciones respiratorias de repetición, entre otras causas. El aumento de la CF en la FQ es multifactorial y refleja la complejidad de la enfermedad, que afecta tanto al sistema respiratorio como al gastrointestinal12,13.
En este estudio se evalúan los cambios observados en la inflamación intestinal en pacientes con FQ, siendo de carácter prospectivo y consiguiendo la participación de 15 unidades pediátricas españolas de referencia en FQ, mediante la determinación de CF en los tratados con LUM/IVA, TEZ/IVA y ETI: previa al tratamiento y a los 6 y 12meses del mismo.
Material y métodosDiseño del estudioEstudio de cohortes prospectivo y multicéntrico de una cohorte de pacientes afectos de FQ tratados con CFTRm, diferenciándose dos grupos: un grupo tratado con LUM/IVA o TEZ/IVA, y otro grupo con ETI. Han participado 15 unidades de FQ de hospitales pediátricos españoles. El estudio fue aprobado por el Comité de Ética del hospital investigador principal (Ref. 282-19) y ratificado por el comité de los otros hospitales participantes. Todos los participantes de entre 12 y 18 años consintieron participar en el estudio, y los pacientes adultos y los padres de los menores firmaron el consentimiento informado. Los criterios de inclusión fueron pacientes diagnosticados con FQ que comenzaron tratamiento con CFTRm. Todas las visitas se realizaron en el entorno ambulatorio y en revisiones rutinarias.
Datos clínicos y demográficosSe registraron los datos demográficos y clínicos: sexo, edad al inicio del tratamiento, suficiencia pancreática, genotipo, íleo meconial y presencia de enfermedad hepática relacionada con FQ o anomalías en los niveles de glucosa. Se analizaron los niveles de CF previos al inicio de CFTRm, y a los 6 y 12meses del tratamiento; no se tuvo en cuenta la técnica de cada centro, ya que se valoró el descenso desde el valor basal de cada individuo.
Análisis estadísticoLos datos del estudio se recopilaron y gestionaron utilizando REDCap (11), herramientas electrónicas de datos alojadas en la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP). El soporte técnico fue proporcionado por la Unidad de Apoyo AEGREDCap, compartida con la Asociación Española de Gastroenterología (AEG). REDCap (Research Electronic Data Capture) es una aplicación web diseñada para apoyar la captura de datos en estudios de investigación, proporcionando una interfaz intuitiva para la entrada de datos validada; registros de auditoría para rastrear la manipulación de datos y los procedimientos de exportación automatizados para descargas de datos a paquetes estadísticos comunes; y para importar datos de fuentes externas. El análisis estadístico se realizó utilizando STATA, versión 13.0. Los resultados se estratificaron en dos grupos según el modulador utilizado: el grupo de LUM/IVA o TEZ/IVA, y el de ETI. Los valores demográficos, clínicos y de CF se expresaron mediante la mediana y su rango intercuartílico (RIC), al no seguir una distribución normal (verificado con la prueba Kolmogorov-Smirnov), o como porcentaje. Las diferencias en los niveles de CF después del tratamiento se determinaron mediante la prueba de rango con signo de Wilcoxon y la prueba de McNemar para datos proporcionales emparejados. Para todos los análisis, se consideró estadísticamente significativo un valor de p<0,05.
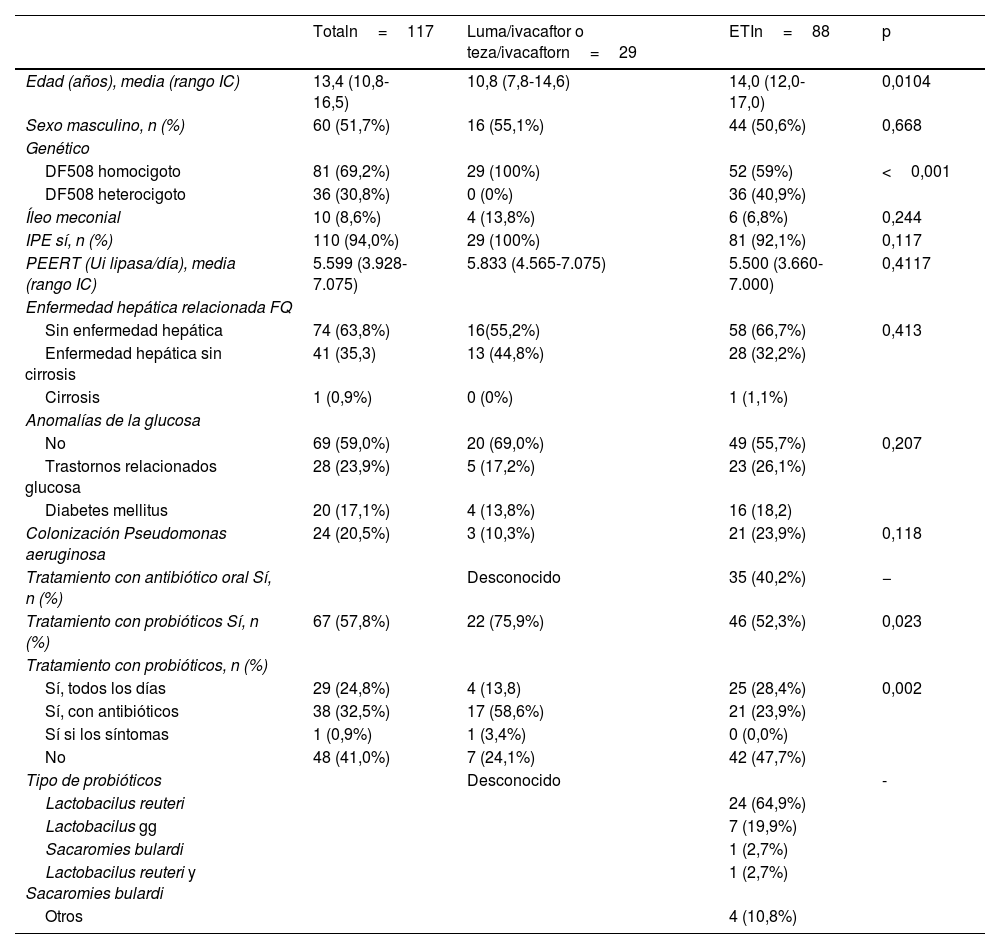
ResultadosSe incluyeron 117 pacientes, con una media de edad de 15,5años (IC95%: 14,0-17,0), rango 3,2 y 47,1años, sin diferencias según sexo y con la presencia en el 100% de la mutación F508del en al menos uno de los alelos (69% homocigotos). Las características demográficas y clínicas basales se recogen en la tabla 1. Las variables de los dos grupos analizados eran similares excepto en edad, genética o aislamiento de Pseudomonas aeruginosa.
Características demográficas y basales de los participantes del estudio
| Totaln=117 | Luma/ivacaftor o teza/ivacaftorn=29 | ETIn=88 | p | |
|---|---|---|---|---|
| Edad (años), media (rango IC) | 13,4 (10,8-16,5) | 10,8 (7,8-14,6) | 14,0 (12,0-17,0) | 0,0104 |
| Sexo masculino, n (%) | 60 (51,7%) | 16 (55,1%) | 44 (50,6%) | 0,668 |
| Genético | ||||
| DF508 homocigoto | 81 (69,2%) | 29 (100%) | 52 (59%) | <0,001 |
| DF508 heterocigoto | 36 (30,8%) | 0 (0%) | 36 (40,9%) | |
| Íleo meconial | 10 (8,6%) | 4 (13,8%) | 6 (6,8%) | 0,244 |
| IPE sí, n (%) | 110 (94,0%) | 29 (100%) | 81 (92,1%) | 0,117 |
| PEERT (Ui lipasa/día), media (rango IC) | 5.599 (3.928-7.075) | 5.833 (4.565-7.075) | 5.500 (3.660-7.000) | 0,4117 |
| Enfermedad hepática relacionada FQ | ||||
| Sin enfermedad hepática | 74 (63,8%) | 16(55,2%) | 58 (66,7%) | 0,413 |
| Enfermedad hepática sin cirrosis | 41 (35,3) | 13 (44,8%) | 28 (32,2%) | |
| Cirrosis | 1 (0,9%) | 0 (0%) | 1 (1,1%) | |
| Anomalías de la glucosa | ||||
| No | 69 (59,0%) | 20 (69,0%) | 49 (55,7%) | 0,207 |
| Trastornos relacionados glucosa | 28 (23,9%) | 5 (17,2%) | 23 (26,1%) | |
| Diabetes mellitus | 20 (17,1%) | 4 (13,8%) | 16 (18,2) | |
| Colonización Pseudomonas aeruginosa | 24 (20,5%) | 3 (10,3%) | 21 (23,9%) | 0,118 |
| Tratamiento con antibiótico oral Sí, n (%) | Desconocido | 35 (40,2%) | − | |
| Tratamiento con probióticos Sí, n (%) | 67 (57,8%) | 22 (75,9%) | 46 (52,3%) | 0,023 |
| Tratamiento con probióticos, n (%) | ||||
| Sí, todos los días | 29 (24,8%) | 4 (13,8) | 25 (28,4%) | 0,002 |
| Sí, con antibióticos | 38 (32,5%) | 17 (58,6%) | 21 (23,9%) | |
| Sí si los síntomas | 1 (0,9%) | 1 (3,4%) | 0 (0,0%) | |
| No | 48 (41,0%) | 7 (24,1%) | 42 (47,7%) | |
| Tipo de probióticos | Desconocido | - | ||
| Lactobacilus reuteri | 24 (64,9%) | |||
| Lactobacilus gg | 7 (19,9%) | |||
| Sacaromies bulardi | 1 (2,7%) | |||
| Lactobacilus reuteri y Sacaromies bulardi | 1 (2,7%) | |||
| Otros | 4 (10,8%) | |||
IPE: insuficiencia pancreática exocrina; PEERT: tratamiento con enzimas pancreáticas.
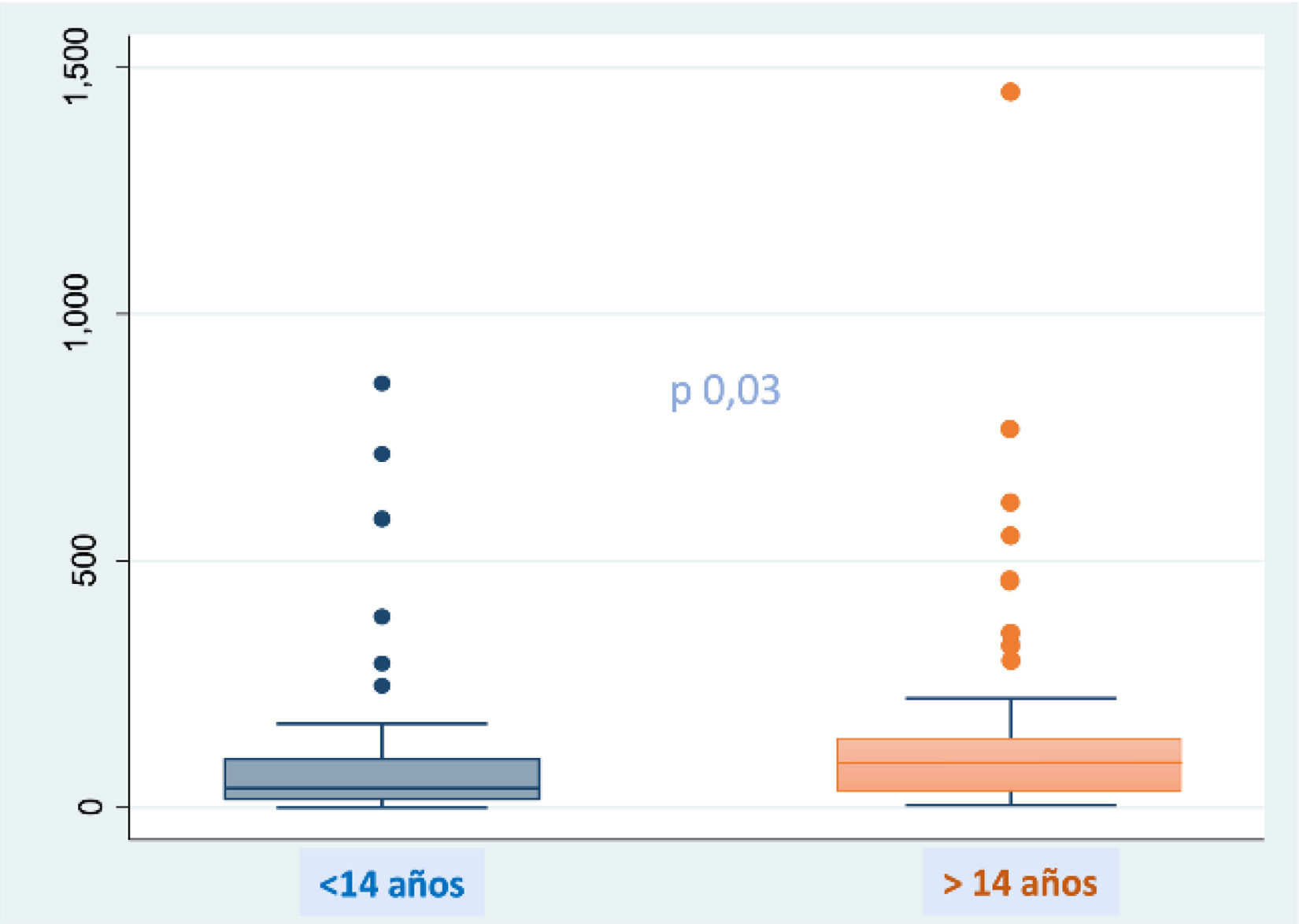
Los valores basales de CF estuvieron entre 1 y 1.450μg/g (mediana 49μg/g [RIC: 23-108]). Para las cifras de CF basal analizadas según las diferentes variables, únicamente se observan diferencias según la edad mediante pruebas no paramétricas Mann-Whitney (fig. 1), obteniendo valores más altos en mayores de 14años. No se encontraron diferencias significativas entre los que tomaban azitromicina de forma crónica, los colonizados por Pseudomonas aeruginosa, la presencia de insuficiencia pancreática exocrina o la toma de probióticos. No hubo diferencias entre los dos grupos en la CF previa al inicio del tratamiento (48μg/g [RIC: 26-91] en el grupo LUM/IVA o TEZ/IVA Vs 52 μg/g [RIC: 22-127] en el grupo de ETI, p=0,5677). Cabe destacar que al inicio del estudio casi la mitad de los pacientes (n=57 [48%]) tenían valores anormales de CF (>50μg/g) y que el 11% de ellos, todos pertenecientes al grupo ETI, tenían valores superiores a 250μg/g, indicativo de inflamación intestinal.
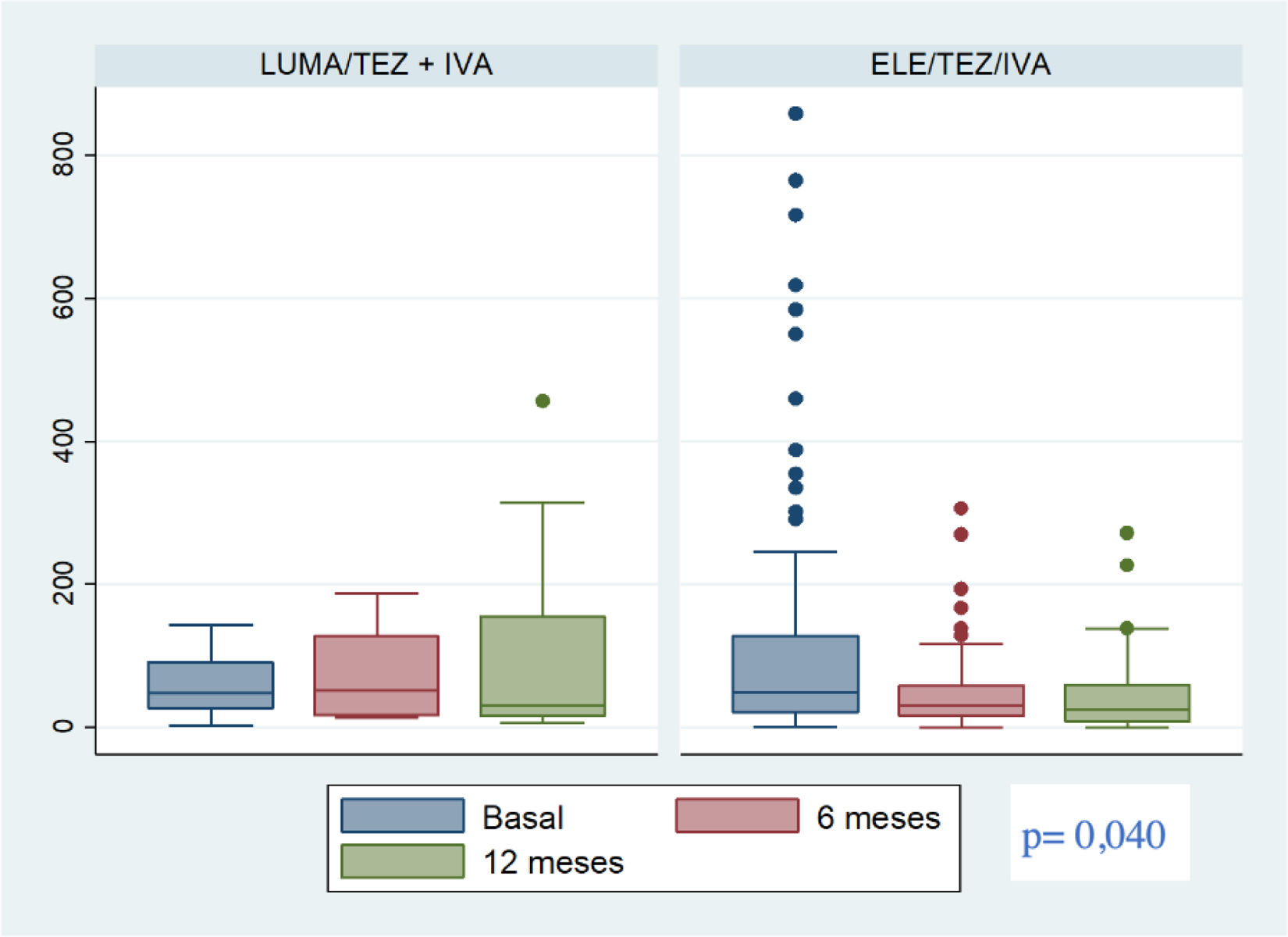
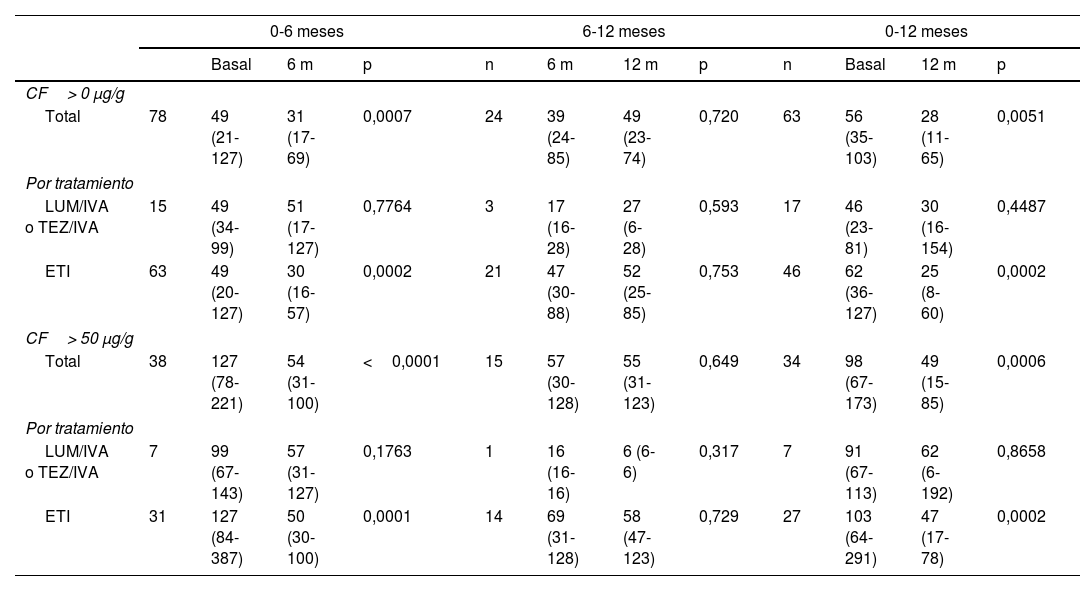
En el grupo total se ha observado una disminución estadísticamente significativa de los valores de CF a los 6 y 12meses de tratamiento respecto al basal (tabla 2). También se observó una disminución progresiva de la proporción de pacientes con niveles de CF >50μg/g a los 6meses 48,7% vs 33,1% (p=0,0067) y a los 12meses 54% vs 33,5% (p=0,0218). No se encontraron diferencias entre los 6 y los 12meses. En el grupo ETI solo 2 pacientes a los 6 meses y 1paciente a los 12meses del tratamiento presentaban cifras de CF >250μg/g (fig. 2).
Evolución en los niveles de calprotectina fecal tras un año de tratamiento con moduladores de CFTR
| 0-6 meses | 6-12 meses | 0-12 meses | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Basal | 6 m | p | n | 6 m | 12 m | p | n | Basal | 12 m | p | ||
| CF> 0 μg/g | ||||||||||||
| Total | 78 | 49 (21-127) | 31 (17-69) | 0,0007 | 24 | 39 (24-85) | 49 (23-74) | 0,720 | 63 | 56 (35-103) | 28 (11-65) | 0,0051 |
| Por tratamiento | ||||||||||||
| LUM/IVA o TEZ/IVA | 15 | 49 (34-99) | 51 (17-127) | 0,7764 | 3 | 17 (16-28) | 27 (6-28) | 0,593 | 17 | 46 (23-81) | 30 (16-154) | 0,4487 |
| ETI | 63 | 49 (20-127) | 30 (16-57) | 0,0002 | 21 | 47 (30-88) | 52 (25-85) | 0,753 | 46 | 62 (36-127) | 25 (8-60) | 0,0002 |
| CF> 50 μg/g | ||||||||||||
| Total | 38 | 127 (78-221) | 54 (31-100) | <0,0001 | 15 | 57 (30-128) | 55 (31-123) | 0,649 | 34 | 98 (67-173) | 49 (15-85) | 0,0006 |
| Por tratamiento | ||||||||||||
| LUM/IVA o TEZ/IVA | 7 | 99 (67-143) | 57 (31-127) | 0,1763 | 1 | 16 (16-16) | 6 (6-6) | 0,317 | 7 | 91 (67-113) | 62 (6-192) | 0,8658 |
| ETI | 31 | 127 (84-387) | 50 (30-100) | 0,0001 | 14 | 69 (31-128) | 58 (47-123) | 0,729 | 27 | 103 (64-291) | 47 (17-78) | 0,0002 |
Los valores se expresan como media y rango intercuartil.
CF: calprotectina fecal; ETI: elexacaftor/tezacaftor/ivacaftor, LUM/IVA: lumacaftor/ivacaftor; TEZ/IVA: tezacaftor/ivacaftor.
El cambio estimado (IC95%) desde el inicio del modulador hasta los 12meses en el grupo de ETI en comparación con el grupo de LUM/IVA o TEZ/IVA fue superior, con una diferencia de −133μg/g (−254 vs −13; p=0,030). Ajustado por sexo, uso de probióticos y aislamiento de Pseudomonas aeruginosa, el cambio fue de −130μg/g (−259 vs −1; p=0,049) (fig. 2).
DiscusiónLa enfermedad pulmonar en la FQ ha sido el foco principal de la investigación clínica, por ser el factor que más influye en la morbimortalidad de los pacientes. Los CFTRm han demostrado ser un gran avance terapéutico con mejoras notables en la función pulmonar y en la disminución de las exacerbaciones pulmonares. Sin embargo, existen pocos estudios que describan los cambios observados en la salud digestiva con estos fármacos y, en concreto, que analicen las posibles mejoras a nivel de la inflamación intestinal con la determinación de CF14-16.
En el presente estudio se han analizado 117 pacientes afectos de FQ de 15 centros pediátricos españoles, con el fin de describir los cambios observados en los niveles de CF basales respecto a los 6 y 12meses del inicio de tratamiento con CFTRm.
Se obtuvieron niveles anormales de CF previos al tratamiento en más de la mitad de los pacientes, al igual que en estudios previos13,14, siendo estos más elevados en los pacientes mayores de 14años, hecho que podría estar relacionado con la progresión temporal de la inflamación crónica en el tracto gastrointestinal y pulmonar, y a una microbiota intestinal alterada, como bien reflejan De Freitas et al.12 en su trabajo. No hubo relación con otros factores asociados, como con el uso de probióticos, a diferencia de otros autores que sí que observan una disminución de las cifras de CF con el uso de algunas cepas probióticas17,18. Tampoco hubo relación significativa con la presencia de insuficiencia pancreática exocrina, a diferencia de lo publicado por Talebi et al.19 en su metaanálisis, que describe además asociación con la función pulmonar, el índice de masa corporal y la colonización por Pseudomonas aeruginosa. En este sentido, en nuestro trabajo sí que se observa una tendencia positiva con la colonización por Pseudomonas aeruginosa, aunque sin ser estadísticamente significativa, probablemente debido al menor tamaño muestral en comparación con la revisión sistemática, interpretando así que la CF es un marcador no invasivo confiable para detectar la inflamación gastrointestinal, pero también está correlacionada con la gravedad de la enfermedad en pacientes con FQ.
Los efectos antinflamatorios a nivel intestinal ya se empezaron a reportar con el uso de IVA, primer fármaco comercializado en monoterapia para mutaciones de claseIII, tal y como publican en dos series de casos de 16 y 64 pacientes20,21. Posteriormente, con la comercialización de nuevos CFTRm, un estudio evaluó la evolución de la inflamación intestinal después del inicio de LUM/IVA en adolescentes con FQ con un seguimiento de un año. Las concentraciones medias de CF disminuyeron significativamente (102μg/g [I: 69-210]) en comparación con el valor inicial (713μg/g [RIC: 148-852], p=0,001)22. Un reciente ensayo clínico evaluó el efecto de LUM/IVA en 44 niños de entre 1 a 2años, encontrando una disminución en la CF de −106mg/kg a las 24semanas23, siendo la población más joven tratada hasta la fecha. Sin embargo, otra investigación aún más reciente con TEZ/IVA en la que midieron CF, cambios en el microbioma intestinal y cuestionario de síntomas digestivos, no observaron diferencias significativas, al igual que en nuestro trabajo24.
Un resultado destacado de nuestro estudio es la diferencia estadísticamente significativa que se observa al comparar la disminución de la CF de LUM/IVA o TEZ/IVA con el ETI, siendo este último el que en mayor medida disminuye las cifras de CF, tanto a los 6 como a los 12 meses (−133). Nuestros resultados tras triple terapia son incluso mejores que los publicados en el estudio PROMISE, un estudio prospectivo de 56 centros que mostró un cambio de −66,2μg/g (IC95%: −86,1 a −46,2) a los 6meses en mayores de 12años25, y otros estudios pediátricos, como el de Reasoner et al.26, en el que objetivan una disminución media a los 12meses de −64μg/g (IC95%: −16 a −112)26. No existen estudios como el presente, que valoren la mejora en la CF tras terapia ETI comparándola con otros moduladores como LUM/IVA o TEX/IVA.
Nuestro estudio presenta algunas limitaciones, dado el carácter observacional y la ausencia de aleatorización. Sin embargo, debemos tener en cuenta que la seguridad y la eficacia de los CFTRm ya han sido demostradas mediante ensayos clínicos, por lo que éticamente no sería posible plantear un estudio aleatorizado, ni denegar el acceso al fármaco a los pacientes con mutaciones susceptibles. Por otra parte, la determinación de CF no centralizada determinaría que la magnitud de los cambios pudiera ser poco precisa. Con el objetivo de subsanar dichas limitaciones, propusimos en el diseño del estudio comparar los resultados separados entre triple terapia y doble terapia, así como, en el análisis estadístico ajustamos los resultados por factores que conocemos que alteran la inflamación intestinal, como el uso de probióticos y aislamiento de Pseudomonas aeruginosa. Además se valoró la reducción de la CF como el cambio estimado en cada paciente, ya que podría haber diferencias según los diferentes laboratorios.
Como fortalezas destacamos su carácter prospectivo y multicéntrico, además de ser el estudio con la mayor serie de casos publicados y el primero en nuestro país que analiza en vida real la efectividad de estos fármacos en reducir la inflamación intestinal.
ConclusionesLa combinación de ETI disminuye de forma significativa los valores de CF comparado con la combinación LUM/IVA o TEZ/IVA, lo que demuestra que la triple terapia no solo es efectiva en mejorar parámetros respiratorios, sino también aspectos digestivos como la inflamación intestinal.
FinanciaciónLos autores no han recibido honorarios para este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Saioa Vicente Santamaría, Unidad Fibrosis Quística, Servicio de Pediatría, Hospital Universitario Ramón y Cajal (Madrid).
Ana Tabares González, Unidad de Fibrosis Quística, Servicio de Pediatría, Hospital Universitario Ramón y Cajal (Madrid).
José Ramón Gutiérrez Martínez, Unidad de Fibrosis Quística, Hospital Universitario Central de Asturias (Oviedo).
Sara Sierra San Nicolás, Unidad de Gastroenterología, Hepatología y Nutrición Pediátrica, Hospital Universitario de Canarias (Tenerife).
Pilar Ortiz Pérez, Unidad de Gastroenterología, Hepatología y Nutrición Pediátrica, Hospital Regional Universitario de Málaga (Málaga).
Luis Peña Quintana, Servicio de Pediatría, Complejo Hospitalario Insular Materno- Infantil de Las Palmas (Las Palmas de Gran Canaria).
Los miembros del Grupo de trabajo de Fibrosis Quística y Páncreas de la SEGHNP se presentan en el Anexo 1.
Presentación en el XXX Congreso de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP), celebrado del 25 al 27 de abril de 2024 en Bilbao. Comunicación oral a mesa de Gastroenterología, siendo el premio a la mejor comunicación del congreso.